Похожие презентации:
Абсолютная температура как мера средней кинетической энергии частиц
1. Абсолютная температура как мера средней кинетической энергии частиц
АБСОЛЮТНАЯ ТЕМПЕРАТУРАКАК МЕРА СРЕДНЕЙ
КИНЕТИЧЕСКОЙ ЭНЕРГИИ
ЧАСТИЦ
УРАВНЕНИЕ
СОСТОЯНИЯ.
ИЗОПРОЦЕССЫ
2. План занятия
ПЛАН ЗАНЯТИЯ• Модель идеального газа. Микро- и
макроскопические параметры
• Основное уравнение МКТ идеального газа.
Связь давления со средней кинетической
энергией. Закон Дальтона
• Абсолютная температура как мера
средней кинетической энергии частиц
• Уравнение состояния
• Изопроцессы
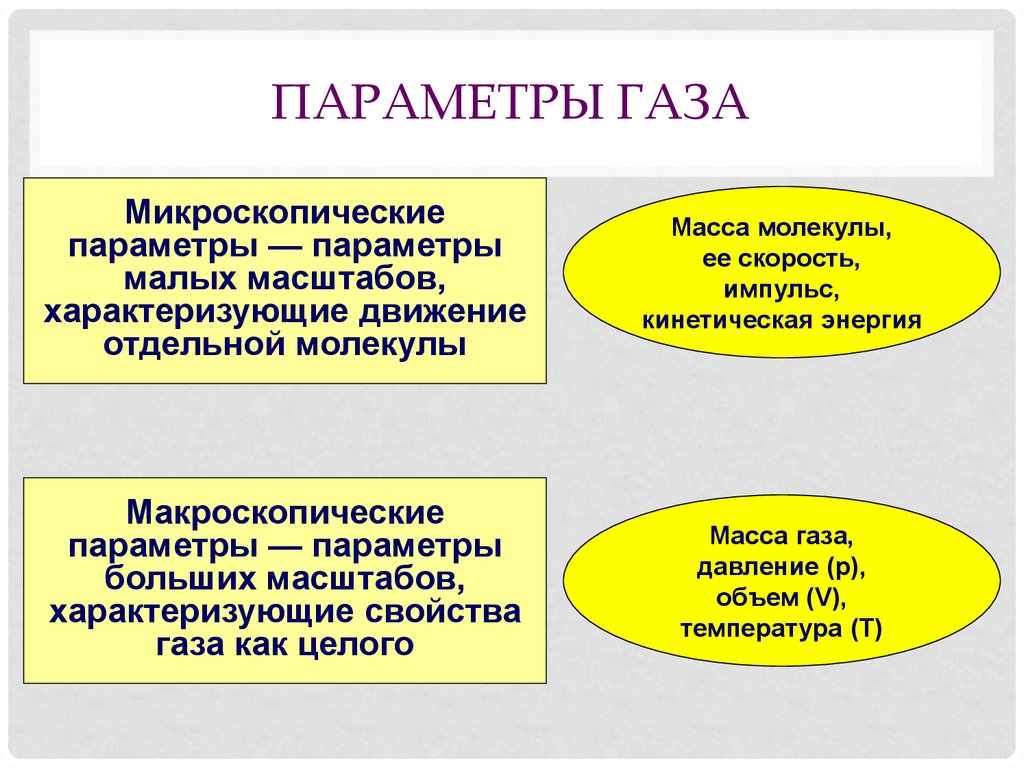
3. Параметры газа
ПАРАМЕТРЫ ГАЗАМикроскопические
параметры — параметры
малых масштабов,
характеризующие движение
отдельной молекулы
Масса молекулы,
ее скорость,
импульс,
кинетическая энергия
Макроскопические
параметры — параметры
больших масштабов,
характеризующие свойства
газа как целого
Масса газа,
давление (p),
объем (V),
температура (T)
4.
Тепловым равновесием называют такое состояние тел,при котором все макроскопические параметры сколь
угодно долго остаются неизменными
• Это означает, что в системе не
меняются объем и давление, не
происходит теплообмен, отсутствуют
взаимные превращения газов,
жидкостей, твердых тел и т. д.
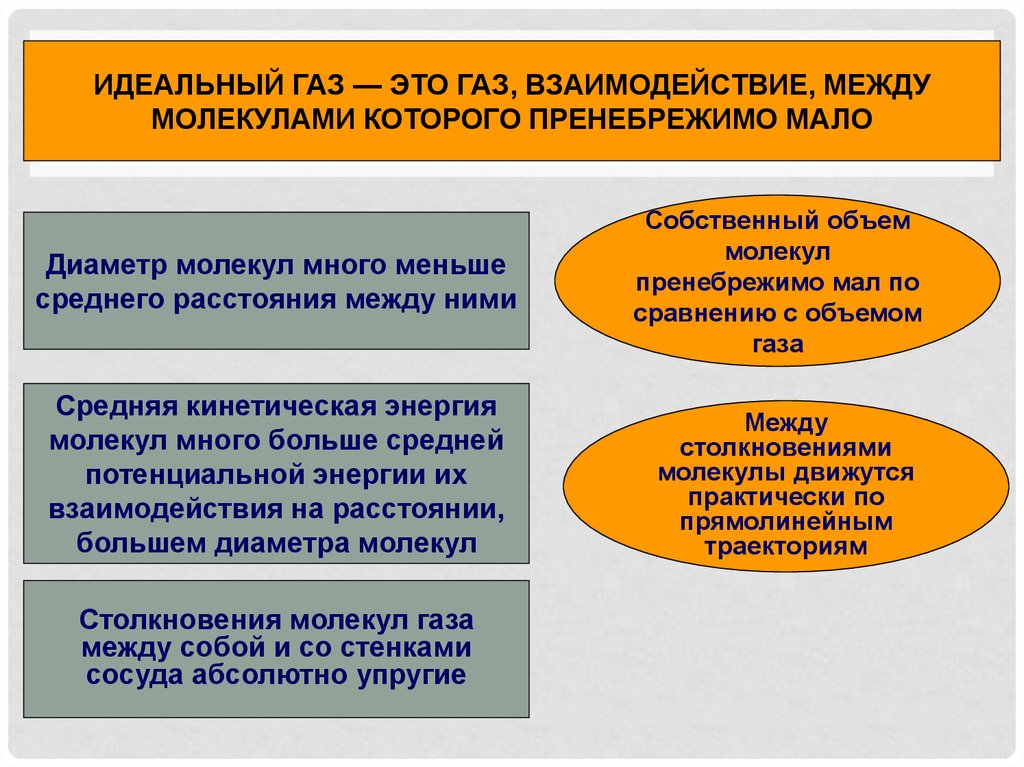
5.
ИДЕАЛЬНЫЙ ГАЗ — ЭТО ГАЗ, ВЗАИМОДЕЙСТВИЕ, МЕЖДУМОЛЕКУЛАМИ КОТОРОГО ПРЕНЕБРЕЖИМО МАЛО
Диаметр молекул много меньше
среднего расстояния между ними
Собственный объем
молекул
пренебрежимо мал по
сравнению с объемом
газа
Средняя кинетическая энергия
молекул много больше средней
потенциальной энергии их
взаимодействия на расстоянии,
большем диаметра молекул
Между
столкновениями
молекулы движутся
практически по
прямолинейным
траекториям
Столкновения молекул газа
между собой и со стенками
сосуда абсолютно упругие
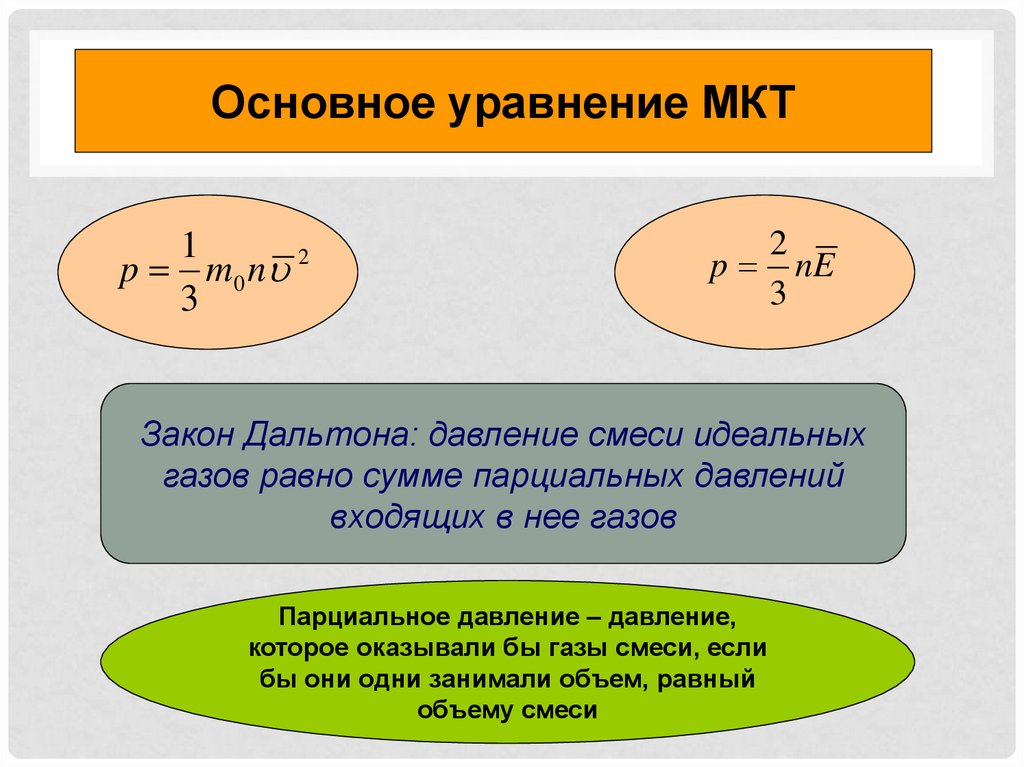
6.
Основное уравнение МКТ1
p m 0 n 2
3
2
p nE
3
Закон Дальтона: давление смеси идеальных
газов равно сумме парциальных давлений
входящих в нее газов
Парциальное давление – давление,
которое оказывали бы газы смеси, если
бы они одни занимали объем, равный
объему смеси
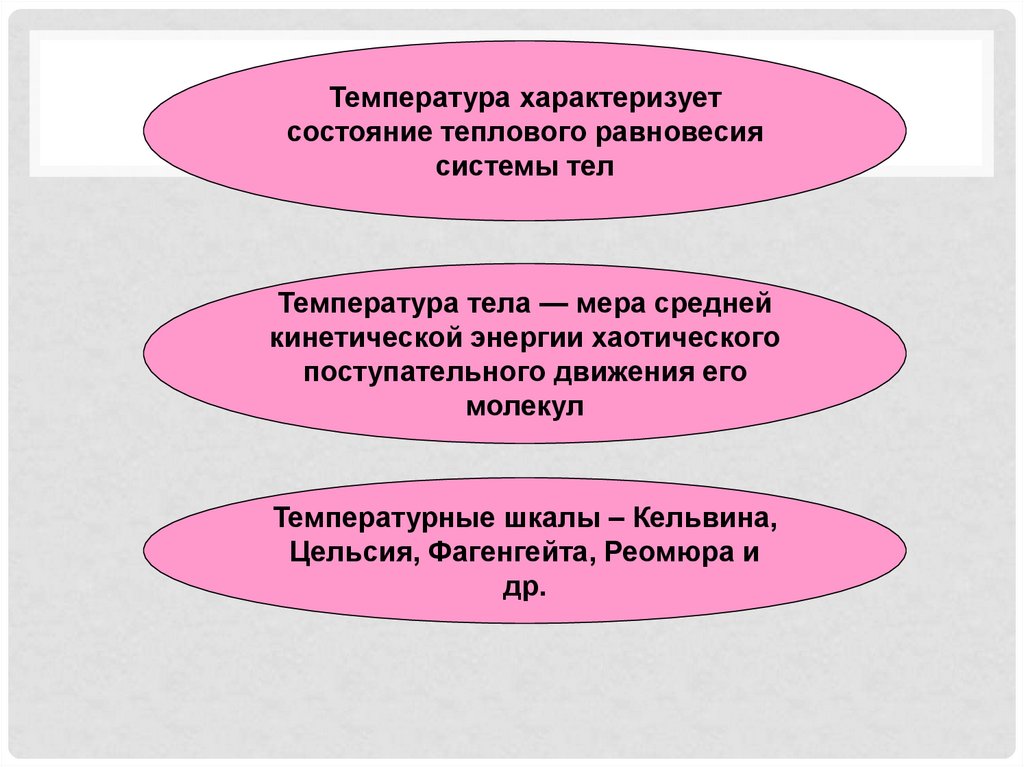
7.
Температура характеризуетсостояние теплового равновесия
системы тел
Температура тела — мера средней
кинетической энергии хаотического
поступательного движения его
молекул
Температурные шкалы – Кельвина,
Цельсия, Фагенгейта, Реомюра и
др.
8.
Абсолютный нуль температуры – предельнаятемпература, при которой давление идеального газа
обращается в нуль при фиксированном объеме или при
которой объем идеального газа стремится к нулю при
неизменном давлении
T = 0t +273
СВЯЗЬ ТЕМПЕРАТУРЫ ПО ШКАЛЕ
КЕЛЬВИНА С ТЕМПЕРАТУРОЙ ПО
ШКАЛЕ ЦЕЛЬСИЯ
9.
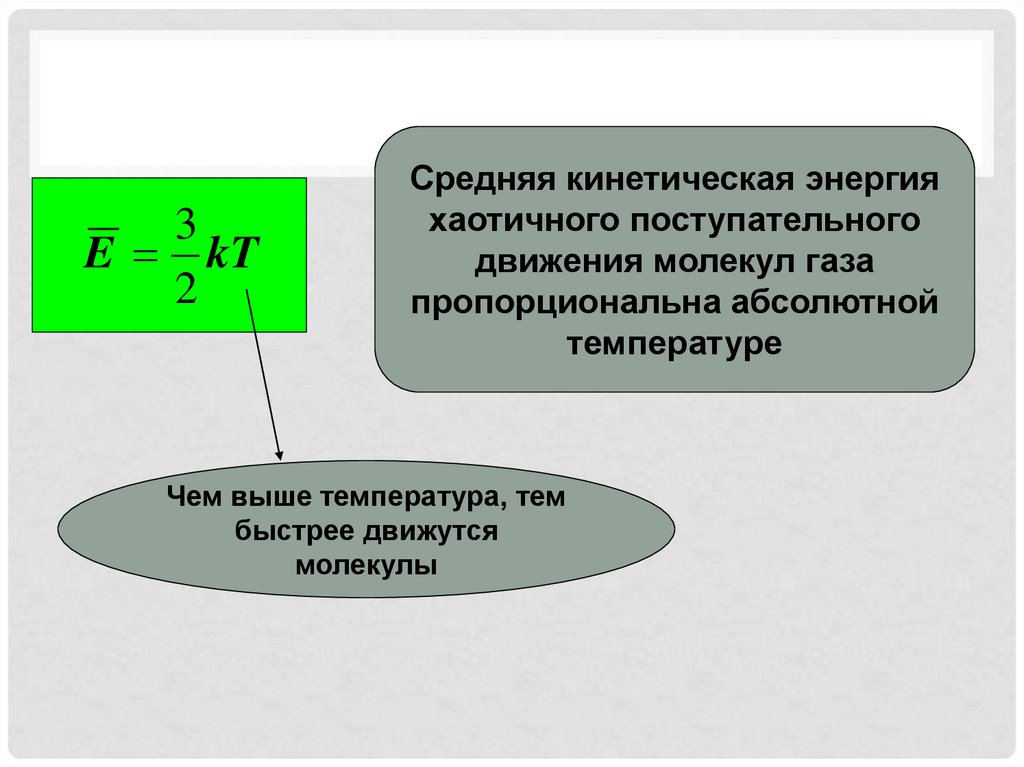
3E kT
2
Средняя кинетическая энергия
хаотичного поступательного
движения молекул газа
пропорциональна абсолютной
температуре
Чем выше температура, тем
быстрее движутся
молекулы
10.
Зависимость давления от концентрации итемпературы
p nkT
N
n
V
Концентрация молекул – число
молекул в 1 м3
k = 1,38*10-23 Дж/К
Постоянная Больцмана
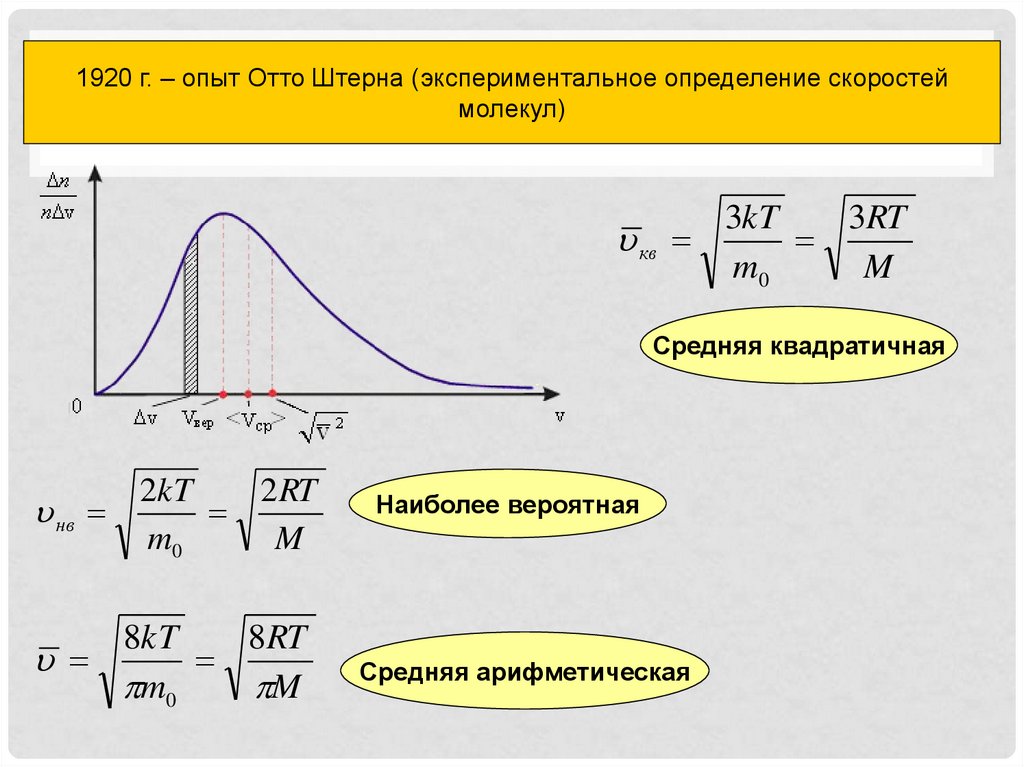
11. Распределение молекул газа по скоростям
1920 г. – опыт Отто Штерна (экспериментальное определение скоростеймолекул)
Распределение молекул газа по скоростям
3kT
3RT
кв
m0
M
Средняя квадратичная
нв
2kT
2 RT
m0
M
8kT
8RT
m0
M
Наиболее вероятная
Средняя арифметическая
12.
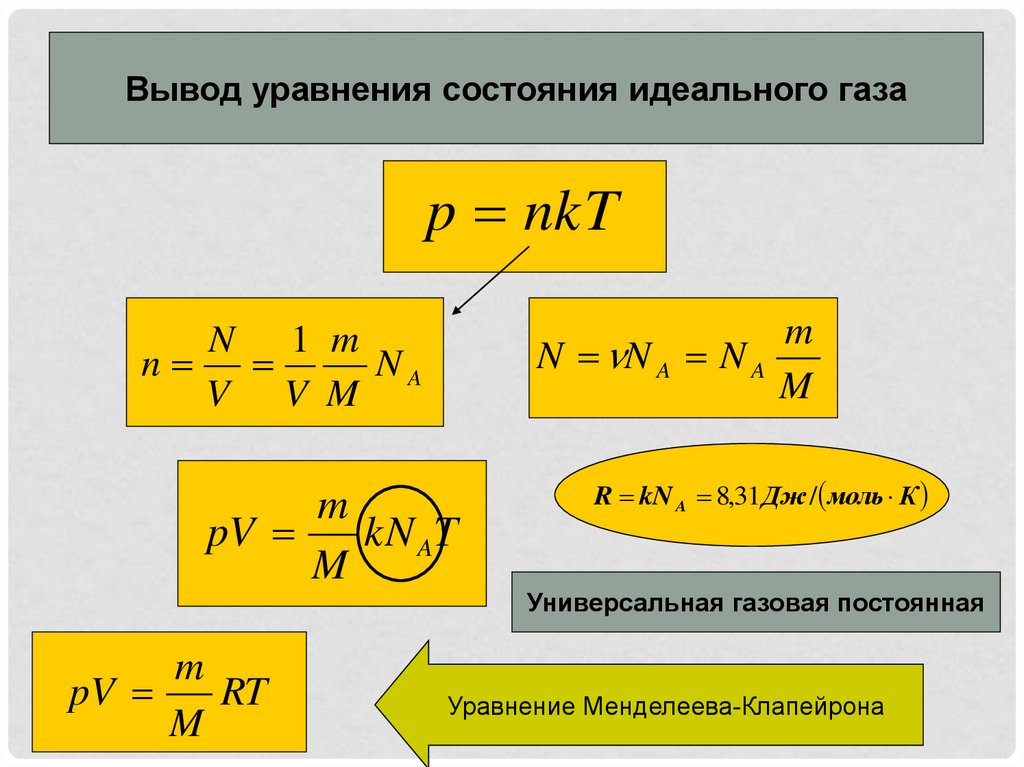
Вывод уравнения состояния идеального газаp nkT
m
N N A N A
M
N 1 m
n
NA
V V M
m
pV
kN AT
M
R kN A 8,31Дж / моль К
Универсальная газовая постоянная
m
pV
RT
M
Уравнение Менделеева-Клапейрона
13.
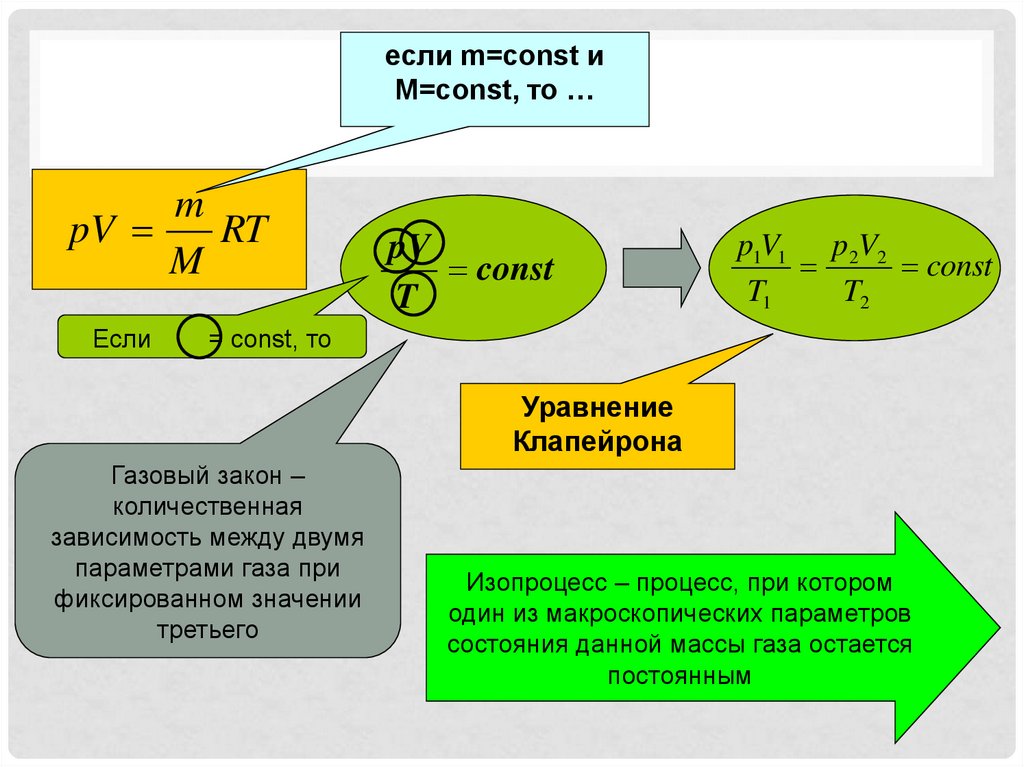
если m=const иM=const, то …
m
pV
RT
M
Если
pV
const
T
p1V1 p 2V2
const
T1
T2
= const, то
Уравнение
Клапейрона
Газовый закон –
количественная
зависимость между двумя
параметрами газа при
фиксированном значении
третьего
Изопроцесс – процесс, при котором
один из макроскопических параметров
состояния данной массы газа остается
постоянным
14.
p1V1 p 2V2const
T1
T2
Если T=const (не
изменяется)
Закон Бойля-Мариотта: для данной
массы газа при постоянной
Изотермический процесс
температуре произведение давления
газа на его объем есть величина
постоянная
pV const
15.
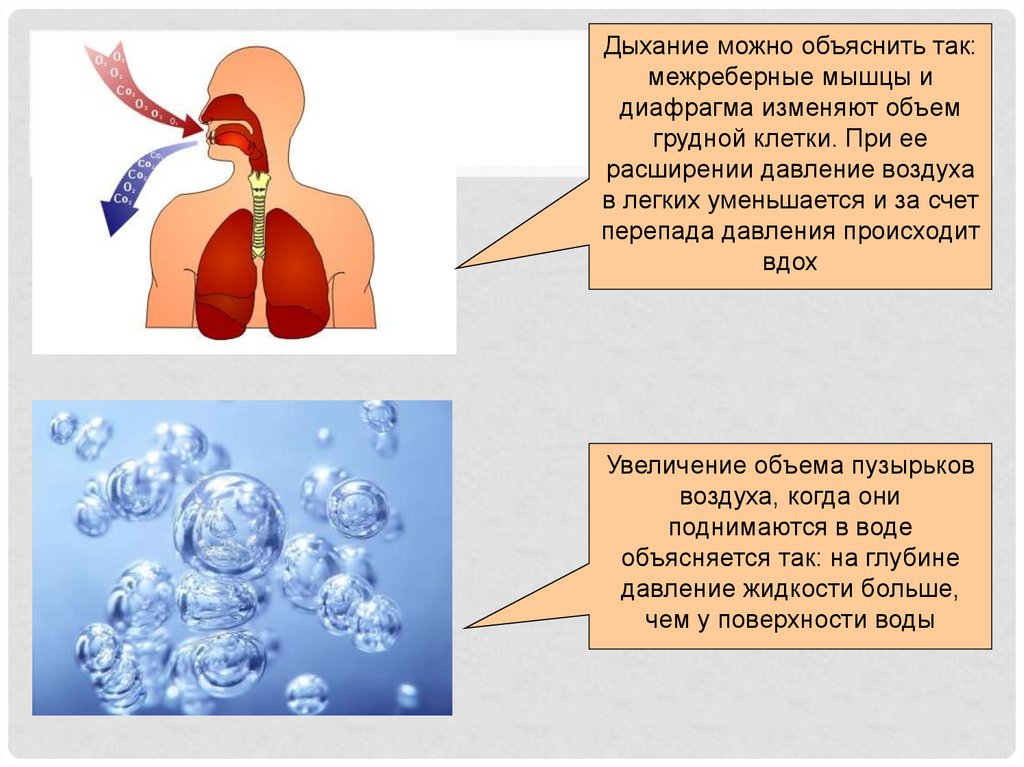
Дыхание можно объяснить так:межреберные мышцы и
диафрагма изменяют объем
грудной клетки. При ее
расширении давление воздуха
в легких уменьшается и за счет
перепада давления происходит
вдох
Увеличение объема пузырьков
воздуха, когда они
поднимаются в воде
объясняется так: на глубине
давление жидкости больше,
чем у поверхности воды
16.
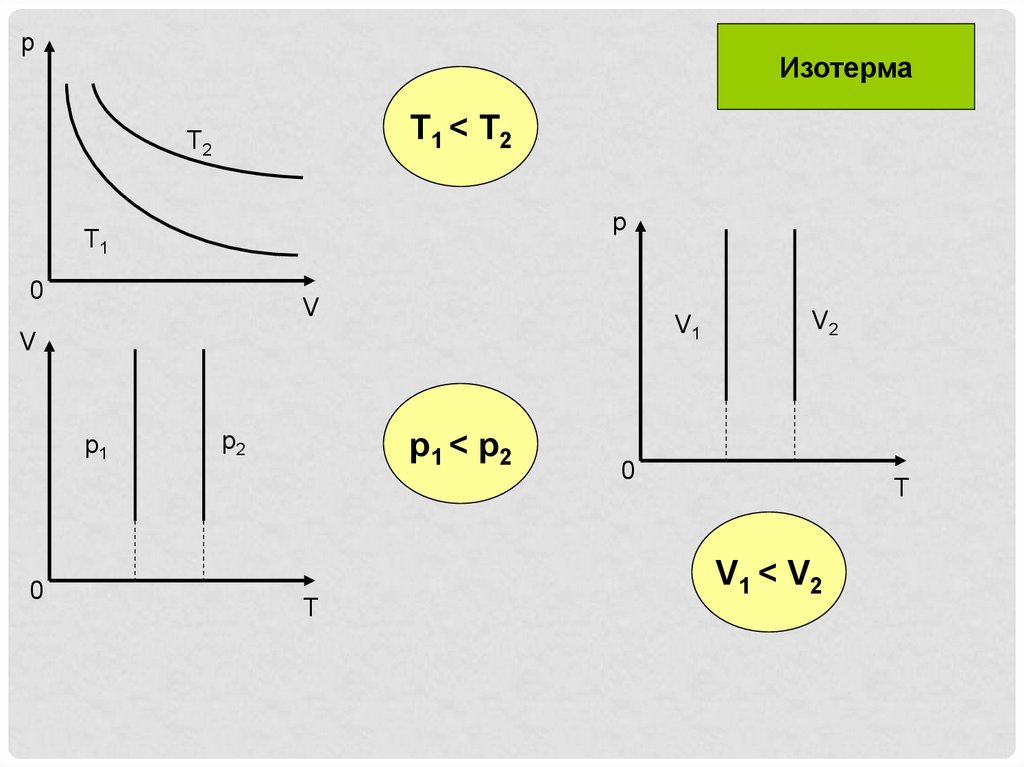
pИзотерма
T1 < T2
T2
p
T1
0
V
V1
V
p1
0
p2
p1 < p2
T
V2
0
T
V1 < V2
17.
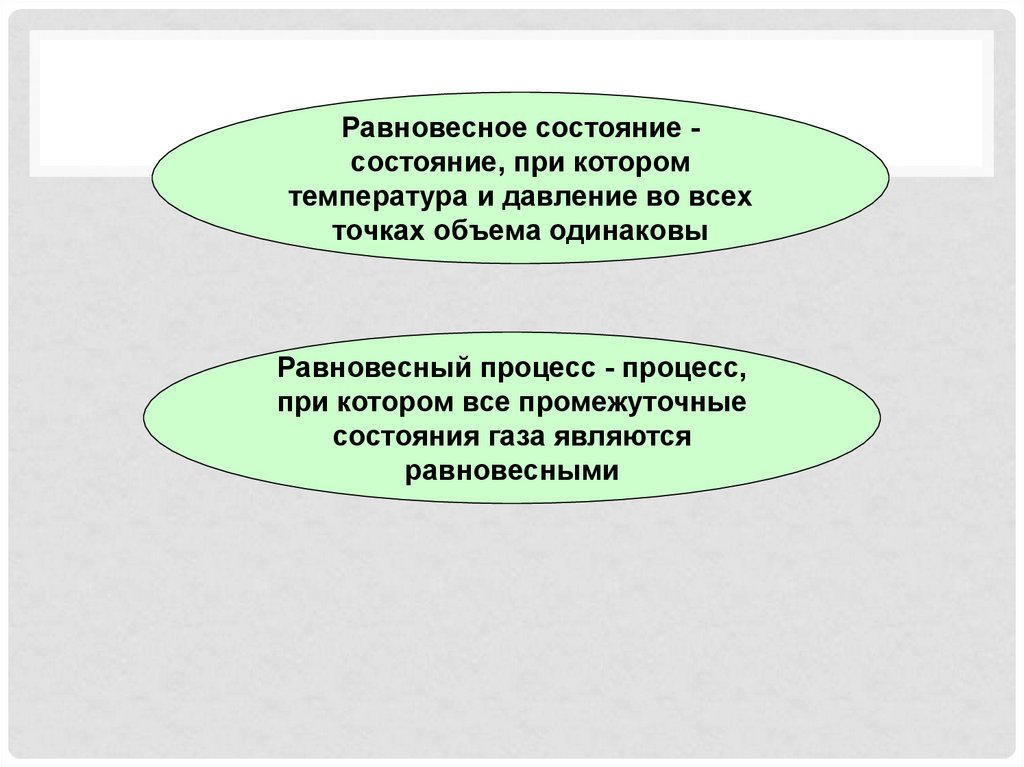
Равновесное состояние состояние, при которомтемпература и давление во всех
точках объема одинаковы
Равновесный процесс - процесс,
при котором все промежуточные
состояния газа являются
равновесными
18.
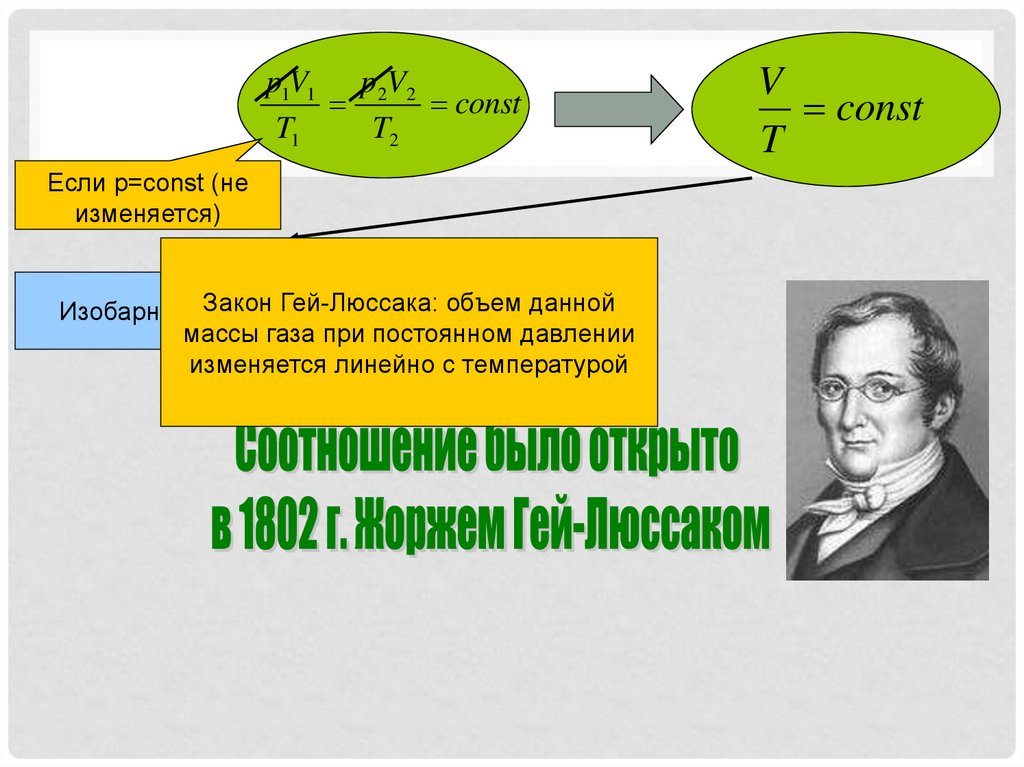
p1V1 p 2V2const
T1
T2
Если p=const (не
изменяется)
Закон Гей-Люссака: объем данной
Изобарный процесс
массы газа при постоянном давлении
изменяется линейно с температурой
V
const
T
19.
VИзобара
p1
p1 < p2
p2
p
V1
0
p
T
•В области низких температур
все изобары идеального газа
сходятся в точке Т = 0
V2
0
T
T1
T1 < T2
T2
0
V
V1 < V2
20.
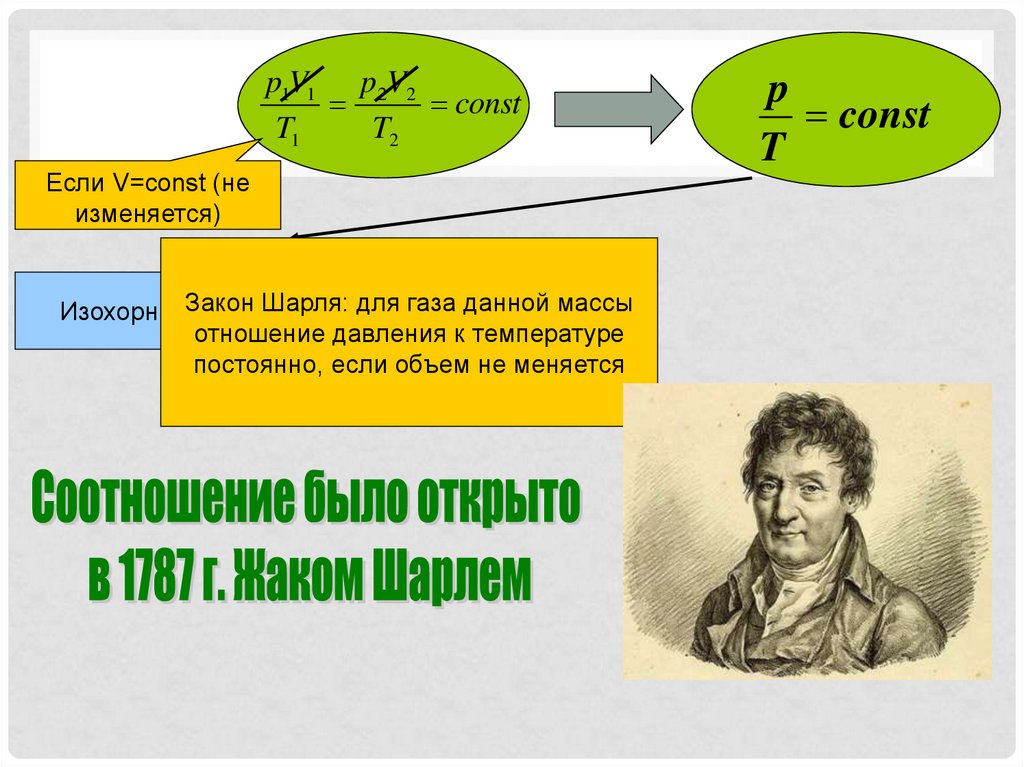
p1V1 p 2V2const
T1
T2
Если V=const (не
изменяется)
Шарля: для газа данной массы
ИзохорныйЗакон
процесс
отношение давления к температуре
постоянно, если объем не меняется
p
const
T
21.
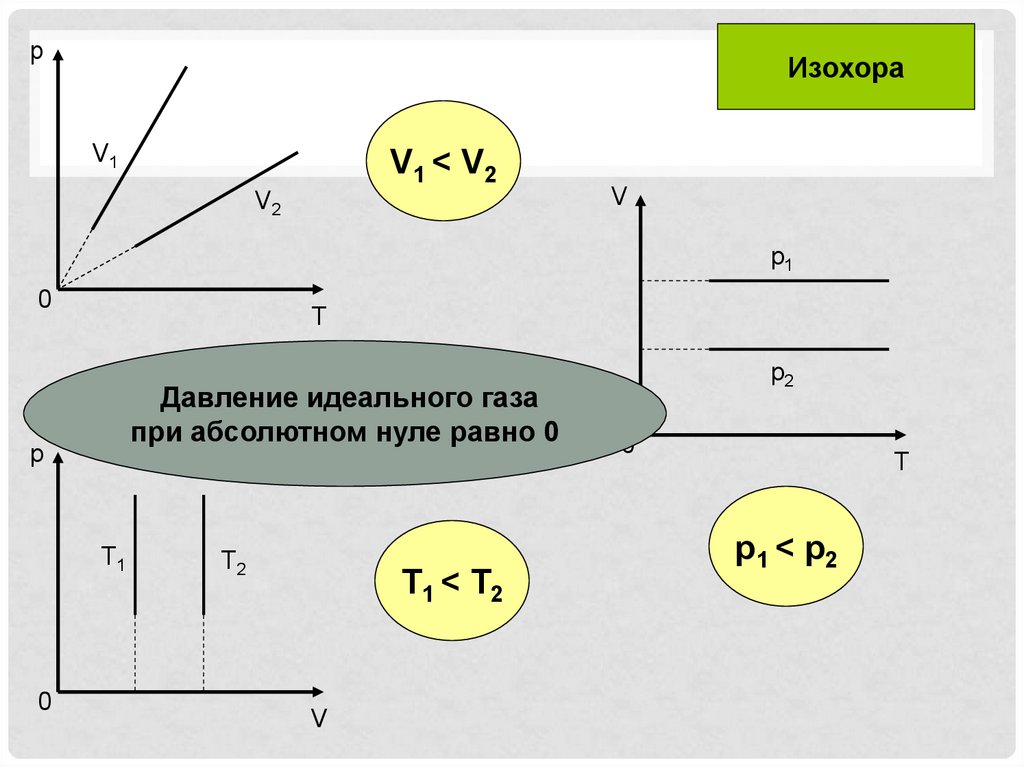
pИзохора
V1
V1 < V2
V2
V
p1
0
T
•Давление идеального газа
при абсолютном нуле равно 0
p
T1
0
T2
T1 < T2
V
p2
0
T
p1 < p2







 Физика
Физика








