Похожие презентации:
Делимость электрического заряда. Электрон. Строение атома
1. Делимость электрического заряда. Электрон. Строение атома
Тема урокаДелимость
электрического заряда.
Электрон.
Строение атома
2. Дискретность электрического заряда
Существованиемельчайших частиц,
имеющих наименьший
электрический заряд,
было доказано опытами
А.Ф.Иоффе и
Р.Милликена
Милликен Р.Э.
(1868-1953 г.г.)
Иоффе А.Ф.
(1880-1960 г.г.)
2
3. Открытие электрона
Был сделан вывод о существовании в природечастицы, имеющей наименьший заряд, который
более не делится. Эту частицу назвали
электроном.
3
4. Электрон
Обозначают знаком ēЭлектрон очень мал.
Масса электрона
составляет 9,1* 10 -31 кг.
За единицу электрического Значение заряда электрона
заряда принят один кулон (1Кл)
Электрон имеет наименьший
отрицательный заряд.
4
5. Заряд электрона
Заряд электрона –предел делимости
электрического
заряда, поэтому его
называют
Значение элементарного
электрического заряда
элементарным
зарядом.
5
6. Модель атома Томсона
Атом представляет собой равномерноположительно заряженный шар,
внутри которого плавают
отрицательные электроны.
Дж. Дж. Томсон
(1856-1940 г.г.)
6
7.
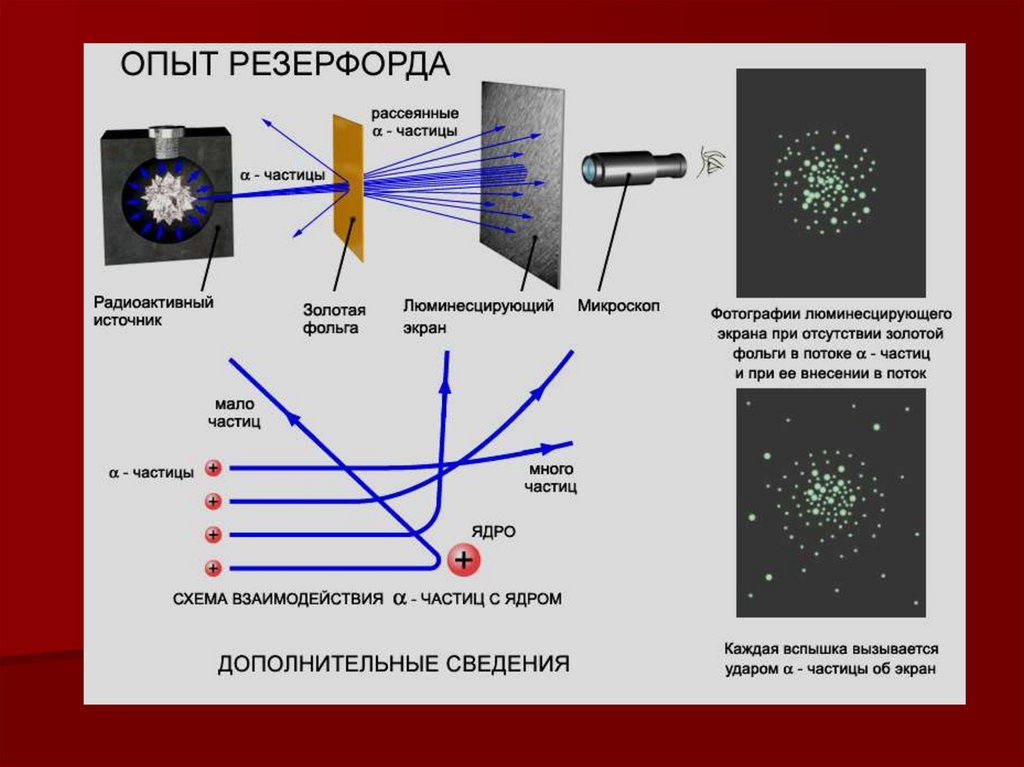
8. Строение атома
Опыт Э.Резерфордапо рассеянию
альфа-частиц
привёл к открытию
новой –
планетарной
модели атома.
Э. Резерфорд
(1871-1937 г.г.)
8
9. Модель атома Резерфорда
В центре атома находитсяположительно заряженное
ядро, состоящее из
протонов и нейтронов.
Вокруг ядра движутся
электроны, образующие
электронную оболочку
атома.
9
10. Ядро атома
Занимает очень малый объём атомаВ нём сосредоточена почти вся масса атома
Заряд ядра является главной характеристикой
атома химического элемента.
Состоит из протонов и нейтронов, которые
называются нуклонами (от латинского
nucleus – ядро)
Положительный заряд ядра равен
отрицательному заряду всех его электронов,
поэтому атом электронейтрален.
10
11. Протоны
Положительно заряженные элементарныечастицы.
Обозначают протоны знаком p+
Масса протона в 1840 раз больше массы
электрона.
Заряд
каждого
протона
равен
по
абсолютному значению заряду электрона.
Число протонов в атоме
равно числу электронов.
11
12. Нейтроны
Нейтральные (не имеющие заряда) частицыядра.
Нейтроны обозначают знаком
n0.
Масса нейтрона приблизительно равна массе
протона.
12
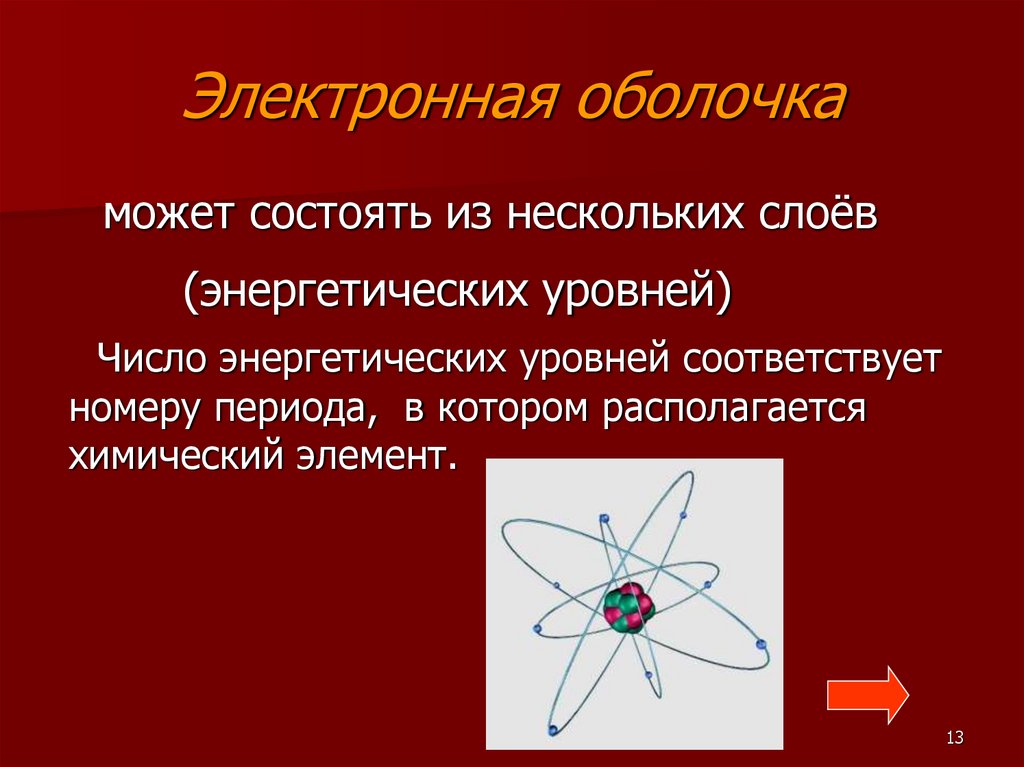
13. Электронная оболочка
может состоять из нескольких слоёв(энергетических уровней)
Число энергетических уровней соответствует
номеру периода, в котором располагается
химический элемент.
13
14. Модели атомов
16
2
7
3
8
4
9
5
10
14
15. Модель атома водорода
Модель атома неона10p+ 10n0 10ē
24
16. Модель атома гелия
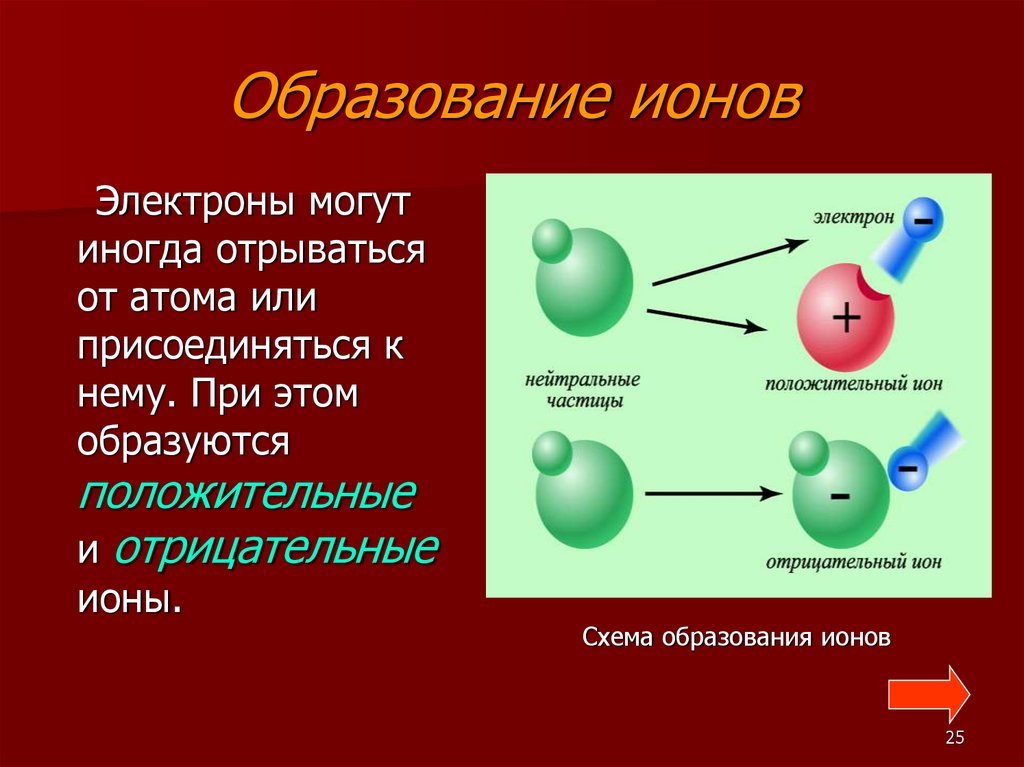
Образование ионовЭлектроны могут
иногда отрываться
от атома или
присоединяться к
нему. При этом
образуются
положительные
и отрицательные
ионы.
Схема образования ионов
25
17. Модель атома лития
Схема образования ионаесли атом азота потерял два электрона,
то он превращается в положительный
ион с зарядом +2
0
+2
N – 2ē N
26
18. Модель атома бериллия
Схема образования ионаесли атом азота приобрёл три электрона,
то он превращается в отрицательный
ион с зарядом – 3
0
-3
N + 3ē N
27















 Физика
Физика








