Похожие презентации:
Оксиды. Распространение оксидов в природе
1. Тема урока: «ОКСИДЫ»
8классУчитель химии Филипская А.С.
МБОУ СОШ № 8
2016-2017 уч. год
2.
3. Цели урока:
Дать определение понятию «оксид»;Научиться составлять названия оксидов
по международной номенклатуре;
Рассмотреть классификацию
оксидов(основные и кислотные);
Охарактеризовать основные физические
свойства оксидов и основные способы
их получения.
4. Распространение оксидов в природе
5.
6.
7.
8. Красные и магнитные железняки Бурый железняк
9.
10.
11.
12.
13. Номенклатура оксидов
14.
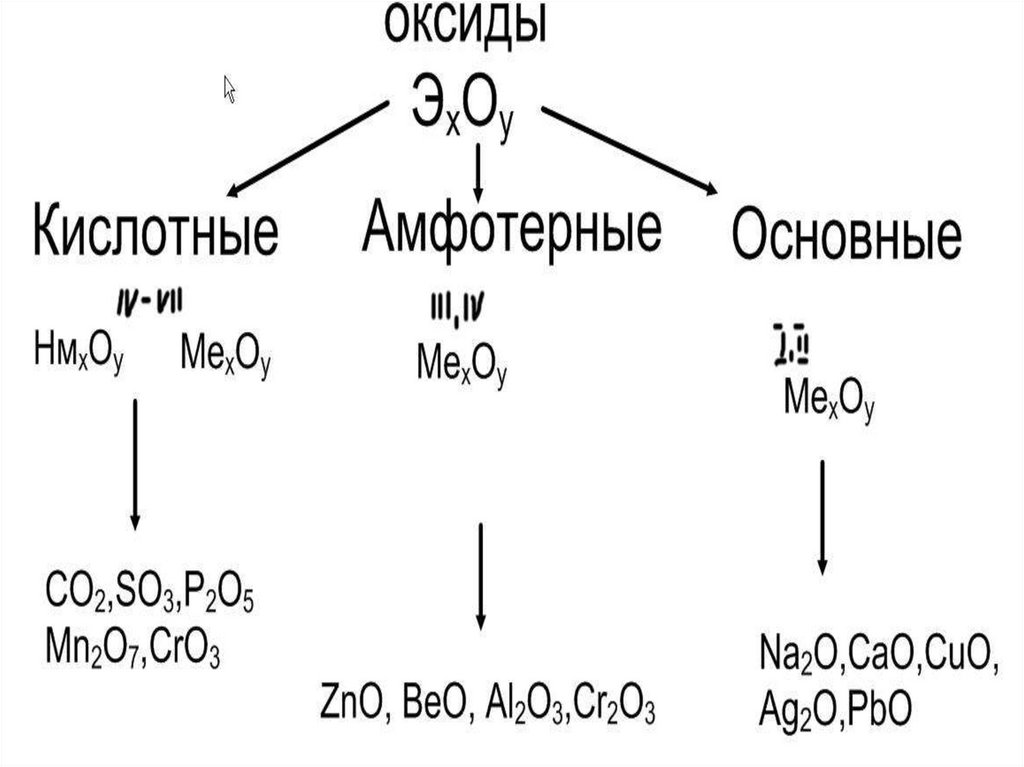
15. Классификация оксидов
16.
17. Физические свойства оксидов
18.
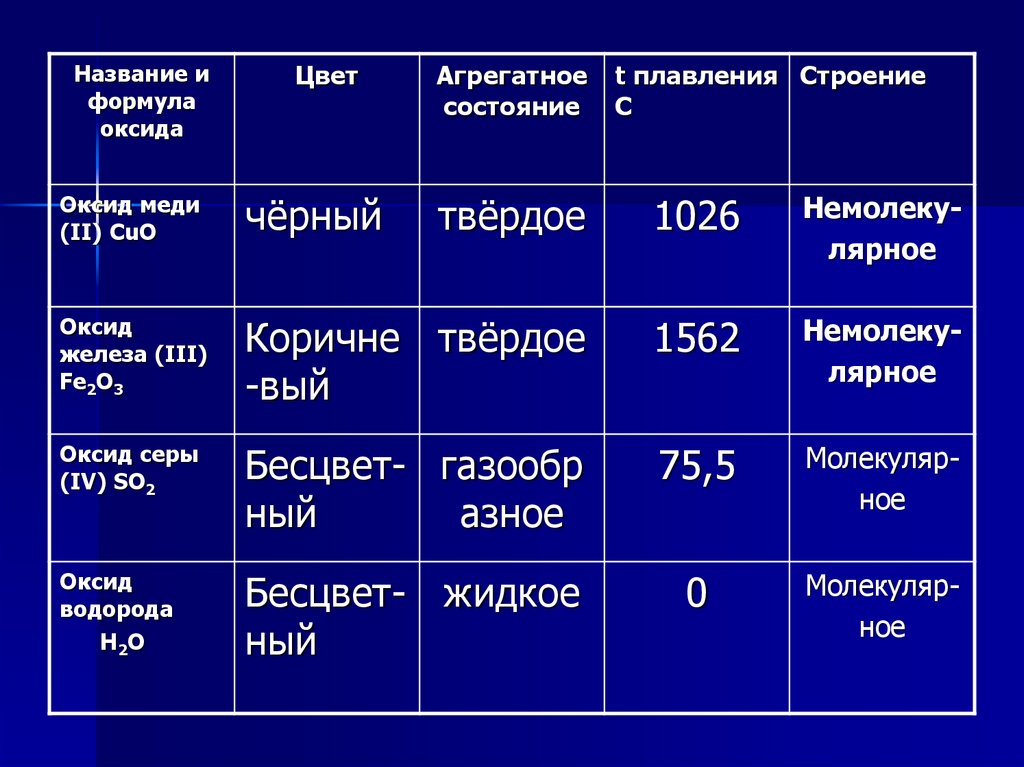
Название иформула
оксида
Цвет
Агрегатное
состояние
t плавления Строение
C
Оксид меди
(II) CuO
чёрный
твёрдое
1026
Немолекулярное
Оксид
железа (III)
Fe2O3
Коричне твёрдое
-вый
1562
Немолекулярное
Оксид серы
(IV) SO2
Бесцвет- газообр
ный
азное
75,5
Молекулярное
Оксид
водорода
H2O
Бесцвет- жидкое
ный
0
Молекулярное
19. Цели урока:
Дать определение понятию «оксид»;Научиться составлять названия оксидов
по международной номенклатуре;
Рассмотреть классификацию
оксидов(основные и кислотные);
Охарактеризовать основные физические
свойства оксидов и основные способы
их получения.
20. Общие способы получения оксидов:
1. Взаимодействием простых веществ с кислородом.2Mg + O2 = 2MgO
2. Горением на воздухе сложных веществ.
В этом случае, как правило, образуются оксиды тех элементов, из которых
состоит сложное вещество. Например:
CH4 + 2O2 = CO2 + 2H2O.
3. Разложением сложных веществ.
а) Разложением нерастворимых оснований.
В этом случае образуются соответствующий оксид металла и вода. Например:
Mg(OH)2 = MgO + H2O.
б) Разложением некоторых кислот.
В этом случае образуются оксид неметалла и вода. Например:
H2SiO3 = SiO2 + H2O
в) Разложением некоторых солей.
CaCO3 = CaO + CO2↑
21.
22.
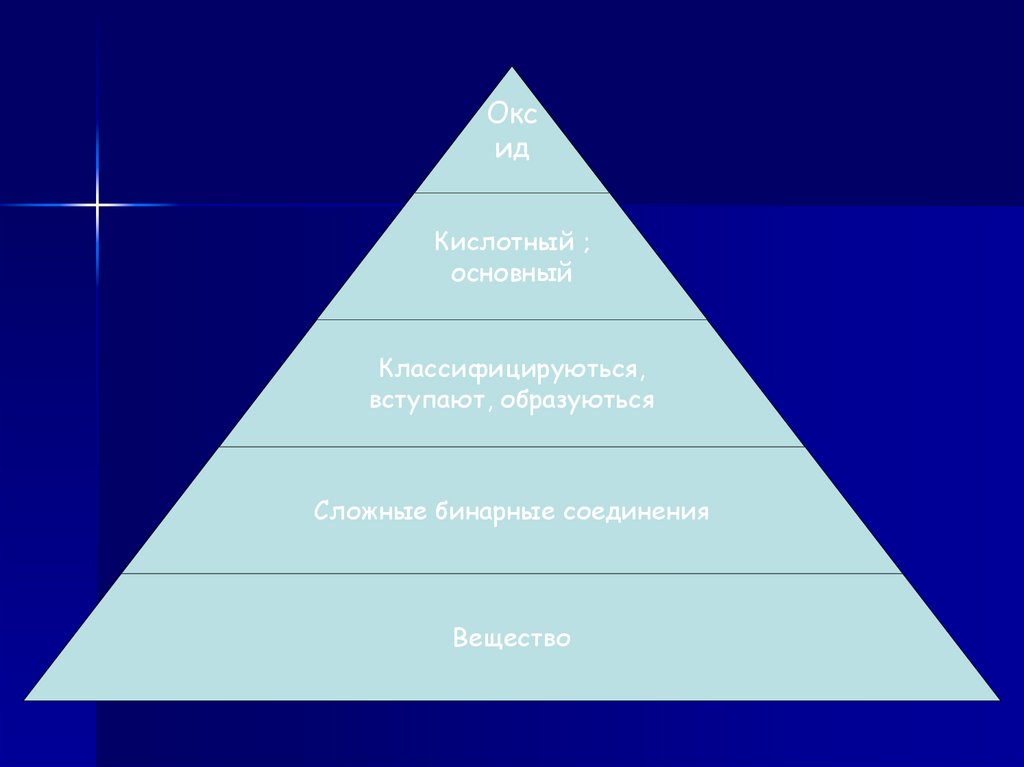
Оксид
Кислотный ;
основный
Классифицируються,
вступают, образуються
Сложные бинарные соединения
Вещество
23. Домашнее задание
Параграф 30№ 1 и № 2 стр. 92
( письменно)


















 Химия
Химия