Похожие презентации:
«Электролиз» расплавов и растворов неорганических веществ
1.
«Электролиз»расплавов и растворов
неорганических веществ
2.
Содержание:Общие понятия электролиза
Порядок разрядки анионов и катионов
Примеры электролиза расплавов
Примеры электролиза растворов солей
Применение
Проверь свои знания
Домашнее задание
3.
Проблемный вопрос.Что произойдёт, если в раствор
или расплав электролита
опустить электроды, которые
присоединены к источнику
электрического тока?
4.
Электролиз – дословно:«лизис» – разложение
«электро» – электрический ток
Цель урока:
сформировать представления у обучающихся
о процессе электролиза, умение составлять
уравнения анодных и катодных процессов,
суммарных процессов электролиза.
5.
Электролиз – это окислительно-восстановительный процесс,протекающий на электродах при
прохождении постоянного
электрического тока через
расплав или раствор электролита.
6.
В расплавах электролизу подвергаются:• щелочи
• термически устойчивые соли
• оксиды металлов
В растворах электролизу подвергаются:
• кислоты
• щелочи
• соли
7.
• Сущность электролизасостоит в том, что за
счёт электрической
энергии осуществляется
химическая реакция,
которая не может
протекать
самопроизвольно.
8.
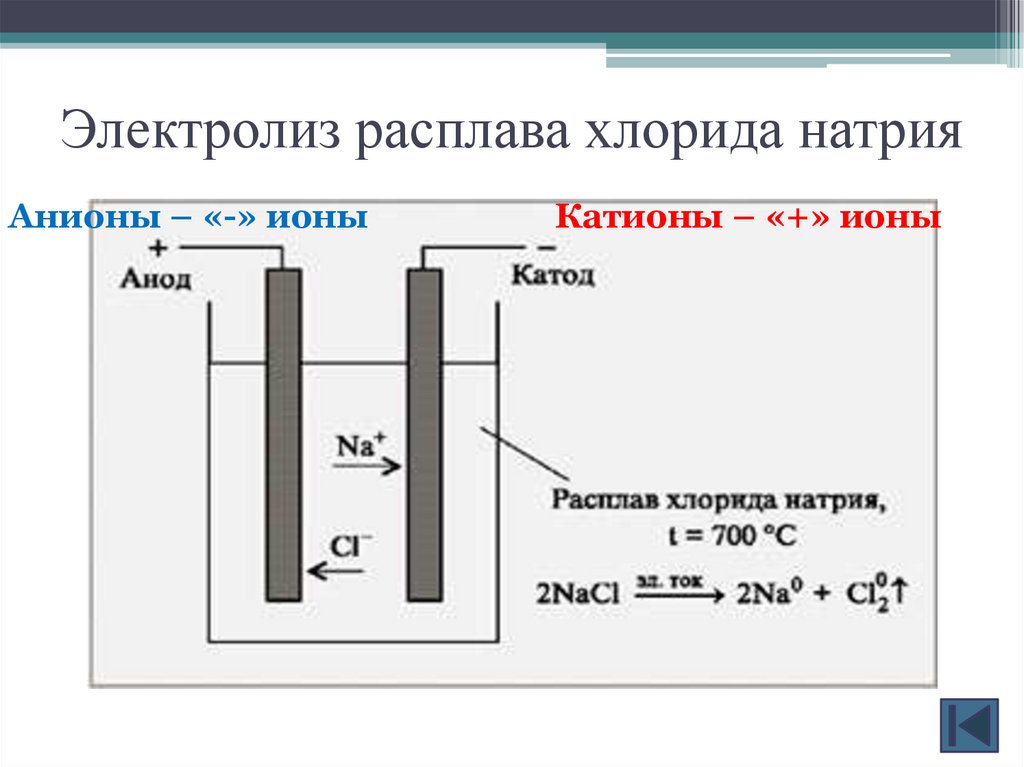
Электролиз расплава хлорида натрияАнионы – «-» ионы
Катионы – «+» ионы
9.
Электролиз – это ОВР• на катоде всегда идёт процесс
восстановления,
• на аноде всегда идёт процесс
окисления.
10.
Для определения результатовэлектролиза существуют следующие
правила:
• Процесс на катоде не зависит от
материала катода, а зависит от
положения металла в
электрохимическом ряду напряжений.
(ЭХРНМе)
11.
Процесс на аноде зависит отматериала анода и от природы
аниона.
1. Если анод нерастворимый, т.е.
инертный (уголь, графит, Pt, Au), то
результаты зависят от анионов
кислотных остатков.
2. Если анод растворимый ( Fe, Cu, Ag, Ni,
Zn и др.), то независимо от природы
аниона идёт окисление самого анода,
например:
Cu0 – 2ē → Cu2+
12.
На аноде – окисление• Порядок окисления анионов:
1) В I очередь окисляются
бескислородные анионы (I -, Br -,
Cl - , S2-...)
и анионов органических кислот:
2RCOO- - 2e → 2CO2 ↑ + R – R
(углеводород)
2) Во II очередь окисляются ОН –
(в щелочной среде)
4ОН - - 4е → О2 ↑ + 2Н2О
или вода
(в кислой и нейтральной среде)
2Н2О – 4е → О2 ↑ + 4Н+
3) не окисляются анионы
кислородосодержащих кислотных
остатков и F -
На катоде – восстановление
ЭХРНМе
( Активность ионов металлов изменяется в обратном
направлении, по сравнению с активностью атомов)
Na+, K+, ……(H+) Cu2+, Ag+, Pt2+, Au3+
Активность ионов растет →
• Порядок восстановления катионов:
1) В I очередь восстанавливаются катионы
Меn+ , стоящие правее водорода (после Н+)
2) Во II очередь восстанавливаются катионы
Н+
(в кислой среде): 2Н+ + 2е → Н2↑
или вода (в нейтральной и щелочной среде)
2Н2О + 2е → Н2 ↑ + 2ОН3) Одновременно могут восстанавливаться
катионы Меn+ и молекулы Н2О (если
катион стоит в ЭХРНМе между Al3+…… Н+ )
4) В растворах никогда не восстанавливаются
Ме, стоящие до Al3+ (включительно)
13.
Электролиз расплава NaClNaCl
расплав
Na+ + Cl-
К(-) : Na+ + 1ē → Na0
А(+) : 2Cl- - 2ē → Cl20
2Na+ + 2Cl2NaCl
Элек. ток
2
1
2Na0 + Cl20↑
2Na0 + Cl20↑
14.
Электролиз расплава NaОНNaОН
расплав
Na+ + ОН-
К(-) : Na+ + 1ē → Na0
А(+) : 4ОН- - 4ē → 2Н2О + О2 ↑
4
1
4Na+ + 4ОН- → 4Na0 + 2Н2О + О2 ↑
эл. ток
4NaОН → 4Na0 + 2Н2О + О2 ↑
15.
Электролиз расплава Al2O3 в криолитеAl2О3
2Al3+ + 3О2Na3AlF6
расплав
К(-) : Al3+ + 3ē → Al0
А(+) : 2О2- - 4ē → О20 ↑
эл. ток
4
3
2 Al2О3 → 4Al0 + 3О2 ↑
16.
Электролиз раствора солибескислородной кислоты NaCl
NaCl
Na+ + ClNa+
Н2О
К(-) : 2Н2О + 2е → Н20↑ + 2ОНА(+) : 2Cl- - 2ē → Cl20↑
1
1
2Н2О + 2Cl- → Н20↑ + 2ОН- + Cl20↑
эл. ток
2NaCl + 2Н2О → Н20↑ + 2 NaОН + Cl20↑
катод
анод
17.
Электролиз раствора соликислородосодержащей кислоты CuSO4
CuSO4
Cu2+ + SO42SO42Н2О
К(-) : Cu2+ + 2e → Cu0↓
2
1
А(+) : 2H2O – 4e → O2↑ + 4H+
2Cu2+ + 2Н2О → 2Cu0 + O2↑ + 4H+
эл. ток
2CuSO4 + 2H2O → 2Cu0↓+ O2↑ + 2H2SO4
катод
анод
18.
Самостоятельная работа• Проанализируйте процесс электролиза
водного раствора сульфата натрия.
• Используя инструкции, запишите
катодный и анодный процессы,
уравнение электролиза данной соли.
• К чему сводится электролиз сульфата
натрия и аналогичных солей?
19.
Электролиз раствора соли Na2SO4Na2SO4
2Na+ + SO42Н2О
К(-) : 2Н2О + 2е → Н20↑ + 2ОНА(+) : 2H2O – 4e → O2↑ + 4H+
Na+
SO42-
2
1
4Н2О + 2H2O → 2Н20↑ + 4ОН- + O2↑ + 4H+
эл. ток
2Н2О → 2Н20↑ + O20↑
катод
анод
Электролиз сводится к электролизу воды
20.
Электролиз раствора солиорганической кислоты СН3СООNa
СН3СООNa
СН3CОО- + Na+
Na+
Н2О
К(-) : 2Н2О + 2е → Н20↑ + 2ОНА(+) : 2СН3CОО- - 2ē → 2CО2↑ + С2Н6↑
1
1
2Н2О + 2СН3CОО- → Н20↑ + 2ОН- + 2CО2↑ + С2Н6↑
эл. ток
2СН3CООNa + 2Н2О → Н20↑+ 2NaОН + 2CО2↑ + С2Н6↑
катод
анод
21.
Электролиз раствора соли NiCl2 , при которомна катоде происходит 2 процесса восстановления
NiCl2
Ni 2+ + 2ClNi2+
Н2О
К(-) : 1) 2Н2О + 2е → Н20↑ + 2ОН- 1 Для таких
процессов принято
2) Ni 2+ + 2e → Ni 0↓
записывать
1
0
А(+) : 2Cl - 2ē → Cl2 ↑
2 уравнения
1) 2Н2О + 2Cl- → Н20↑ + 2ОН- + Cl20↑
NiCl2 + 2Н2О → Н20↑ + Ni(ОН)2↓ + Cl20↑
2) Ni 2+ + 2Cl- → Ni 0↓ + Cl20↑
NiCl2 → Ni 0↓ + Cl20↑
или записываем суммарное уравнение:
эл. ток
2NiCl2 + 2Н2О → Ni 0↓+ Н20↑ + Ni(ОН)2↓ + 2Cl20↑
катод
анод
22.
Применение электролизаКатодные процессы
Анодные процессы
• В гальваностегии
( никелирование,
серебрение).
• В гальванопластике
(изготовление копий).
• Получение чистых металлов
(натрий, медь, алюминий).
• Электрометаллургия
расплавов. Очистка
металлов, полученных при
выплавке из руды, от
посторонних примесей.
• Промышленный способ
получения кислорода и
водорода.
• Оксидирование
алюминия.
• Электрополировка
поверхностей
(электроискровая
обработка,
электрозаточка).
• Электрогравировка.
23.
Применение электролизаПроцесс очищения
предметов электролизом
Результат процесса
24.
25.
Гальванопластика политехническогогосударственного музея
«Георгий Победоносец»
Барельеф
«Портрет Б.С.Якоби»
26.
27.
(Правильный ответ - жми на чёрныйпрямоугольник, находящийся под вариантом
ответа.)
28.
Установите правильнуюпоследовательность в определении
электролиза
1.
2.
3.
4.
5.
6.
7.
окислительно-восстановительные реакции
если через раствор или расплав
Электролиз – это
протекающие на электродах
пропускают
электролита
постоянный ток
3, 1, 4, 2, 6, 5, 7
29.
Ответьте на вопросы:1. При электролизе к аноду движутся:
а) катионы б) анионы в) все ионы г) электроны
2. При электролизе расплава хлорида меди (II)
на катоде выделится:
а) медь б) водород в) хлор г) кислород
3. На аноде выделится кислород при электролизе
растворов: а) CuBr2 б) NaNO3 в) FeCl3
30.
4. Установите соответствие между формулой вещества ипродуктом, образующимся на катоде при электролизе её водного
раствора
ФОРМУЛА ВЕЩЕСТВА
ПРОДУКТ ЭЛЕКТРОЛИЗА
А) CuBr2
Б) CuSO4
В) NaNO3
Г) Ba(NO3)2
А
Б
2
2
1)
H2
2)
Cu
3)
Na
4)
Ba
5)
NO2
6)
Br2
В
1
Г
1
31.
5. Установите соответствие между формулой вещества ипродуктом, образующимся на инертном аноде при электролизе
её водного раствора
ФОРМУЛА ВЕЩЕСТВА
ПРОДУКТ ЭЛЕКТРОЛИЗА
А) ZnSO4
Б) NiCl2
В) NiF2
Г) Na2S
А
1)
Cl2
2)
O2
3)
H2
4)
S
5)
SO2
6)
HF
Б
2
1
В
2
Г
4
32.
6. Установите соответствие между названием соли ипродуктами электролиза её водного раствора на инертных
электродах
НАЗВАНИЕ СОЛИ
ПРОДУКТ ЭЛЕКТРОЛИЗА
А) хлорид меди(II) (раствор)
Б) хлорид меди(II) (расплав)
В) хлорид натрия (раствор)
Г) хлорид натрия (расплав)
А
Б
4
4
1)
водород, хлор
2)
натрий, хлор
3)
гидроксид меди(II), водород
4)
медь, хлор,
5)
водород, кислород
6)
гидроксид натрия, хлор,
водород
В
6
Г
2
33.
7. Установите соответствие между формулой соли иуравнением процесса, протекающего на аноде при электролизе
её водного раствора.
ФОРМУЛА СОЛИ
УРАВНЕНИЕ АНОДНОГО ПРОЦЕССА
А) KCl
Б) AlBr3
В) CuSO4
Г) AgNO3
А
1)
1) 2H2O – 4e → O2 + 4H+
2)
2) 2H2O + 2e → H2 + 2OH-
3)
3) 2Cl- -2e → Cl20
4)
4) 2Br- - 2e → Br20
5)
5) 2SO42- -2e → S2O82-
6)
6) 2NO3- -2e → 2NO2 + O2
Б
3
4
В
1
Г
1
34.
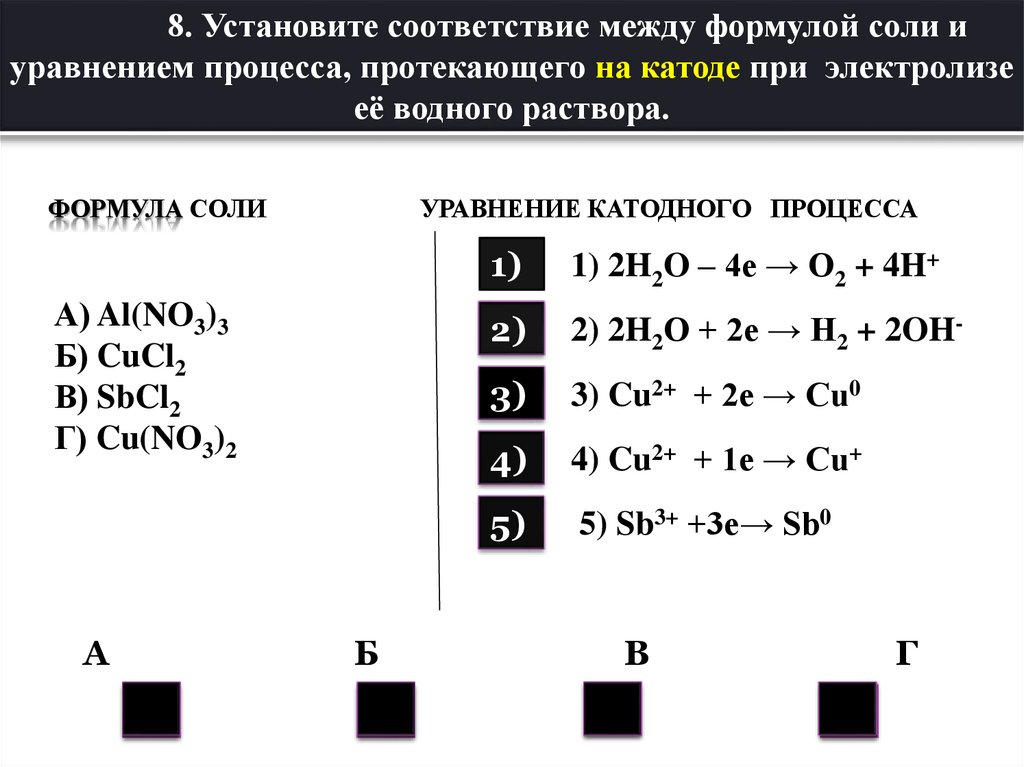
8. Установите соответствие между формулой соли иуравнением процесса, протекающего на катоде при электролизе
её водного раствора.
ФОРМУЛА СОЛИ
УРАВНЕНИЕ КАТОДНОГО ПРОЦЕССА
А) Al(NO3)3
Б) CuCl2
В) SbCl2
Г) Cu(NO3)2
А
1)
1) 2H2O – 4e → O2 + 4H+
2)
2) 2H2O + 2e → H2 + 2OH-
3)
3) Cu2+ + 2e → Cu0
4)
4) Cu2+ + 1e → Cu+
5)
5) Sb3+ +3e→ Sb0
Б
2
3
В
2
Г
3
35.
9. Задача: Сравните, какие продукты будут находиться в растворе врезультате электролиза водного раствора нитрата меди(II) с
инертными электродами в двух случаях:
а) соль полностью подвергнута электролизу и после этого
электроды сразу вынуты из раствора;
б) соль полностью подвергнута электролизу, после этого в течение
некоторого времени электроды остаются в растворе.
Первый случай.
Решение:
При электролизе раствора нитрата меди(II) на инертных
электродах будут протекать следующие процессы:
А(+): 2H2O – 4e → 4H+ + O2↑
К(–): Cu2+ + 2e → Cu0
Суммарное уравнение электролиза:
2Cu2+ + 2H2O → 2Cu0 + 4H+ + O2↑
В молекулярном виде:
2Cu(NO3)2 + 2H2O → 2Cu + O2↑ + 4HNO3
Если по окончании электролиза соли сразу вынуть электроды, то
в электролитической ванне останется раствор азотной кислоты.
36.
Второй случай: В условии не оговорено, отключен лиэлектрический ток после полного электролиза соли. Если в
растворе азотной кислоты находятся подключенные к источнику
тока электроды, раствор будет подвергаться дальнейшему
электролизу:
A(+): 2H2O – 4e → 4H+ + O20↑
K(–): 2H+ + 2e → H20↑
Суммарное уравнение:
2H2O → 2H2↑ + O2↑
В результате концентрация азотной кислоты будет увеличиваться.
Если ток отключен сразу же после полного электролиза нитрата
меди(II), то получившаяся разбавленная азотная кислота будет
реагировать с медью, осажденной на катоде:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
В растворе останутся нитрат меди(II) и азотная кислота.



































 Химия
Химия








