Похожие презентации:
Электролиз расплавов и растворов солей
1. Электролиз расплавов и растворов солей
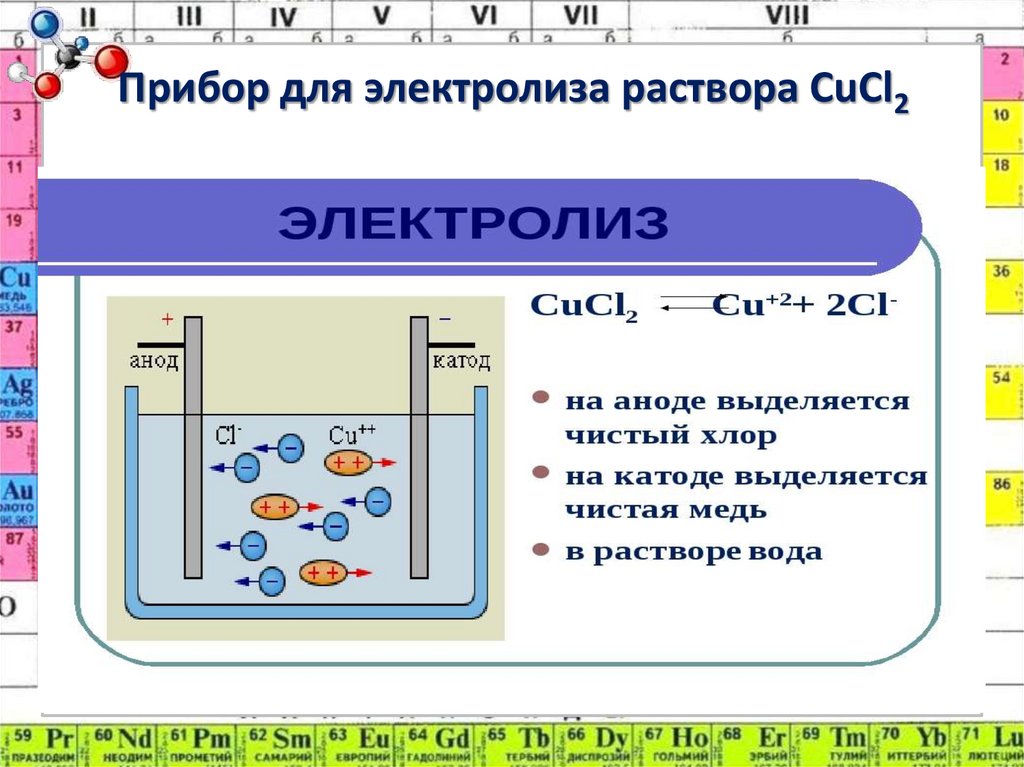
2. Электролиз –
это окислительновосстановительный процесс,протекающий на электродах,
при пропускании постоянного
электрического тока через
раствор или расплав
электролита.
3. Прибор для электролиза раствора CuCl2
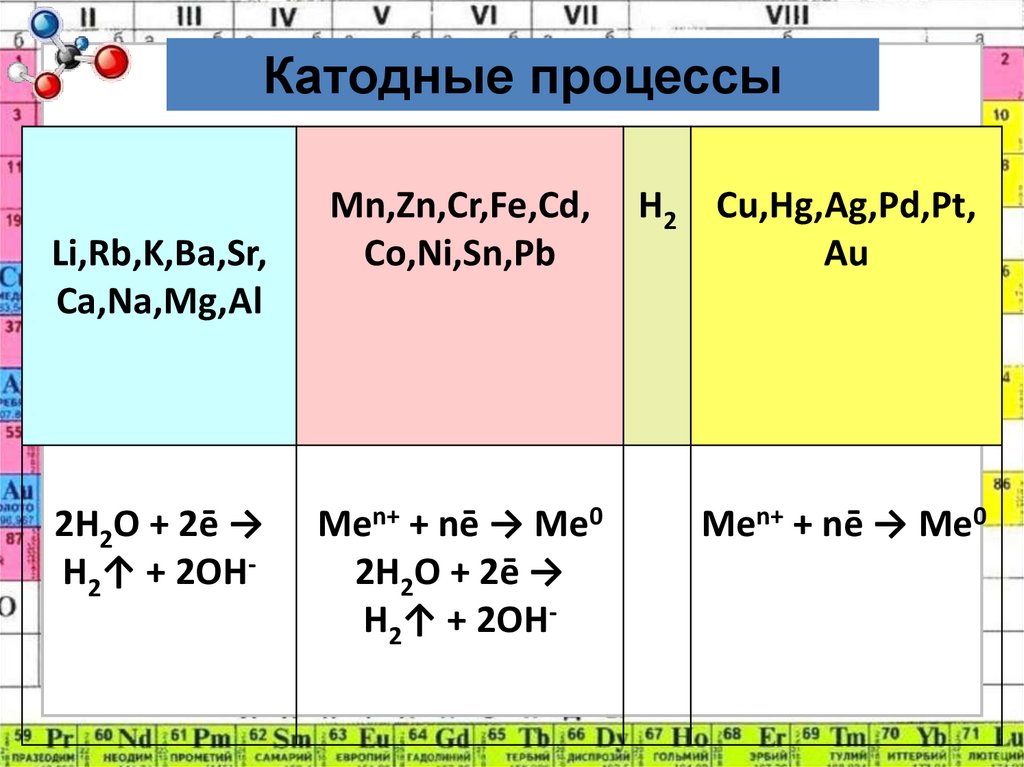
4. Катодные процессы:
1. Катионы металлов после Н (от Cu2+ до Au3+)полностью восстанавливаются на катоде.
2. Катионы металлов от Li+ до Al+3
включительно не восстанавливаются,
вместо них восстанавливаются молекулы
воды:
2H2O + 2ē → H2↑+2OHˉ
3. Катионы металлов от Al 3+ до H+
восстанавливаются одновременно с
молекулами воды.
5.
Катодные процессыLi,Rb,K,Ba,Sr,
Ca,Na,Mg,Al
2H2O + 2ē →
H2↑ + 2OH-
Mn,Zn,Cr,Fe,Cd,
Co,Ni,Sn,Pb
H2 Cu,Hg,Ag,Pd,Pt,
Au
Men+ + nē → Me0
2H2O + 2ē →
H2↑ + 2OH-
Men+ + nē → Me0
6. Анодные процессы
1. В первую очередь на анодеокисляются бескислородные анионы:
S²ˉ, Iˉ, Brˉ, Clˉ (кроме Fˉ )и анионы
органических кислот:
2RCOOˉ - 2ē → 2 CO2↑ + R-R
2. Во вторую очередь OHˉ анионы,
окисляются молекулы воды:
2H2О – 4ē → О2↑ + 4Н+
7.
Анодные процессыБескислородный
(Cl , Br , I , S и др.)
Кислородсодержащий
(SO4, NO3,CO3, F
и др.)
Окисление анионов
(кроме фторидов)
В кислой, нейтральной
средах:
A - nē → A
2H2O – 4ē → O2↑ + 4H
B щелочной среде:
4OH - 4ē → O2↑ + 2H2O
8.
ПримерыCuSO4 → Cu2+ + SO4²ˉ
-К: Cu2+ + 2ē → Cuº
+A: 2H2O – 4ē → O2↑ + 4Н+
ˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉ
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
9.
Na2CО3 → 2Na+ + CО3²ˉ-K: 2H2O + 2ē → H2º +2OH ˉ
+А : 2H2O – 4ē → O2º +4H+
2H2O→ 2H2º +O2º
10.
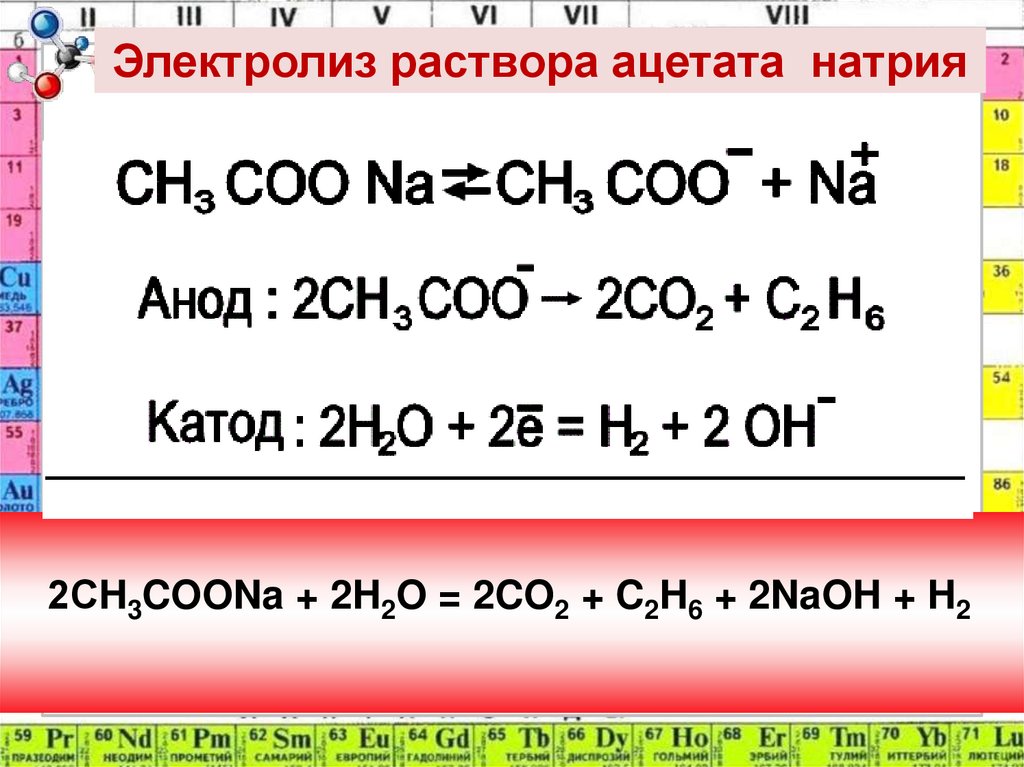
Электролиз раствора ацетата натрия2СH3COONa + 2H2O = 2CO2 + C2H6 + 2NaOH + H2
11.
1.Установите соответствие между формулой соли иуравнением процесса, протекающего на аноде
при электролизе её водного раствора.
ФОРМУЛА СОЛИ
А) KCl
Б) AlBr3
В) CuSO4
Г) AgNO3
УРАВНЕНИЕ АНОДНОГО ПРОЦЕССА
1) 2H2O – 4e → O2 + 4H+
2) 2H2O + 2e → H2 + 2OH3) 2Cl- -2e → Cl20
4) 2Br- - 2e → Br20
5) 2SO42- -2e → S2O826) 2NO3- -2e → 2NO2 + O2
12.
2. Установите соответствие между формулой соли и продуктом,образующимся на катоде при электролизе её водного раствора.
ФОРМУЛА СОЛИ
ПРОДУКТЫ НА КАТОДЕ
А) CuBr2
1) H2
Б) CuSO4
2) Сu
В) NaNO3
3) Na
Г) Ba(NO3)2
4) Ba
5) NO2
6) Br2
3. Установите соответствие между формулой соли и уравнением процесса,
протекающего на катоде при электролизе её водного раствора.
ФОРМУЛА СОЛИ
УРАВНЕНИЕ КАТОДНОГО ПРОЦЕССА
А) Al(NO3)3
1) 2H2O – 4e → O2 + 4H+
Б) CuCl2
2) 2H2O + 2e → H2 + 2OHВ) SbCl2
3) Cu2+ + 2e → Cu0
Г) Cu(NO3)2
4) Cu2+ + 1e → Cu+
5) Sb3+ +3e→ Sb0









 Химия
Химия








