Похожие презентации:
Закономерности изменения свойств химических элементов в Периодической системе химических элементов
1.
«Закономерности изменениясвойств химических
элементов в Периодической
Системе Химических
Элементов
( ПСХЭ)»
2.
I. ТЕСТ «ПОВТОРЕНЬЕ –МАТЬУЧЕНЬЯ»
• 1) Как определить число энергетических
уровней в атоме элемента:
• а) по порядковому номеру элемента
• б) по номеру группы
• в) по номеру ряда
• г) по номеру периода
3.
ПОВТОРЕНЬЕ –МАТЬ УЧЕНЬЯ• 2) Как определяется место химического
элемента в периодической системе Д.И.
Менделеева:
• а) количеством электронов на внешнем
уровне
• б) количеством нейтронов в ядре
• в) зарядом ядра атома
• г) атомной массой
4.
ПОВТОРЕНЬЕ –МАТЬ УЧЕНЬЯ• 3)Сколько энергетических уровней в атоме
кальция:
• а) 1
• б) 2
• в) 3
• г) 4
5.
ПОВТОРЕНЬЕ –МАТЬ УЧЕНЬЯ• 4) Укажите элемент, возглавляющий
большой период периодической системы
элементов:
• а) Cu (№29)
• б) Ag (№47)
• в) К (№19)
• г) Au (№79)
6.
ПОВТОРЕНЬЕ –МАТЬ УЧЕНЬЯ• 5) Атом, в ядре которого содержится 18
нейтронов и 16 протонов, имеет заряд
ядра:
• а) +35
• б) +1
• в) +18
• г) +16
7.
ПОВТОРЕНЬЕ –МАТЬ УЧЕНЬЯ• 6) Атомы одного химического элемента
содержат:
• а) одинаковое число нейтронов в ядре
• б) одинаковое число протонов и
нейтронов
• в) одинаковое число протонов и
электронов
• г) разное число протонов в ядре
8.
ПОВТОРЕНЬЕ –МАТЬ УЧЕНЬЯ• 7) Назовите элемент, расположенный в II
периоде , на внешнем слое атома 4
электрона:
• а) S
• б) Si
• в) Ti
• г) C
9.
ПОВТОРЕНЬЕ –МАТЬ УЧЕНЬЯ8) Оперделите схему строения атома фтора:
а)
+? )
)
)
2e 8e 1e
б) +? )
)
)
2e 8e 7e
в) +? )
)
2e 8e
г) +? )
)
2e 5e
10.
ПОВТОРЕНЬЕ –МАТЬ УЧЕНЬЯ• 9) Определите какой это элемент:
+Z) ) ) ?
4е
• а) №12 , Mg
• б) № 6, C
• в) № 4, Be
• г) №14, Si
11.
ПРОВЕРКА1) г 2)в 3)г
4)в
5)г
6) в
7)г
8)г
9)б
12.
«Закономерности изменениясвойств химических
элементов
в ПСХЭ»
13.
1.Изменение свойствхимических элементов
в периодах
14.
Период- это горизонтальный ряд химическихэлементов, который начинается с водорода или
щелочного металла и заканчивается неметаллом благородным газом
15.
Например:• IIпериод: Li……………………………………Ne
• III период: Na…………………………….....Ar
• IV период: K……………………………………….
………………………………………………………….Kr
16.
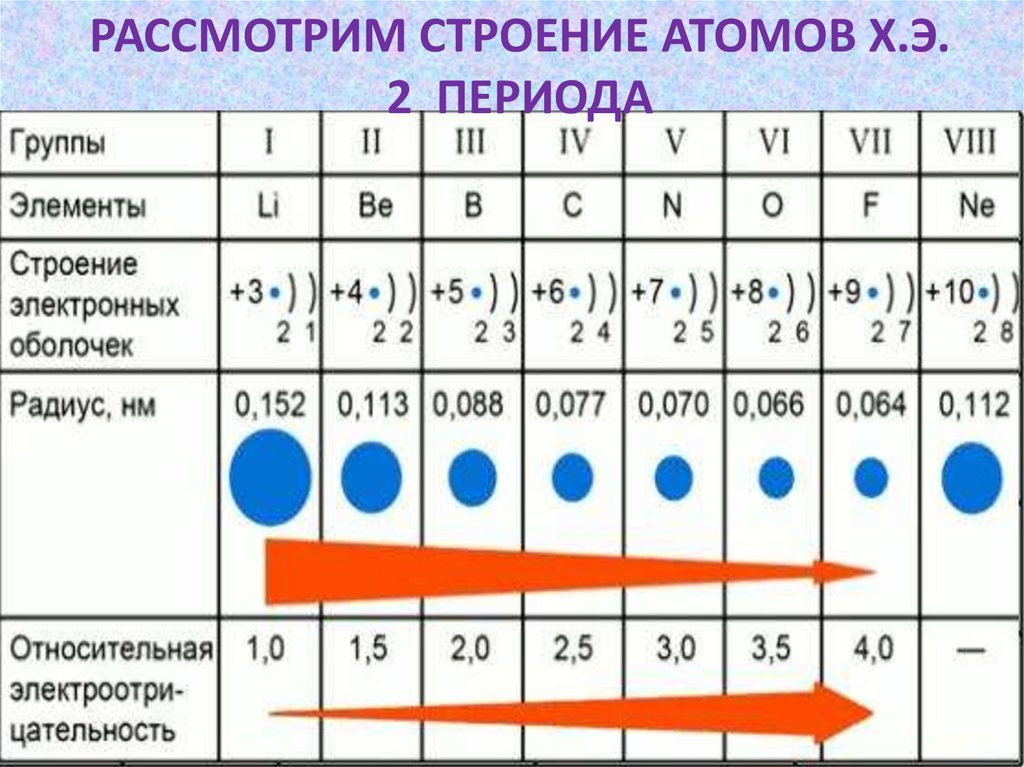
РАССМОТРИМ СТРОЕНИЕ АТОМОВ Х.Э.2 ПЕРИОДА
17.
Рассмотрим строение атомов х.э. напримере х.э. III периода
13Na +13 )
)
2e 8e
) или 1s2 2s2 2p6 3s1
1e
) или 1s2 2s2 2p6 3s2
2e 8e 2e
……………………………………………………………..
17Cl +13 ) ) )
или 1s2 2s2 2p6 3s2 3р5
2e 8e 7e
12Mg +12 ) )
18.
Изменение радиуса атома х.э. впериодах слева направо
19.
20.
Вывод №1.В одном периоде слеванаправо:
1)заряд ядра атома увеличивается;
2)количество электронов на внешнем слое
атомов увеличивается;
3) радиус атома уменьшается;
4) способность атомов принимать
электроны увеличивается;
5) ослабевают металлические и
усиливаются неметаллические свойства
21.
Вывод №2Период- это горизонтальный
ряд химических элементов, в
котором слева направо
ослабевают металлические и
усиливаются неметаллические
свойства
22.
2.Изменение свойствхимических элементов
в группах
главных подгруппах
23.
Вспомним, что• ГРУППА Х.Э. – вертикальный ряд
химических элементов, сходных по
свойствам .
• стр.183 (2019г) или 169 ( 2018г)
учебника.
24.
Изменения свойствхимических элементов и их соединений в
группах главных подгруппах (А)
В группах все элементы имеют сходное электронное
строение.
25.
Различий в наполнении внешнего энергетическогоуровня электронами нет.
Номер группы периодической системы соответствует
числу электронов на внешней электронной оболочке
атомов элементов этой группы
26.
27.
Вывод №3. В одной группе сверхувниз:
1)заряд ядра атома увеличивается;
2)количество электронов на внешнем
слое не изменяется;
3) радиус атома увеличивается;
4) способность атомов отдавать
электроны увеличивается;
5) усиливаются металлические и
ослабевают неметаллические
свойства
28.
Вывод №4.ГРУППА Х.Э. – ЭТО вертикальный ряд
химических элементов, в котором
сверху вниз усиливаются
металлические свойства
29.
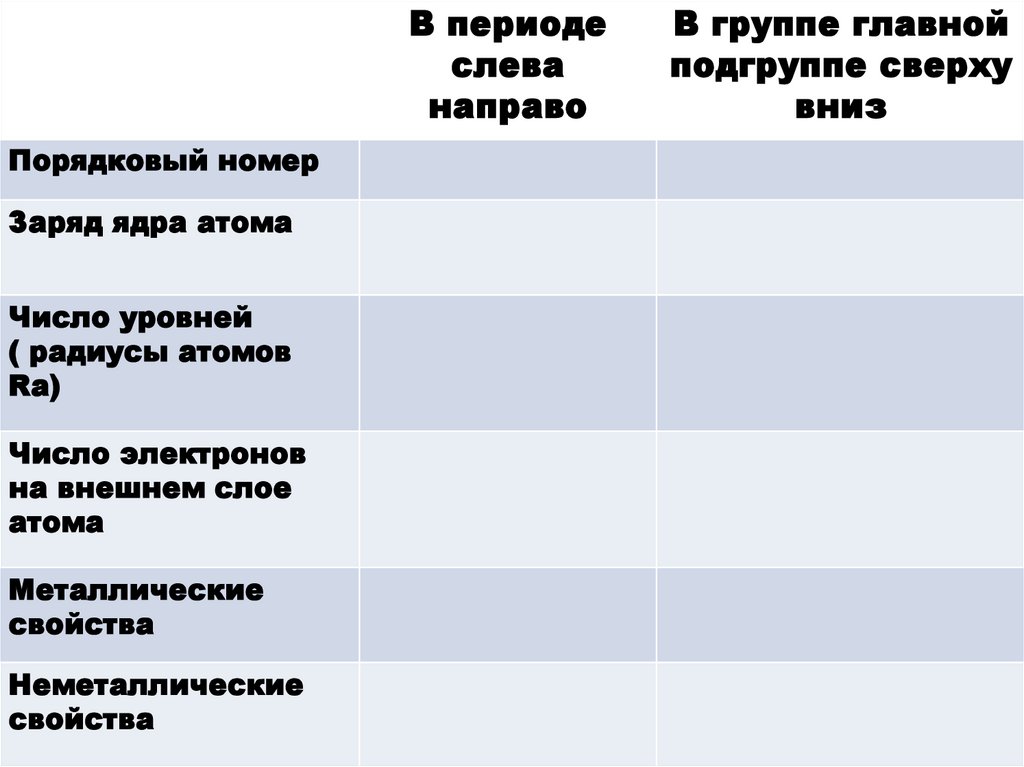
Задание №1.Заполните таблицу
«Закономерности изменения
свойств химических элементов
в ПСХЭ»
30.
В периодеслева
направо
Порядковый номер
Заряд ядра атома
Число уровней
( радиусы атомов
Ra)
Число электронов
на внешнем слое
атома
Металлические
свойства
Неметаллические
свойства
В группе главной
подгруппе сверху
вниз
31.
Задание №2Тест
• 1) Как изменяются радиусы атомов в
периоде:
• а) увеличиваются
• б) уменьшаются
• в) не изменяются
32.
• 2)У какого из элементов более выраженыметаллические свойства
• а) литий
• б) калий
• в) натрий
33.
3)Между радиусами атомов поставитьзнаки больше или меньше
а) радиус атома натрия
б) радиус атома фтора
г) радиус атома серы
радиус атома магния
радиус атома брома
радиус атома фосфора
34.
• 4)Как изменяются радиусы атомов вглавных подгруппах сверху вниз:
• а) увеличиваются
• б) уменьшаются
• в) не изменяются
35.
• 5) Чем определяются свойства химическихэлементов:
• а) величиной относительной атомной масс
б) числом электронов на внешнем слое
• в) зарядом ядра атома
36.
• 6)У какого элемента наиболее выраженынеметаллические свойства:
• а) Кремний
• б) Углерод
• г) Кислород
37.
• 7)Металлический характер свойствэлементов в ряду Li --> Na --> K --> Rb:
• 1) уменьшается
• 2) возрастает
• 3) не изменяется
38.
• 8) Неметаллические свойства усиливаютсяв ряду:
• 1) S, O, F
• 2) B, C, Si
• 3) S, P, As
• 4) O, Br, F
39.
Задание1) Записать все выводы и выполнить
задания из презентации или из
документа к уроку
2) §48 стр.208-210 или 192-193
( изучить)






































 Химия
Химия








