Похожие презентации:
Оксиды, их классификация и свойства
1.
19.02.2024ОКСИДЫ, ИХ
КЛАССИФИКАЦИЯ
И СВОЙСТВА
2.
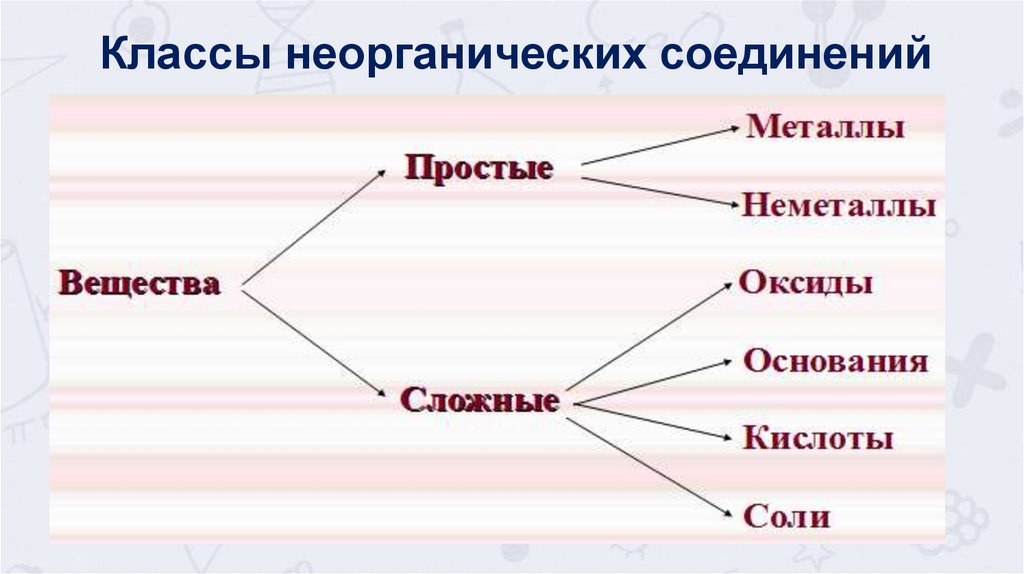
Классы неорганических соединений3.
Оксиды – сложные веществаОксиды – бинарные соединения
4.
Оксиды• Э — элемент (металл или неметалл),
• О — кислород (валентность II)
5.
Оксиды — это сложныевещества, состоящие из двух
ХЭ, один из которых кислород с
валентностью II
(исключение
—
фторид
кислорода ОF2 ).
6.
Номенклатура оксидов• Na2O — оксид натрия
• СаО — оксид кальция
• Fe2O3 — оксид железа (III)
• CO2 — оксид углерода (IV)
7.
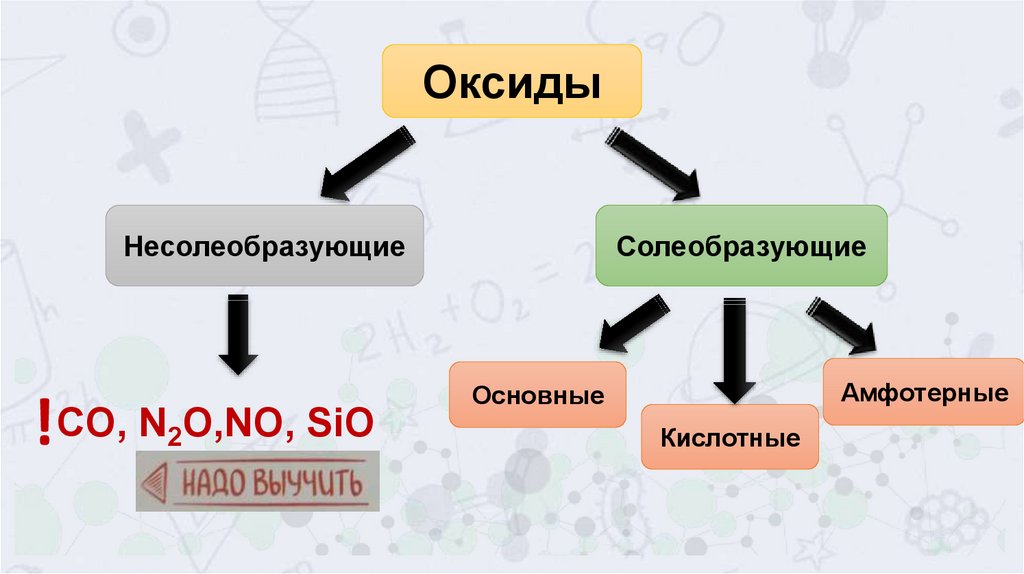
ОксидыНесолеобразующие
!CO, N O,NO, SiO
2
Солеобразующие
Амфотерные
Основные
Кислотные
8.
Основные это оксиды Мē с валентностьюI или II, которым соответствуют основания.
(исключение: BeO — оксид бериллия,
ZnO — оксид цинка
I или II
Пример:
II
Meх Оу
Na2O - NaOH,
CaO – Ca(OH)2,
CuO – Cu(OH)2
9.
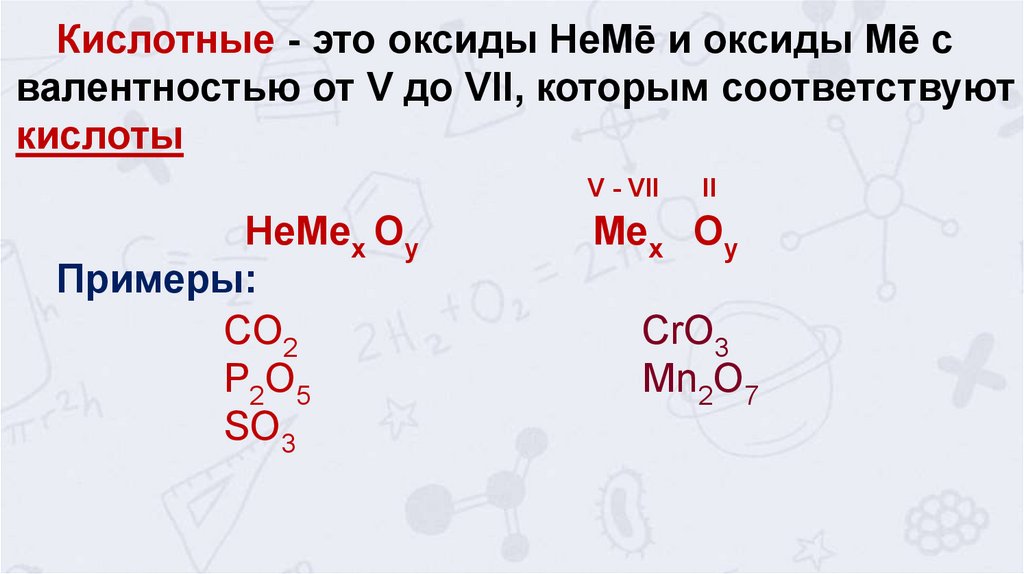
Кислотные - это оксиды НеМē и оксиды Мē свалентностью от V до VII, которым соответствуют
кислоты
V - VII
НеMeх Оу
Примеры:
CO2
P2O5
SO3
II
Meх Оу
CrO3
Mn2O7
10.
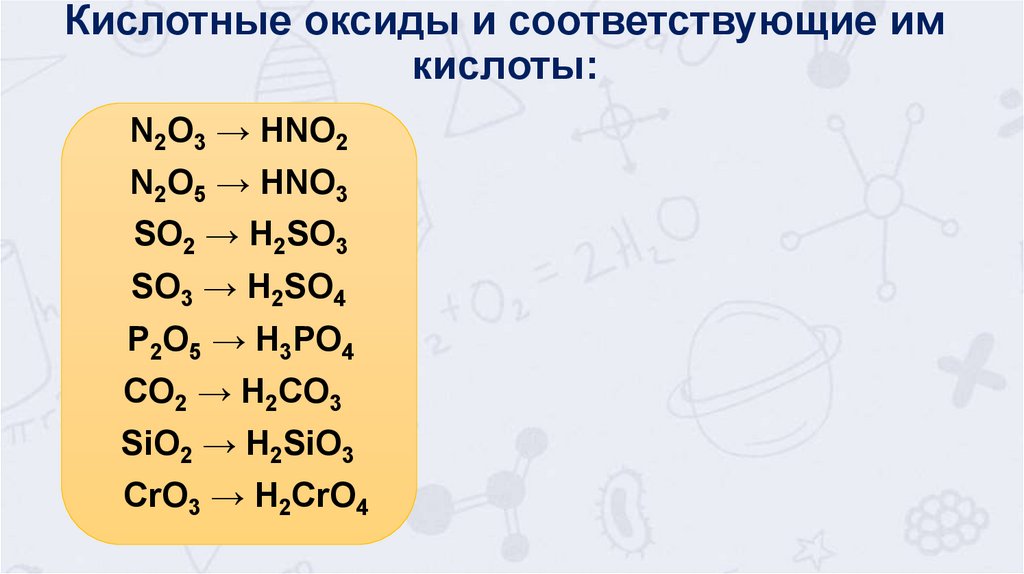
Кислотные оксиды и соответствующие имкислоты:
N2O3 → HNO2
N2O5 → HNO3
SO2 → H2SO3
SO3 → H2SO4
P2O5 → H3PO4
CO2 → H2CO3
SiO2 → H2SiO3
CrO3 → H2CrO4
11.
Амфотерные это оксиды Мē,которымсоответствуют амфотерные гидроксиды:
BeO — Be(OH)2
ZnO — Zn(OH)2
Al2O3 — Al(OH)3
Cr2O3 — Cr(OH)3
Fe2O3 —Fe(OH)3
12.
13.
ОксидСоответствующий
гидроксид
Основный оксид
Основание
Кислотный оксид
Кислота
Амфотерный оксид
Амфотерный
гидроксид
14.
Физические свойства оксидовFe2O3
NO2
Pb2O3
Cr2O3
MnO2
15.
Вода – жидкий оксид16.
Оксид кремния (IV) –твёрдый оксид
17.
Углекислый и угарный газ – газообразные оксиды18.
19.
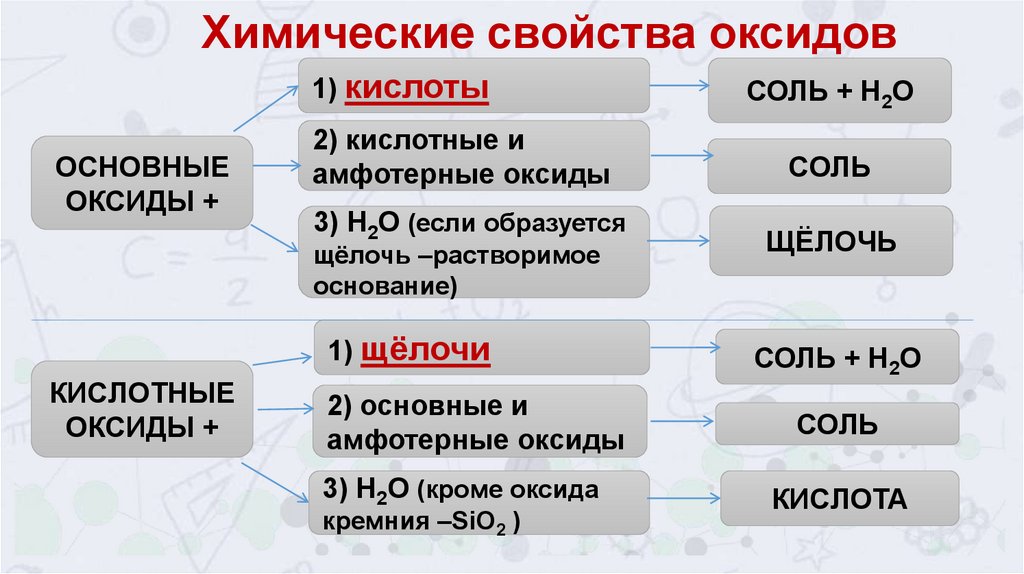
Химические свойства оксидов1) кислоты
ОСНОВНЫЕ
ОКСИДЫ +
2) кислотные и
амфотерные оксиды
3) Н2О (если образуется
щёлочь –растворимое
основание)
1) щёлочи
КИСЛОТНЫЕ
ОКСИДЫ +
СОЛЬ + Н2О
СОЛЬ
ЩЁЛОЧЬ
СОЛЬ + Н2О
2) основные и
амфотерные оксиды
СОЛЬ
3) Н2О (кроме оксида
КИСЛОТА
кремния –SiO2 )
20.
21.
Применение оксидов• Оксид цинка ZnO
22.
Применение оксидов• Оксид титана (IV) TiO2
23.
Применение оксидов• Оксид хрома (III) Cr2O3
24.
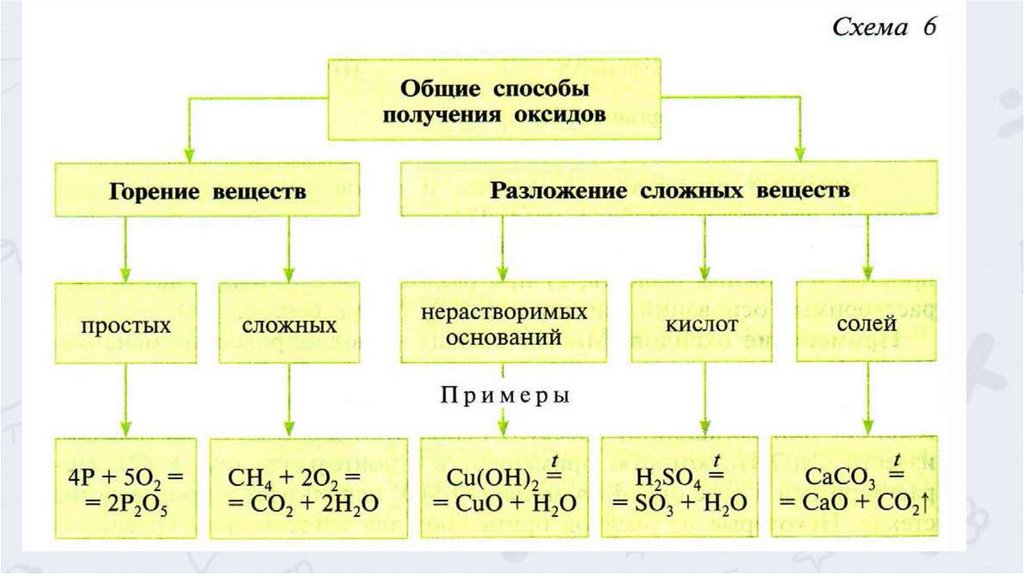
Дома: § 40, упр 1,2,3,4 (п.)1. Распределите оксиды: N2О3, BaO, FeO, SО2, СО, SiО2,
К2О, CrО3 по таблице:
Несолеобра Кислотные
зующие
оксиды
оксиды
Гидроксиды, им
соответствующие
Основные
оксиды
Гидроксиды, им
соответствующие
2. Приведите уравнения возможных реакций между:
а) оксидом бария и: СО2, HNО3, NaOH, Н2О, CuO, HBr;
б) оксидом серы(VI) и: CaO, НСl, KOH, Н2O, СО, Na2O.
3. К 134 г раствора с массовой долей хлорида меди(II) 2%
добавили избыток раствора нитрата серебра. Определите
массу выпавшего осадка.

















 Химия
Химия








