Похожие презентации:
Классификация и свойства оксидов
1.
Презентацию выполнила:Мальшина Т.Н.,
преподаватель химии
БПОУ ВО
«Борисоглебскмедколледж»
2.
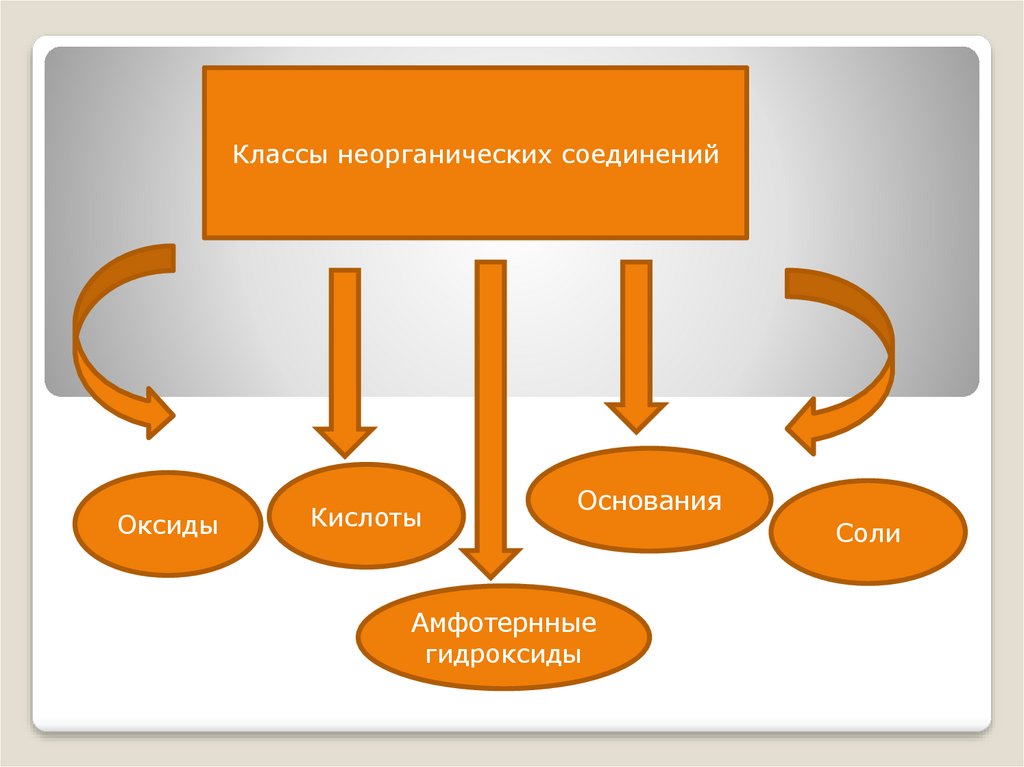
Классы неорганических соединенийОксиды
Кислоты
Основания
Амфотернные
гидроксиды
Соли
3.
Из слов составьтеопределение оксидов:
состоящие,
бинарные,из,
соединения, элементов
двух, кислород, одним,
со, которых, степенью,
является, окисления -2
4.
Оксиды-бинарныесоединения,
состоящие из двух элементов,
одним из которых является
кислород со степенью
окисления -2.
Правильный ответ
5.
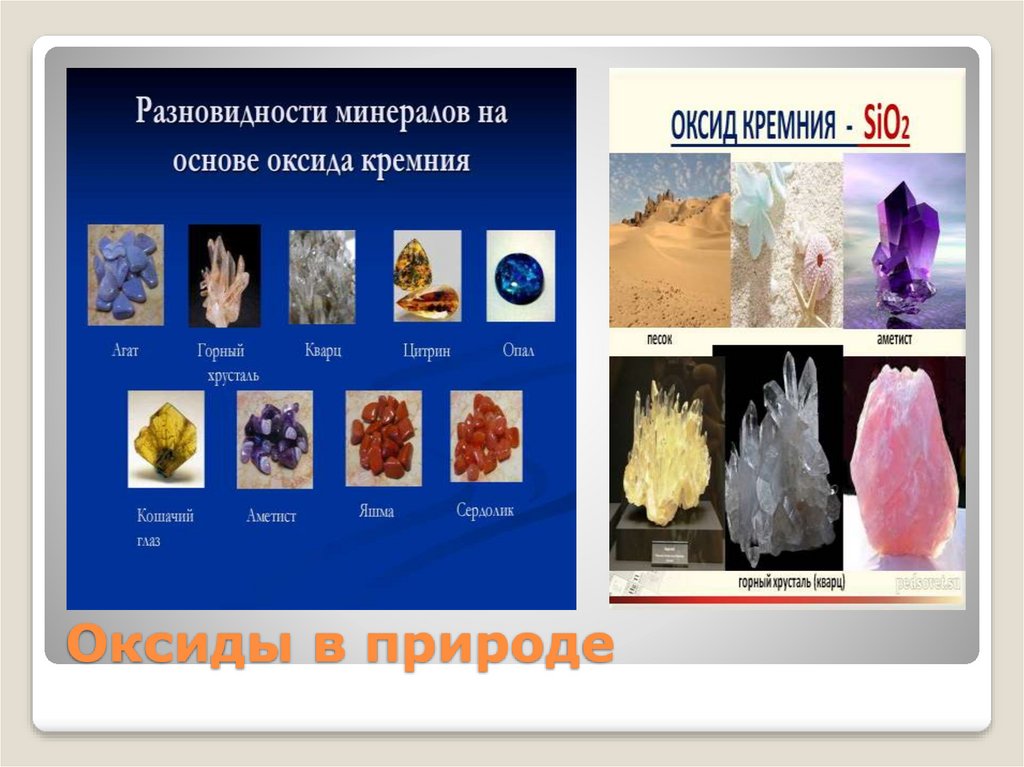
Оксиды в природе6.
Оксиды в природе7.
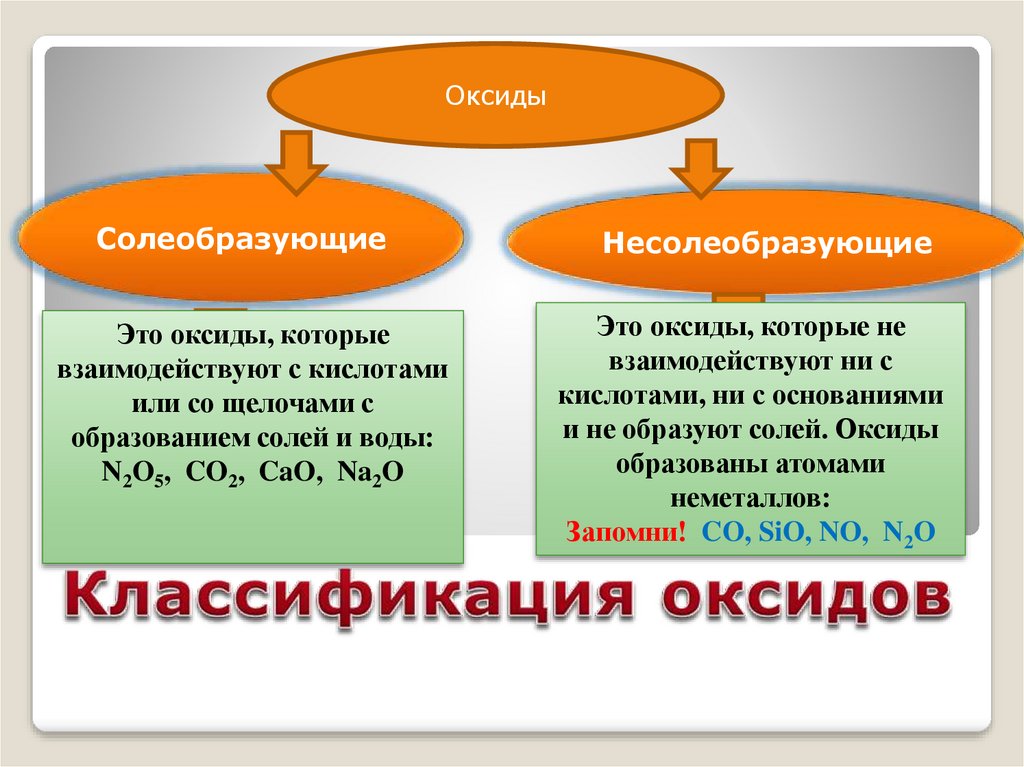
ОксидыСолеобразующие
Это оксиды, которые
взаимодействуют с кислотами
или со щелочами с
образованием солей и воды:
N2O5, CO2, CaO, Na2O
Несолеобразующие
Это оксиды, которые не
взаимодействуют ни с
кислотами, ни с основаниями
и не образуют солей. Оксиды
образованы атомами
неметаллов:
Запомни! CO, SiO, NO, N2O
8.
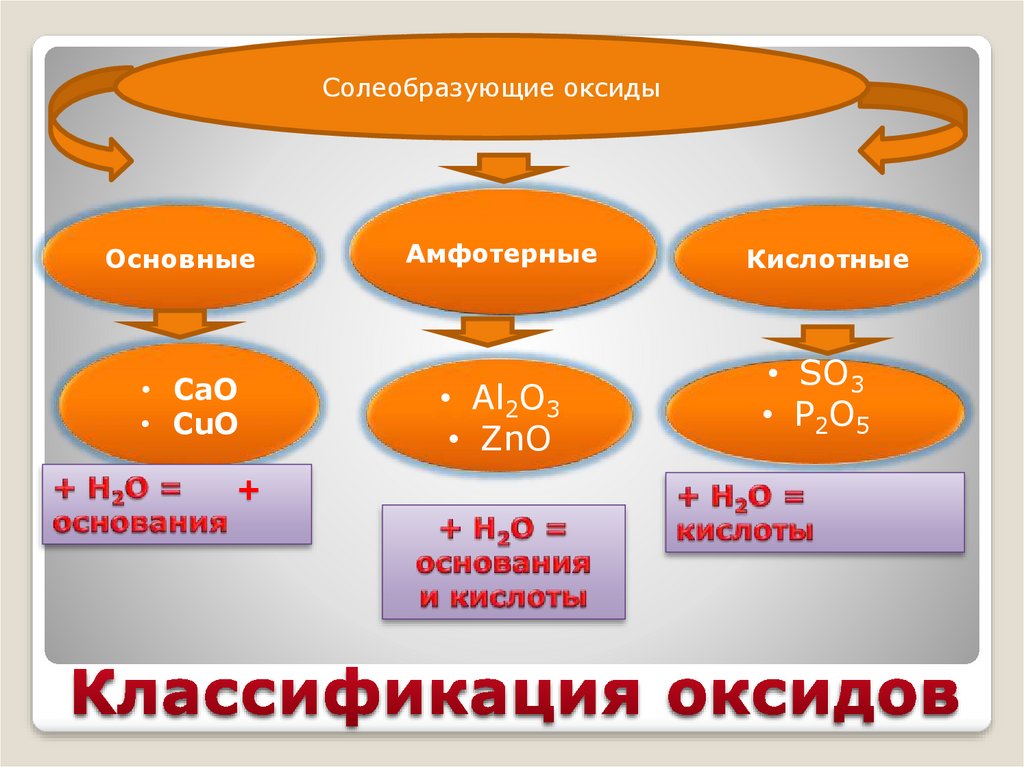
Солеобразующие оксидыОсновные
• CaO
• CuO
+
Амфотерные
• Al2O3
• ZnO
Кислотные
• SO3
• P2O5
9.
Проанализируйте состав основных оксидови дайте полные определения основным,
оксидам. Вставьте нужные термины
Основные:MnO, Li2O, NiO, FeO – это
оксиды- элементов … (Me или Неме) в
степени окисления (+1, +2, +3, +4)
MnO-Mn(OH)2, Li2O- LiOH, NiO - Ni(OH)2
FeO- Fe(OH)2. –этим окидам
соответсвуют гидроксиды… (основания ,
кислоты , амфотерныегидроксиды)
10.
Проанализируйте состав кислотныхоксидов и дайте полные определения
кислотным оксидам
Кислотные Cl2O,Cl2O7,MnO3,Mn2O7, N2O5, SO2,
это оксиды- элементов … (Me или Неме) в
степени окисления (+1, +2, +3, +4, +5-+7)
Cl2O-HClO ,Cl2O7- HClO4 , Mn2O7HMnO4,
N2O5-HNO3, SO2 - H2SO3, CrO3-H2CrO4
этим окcидам соответствуют гидроксиды…
(основания , кислоты , амфотерные
гидроксиды)
11.
Проанализируйте состав амфотерныхоксидов и дайте полные определения
амфотерным оксидам
Амфотерные MnO2, Al2O3, Fe2O3, Cr2O3
исключение ZnO, BeO, PbO,SnO
этим окидам соответсвуют гидроксиды…
(основания , кислоты
амфотерныегидроксиды)
– это оксиды- элементов … (Me или Неме)
в степени окисления (+1, +2, +3, +4)
12.
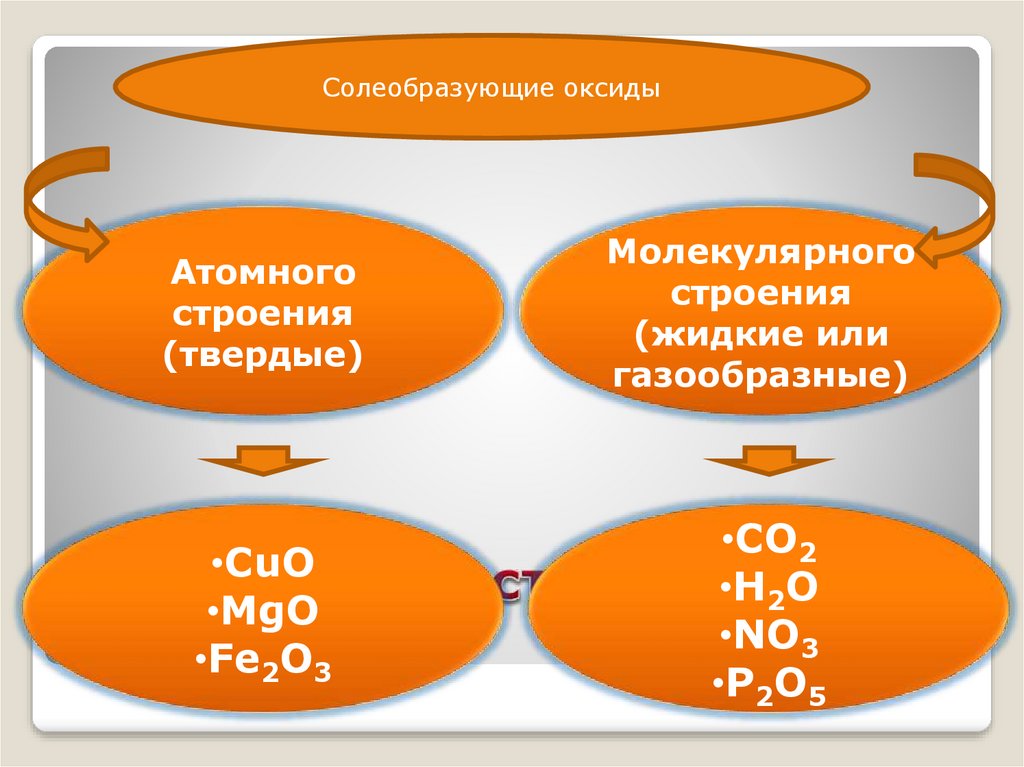
Солеобразующие оксидыАтомного
строения
(твердые)
Молекулярного
строения
(жидкие или
газообразные)
•CuO
•MgO
•Fe2O3
•CO2
•H2O
•NO3
•P2O5
13.
14.
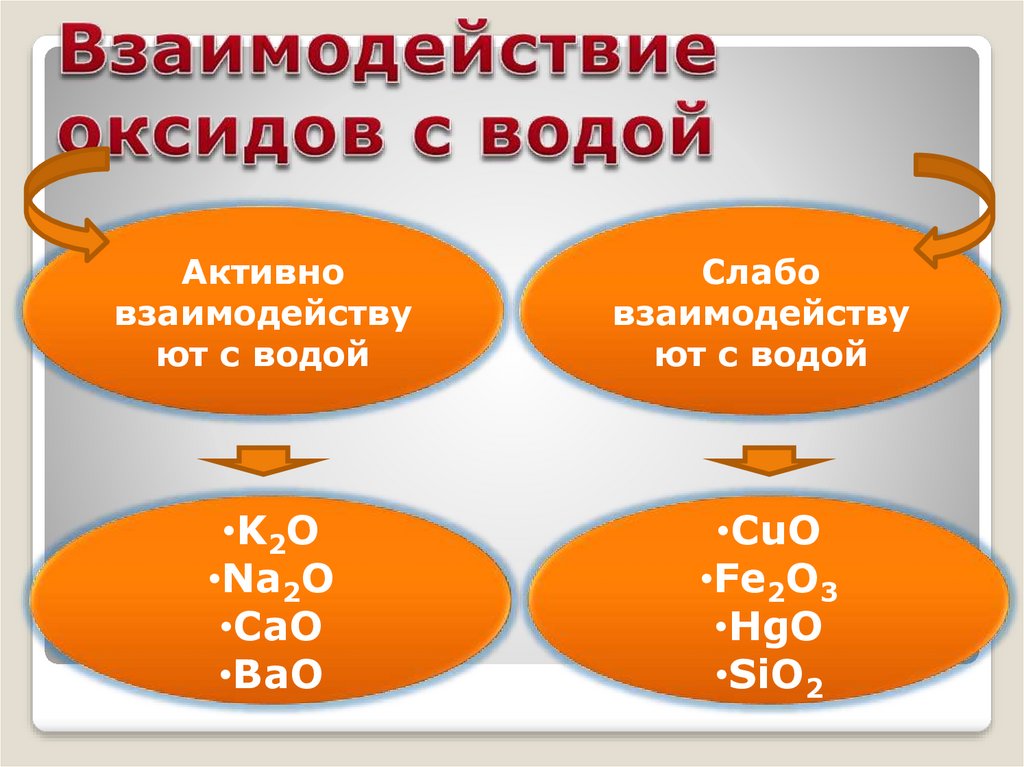
Активновзаимодейству
ют с водой
Слабо
взаимодейству
ют с водой
•K2O
•Na2O
•CaO
•BaO
•CuO
•Fe2O3
•HgO
•SiO2
15.
Na2O + H2O = ?NaOHCaO + H2O = Ca(OH)2
16.
MgO + H2SO4=MgSO4+H2OBaO+?HCl = BaCl2 + H2O
17.
CaO + CO2 = CaCO3BaO + SiO2 = BaSiO3
18.
SO3 + H2O = H2SO4P2O5 + ?H2O →?H3PO4
19.
?NaOH+SO2=Na2SO3+ H2OCa(OH)2+CO2=CaCO3 + H2O
20.
SiO2 + CaO = CaSiO321.
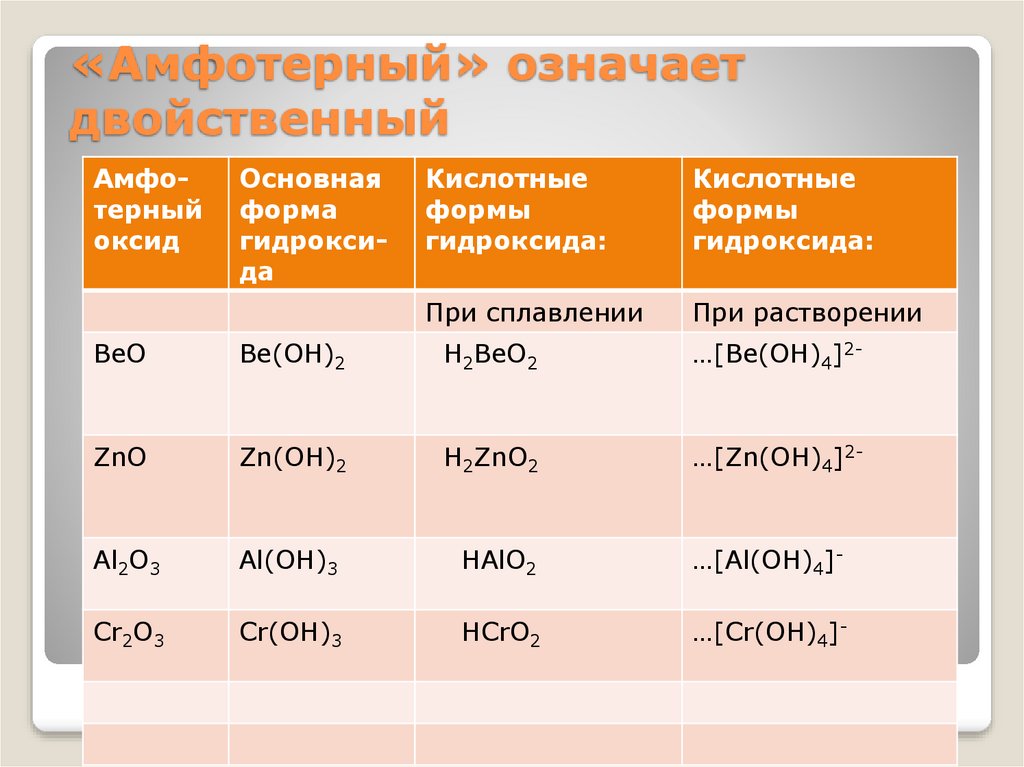
«Амфотерный» означаетдвойственный
Амфотерный
оксид
Основная
форма
гидроксида
Кислотные
формы
гидроксида:
Кислотные
формы
гидроксида:
При сплавлении
При растворении
BeO
Be(OH)2
H2BeO2
…[Be(OH)4]2-
ZnO
Zn(OH)2
H2ZnO2
…[Zn(OH)4]2-
Al2O3
Al(OH)3
HAlO2
…[Al(OH)4]-
Cr2O3
Cr(OH)3
HCrO2
…[Cr(OH)4]-
22.
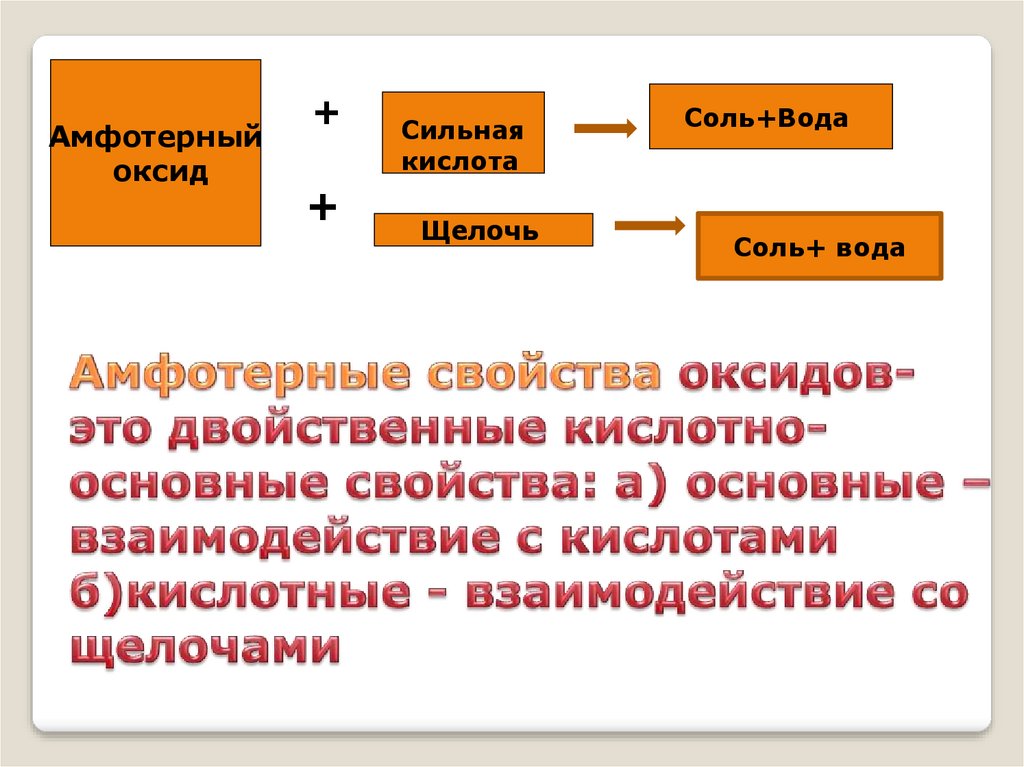
+Амфотерный
оксид
+
Сильная
кислота
Щелочь
Соль+Вода
Соль+ вода
23.
Основные свойстваZnO + H2SO4 = ZnSO4 + H2O
Кислотные свойства
При сплавлении
ZnO + ?NaOH →Na2ZnO2 + H2O
Цинкат
натрия
В растворе щелочи получается комплексная
соль
ZnO + ?NaOH +2H2O →Na2 [Zn(OH)4]
24.
ОИ 1.С.268-272, с.273зад.8,9
ОИ 1 Химия: учеб, для студ. проф. О.С.Габриелям
учеб, заведений
М., Изд. центр
«Академия», 2015.
















 Химия
Химия








