Похожие презентации:
Алкины, ароматические соединения
1.
ЛекцияАлкины, ароматические
соединения
2. Алкины. Номенклатура
• Углеводороды, содержащие тройную связь, называются алкинами. К алкинамчасто применяют название ацетилены по названию первого члена
гомологического ряда. Они образуют гомологический ряд с общей формулой
CnH2n-2. По номеклатуре IUPAC названия алкинов образуют путем замены
окончания «-ан» в названии соответствующего алкана окончанием "-ин":
Соответствующие алкинам одновалентные радикалы
Например, этинил-, пропинил- и т.д..
называются алкинил-.
3. Алкины. Номенклатура
• Правила составления названий алкинов по международной номенклатуреаналогичны правилам составления алкенов.
• 1. При составлении названия алкина выбирается самая длинная цепь,
включающая тройную связь. Нумерация цепи идет с того конца, к которому ближе
находится кратная связь, ее местоположение указывается наименьшим из двух
номеров углеродных атомов. Если тройная связь находится на одинаковом
расстоянии от концов цепи, нумерацию ведут с того конца, к которому ближе
находится заместитель.
• 2. В названии соответствующего алкана окончание –ан заменяют на –ин.
• 3. Перед названием главной цепи указывают номер атома углерода, при котором
находится заместитель, и название этого заместителя.
• 4. Цифра, обозначающая положение тройной связи, ставится после суффикса –ин.
• 5. Если в цепи присутствует старшая группа нумерация начинается с атома
углерода, связанного с данной функцией
5 4 3 2 1
HC C C C C OH
H2 H2 H2
пент-4-ин-1-ол
4. Изомерия алкинов
• Структурная изомерия.• 1. Изомерия положения тройной связи (начиная с С4H6)
2. Изомерия углеродного скелета (начиная с С5Н8)
3. Межклассовая изомерия с алкадиенами и циклоалкенами
(начиная с С4H6)
Простанственная изомерия относительно тройной связи в алкинах
не проявляется, т.к. каждый атом углерода, прилежащий к тройной
связи, соединен только с одним единственным заместителем,
который может располагаться только вдоль
линии связи
5. Получение ацетилена и его производных
• Ацетилен получают в промышленности тремя способами.1. Высокотемпературный крекинг метана и его гомологов
2. Гидрирование углерода при 3000 °С. Время нагревания должно
быть очень коротким во избежание обратного процесса разложения
ацетилена на элементы. Поэтому реакцию проводят, используя
электрическую дугу между угольными электродами в токе водорода.
3. Карбидный метод Прокаливанием в электрических печах смеси оксида
кальция с коксом при 1800—2000°С получают карбид кальция, при
действии на который Н2О образуется гидроксид кальция и ацетилен:
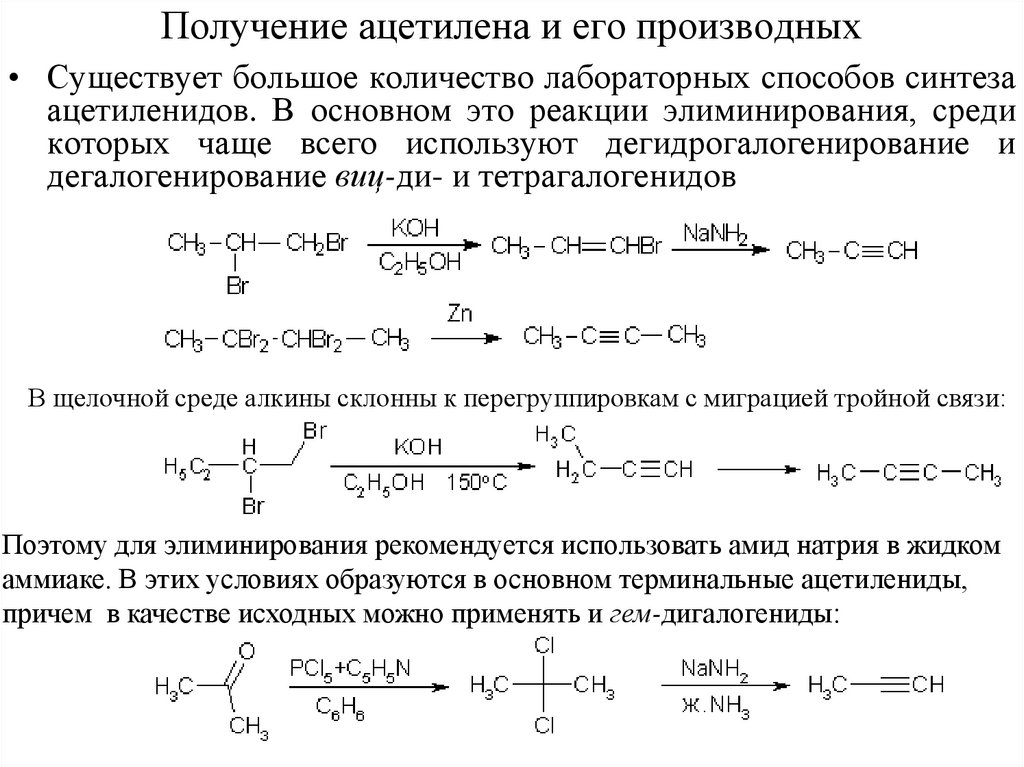
6. Получение ацетилена и его производных
• Существует большое количество лабораторных способов синтезаацетиленидов. В основном это реакции элиминирования, среди
которых чаще всего используют дегидрогалогенирование и
дегалогенирование виц-ди- и тетрагалогенидов
В щелочной среде алкины склонны к перегруппировкам с миграцией тройной связи:
Поэтому для элиминирования рекомендуется использовать амид натрия в жидком
аммиаке. В этих условиях образуются в основном терминальные ацетилениды,
причем в качестве исходных можно применять и гем-дигалогениды:
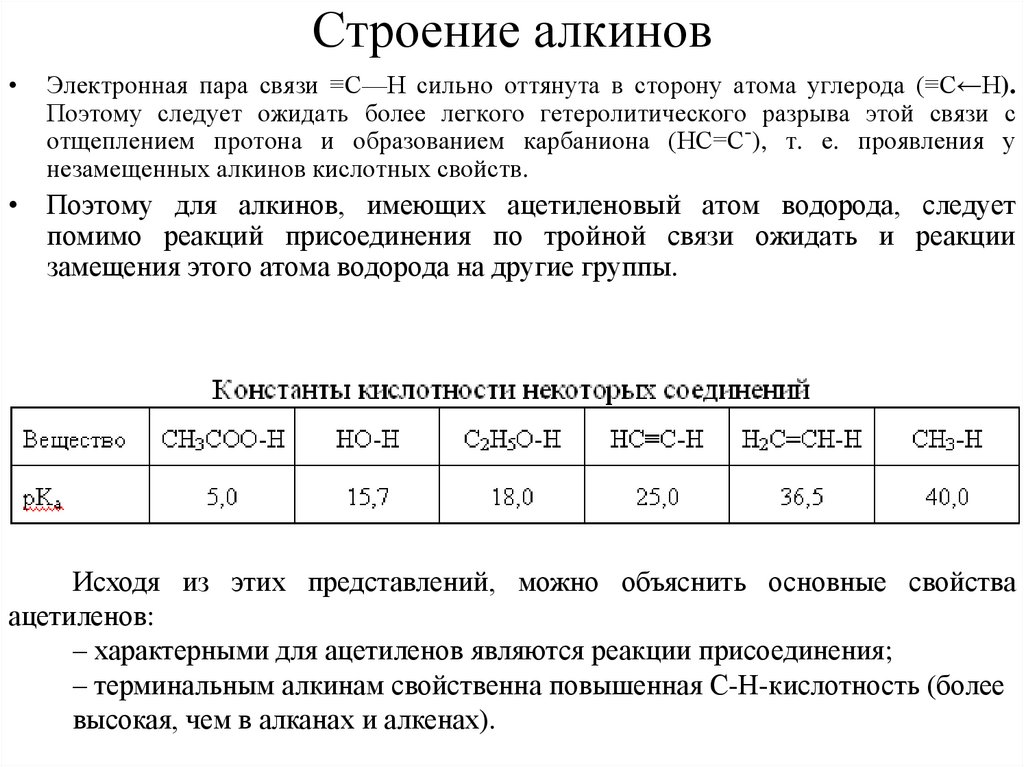
7. Строение алкинов
• Атомы углерода в ацетилене имеют sp-гибридизацию и соединены междусобой одной σ- и двумя p-связями. Поэтому молекула ацетилена линейна
(валентный угол – угол между связями - 180°).
8. Строение алкинов
Электронная пара связи ≡С—Н сильно оттянута в сторону атома углерода (≡С←Н).
Поэтому следует ожидать более легкого гетеролитического разрыва этой связи с
отщеплением протона и образованием карбаниона (НС=С-), т. е. проявления у
незамещенных алкинов кислотных свойств.
• Поэтому для алкинов, имеющих ацетиленовый атом водорода, следует
помимо реакций присоединения по тройной связи ожидать и реакции
замещения этого атома водорода на другие группы.
Исходя из этих представлений, можно объяснить основные свойства
ацетиленов:
– характерными для ацетиленов являются реакции присоединения;
– терминальным алкинам свойственна повышенная С-Н-кислотность (более
высокая, чем в алканах и алкенах).
9. Каталитическое гидрирование и восстановление
• Каталитическое гидрирование алкинов в присутствии такихкатализаторов, как никель, платина, палладий, происходит с
образованием алкана.
Pt or Pd
R1 C C R2 + 2H2
R1 C C R2
H2 H2
Каталитическое присоединение водорода к алкинам может происходить
в одну стадию с образованием алкена.
R1 C C R2 + H2
Pt / Pb
R1 C C R2
H H
Восстановление алкинов в жидком аммиаке, а так же литий
алюминийгидридом ведёт преимущественно к образованию транс-алкена.
H3C C C CH3 + H2
LiAlH4, t
H3C
H
C C
H
CH3
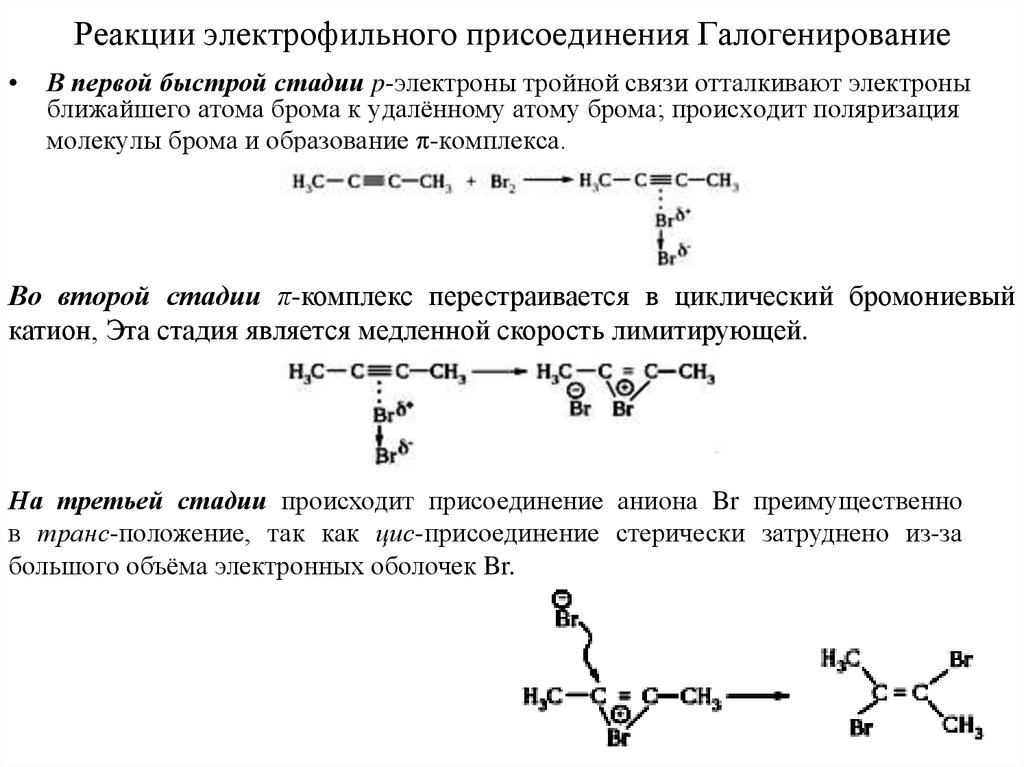
10. Реакции электрофильного присоединения Галогенирование
• Алкины, как и алкены, имеют доступные для атаки p-электроны ивступают в реакции электрофильного присоединения. Но из-за
повышенной электроотрицательности sp-гибридизованных атомов
углерода и укороченности связей поляризуемость p-электронов
тройной связи С≡С уменьшена, поэтому тройная углерод-углеродная
связь по сравнению с двойной связью С=С менее реакционноспособна
в отношении электрофильных реагентов.
• Электрофильное присоединение галогенов (хлора, брома) к алкинам
протекает аналогично реакции присоединения к алкенам.
H3C C C CH3 + Br2
H3C
Br
C C
Br
CH3
11. Реакции электрофильного присоединения Галогенирование
В первой быстрой стадии p-электроны тройной связи отталкивают электроны
ближайшего атома брома к удалённому атому брома; происходит поляризация
молекулы брома и образование π-комплекса.
Во второй стадии π-комплекс перестраивается в циклический бромониевый
катион, Эта стадия является медленной скорость лимитирующей.
На третьей стадии происходит присоединение аниона Br преимущественно
в транс-положение, так как цис-присоединение стерически затруднено из-за
большого объёма электронных оболочек Br.
12. Гидрогалогенирование
• Алкины реагируют с галогеноводородами (хлороводородом, бромоводородом)подобно алкенам.
Механизм реакции. Образующийся в первой быстрой стадии π-комплекс во
второй медленной стадии превращается в σ-комплекс - карбокатион.
В третьей стадии происходит стабилизация карбкатиона – взаимодействие с
анионом брома.
Взаимодействие бромалкена со второй молекулой бромоводорода происходит по
правилу Марковникова при R=CH3
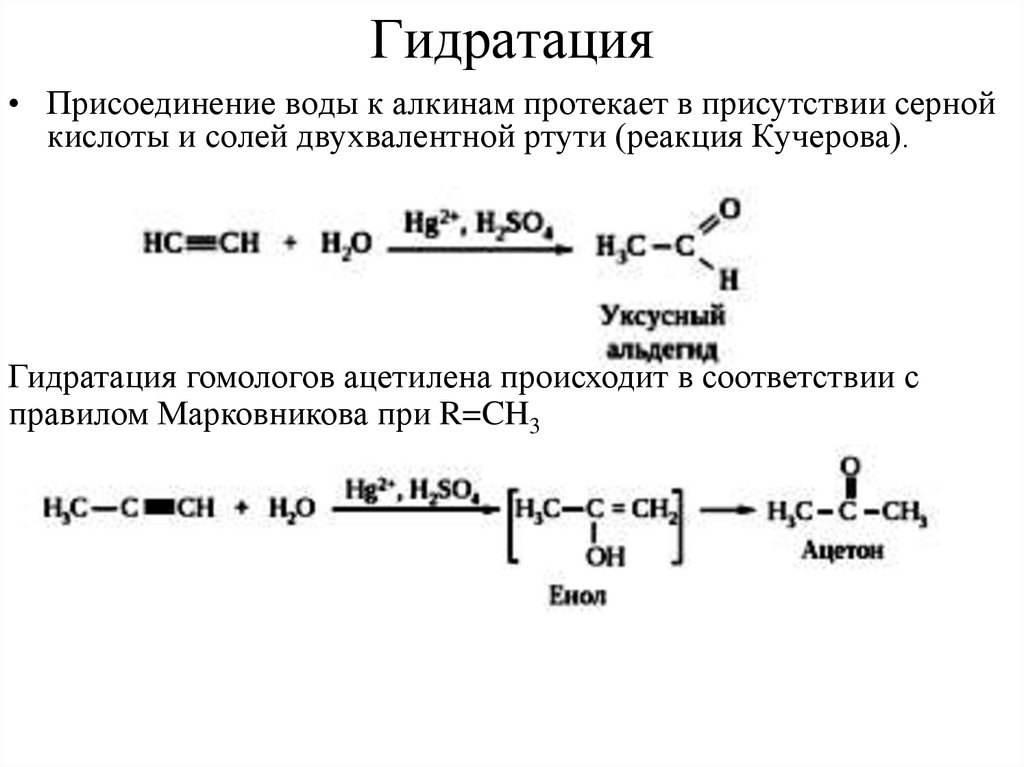
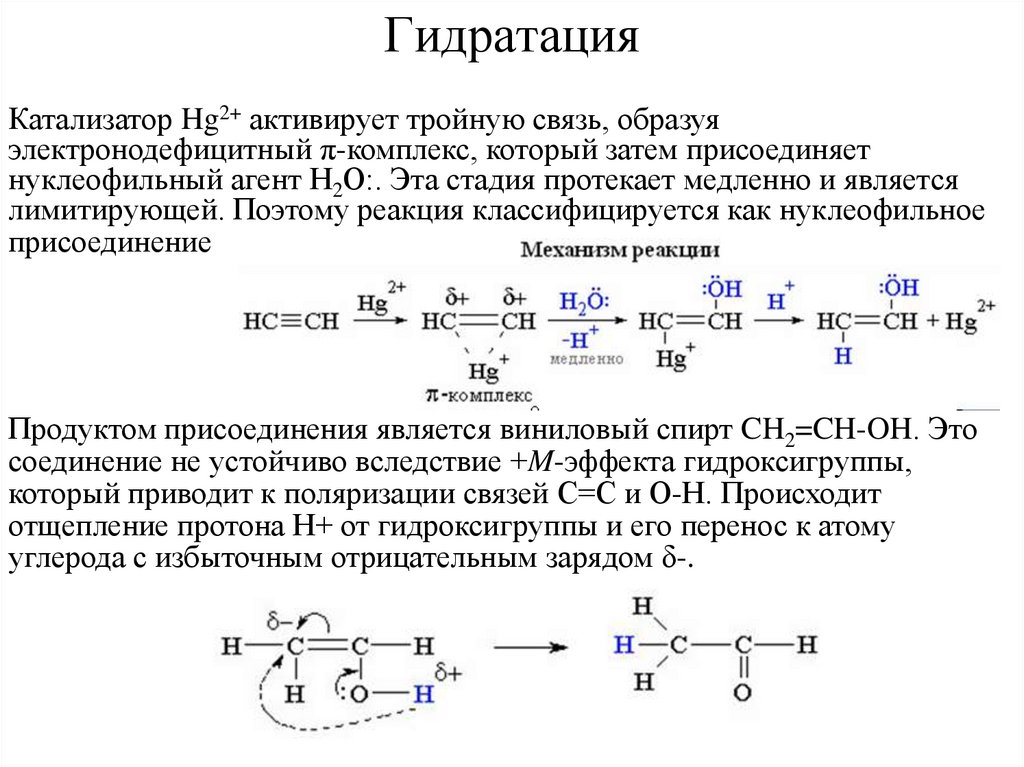
13. Гидратация
• Присоединение воды к алкинам протекает в присутствии сернойкислоты и солей двухвалентной ртути (реакция Кучерова).
Гидратация гомологов ацетилена происходит в соответствии с
правилом Марковникова при R=CH3
14. Гидратация
Катализатор Hg2+ активирует тройную связь, образуяэлектронодефицитный π-комплекс, который затем присоединяет
нуклеофильный агент Н2О:. Эта стадия протекает медленно и является
лимитирующей. Поэтому реакция классифицируется как нуклеофильное
присоединение.
Продуктом присоединения является виниловый спирт CH2=CH-OH. Это
соединение не устойчиво вследствие +M-эффекта гидроксигруппы,
который приводит к поляризации связей С=С и О-Н. Происходит
отщепление протона Н+ от гидроксигруппы и его перенос к атому
углерода с избыточным отрицательным зарядом δ-.
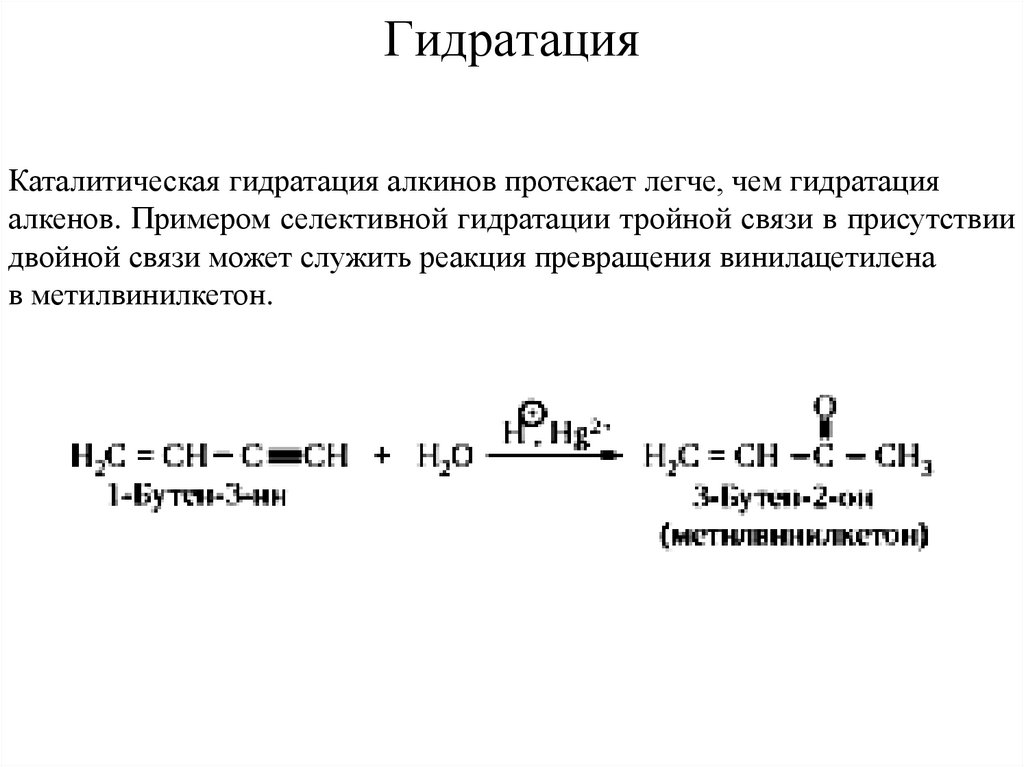
15. Гидратация
Каталитическая гидратация алкинов протекает легче, чем гидратацияалкенов. Примером селективной гидратации тройной связи в присутствии
двойной связи может служить реакция превращения винилацетилена
в метилвинилкетон.
16. Гидроборирование
• Другой способ присоединения элементов воды (Н и ОН) состоитв реакции присоединения борана по тройной связи с
последующим окислением триалкенилборана пероксидом
водорода в щелочной среде.
• Образовавшийся виниловый спирт изомеризуется в более
устойчивый альдегид (если алкин имеет концевую тройную
связь) или кетон.
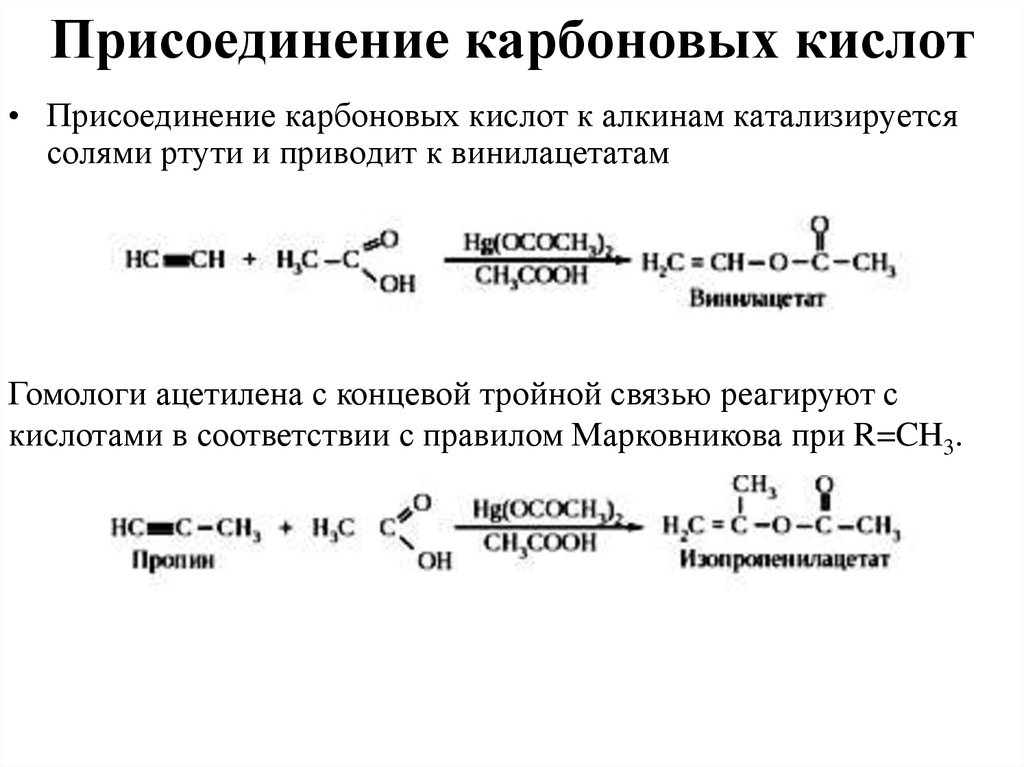
17. Присоединение карбоновых кислот
• Присоединение карбоновых кислот к алкинам катализируетсясолями ртути и приводит к винилацетатам
Гомологи ацетилена с концевой тройной связью реагируют с
кислотами в соответствии с правилом Марковникова при R=CH3.
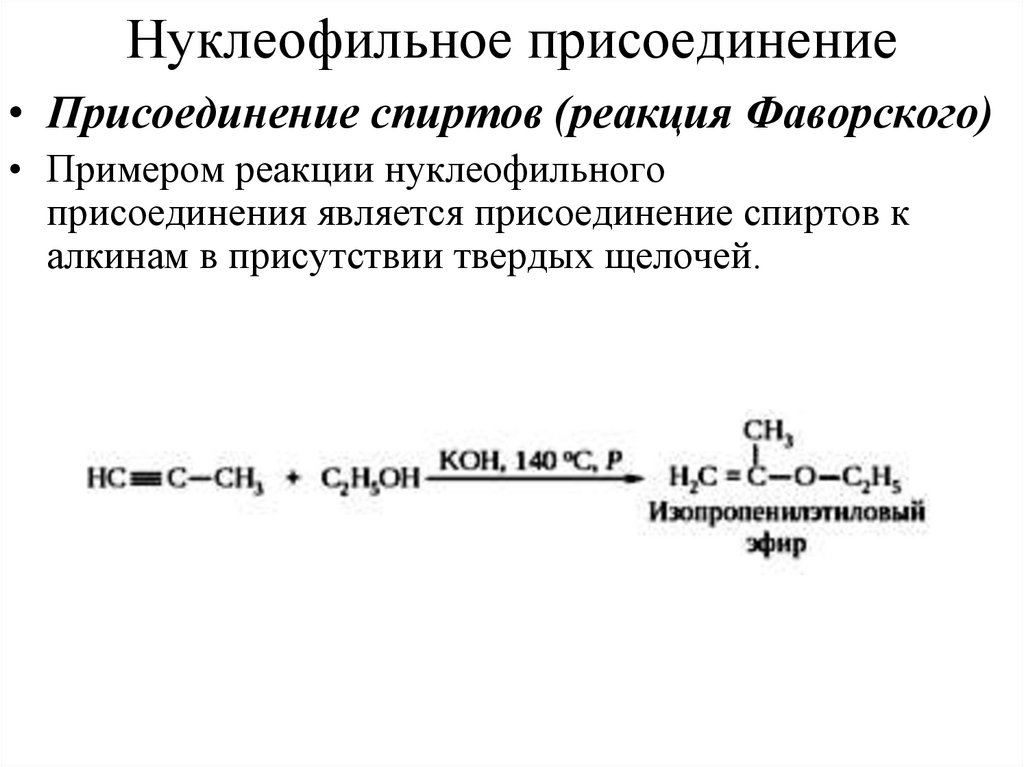
18. Нуклеофильное присоединение
• Присоединение спиртов (реакция Фаворского)• Примером реакции нуклеофильного
присоединения является присоединение спиртов к
алкинам в присутствии твердых щелочей.
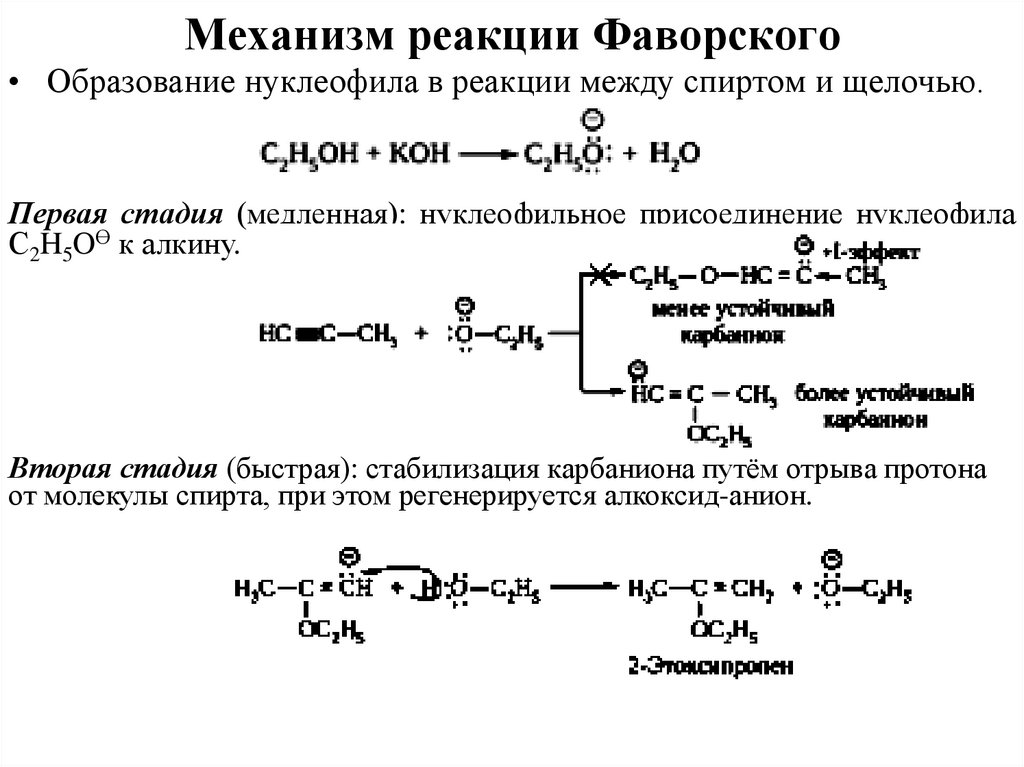
19. Механизм реакции Фаворского
• Образование нуклеофила в реакции между спиртом и щелочью.Первая стадия (медленная): нуклеофильное присоединение нуклеофила
С2H5OӨ к алкину.
Вторая стадия (быстрая): стабилизация карбаниона путём отрыва протона
от молекулы спирта, при этом регенерируется алкоксид-анион.
20. Нуклеофильное присоединение
• Синильная кислота так же присоединяется к ацетилену собразованием акрилонитрила. Реакция протекает в присутствии
солей одновалентной меди. Стадией, лимитирующей скорость
этой реакции, является нуклеофильное присоединение цианидиона к тройной связи.
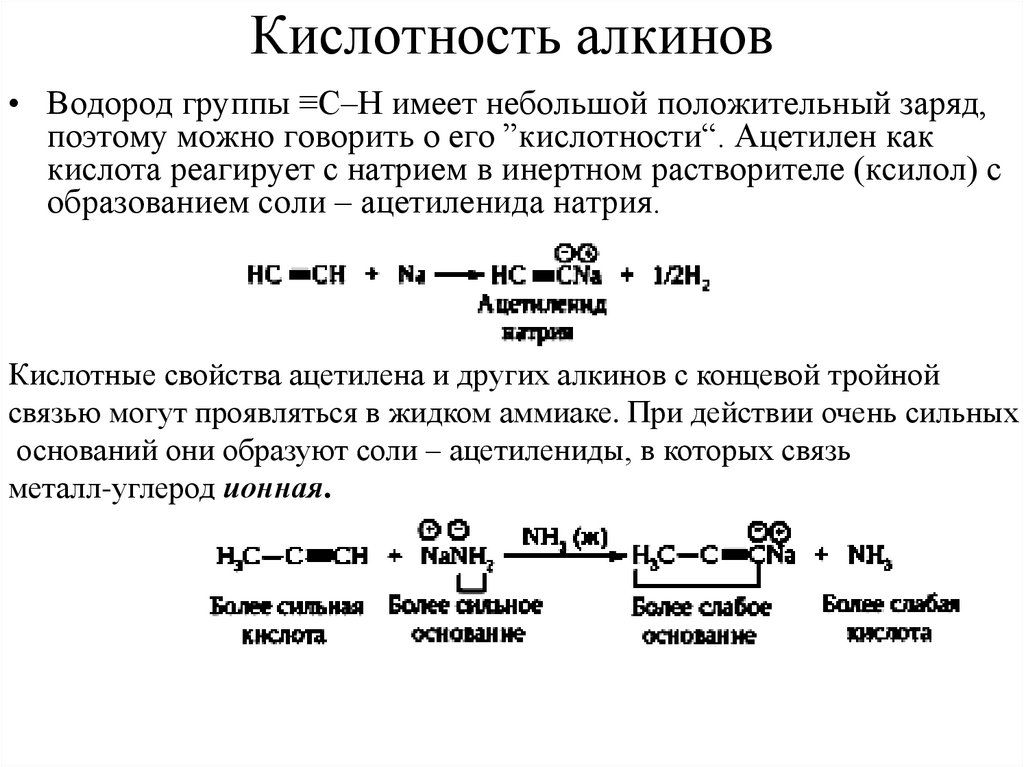
21. Кислотность алкинов
• Водород группы ≡С–Н имеет небольшой положительный заряд,поэтому можно говорить о его ”кислотности“. Ацетилен как
кислота реагирует с натрием в инертном растворителе (ксилол) с
образованием соли – ацетиленида натрия.
Кислотные свойства ацетилена и других алкинов с концевой тройной
связью могут проявляться в жидком аммиаке. При действии очень сильных
оснований они образуют соли – ацетилениды, в которых связь
металл-углерод ионная.
22. Качественные реакции на алкины
• Известны ацетилениды одновалентных металлов меди и серебра. Этисоединения имеют ковалентные полярные связи металл-углерод. Их
можно получить взаимодействием ацетилена и алкинов с концевой
тройной связью с аммиачным раствором оксидов Аg 1+ и Cu 1+ .
• Ацетилениды меди и серебра нерастворимы в воде (качественные
реакции на концевую тройную связь).
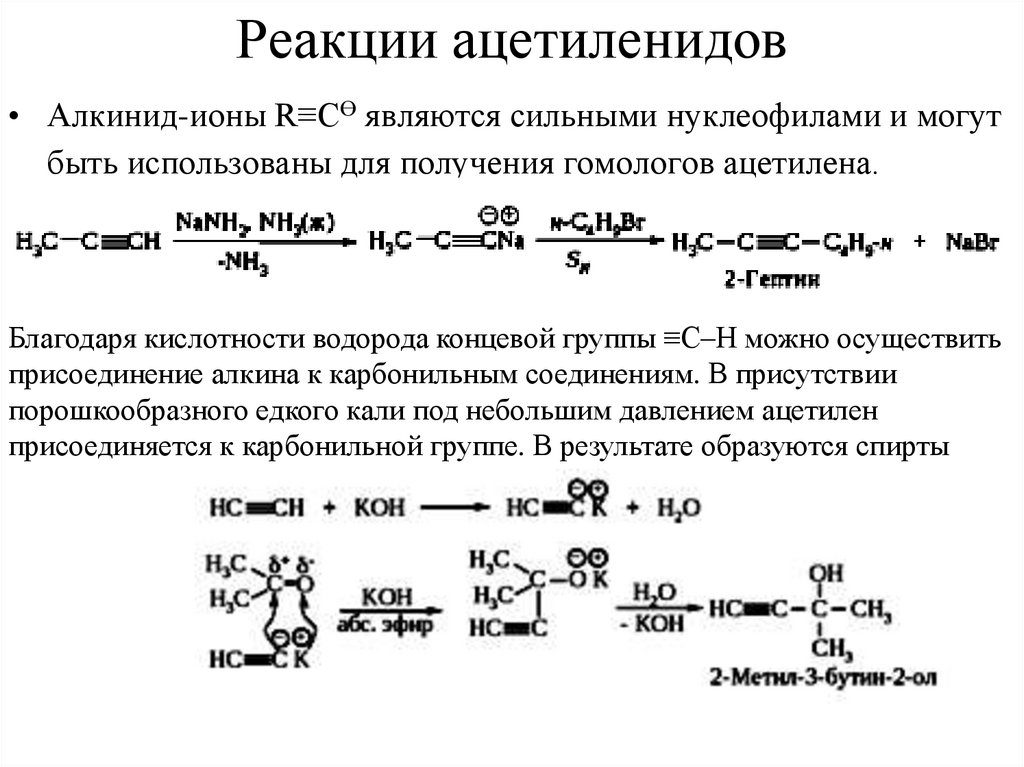
23. Реакции ацетиленидов
• Алкинид-ионы R≡СӨ являются сильными нуклеофилами и могутбыть использованы для получения гомологов ацетилена.
Благодаря кислотности водорода концевой группы ≡С–Н можно осуществить
присоединение алкина к карбонильным соединениям. В присутствии
порошкообразного едкого кали под небольшим давлением ацетилен
присоединяется к карбонильной группе. В результате образуются спирты
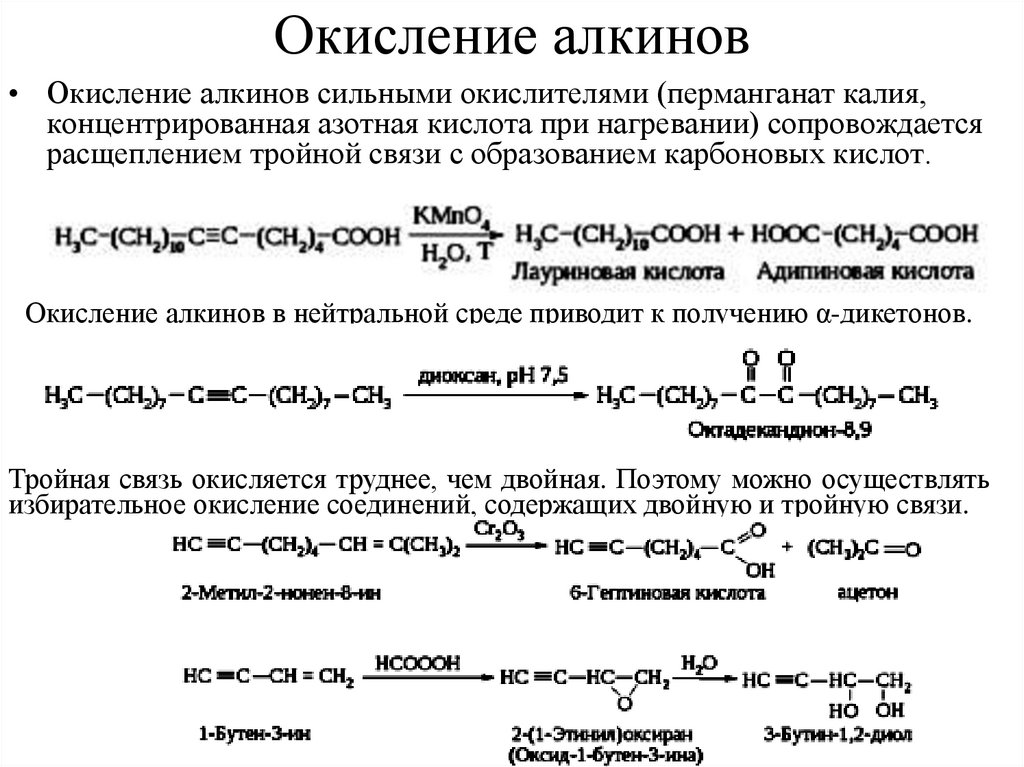
24. Окисление алкинов
• Окисление алкинов сильными окислителями (перманганат калия,концентрированная азотная кислота при нагревании) сопровождается
расщеплением тройной связи с образованием карбоновых кислот.
Окисление алкинов в нейтральной среде приводит к получению α-дикетонов.
Тройная связь окисляется труднее, чем двойная. Поэтому можно осуществлять
избирательное окисление соединений, содержащих двойную и тройную связи.
25. Радикальное присоединение бромоводорода
• В присутствии пероксида присоединение бромистоговодорода к алкинам происходит против правила
Марковникова
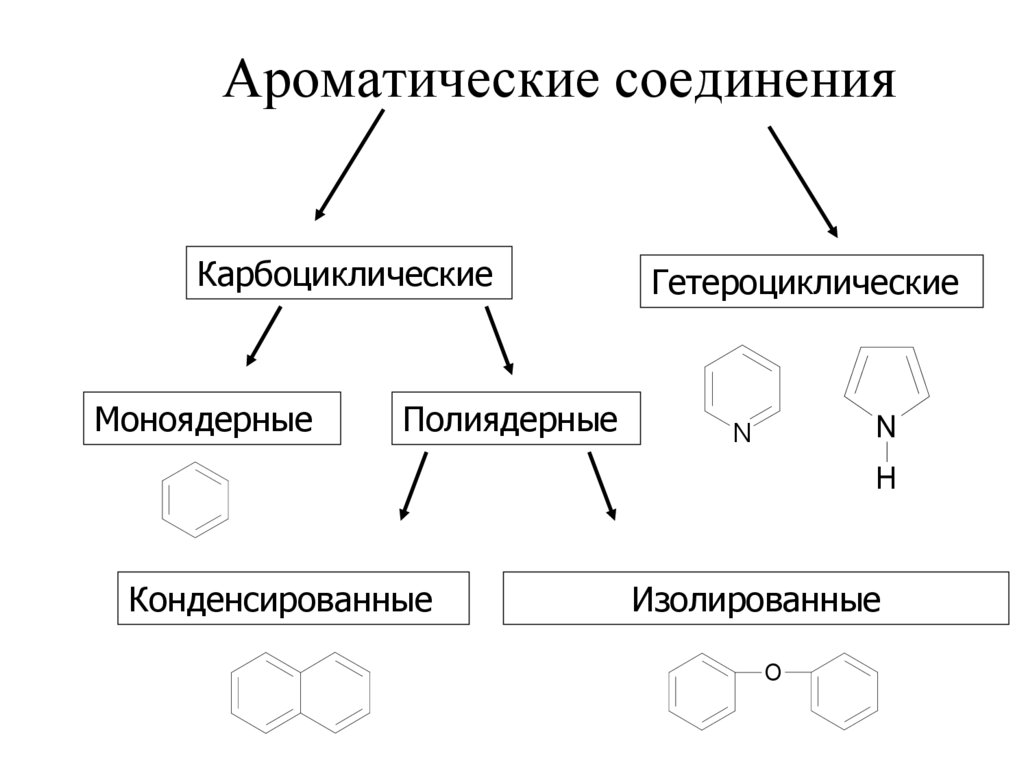
26. Ароматические соединения
• Соединения, которые содержат циклические сопряженныеπ-электронные системы, удовлетворяющие критериям
ароматичности, называются ароматическими системами
• Критерии ароматичности:
• 1. Специфическая реакционная способность.
• 2. Выигрыш по энергии, в сравнении с системой
несопряжённых двойных связей. Энергия резонанса
• 3. Магнитные эффекты. Наличие кольцевого магнитного
тока
• 4. Все атомы, образующие ароматическую систему, лежат в
одной плоскости
• 5. Практически всегда соблюдается правило Хюккеля:
ароматичной может быть лишь система, содержащая (в
кольце) 4n + 2 электронов (где n = 0, 1, 2,…).
27. Ароматические соединения
КарбоциклическиеМоноядерные
Полиядерные
Гетероциклические
N
N
H
Конденсированные
Изолированные
O
28. Открытие бензола
• 1825 г. английский ученый М. Фарадей впервые выделилбензол из конденсата светильного газа.
• 1834 г. немецкий химик Э. Митчерлих синтезировал это
соединение декарбоксилированием бензойной кислоты в
присутствии оксида кальция и установил его эмпирическую
формулу.
• С6Н5СООН + СаО → С6Н6 + СаСО3.
• 1845 г. впервые выделен А. Гофманом как продукт
коксохимического производства.
• Соответственно формуле С6Н6 бензол должен был бы
проявлять свойства ненасыщенного соединения и, прежде
всего, в реакциях присоединения. Однако свойства бензола
существенно отличаются от свойств ненасыщенных
углеводородов.
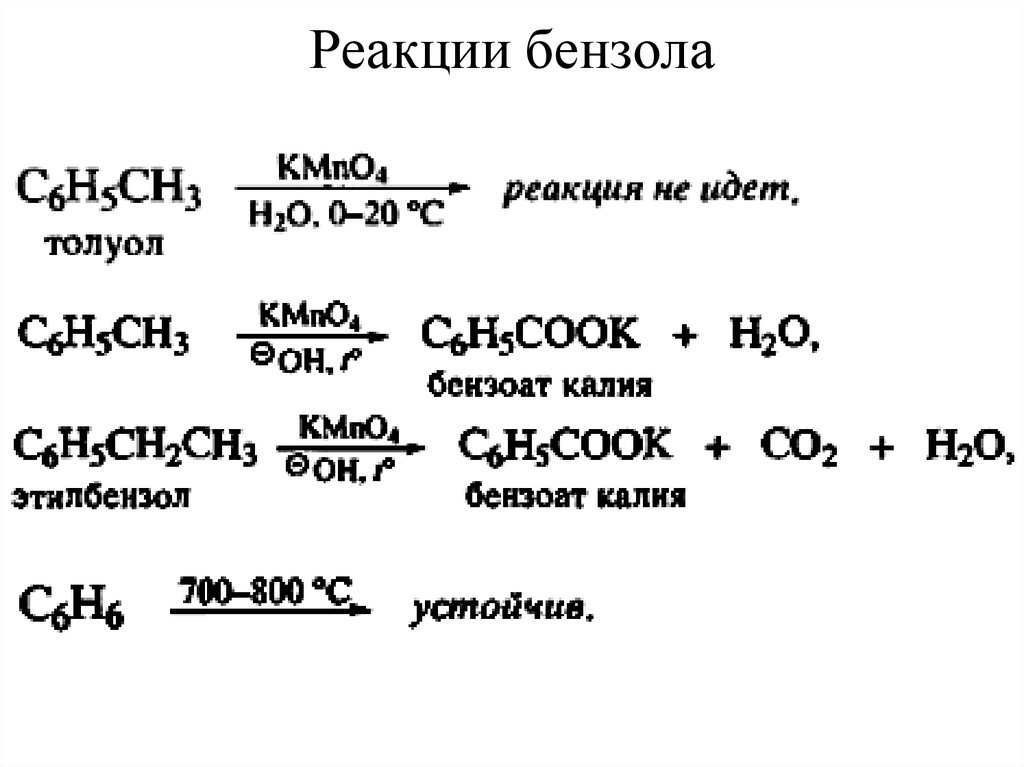
29. Реакции бензола
30. Реакции бензола
31. Химические критерии ароматичности
Таким образом, ароматичность бензолазаключается, прежде всего, в его
специфической реакционной способности:
инертностью в реакциях присоединения,
склонностью к реакциям замещения,
устойчивостью к окислению
устойчивостью к нагреванию.
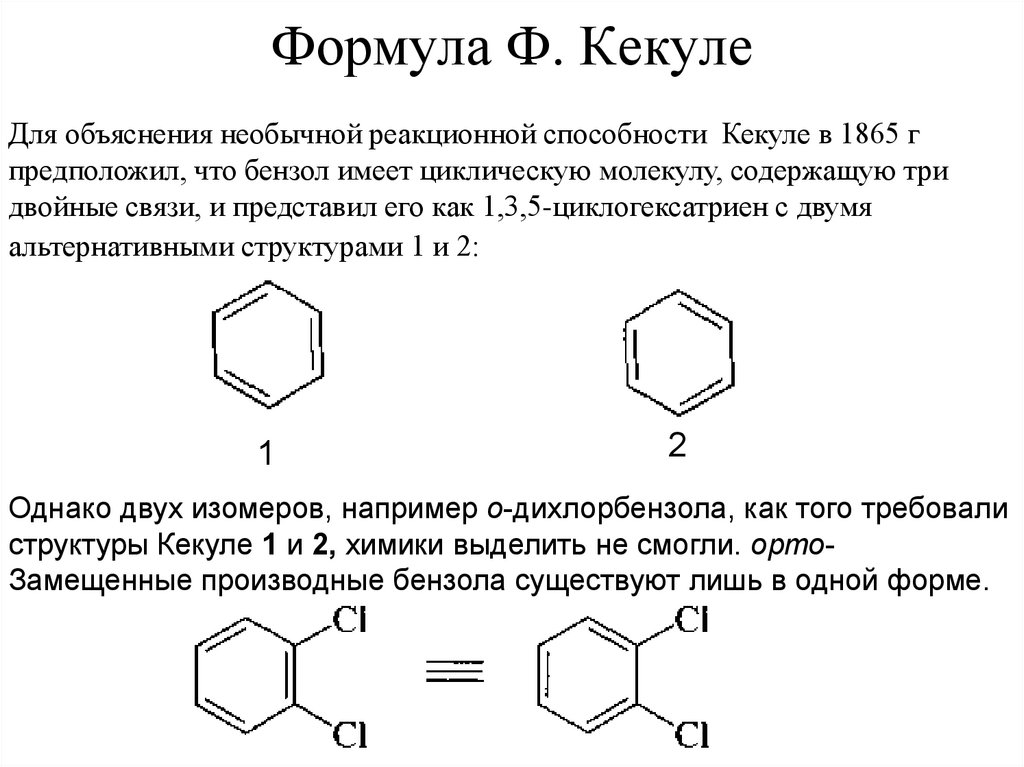
32. Формула Ф. Кекуле
Для объяснения необычной реакционной способности Кекуле в 1865 гпредположил, что бензол имеет циклическую молекулу, содержащую три
двойные связи, и представил его как 1,3,5-циклогексатриен с двумя
альтернативными структурами 1 и 2:
1
2
Однако двух изомеров, например о-дихлорбензола, как того требовали
структуры Кекуле 1 и 2, химики выделить не смогли. ортоЗамещенные производные бензола существуют лишь в одной форме.
33. Резонансные структуры бензола
Американский ученый М. Дьюар предложил рассматривать распределениеэлектронов в молекуле бензола как суперпозицию (усредненное состояние)
целого ряда структур. Было предположено, что реальная структура бензола
лучше всего описывается набором из нескольких десятков резонансных
структур. Здесь приведены пять резонансных структур 1-5, которые вносят
наибольший вклад в структуру резонансного гибрида 6 бензола.
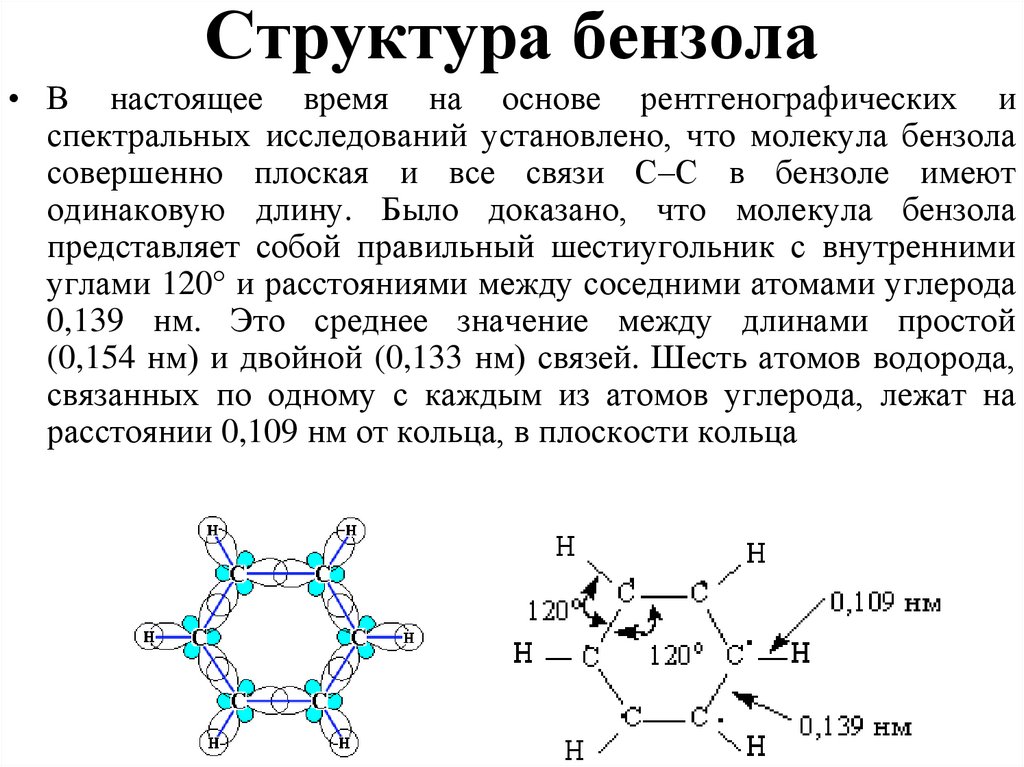
34. Структура бензола
• В настоящее время на основе рентгенографических испектральных исследований установлено, что молекула бензола
совершенно плоская и все связи С–С в бензоле имеют
одинаковую длину. Было доказано, что молекула бензола
представляет собой правильный шестиугольник с внутренними
углами 120° и расстояниями между соседними атомами углерода
0,139 нм. Это среднее значение между длинами простой
(0,154 нм) и двойной (0,133 нм) связей. Шесть атомов водорода,
связанных по одному с каждым из атомов углерода, лежат на
расстоянии 0,109 нм от кольца, в плоскости кольца
35. Структура бензола
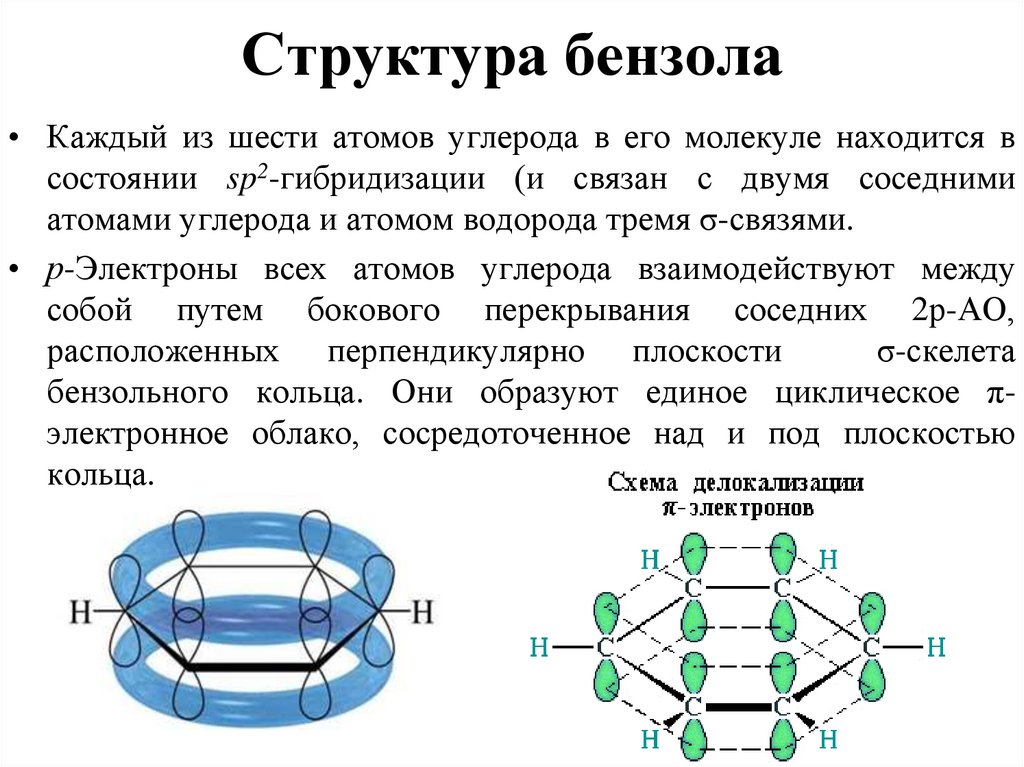
• Каждый из шести атомов углерода в его молекуле находится всостоянии sp2-гибридизации (и связан с двумя соседними
атомами углерода и атомом водорода тремя σ-связями.
• р-Электроны всех атомов углерода взаимодействуют между
собой путем бокового перекрывания соседних 2р-АО,
расположенных перпендикулярно плоскости
σ-скелета
бензольного кольца. Они образуют единое циклическое πэлектронное облако, сосредоточенное над и под плоскостью
кольца.
36. Структура бензола
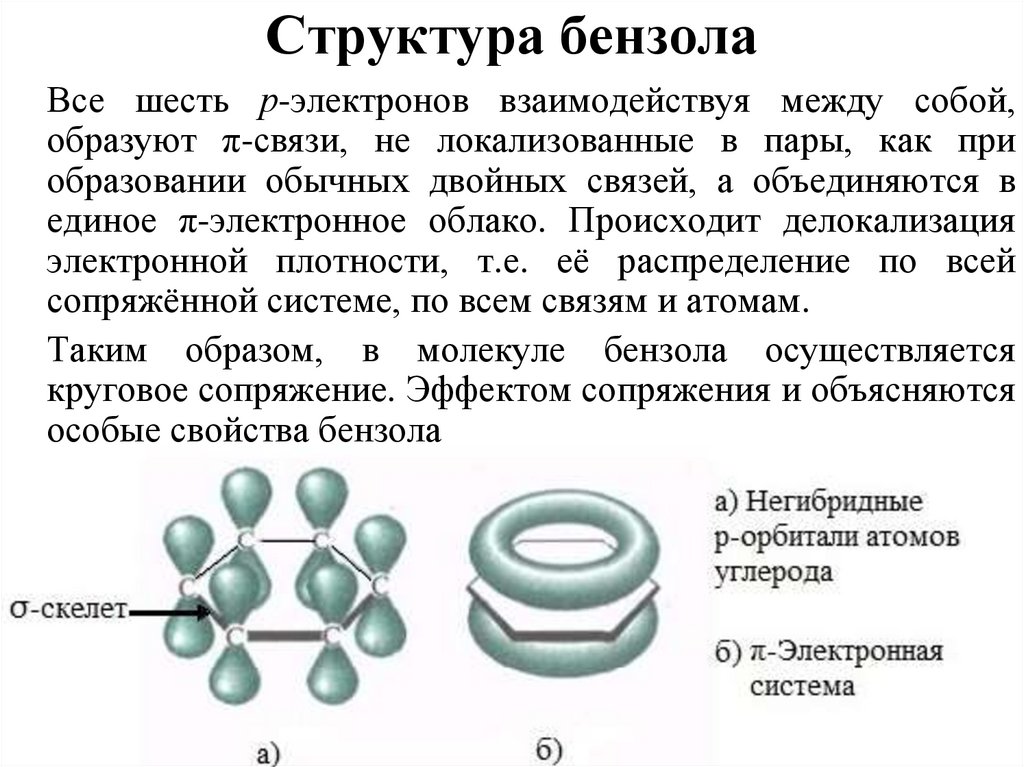
Все шесть р-электронов взаимодействуя между собой,образуют π-связи, не локализованные в пары, как при
образовании обычных двойных связей, а объединяются в
единое π-электронное облако. Происходит делокализация
электронной плотности, т.е. её распределение по всей
сопряжённой системе, по всем связям и атомам.
Таким образом, в молекуле бензола осуществляется
круговое сопряжение. Эффектом сопряжения и объясняются
особые свойства бензола
37. Энергия сопряжения бензола
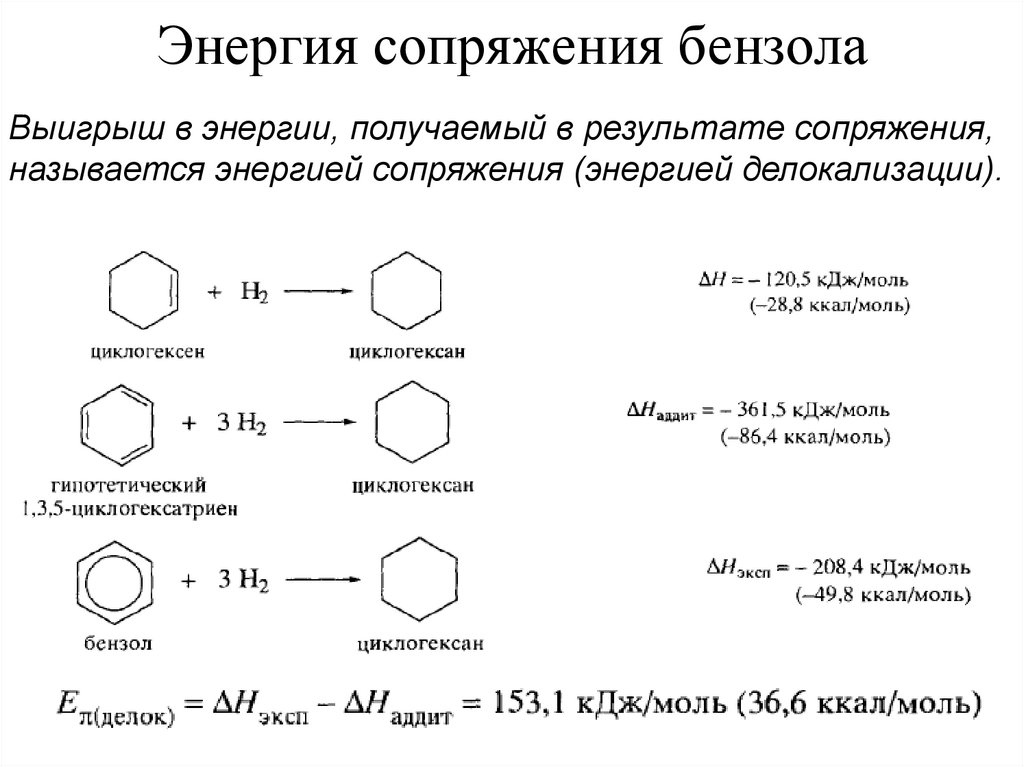
Выигрыш в энергии, получаемый в результате сопряжения,называется энергией сопряжения (энергией делокализации).
38. Энергия сопряжения бензола
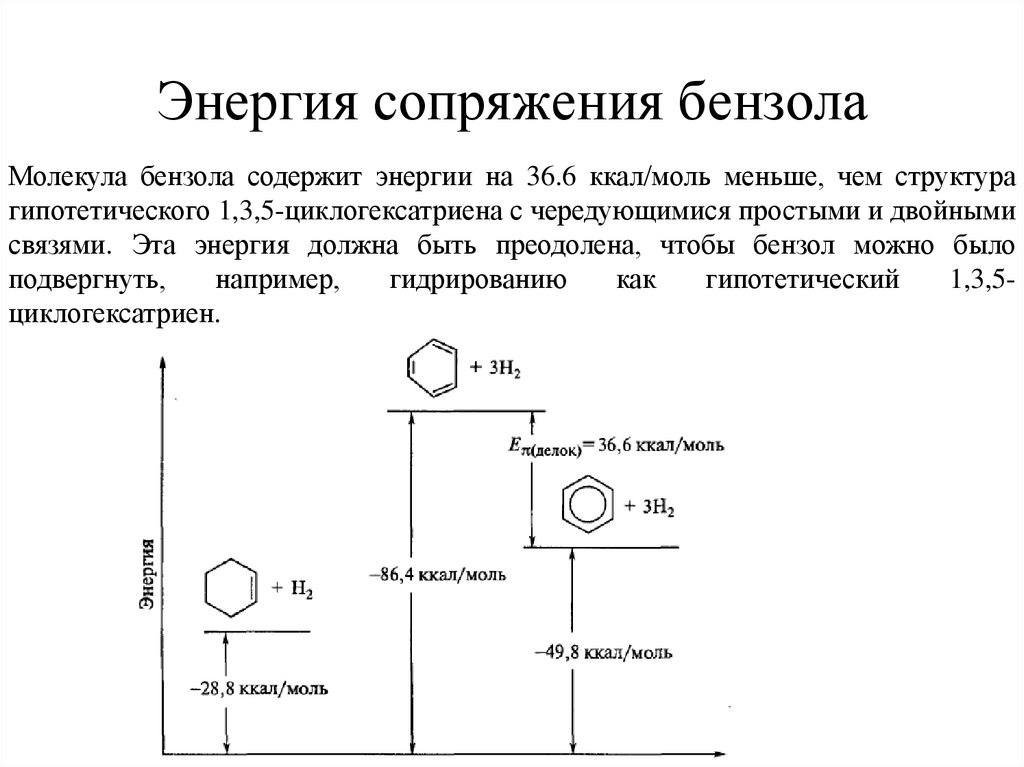
Молекула бензола содержит энергии на 36.6 ккал/моль меньше, чем структурагипотетического 1,3,5-циклогексатриена с чередующимися простыми и двойными
связями. Эта энергия должна быть преодолена, чтобы бензол можно было
подвергнуть,
например,
гидрированию
как
гипотетический
1,3,5циклогексатриен.
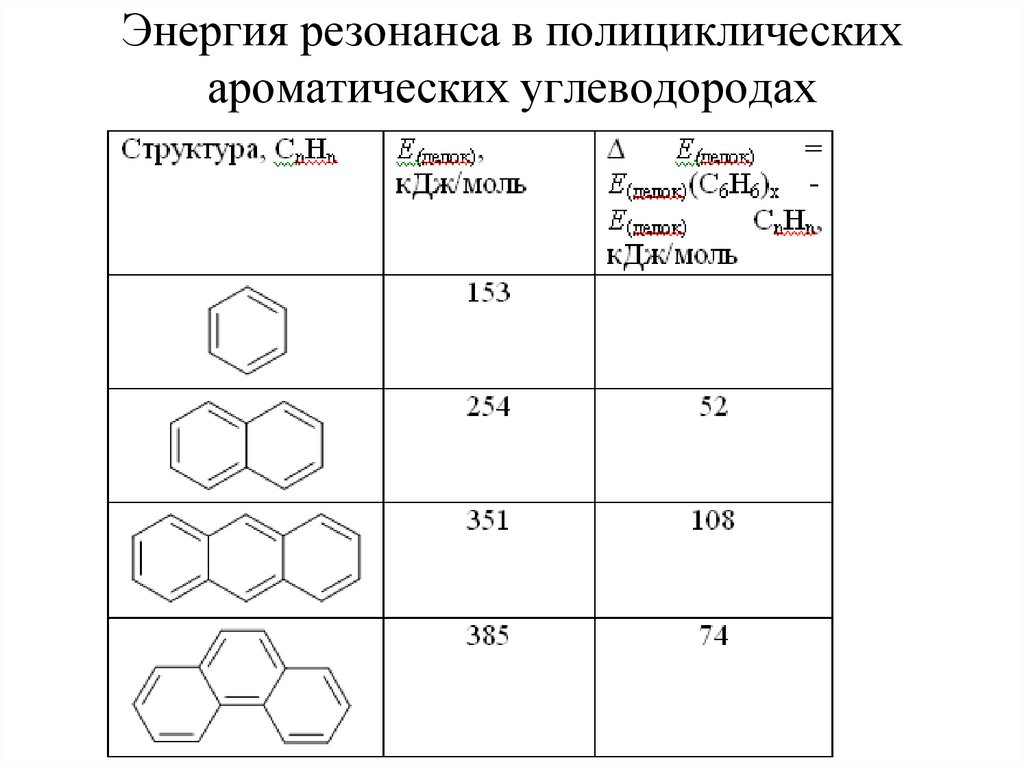
39. Энергия резонанса в полициклических ароматических углеводородах
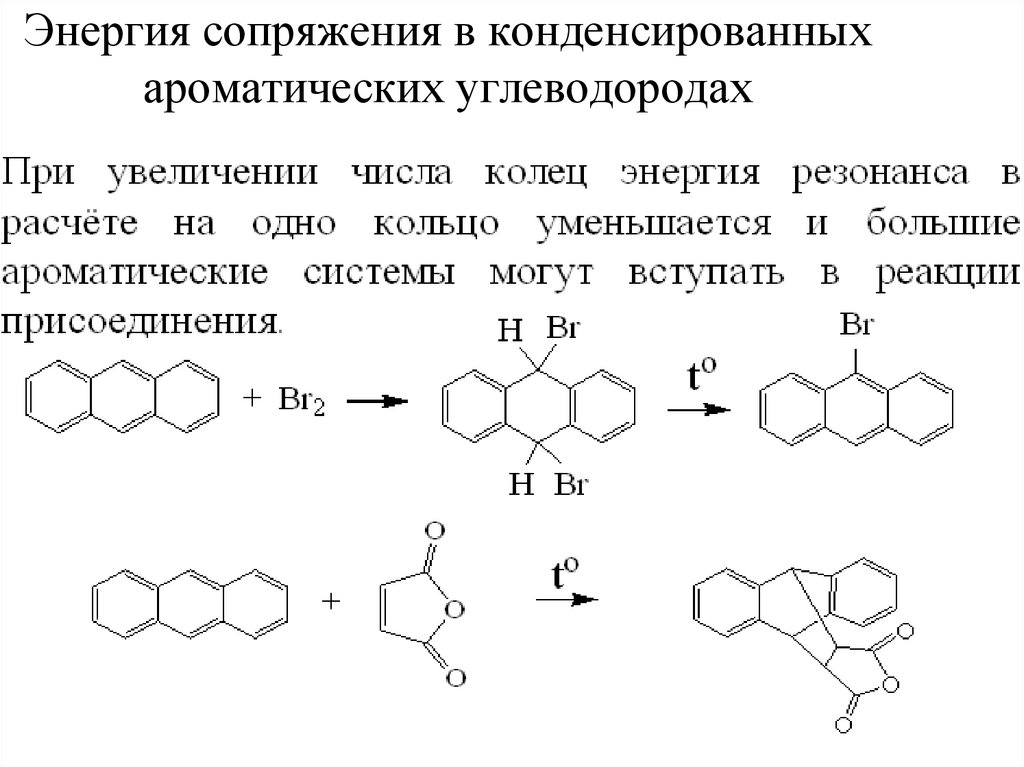
40. Энергия сопряжения в конденсированных ароматических углеводородах
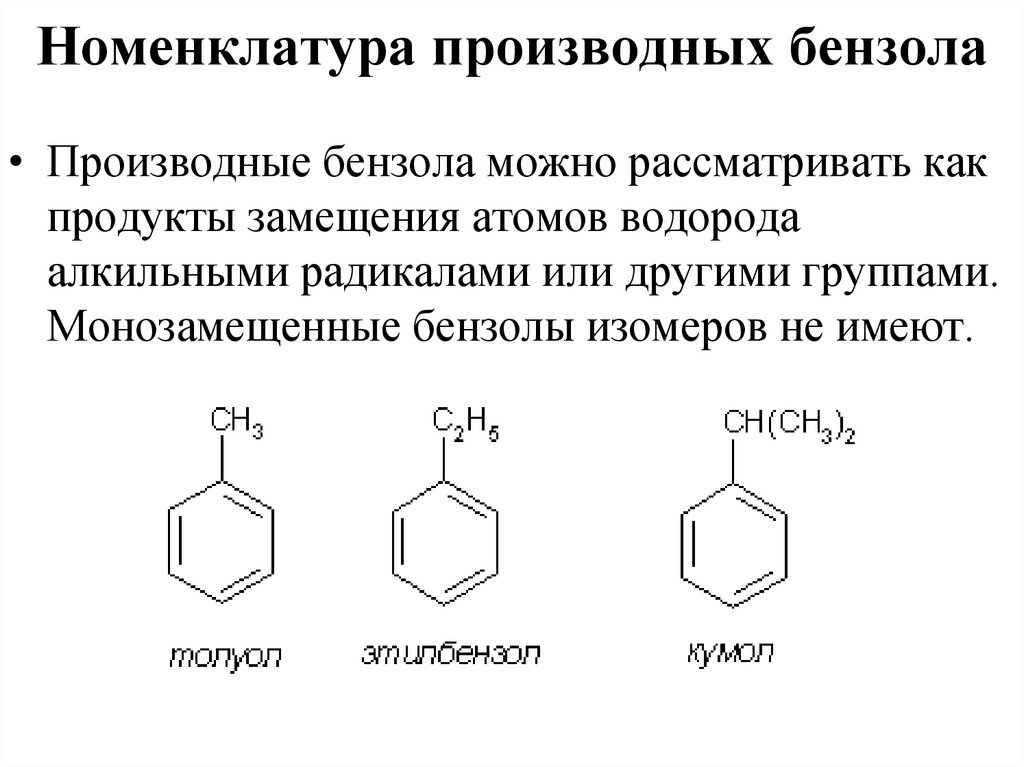
41. Номенклатура производных бензола
• Производные бензола можно рассматривать какпродукты замещения атомов водорода
алкильными радикалами или другими группами.
Монозамещенные бензолы изомеров не имеют.
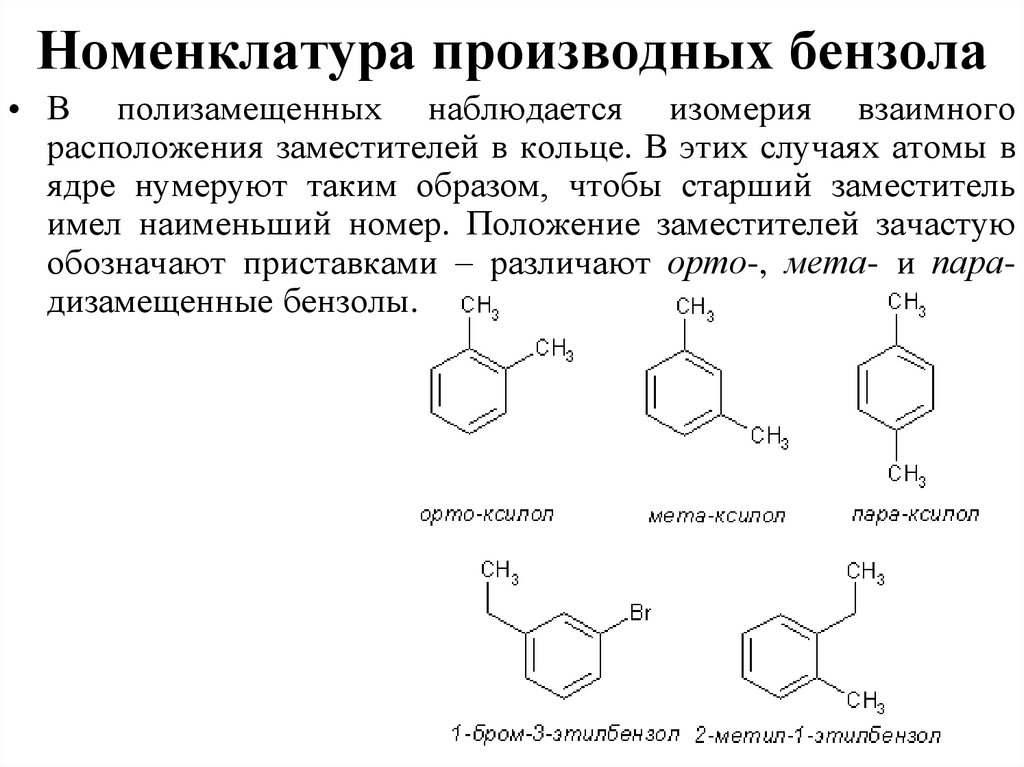
42. Номенклатура производных бензола
• В полизамещенных наблюдается изомерия взаимногорасположения заместителей в кольце. В этих случаях атомы в
ядре нумеруют таким образом, чтобы старший заместитель
имел наименьший номер. Положение заместителей зачастую
обозначают приставками – различают орто-, мета- и парадизамещенные бензолы.
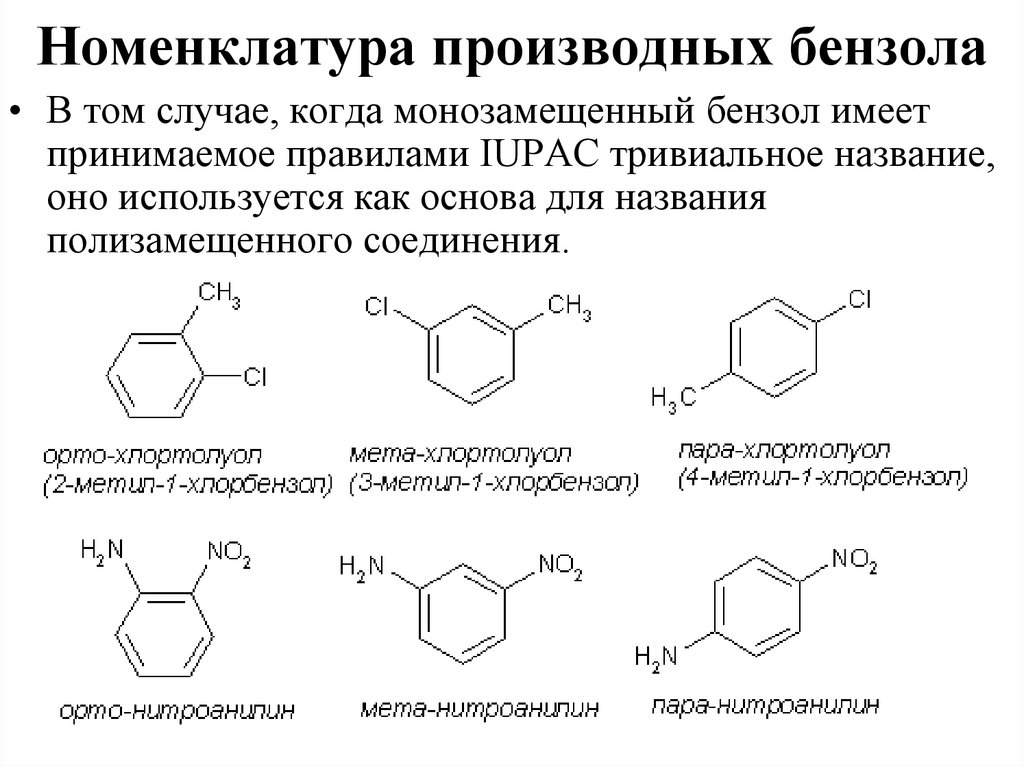
43. Номенклатура производных бензола
• В том случае, когда монозамещенный бензол имеетпринимаемое правилами IUPAC тривиальное название,
оно используется как основа для названия
полизамещенного соединения.
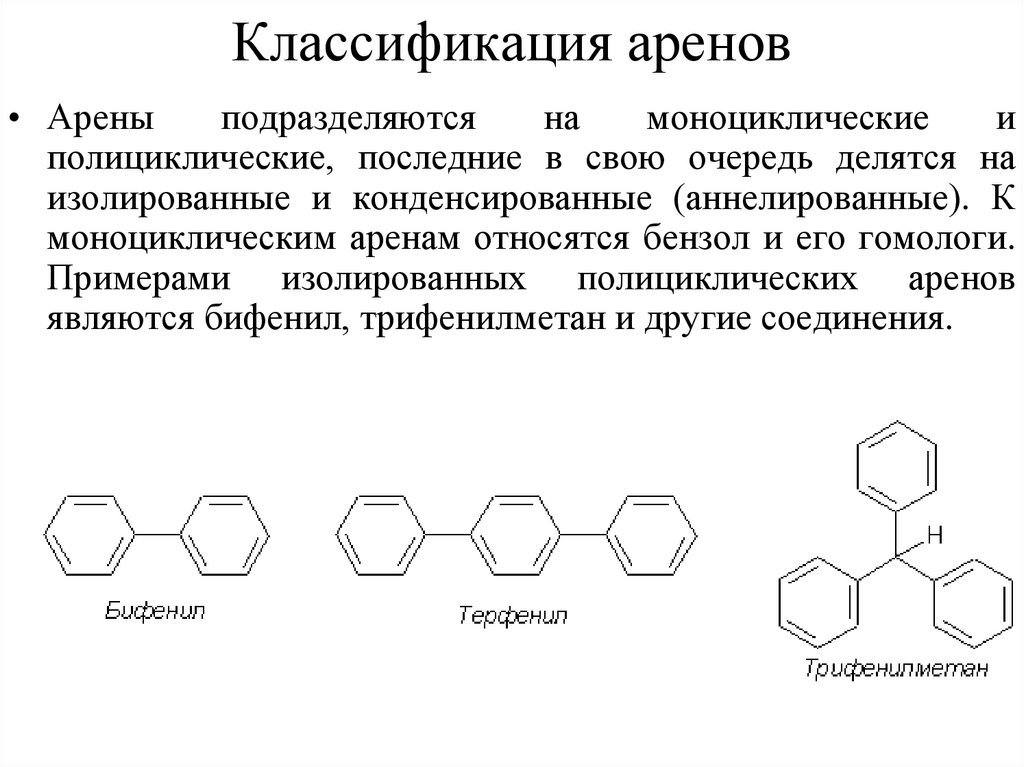
44. Классификация аренов
• Ареныподразделяются
на
моноциклические
и
полициклические, последние в свою очередь делятся на
изолированные и конденсированные (аннелированные). К
моноциклическим аренам относятся бензол и его гомологи.
Примерами изолированных полициклических аренов
являются бифенил, трифенилметан и другие соединения.
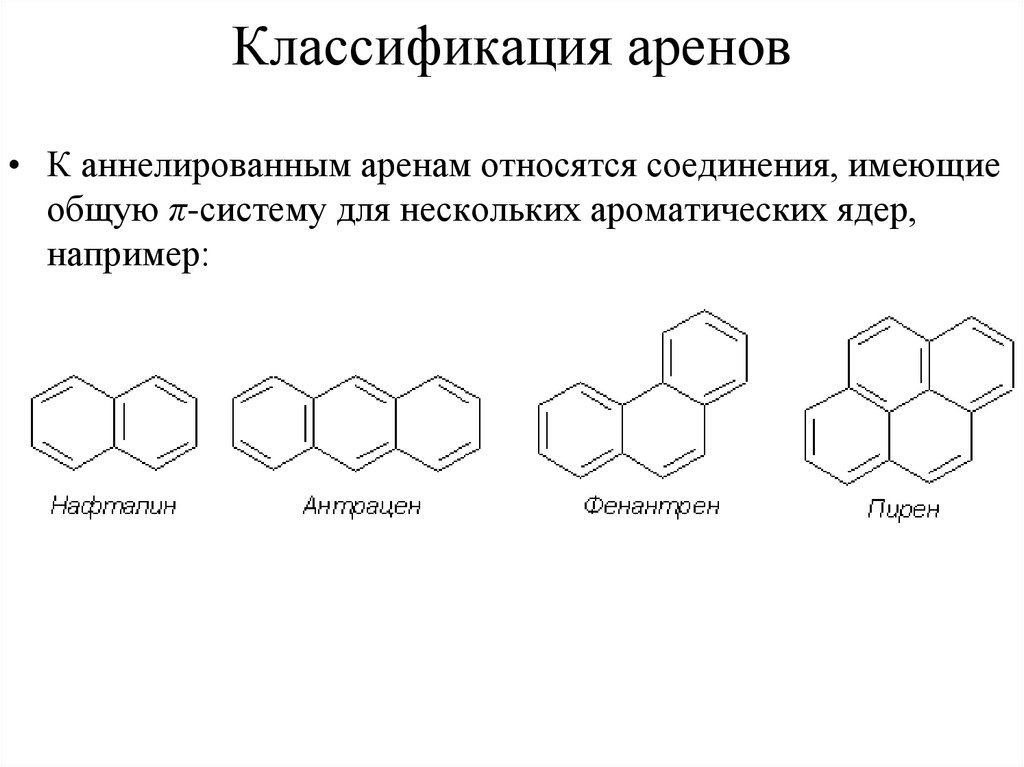
45. Классификация аренов
• К аннелированным аренам относятся соединения, имеющиеобщую π-систему для нескольких ароматических ядер,
например:
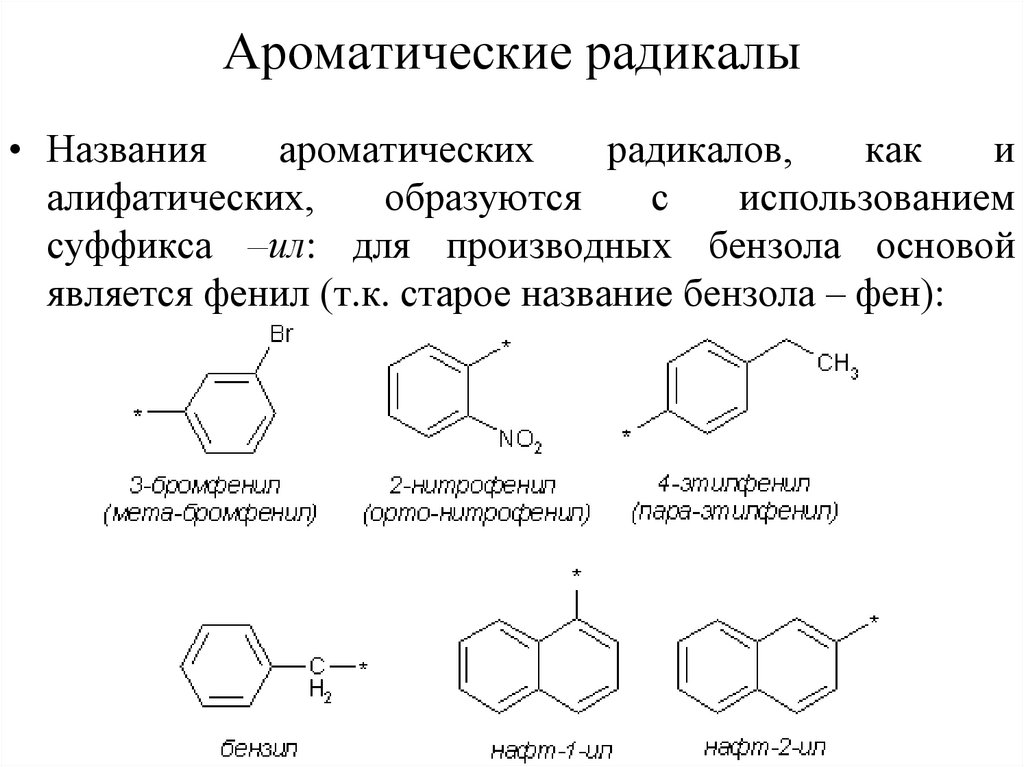
46. Ароматические радикалы
• Названияароматических
радикалов,
как
и
алифатических,
образуются
с
использованием
суффикса –ил: для производных бензола основой
является фенил (т.к. старое название бензола – фен):


















 Химия
Химия








