Похожие презентации:
Биологическая химия-биохимия полости рта
1.
СЗГМУ им. И. И. МЕЧНИКОВАКАФЕДРА КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ,
БИОЛОГИЧЕСКОЙ И ОБЩЕЙ ХИМИИ ИМ. В.В. СОКОЛОВСКОГО
БИОЛОГИЧЕСКАЯ ХИМИЯ-БИОХИМИЯ ПОЛОСТИ РТА
Раздел IX
ЛЕКЦИЯ
ОБМЕН ХОЛЕСТЕРОЛА И КЕТОНОВЫХ ТЕЛ.
ОБМЕН ЛИПОПРОТЕИНОВ ПЛАЗМЫ КРОВИ.
Доцент Антонова Ж.В.
2023/2024
2.
План лекции1.Пути использования ацетил-КоА
2. Кетогенез. 3. Регуляция синтеза. 4.Кетолиз.
5. Общая схема обмена КТ. 6. Биологическая роль КТ.
7. Обмен ХС. 7.1. Биологическая роль ХС. 7.2. Фонд ХС и пути его использования.
7.3. Синтез ХС: этапы и реакции. 7.4. Регуляция синтеза ХС. 7.5. Этерификация ХС.
7.6. Выведение ХС из организма.
8. ЛП плазмы крови. Строение. 8.1. Методы выделения ЛП. 8.2.Состав, свойства, роль
липопротеинов плазмы крови. 8.3.Биологическая роль аполипопротеинов (Апо) плазмы
крови.
8.4. Метаболизм ХМ.
8.5.Метаболизм ЛПОНП. 8.6. Метаболизм ЛПНП. 8.7. Метаболизм ЛПВП.
8.8. Роль ЛПВП.
9.Атеросклероз. 9.1.Дисфункция эндотелия. 9.2. Патогенез атеросклероза
2/Ж.В.
3.
Список сокращенийДГ - дегидрогеназа
КТ – кетоновые тела
ЖК – жирные кислоты
ВЖК- высшие жирные кислоты
ЛПЛ – липопротеинлипаза внепеченочных тканей
Т½ - период полураспада липопротеина
БАВ – биологически активные вещества
ХС – холестерол
ОХС – общий холестерол
ТАГ – триацилглицерол
ФЛ – фосфолипиды
ЭХС – эфиры холестерола
Б – белки
ЛХАТ –лецитинхолестеролацилтрансфераза
АГ - артериальная гипертензия
3/Ж.В.
4.
1. Пути использования ацетил-КоА1. Ацетил-КоА окисляется в ЦТК (митохондрия)
2. Используется в синтезе жирных кислот (липогенез / цитоплазма)
3. Используется на синтез холестерола (холестерологенез / цитоплазма)
4. Идет на синтез кетоновых тел (кетогенез / митохондрия)
5. Используется в синтезе ацетилхолина (ЦНС, вегетативные ганглии,
мотонейроны)
6. Участвует в реакциях ацетильной конъюгации при обезвреживании
ксенобиотиков и эндогенных метаболитов, содержащих –NH2 группу
(печень)
Пути использования ацетил-КоА зависят от
энергообеспеченности клетки и потребности организма в этих
веществах.
4/Ж.В.
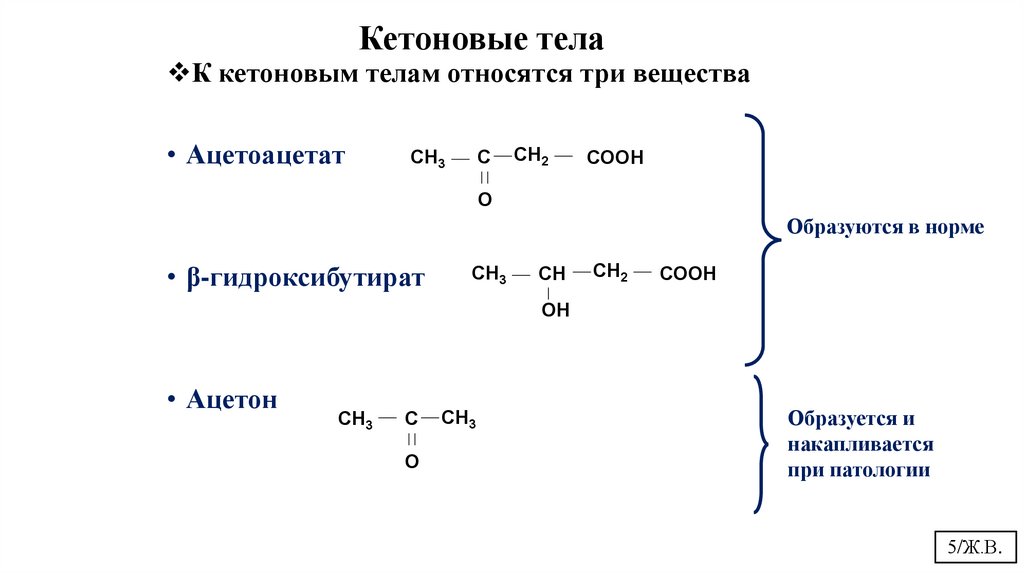
5.
Кетоновые телаК кетоновым телам относятся три вещества
• Ацетоацетат
СН3
С
CH2
СООН
O
Образуются в норме
• β-гидроксибутират
СН3
СН
CH2
СООН
OН
• Ацетон
СН3
С
O
CH3
Образуется и
накапливается
при патологии
5/Ж.В.
6.
глюкагон2. Синтез кетоновых тел в печени
H3C C(кетогенез)
SKoA
Ацетил-КоА
Ацетил-КоА
Матрикс митохондрии
глюкагон
Из β-окисления
HS-KoA
O НАДН2
Печень
O
ЦТК
H3C
Cb-окисление
SKoA
жировая
Ацетил-КоА +
O+
глюкагон
Ацетил-КоА
НАД
Ацетил-КоА
ткань
H3C C SKoA
тиолаза
Ацетил-КоА
глицерин Ацетил-КоА
глюкагон
ТГ НАДН2ЖК
b-окисление
глюкагон
+
Ацетил-КоА
НАД
O
ЖК
H
3C
C
HS-KoA
+ H3C
Тиолаза
H3C
C
HS-KoA
ГМГ-КоА
синтаза
CH
3
ХС
H3C
HS-KoA
O
H2
C C SKoA
Ацетоацетил-КоА
O
HS-KoA
HS-KoA
H3C
OЖК O
ГМГ-КоА синтаза
H2
C C C SKoA HS-KoA инд. ЖК
Ацетоацетил-КоА
тиолаза
ГМГ-КоА
синтаза H2
O
C SKoA
глюкагон
Ацетил-КоА
Ацетил-КоА
HOOC
C SKoA
Ацетил-КоА
OH
O
H2
C C ГМГ-КоА
C C SKoA
(ГидроксиМетилГлутарил-КоА)
CH 3
ГМГ-КоА
Ацетон HS-KoA инд. ЖК OH O
O
ГМГ-КоА
лиаза
неферH2
H2
C SKoA
H3C C SKoA
CO2 ХС мента- HOOC C C CГМГ-КоА
Ацетоацетат
лиаза
глюкагон
Ацетил-КоА
6/Ж.В.
CH 3
тивно
7.
Продолжение:Ацетоацетат
спонтанно
СО2
кровь
Ацетон
Из β-окисления
НАДН2
β-гидроксибутират ДГ
НАД+
β-гидроксибутират
(при накоплении ацетоацетата /патология)
Печень сама не использует кетоновые тела и они поступают в кровь.
Из крови они больше всего захватываются сердечной и скелетными мышцами,
корковым слоем почек, где они используются для получения энергии.
Клетки мозга могут использовать кетоновые тела при патологиях (СД) или при
длительном углеводном голодании. В норме клетки мозга для энергии используют
глюкозу.
7/Ж.В.
8.
3. Регуляция синтеза кетоновых телРегуляторный фермент синтеза КТ - ГМГ- КоА-синтаза.
• Высокие концентрации ЖК в крови индуцируют биосинтез ГМГ-КоА-синтазы.
Концентрация ЖК в крови увеличивается при мобилизации жиров из жировой ткани
под действием глюкагона, адреналина, т.е. при голодании или физической работе.
• Высокие концентрации свободного НS- КоА ингибируют ГМГ-КоА-синтазу. Когда
поступление ЖК в клетки печени увеличивается, НS-КоА связывается с ними,
концентрация свободного НS-КоА снижается и фермент становится активным.
8/Ж.В.
9.
4. Использование кетоновых тел во внепеченочных тканях (кетолиз)3АТФ
НАД+
кровь
НАДН2
Печень
ЦТК
β-гидроксибутират β-гидроксибутират ДГ
глюкагон
АДФ + Фн
Ацетил-КоА
O
O
HАцетоацетат
3C C SKoA
Ацетил-КоА
ЦТК H3C C SKoA
АТФ
Ацетил-КоА
глюкагон
Сукцинил-КоА Сукцинат
НАДН2
b-окисление
O
тиолаза
HS-KoA
O
H2
C C SKoA
H3C C
жировая
+
Ацетоацетил-КоА
Ацетоацетат
НАД
ткань
O
глицерин Сукцинил-КоА-ацетоацетат-КоА-трансфераза
H3C C SKoA
HS-KoA
9/Ж.В.
10.
-НАДН2
O
b-окисление
H3C
НАД+
C
H2
C C SKoA
Ацетоацетил-КоА
O
HS-KoA HS-KoA
ЖК
O
H3C
Тиолаза
Ацетил-КоА
ГМГ-КоА синтаза
HS-KoA инд. ЖК
ХС
C SKoA
OH
O
H2
H2
HOOC C C C C SKoA
Ацетил-КоА
Ацетил-КоА
глюкагон
CH 3
ЦТК
ГМГ-КоА
ГМГ-КоА лиаза
12 АТФ
O
ЦТК
H312
C АТФ
C SKoA
Ацетил-КоА
O
HOOC
H2
C C
CH 3
Ацетоацетат
10/Ж.В.
11.
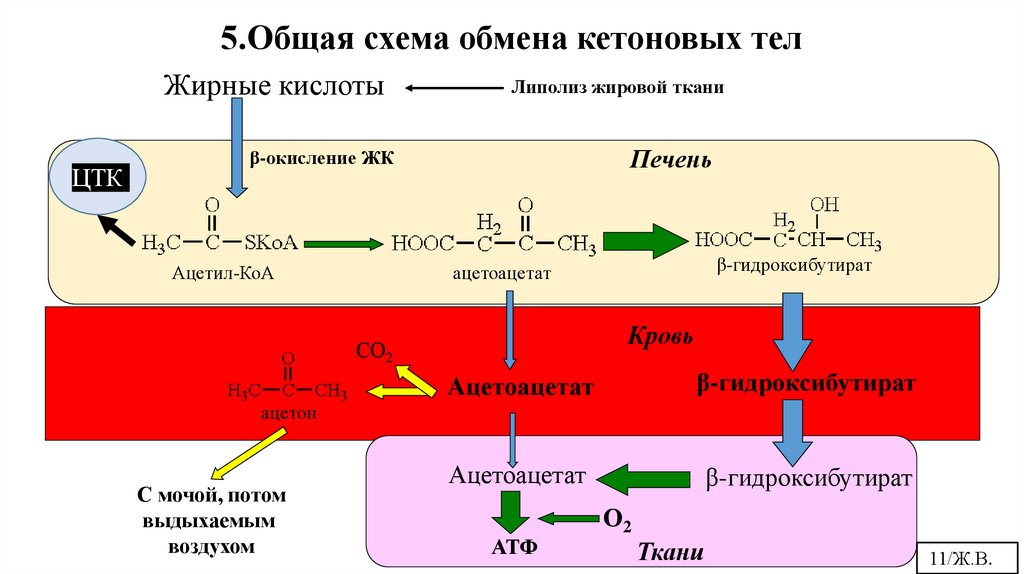
5.Общая схема обмена кетоновых телЦТК
Жирные кислоты
Липолиз жировой ткани
β-окисление ЖК
Печень
Ацетил-КоА
β-гидроксибутират
ацетоацетат
Кровь
СО2
Ацетоацетат
β-гидроксибутират
Ацетоацетат
β-гидроксибутират
ацетон
С мочой, потом
выдыхаемым
воздухом
АТФ
О2
Ткани
11/Ж.В.
12.
6. Биологическая роль кетоновых тел• КТ - альтернативный, водорастворимый источник энергии (1 мол. КТ /
26 АТФ) для мышц (скелетной и сердечной), коры надпочечников и др.
внепеченочных тканей.
• Окисление КТ, как и ЖК, сберегает глюкозу, что имеет большое
значение в энергоснабжении аэробных тканей при голодании и
физических нагрузках, когда возникает дефицит глюкозы.
• При голодании и сахарном диабете КТ использует мозг в качестве
источника энергии (ЖК не проходят гематоэнцефалический барьер).
Содержание КТ в крови:
• 30 мг/л – норма
• 300-500 мг/л – при голодании
• 3-4 г/л – при сахарном диабете
19/Ж.В.
13.
7. Обмен холестеролаХолестерол (ХС) — стероид, характерный только для животных
организмов.
• В сутки в организме синтезируется 1г ХС.
• ХС синтезируется в печени (50%), тонком кишечнике (15-20%), коже,
коре надпочечников, половых железах.
• С пищей поступает в сутки 0,3—0,5г ХС.
7.1. Биологическая роль ХС
Входит в состав мембран клеток, увеличивает их электроизоляционные
свойства, структурирует мембрану, придает ей жесткость и прочность;
входит в наружную оболочку ЛП плазмы крови.
В мембране защищает полиненасыщенные ЖК от окисления
(структурный антиоксидант);
Из ХС синтезируются: жёлчные кислоты, стероидные гормоны,
13/Ж.В.
витамин D3 в коже под действием УФ, эфиры холестерола.
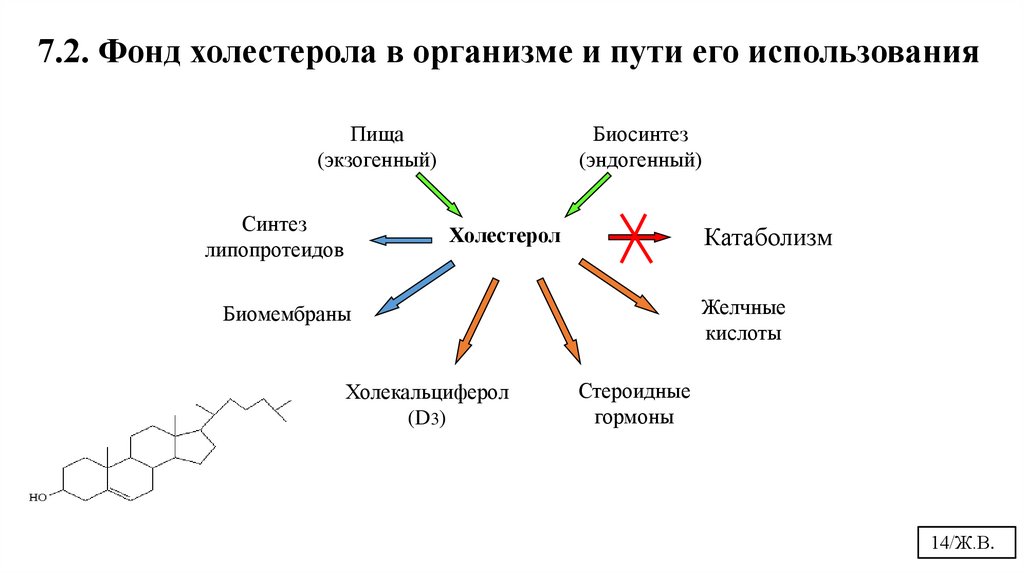
14.
7.2. Фонд холестерола в организме и пути его использованияПища
(экзогенный)
Синтез
липопротеидов
Биосинтез
(эндогенный)
Катаболизм
Холестерол
Желчные
кислоты
Биомембраны
Холекальциферол
(D3)
Стероидные
гормоны
14/Ж.В.
15.
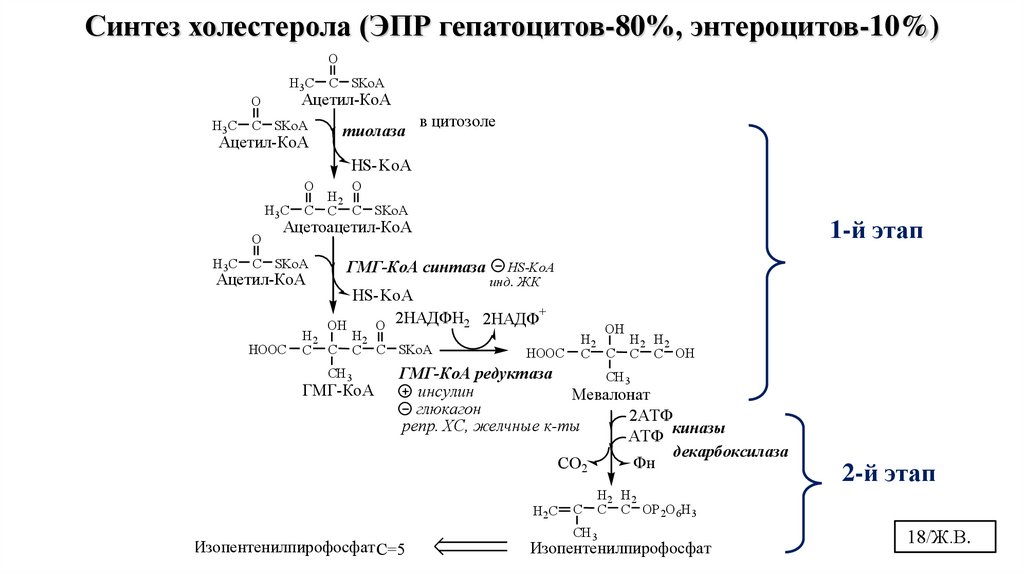
7.3. СИНТЕЗ ХОЛЕСТЕРОЛАПроисходит в цитозоле, в ЭПР клеток.
Это один из самых длинных метаболических путей в организме
человека (около 100 последовательных реакций).
Условно можно разделить на 3 этапа:
I этап - образование мевалоната (мевалоновой кислоты).
• Две молекулы ацетил-КоА конденсируются тиолазой с образованием
ацетоацетил-КоА.
• Гидроксиметилглутарил-КоА-синтаза (ГМГ-КоА) присоединяет третий
ацетильный остаток к ацетоацетил-КоА с образованием ГМГ-КоА.
• ГМГ-КоА-редуктаза восстанавливает ГМГ-КоА до мевалоната с
использованием 2 молекул НАДФH2.
• Примечание: синтез ХС писать в формулах до образования мевалоновой
кислоты, затем сущность этапов можно описывать словами. 15/Ж.В.
16.
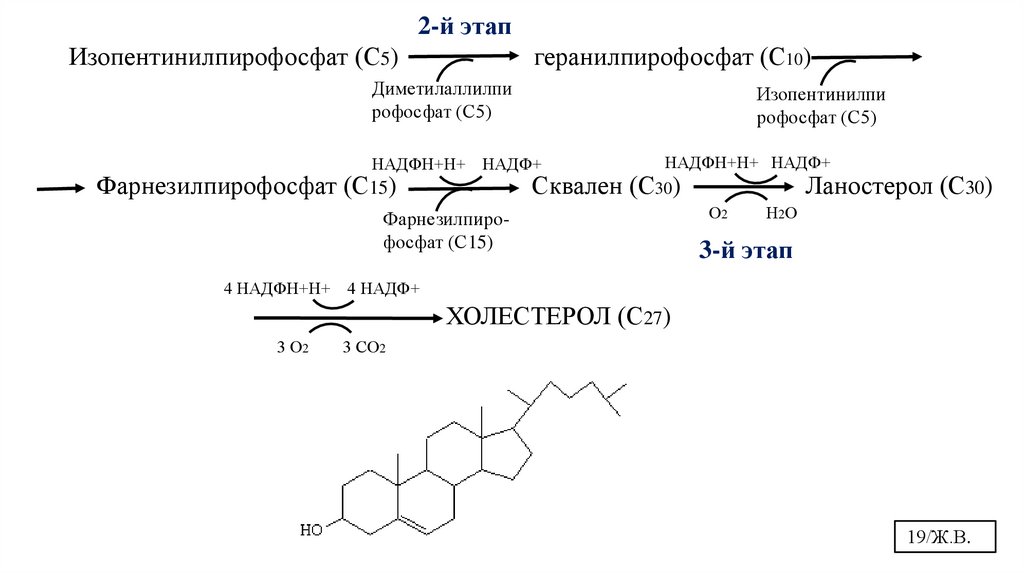
II этап - образование сквалена• Мевалонат превращается в изопреноидную структуру —
изопентенилпирофосфат (5 атомов углерода). Изомеризация
двойной связи в изопентинилпирофосфате приводит к
образованию диметилалилпирофосфата.
• Изопентенилпирофосфат и диметилалилпирофосфат
конденсируются в геранилпирофосфат (10 атомов углерода).
• Присоединение изопентенилпирофосфата к
геранилпирофосфату дает фарнезилпирофосфат (15 атомов
углерода).
• 2 Фарнезилпирофосфата конденсируются в сквален (15 атомов
углерода).
16/Ж.В.
17.
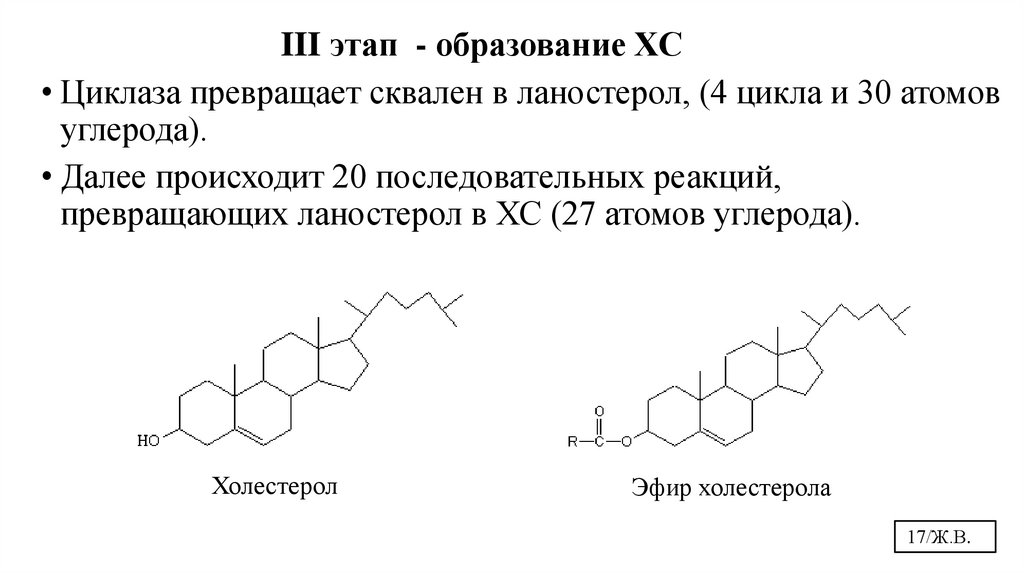
III этап - образование ХС• Циклаза превращает сквален в ланостерол, (4 цикла и 30 атомов
углерода).
• Далее происходит 20 последовательных реакций,
превращающих ланостерол в ХС (27 атомов углерода).
Холестерол
Эфир холестерола
17/Ж.В.
18.
Синтез холестерола (ЭПР гепатоцитов-80%, энтероцитов-10%)O
H3C
Ацетил-КоА
O
H3C
C SKoA
C SKoA
тиолаза
Ацетил-КоА
в цитозоле
HS-KoA
O
H3C
O
H3C
O
H2
C C C SKoA
1-й этап
Ацетоацетил-КоА
C SKoA
Ацетил-КоА
HOOC
ГМГ-КоА синтаза
HS-KoA
инд. ЖК
HS-KoA
+
OH
O 2НАДФН2 2НАДФ
H2
C C
H2
C C SKoA
CH 3
ГМГ-КоА
HOOC
OH
H2
H2 H2
C
C
C C OH
ГМГ-КоА редуктаза
CH 3
инсулин
Мевалонат
глюкагон
2АТФ
репр. ХС, желчные к-ты
АТФ киназы
декарбоксилаза
Фн
СО2
H2C
6 Изопентенилпирофосфат С=5
C
2-й этап
H2 H2
C C OP 2O6H3
CH 3
Изопентенилпирофосфат
18/Ж.В.
19.
2-й этапИзопентинилпирофосфат (С5)
геранилпирофосфат (С10)
Диметилаллилпи
рофосфат (С5)
Изопентинилпи
рофосфат (С5)
НАДФН+Н+ НАДФ+
Сквален (С30)
Ланостерол (С30)
О2
Н2О
НАДФН+Н+ НАДФ+
Фарнезилпирофосфат (С15)
Фарнезилпирофосфат (С15)
3-й этап
4 НАДФН+Н+ 4 НАДФ+
ХОЛЕСТЕРОЛ (С27)
3 О2
3 СО2
19/Ж.В.
20.
7.4. Регуляция синтеза ХСЗа счет изменения активности и количества ключевого фермента ГМГКоА-редуктазы.
• Аллостерическая регуляция: ХС и желчные кислоты - ингибиторы (по принципу
отрицательной обратной связи)
• Ковалентная модификация: инактивация фермента путем фосфорилирования
вызывается адреналином и глюкагоном за счет активации киназы ГМГ-Ко-Аредуктазы по аденилатциклазному пути. Инсулин, активируя протеинфосфатазу,
приводит к дефосфорилированию фермента и его активации.
• Репрессия гена ГМГ-КоА-редуктазы экзогенным ХС.
Ингибиторы синтеза ХС – статины (ловастатин, аторвастатин и
др.). Статиныы являются конкурентными ингибиторами ГМГ-КоАредуктазы.
20/Ж.В.
21.
7.5.Этерификация ХСХС образует с ВЖК сложные эфиры (ЭХС), которые более
гидрофобны, чем сам ХС.
• В клетках эту реакцию катализирует
АХАТ(АцилКоА:ацилхолестеролтрансфераза):
ХС + Ацил-КоА → ЭХС + HSKoA
• ЭХС формирует в цитоплазме липидные капли, которые являются
формой хранения ХС. По мере необходимости ЭХС гидролизуются
холестеролэстеразой на ХС и ВЖК.
• ЭХС синтезируются в крови в ЛПВП под действием ЛХАТ
(лецитин: холестеролацилтрансферазы):
ХС + лецитин → ЭХС + лизолецитин
21/Ж.В.
22.
7.6. Выведение ХС из организмаВ сутки из организма выводится 1,0 г - 1,3г ХС
• С желчью: 0,5 - 0,7 г/сут - в виде жёлчных кислот.
• С фекалиями ≈ 0,5-0,7 г/сут – в виде холестанола и
копростанола, которые образуюся из ХС в кишечнике
путем восстанавления по двойной связи под
действием ферментов бактерий.
• С кожным салом выделяется ≈ 0,1 г/сут
22/Ж.В.
23.
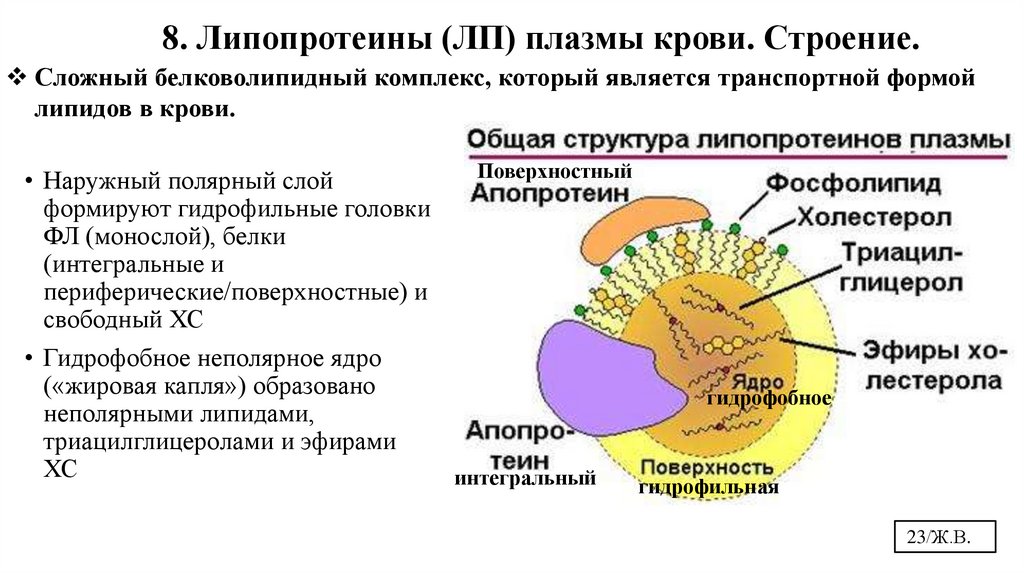
8. Липопротеины (ЛП) плазмы крови. Строение.Сложный белковолипидный комплекс, который является транспортной формой
липидов в крови.
Поверхностный
• Наружный полярный слой
формируют гидрофильные головки
ФЛ (монослой), белки
(интегральные и
периферические/поверхностные) и
свободный ХС
• Гидрофобное неполярное ядро
(«жировая капля») образовано
гидрофобное
неполярными липидами,
триацилглицеролами и эфирами
ХС
интегральный
гидрофильная
23/Ж.В.
24.
8.1. Методы выделения ЛП.Метод ультрацентрифугирования позволяет разделить ЛП на основании их различной плотности,
которая зависит от соотношения количества липидов и белков, и измеряется по способности
флотировать (всплывать) при ультрацентрифугировании в растворах с разной плотностью,
создаваемой NaCl или KBr. Так были выделены 4 основные фракции, отличающиеся по плотности
частиц: ХМ, ЛПОНП, ЛПНП, ЛПВП.
Метод электрофореза в геле позволяет разделить ЛП в зависимости от заряда и размера частиц. Заряд
зависит от количества белков в ЛП. Все типы ЛП движутся к аноду.
ЛП(разделение ультрацентрифугированием
по плотности)
Плотность, г/мл
Диаметр частиц
ЛП (разделение
электрофорезом)
1. Хиломикроны (ХМ)
0,92-0,98
>120 нм
ХМ
2. ЛП очень низкой плотности (ЛПОНП)
0,96-1,00
30-100 нм
Пре β-ЛП
3. ЛП низкой плотности (ЛПНП)
1,00-1,06
21-100 нм
β-ЛП
4. ЛП высокой плотности (ЛПВП)
1,06-1,21
7-15 нм
α-ЛП
Т.к. плотность частиц зависит от соотношения липид/белок, соотношение уменьшается, а
следовательно уменьшается и размер частиц от ХМ к ЛПВП
24/Ж.В.
25.
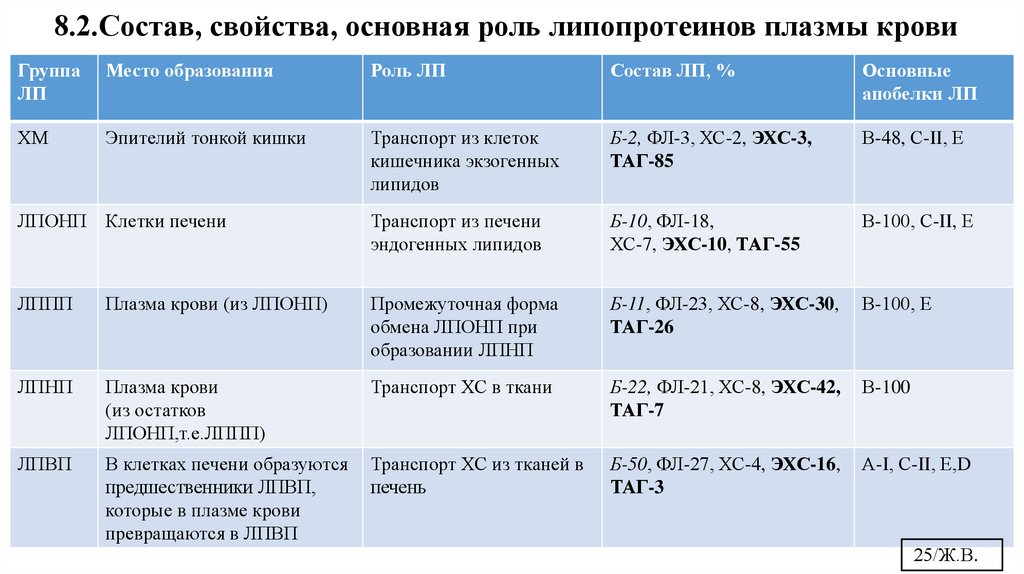
8.2.Состав, свойства, основная роль липопротеинов плазмы кровиГруппа
ЛП
Место образования
Роль ЛП
Состав ЛП, %
Основные
апобелки ЛП
ХМ
Эпителий тонкой кишки
Транспорт из клеток
кишечника экзогенных
липидов
Б-2, ФЛ-3, ХС-2, ЭХС-3,
ТАГ-85
В-48, С-II, Е
ЛПОНП
Клетки печени
Транспорт из печени
эндогенных липидов
Б-10, ФЛ-18,
ХС-7, ЭХС-10, ТАГ-55
В-100, С-II, Е
ЛППП
Плазма крови (из ЛПОНП)
Промежуточная форма
обмена ЛПОНП при
образовании ЛПНП
Б-11, ФЛ-23, ХС-8, ЭХС-30,
ТАГ-26
В-100, Е
ЛПНП
Плазма крови
(из остатков
ЛПОНП,т.е.ЛППП)
Транспорт ХС в ткани
Б-22, ФЛ-21, ХС-8, ЭХС-42,
ТАГ-7
В-100
ЛПВП
В клетках печени образуются
предшественники ЛПВП,
которые в плазме крови
превращаются в ЛПВП
Транспорт ХС из тканей в
печень
Б-50, ФЛ-27, ХС-4, ЭХС-16,
ТАГ-3
А-I, С-II, Е,D
25/Ж.В.
26.
8.3.Биологическая роль аполипопротеинов (Апо) плазмы крови.Аполипопротеины (Апо) – это белки, входящие в состав ЛП.
Выделяют 5 основных классов: A, B, C, D, E
Апо
Биологическая роль
АпоА-I
Активатор фермента лецитин:холестеролацилтрансферазы (ЛХАТ), которая синтезирует
эфиры ХС путем переноса остатка ЖК из 2-го положения лецитина на ХС. ЛХАТ и
АпоА-I связаны с ЛПВП. Синтезируется в печени и в кишечнике
АпоB-48
Синтезируется в кишечнике, формирует ХМ
АпоВ-100
Лиганд рецепторов, синтезируется в печени, формирует ЛПОНП и ЛПНП
АпоС-II
Активатор липопротеинлипазы (ЛПЛ), мембраносвязанного фермента на поверхности
эндотелия капилляров различных тканей. ЛПЛ синтезируется в печени и
гидролизует ТАГ в ХМ и ЛПОНП внепеченочных тканей. Для её работы необходим
гепарин, АпоС-II
АпоD
Транспорт ЭХС между ЛП в крови, синтезируется в печени, хранится на ЛПВП
АпоE
Лиганд рецепторов, синтезируется в печени
26/Ж.В.
27.
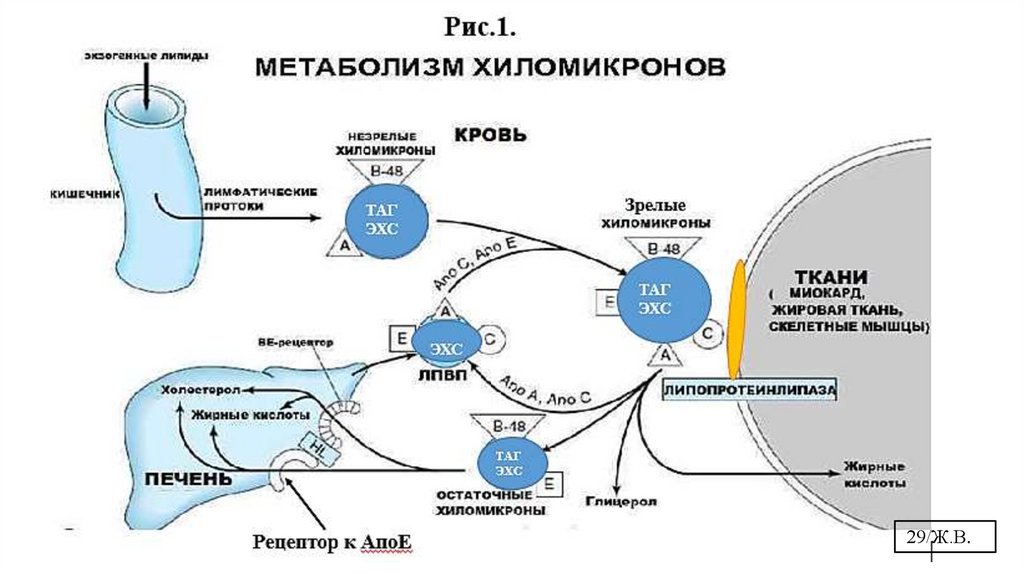
8.4. Метаболизм хиломикронов (ХМ), Рис. 1.• ХМ формируются в стенке кишечника, несут экзогенные липиды во
внепеченочные ткани.
• Состав ХМ: 88% ТГ, 4% ХС и ЭХС, 1-2% белки (апоВ-48/интеградьный, С-II ,
Е, А - поверхностные)
• Самые крупные и легкие ЛП, неустойчивы, секретируются в лимфу, затем в
кровь.
• Незрелые ХМ в крови получают от ЛПВП апо С-II и апо Е и становятся
«зрелыми». Они несут субстрат (ТАГ) для ЛПЛ внепеченочных тканей и
активатора для неё – Апо С-II. ХМ начинают взаимодействовать с ЛПЛ
внепеченочных тканей.
• В крови, на поверхности эндотелия внепеченочных тканей ТАГ в составе ХМ
подвергаются гидролизу под действием липопротеинлипазы внепеченочных
тканей. ЛПЛ активируется инсулином. ЖК поступают в ткани, глицерол – в
печень.
• В результате гидролиза ТАГ хиломикроны теряют значительную часть ТАГ (до
90%), но ЭХС, переносимые из кишечника в составе ХМ- остаются в
гидрофобном ядре липопротеина.
27/Ж.В.
28.
8.4. Метаболизм хиломикронов (ХМ), Рис.1. - продолжение• ХМ значительно уменьшаются в размерах, теряют сродство к апоС,
который возвращается на ЛПВП, и превращаются в остаточные или
ремнантные частицы (РЧ), богатые ЭХС. Ремнанты содержат АпоВ48 и
АпоЕ.
• РЧ захватываются печенью с помощью рецептора к апоЕ (рецептор
опосредованный эндоцитоз). В печень РЧ приносят ЭХС.
• ХМ переносят ТАГ в основном в жировую ткань, где ЛПЛ в 10 раз
активнее, чем в мышцах.
• Т½=10-15 мин.
• При наследственной недостаточности ЛПЛ или дефекте в апоС-II
наблюдается гиперхиломикронемия – гиперлипопротеинемия I типа по
классификации гиперлипидемий по Фредриксону (редкий тип) – не
приводит к атеросклерозу
28/Ж.В.
29.
29/Ж.В.30.
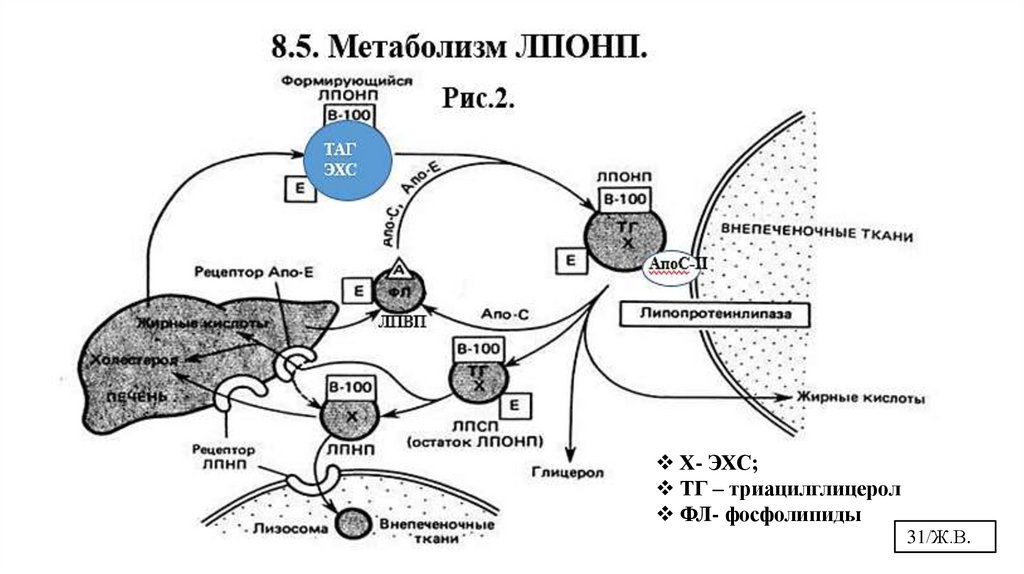
8.5. Метаболизм ЛПОНП, Рис.2• Синтезируются паренхиматозными клетками печени
• Переносят эндогенные липиды (в первую очередь ТАГ и ЭХС из печени в
другие ткани)
• Состав ЛПОНП: 50% ТГ, 20% ХС и ЭХС, 10% белки (апоB-100, C-II, E, D)
• Т½=2-4 часа
• Взаимодействие с ЛПЛ приводит к потере ТАГ и АпоС-II и образованию
ремнантных ЛПОНП (ЛППП), богатых ЭХС, также, как это было у ХМ.
• В образовании ЛПНП участвуют ЛПВП, передавая остаточным ЛПОНП
ЭХС и забирая свободный ХС и ТАГ
• ЛПОНП значительно повышаются в крови больных с
дислипопротеинемиями IIb, IV и V типов. Природа генетических дефектов
до сих пор неясна.
30/Ж.В.
31.
Х- ЭХС;ТГ – триацилглицерол
ФЛ- фосфолипиды
31/Ж.В.
32.
8.6. Метаболизм ЛПНП, Рис.2• Образуются в плазме крови из остаточных ЛПОНП т. е.- ЛППП
• Состав ЛПНП: 10% ТГ, 55% ХС и ЭХС, 20% белки (апоВ-100)
• Т½ ≈ 2,5 дня
• ЛПНП, как и ЛПОНП, переносят ХС из печени в ткани в виде ЭХС
• ЛПНП захватываются тканями рецептор-опосредованным
эндоцитозом по механизму интернализации через рецептор к АпоВ100.
• Модификация ЛПНП (окисление, гликозилирование и др.) приводит к
их атерогенности.
32/Ж.В.
33.
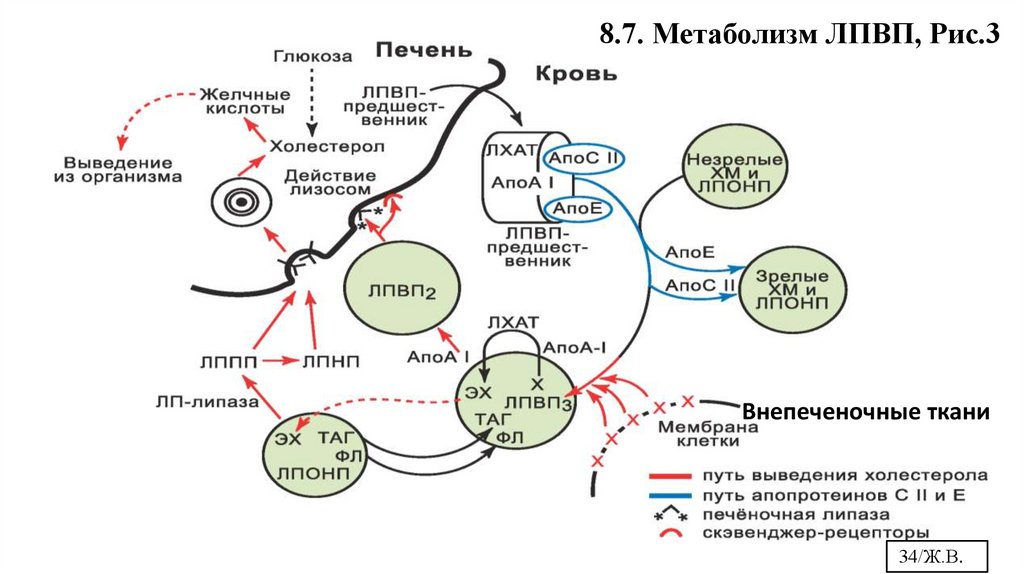
8.7. Метаболизм ЛПВП, Рис.3• Антиатерогенные ЛП. Синтезируются в печени и в кишечнике
• Состав ЛПВП: 10% ТГ, 30% ХС и ЭХС, 45% белки (апоА, С, Д, Е). 90% всех белков
– это апоА-I и А-II
• Т½ ≈ 5 суток
• Очень сильный акцептор свободного ХС из тканей, благодаря наличию ЛХАТ и
апоА-I
• Незрелые ЛПВП- в виде диска, состоящего из бислоя фосфолипидов. Нет
гидрофобного ядра, т. к. еще не насинтезировались ЭХС. Для реакции, идущей в
ЛПВП, он «вычерпывает» ХС из внепеченочных тканей и поверхности других ЛП
(рис.3). Реакция идет с ЛХАТ, активатор Апо-А-I. ЭХС поступают внутрь ЛПВП,
формируя гидрофобное ядро, ЛПВП ЛХАТ
становятся сферическим.
ХС+лецитин
ЭХС+лизолецитин
• ЛПВП, обогащенные ЭХС, направляются в печень, где деградируют.
33/Ж.В.
34.
8.7. Метаболизм ЛПВП, Рис.3Внепеченочные ткани
34/Ж.В.
35.
8.8. Основная роль ЛПВП1. Участие ЛПВП в транспорте ХС от других органов к печени, или
«обратный транспорт ХС», – основной механизм, благодаря которому
ЛПВП может защитить стенку артерии.
2. Оказывают антиоксидантное действие на ЛПНП, используя для
этерификации ХС не свой лецитин, а лецитин(ФЛ) ЛПНП, жирная
кислота которого часто уже подвергнута перекисному окислению.
2. Снабжают белками и ЭХС другие ЛП, повышая их стабильность.
4. ЛПВП могут захватывать ХС из макрофагов, способствуя
рассасыванию липидных полосок, самой ранней формы
атеросклеротического поражения сосудов
35/Ж.В.
36.
9. Атеросклероз (АС)• Дегенеративное заболевание сосудов
• Сложный многоэтапный патологический процесс, поражающий
внутреннюю оболочку крупных и средних артерий
• В настоящее время популярна теория, в соответствии с которой АС
рассматривается как реакция на повреждение сосудистой стенки
(эндотелия)
• Под повреждением подразумевается не механическая травма, а его
дисфункция.
36/Ж.В.
37.
9.1. Дисфункция эндотелия• Проявляется повышением проницаемости и адгезивности, увеличением
секреции прокоагулянтных и сосудосуживающих факторов
• Дисфункцию эндотелия могут вызвать:
• Гемодинамические факторы (АГ)
• Токсичные соединения (компоненты табачного дыма)
• Инфекционные агенты (вирус герпеса)
• Иммунные комплексы
• Измененный уровень гормонов (адреналин повышен, инсулин снижен)
• Избыток гомоцистеина
• Но самый важный - гиперхолестеролемия, при которой ОХС>5,2ммоль/л
(референсный интервал 3,4-5,2 ммоль/л)
37/Ж.В.
38.
9.2. Патогенез атеросклероза• В результате дисфункции эндотелия возникает избыточная
инфильтрация интимы ЛПНП, активируются процессы их
модификации и развивается воспалительная реакция
• За модифицированными ЛПНП (мЛПНП) устремляются
моноциты и Т-лимфоциты крови
• Моноциты дифференцируются в макрофаги (МФ)
• Задача МФ – захват мЛПНП с их последующей деструкцией
38/Ж.В.
39.
9.2. Патогенез атеросклероза - продолжение• Однако неконтролируемый захват ЛП через «скевенджеррецепторы» МФ приводит к накоплению большого
количества ЭХС и ХС и перерождению МФ в пенистые
клетки, которые дают начало липидным полоскам – I-ой
морфологической стадии атеросклеротической бляшки
• МФ секретируют БАВ, включая хемокины, митогены и
факторы роста, которые стимулируют миграцию из медии
в интиму гладкомышечных клеток и фибробластов, их
пролиферацию и синтез соединительной ткани
39/Ж.В.
40.
9.2. Патогенез атеросклероза - продолжение• Нарушение целостности фиброзной капсулы приводит к
контакту ее содержимого с тромбоцитами и
немедленному формированию тромба, что может
привести к ишемии сердца, мозга, почек и даже к
внезапной смерти
• На поздних стадиях развития фиброзные бляшки
представляют собой плотные ригидные образования,
имеющие прочную соединительнотканную капсулу и
содержащие относительно мало липидов и много
фиброзной ткани (белые бляшки). Они вызывают
значительное сужение сосудов.
40/Ж.В.
41.
Рекомендуемая литератураОсновная
1.Биохимия : учебник / под ред. Е.С. Северина. – М. : ГЭОТАР-Медиа, 2011. – С. 399–457.
2.Биохимия [Электронный ресурс] : учебник / под ред. Е.С. Северина. – 5-е изд., испр. и доп. – М. : ГЭОТАР-Медиа, 2015. –
http://www.studmedlib.ru / book / ISBN9785970433126.html (разд. 8, п. V–IХ; с. 399–457).
3.Биологическая химия. Биохимия полости рта : учебник / Т.П. Вавилова, А.Е. Медведев. – М. : ГЭОТАР-Медиа, 2014. – С. 171–
181, 231–238, 286–288, 319–326.
4.Биологическая химия. Биохимия полости рта [Электронный ресурс] : учебник / Т.П. Вавилова, А.Е. Медведев. – М. : ГЭОТАРМедиа, 2014. – http://www.studmedlib.ru / book / ISBN9785970430392.html (ч. IV, гл. 12; ч. V, гл. 14; с. 171–181; 231–238; 286–288;
319–326).
5.Метаболические нарушения и зубочелюстная система : учебно-методическое пособие для студентов стоматологических
факультетов медицинских вузов / под ред. Л.Б. Гайковой, Ж.В. Антоновой, Р.Н. Павловой. – СПб. : Изд-во СЗГМУ им. И.И.
Мечникова, 2017. – С. 112–124.
6.Обмен липидов. Биологические мембраны : учебно-методическое пособие к практическим и лабораторным занятиям по
биологической химии – биохимии полости рта для студентов стоматологических факультетов медицинских вузов / под ред. Ж.В.
Антоновой, Р.Н. Павловой, Л.Б. Гайковой. – СПб. : Изд-во СЗГМУ им. И.И. Мечникова, 2018. – С. 43–70.
7.Сборник тестовых заданий по разделам биологической химии и биохимии полости рта : учебно-методическое пособие для
студентов стоматологического факультета / под ред. В.А. Дадали, Ж.В. Антоновой, Р.Н. Павловой. – СПб. : Изд-во СЗГМУ им. И.И.
Мечникова, 2017. – С. 83–107.
Дополнительная
8.Биологическая химия / Т.Т. Березов, Б.Ф. Коровкин. – М. : Медицина, 1998. – С. 194–203, 248–287, 289–298, 357–361, 363–406.
41/Ж.В.
42.
Спасибо за внимание!42/Ж.В.































 Химия
Химия








