Похожие презентации:
Предельные одноатомные спирты
1. Предельные одноатомные спирты
2.
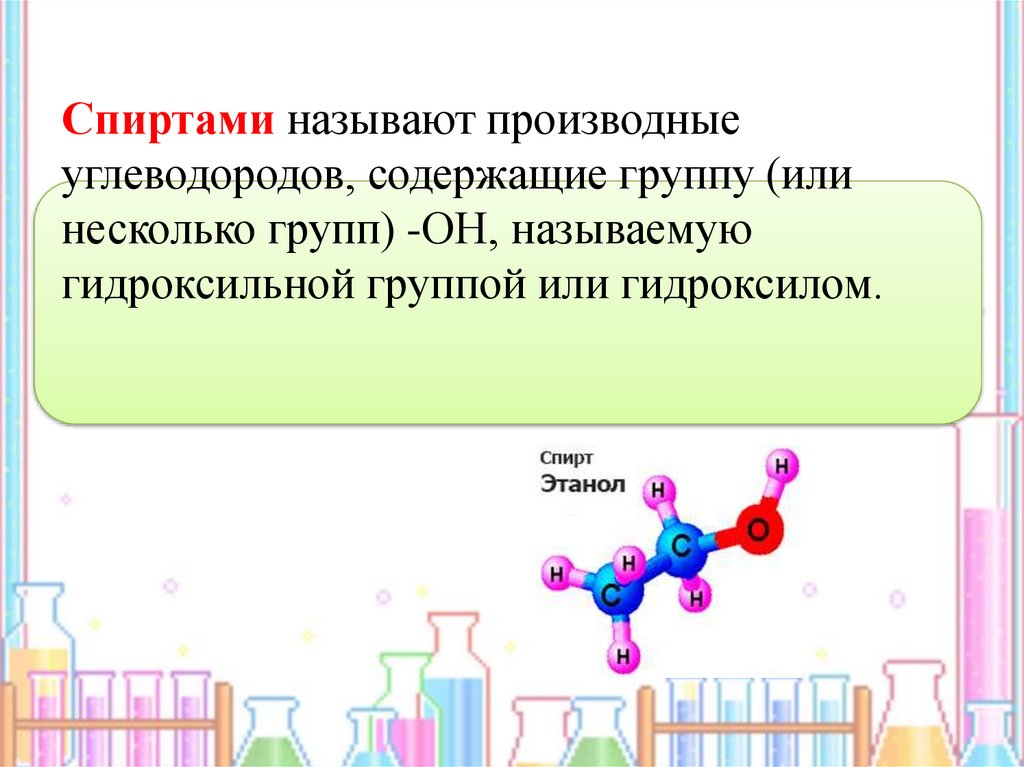
Спиртами называют производныеуглеводородов, содержащие группу (или
несколько групп) -ОН, называемую
гидроксильной группой или гидроксилом.
3.
Функциональной называют группуатомов, которая определяет наиболее
характерные свойства вещества и его
принадлежность к определенному
классу соединений.
4.
Предельными одноатомнымиспиртами или, алканолами называют
органические соединения, в молекулах
которых алкильный радикал (R) связан с
гидроксильной группой.
Состав их соответствует формуле
R – ОН или СnH2n+1OH
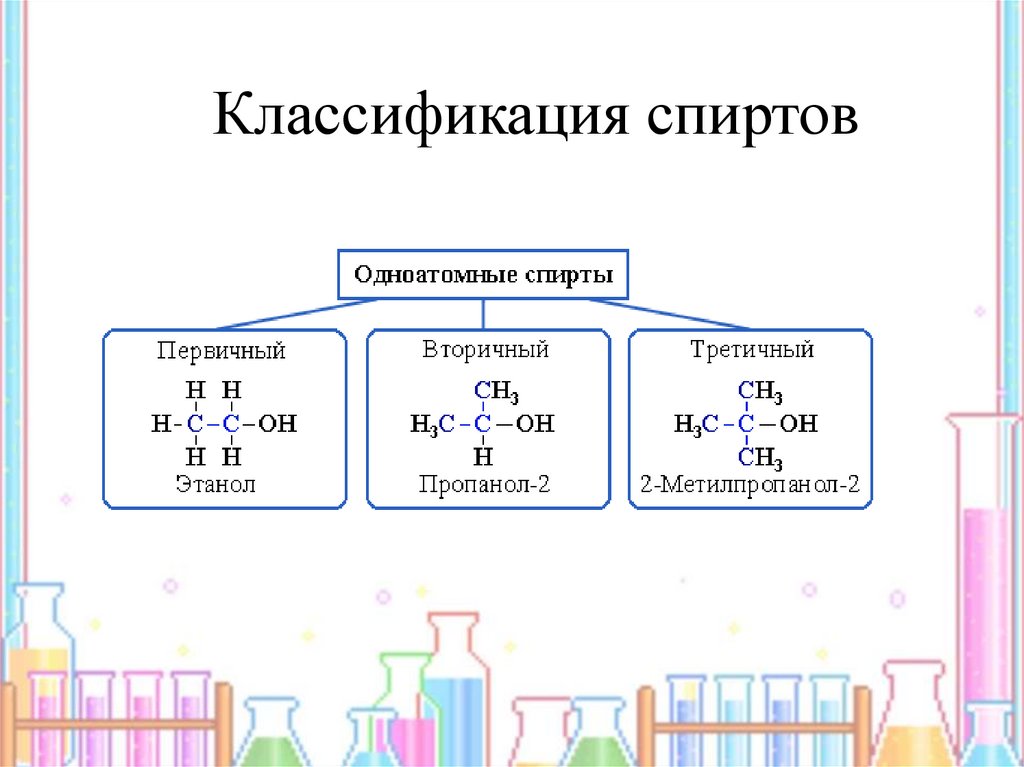
5. Классификация спиртов
6.
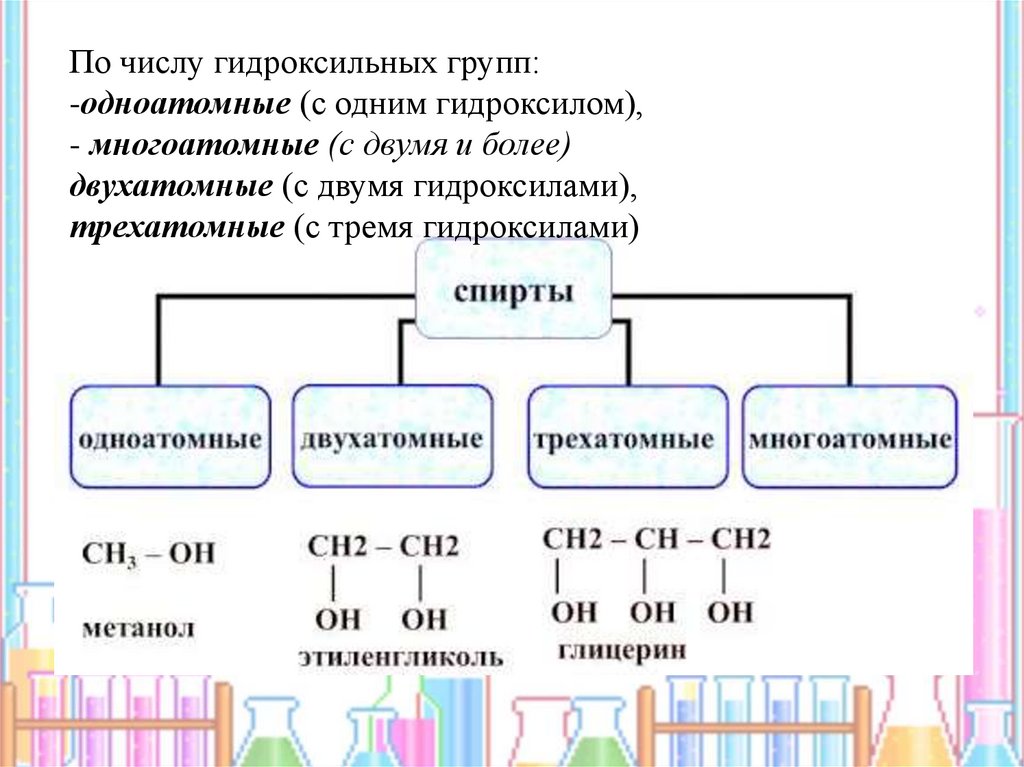
По числу гидроксильных групп:-одноатомные (с одним гидроксилом),
- многоатомные (с двумя и более)
двухатомные (с двумя гидроксилами),
трехатомные (с тремя гидроксилами)
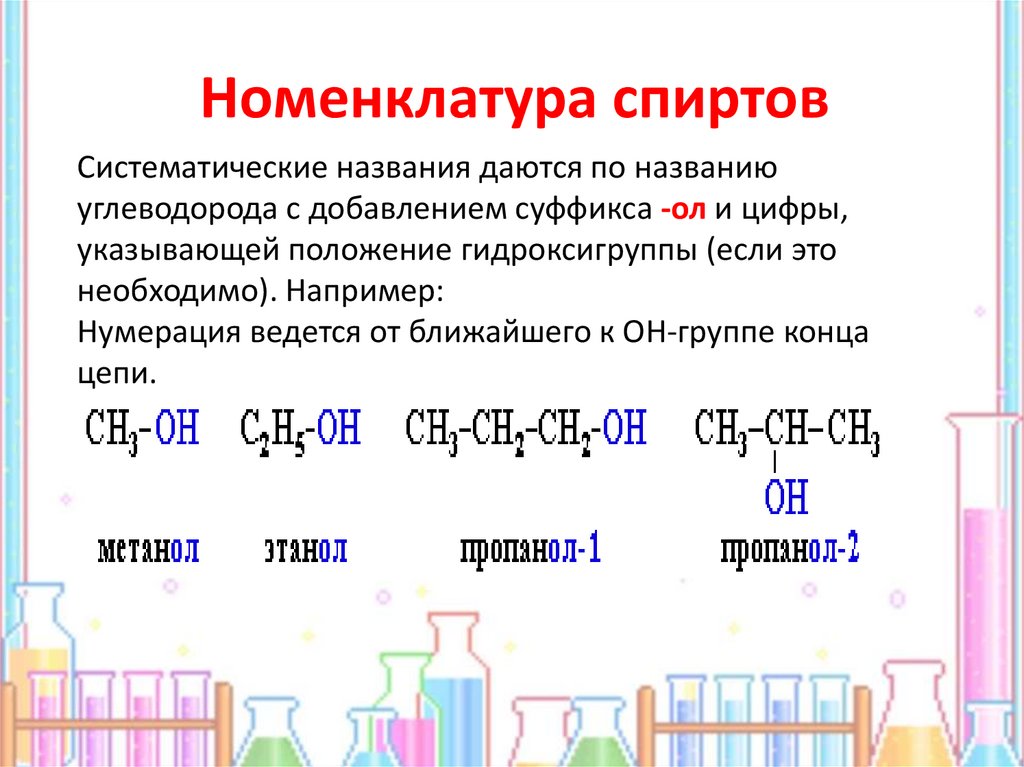
7. Номенклатура спиртов
Систематические названия даются по названиюуглеводорода с добавлением суффикса -ол и цифры,
указывающей положение гидроксигруппы (если это
необходимо). Например:
Нумерация ведется от ближайшего к ОН-группе конца
цепи.
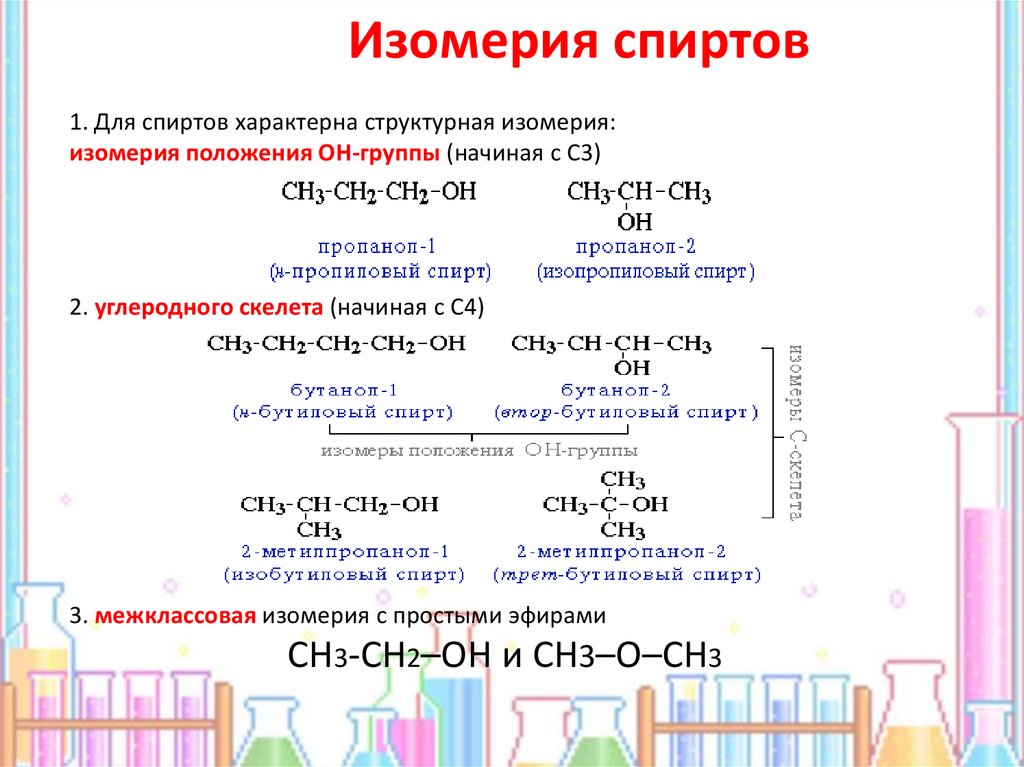
8. Изомерия спиртов
1. Для спиртов характерна структурная изомерия:изомерия положения ОН-группы (начиная с С3)
2. углеродного скелета (начиная с С4)
3. межклассовая изомерия с простыми эфирами
СН3-CH2–OH и CH3–O–CH3
9. Водородная связь
Уменьшение расстояния между молекулами спиртовприводит к тому, что среди спиртов нет газообразных
Веществ, но температура кипения их низкая.
Связь между атомами водорода одной молекулы
(или ее части) и атомов сильно
электроотрицательных элементов (F, O, N) другой
молекулы (или ее части) называют водородной
10. Химические свойства спиртов
1. Взаимодействие с галогеноводородами, подобновзаимодействию щелочей с кислотами
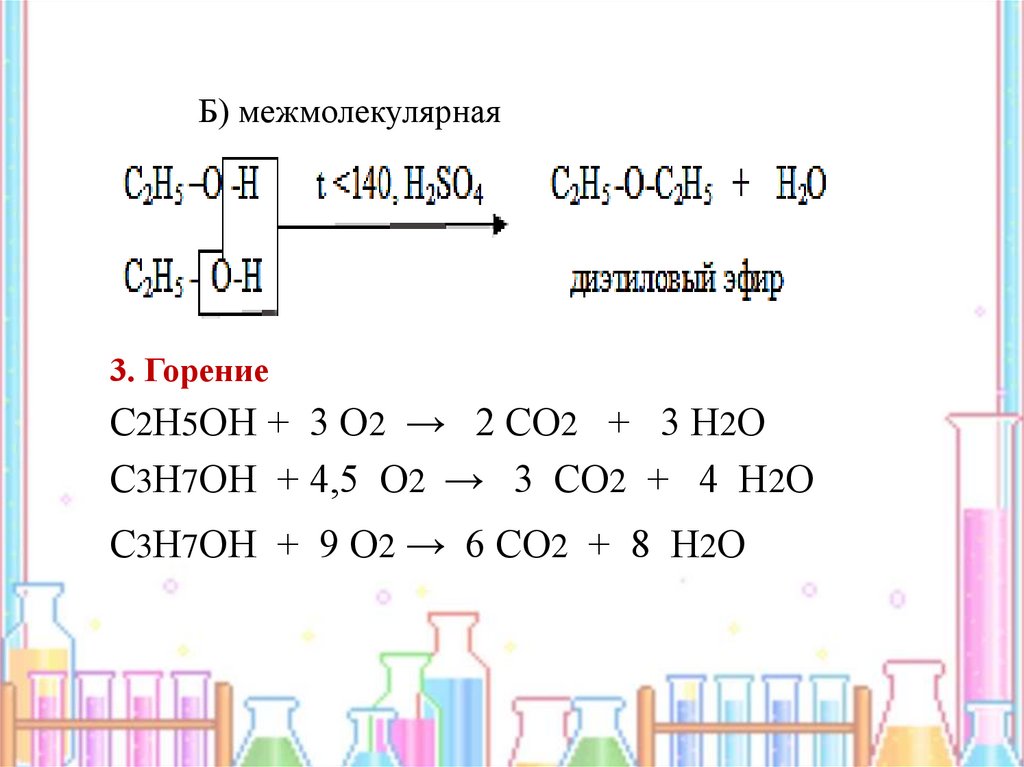
2. Дегидратация
А) внутримолекулярная
11.
Б) межмолекулярная3. Горение
С2Н5ОН + 3 О2 → 2 СО2 + 3 Н2О
С3Н7ОН + 4,5 О2 → 3 СО2 + 4 Н2О
С3Н7ОН + 9 О2 → 6 СО2 + 8 Н2О
12.
4. Спирты взаимодействуют сощелочными и щелочно-земельными
металлами
2СН3-СН2-ОН + 2К → 2СН3-СН2-ОК + Н2↑
2СН3-СН2-ОН + Са → (СН3-СН2-О)2Са + Н2↑
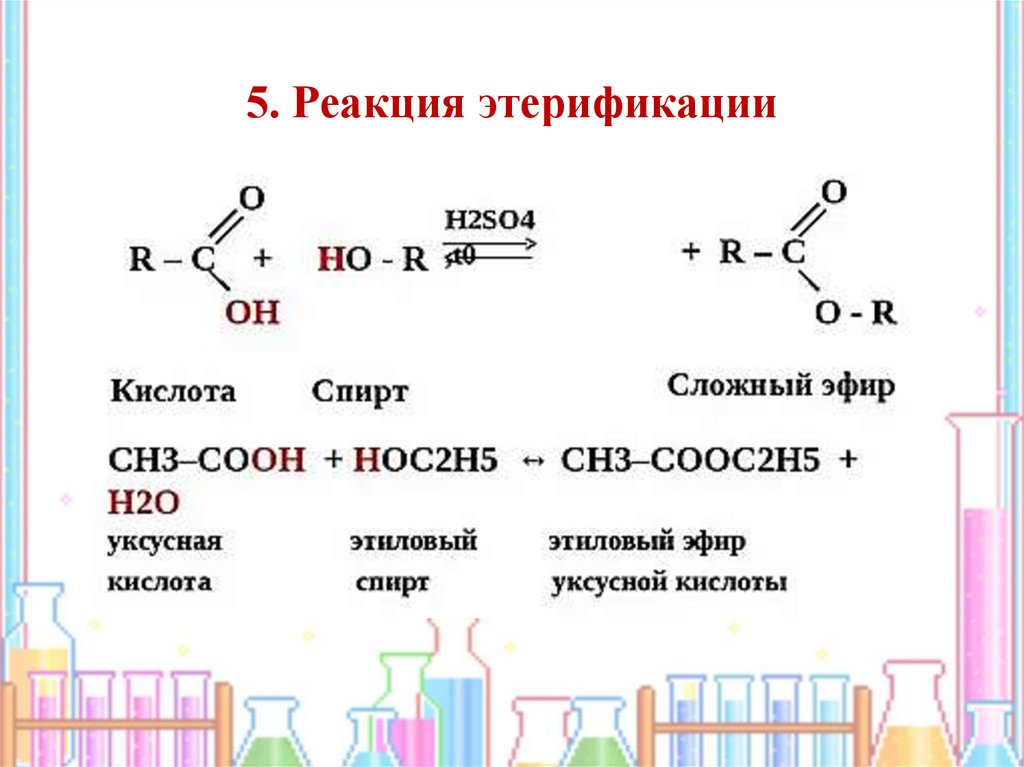
13.
5. Реакция этерификации14. Взаимодействие оксида меди с этанолом
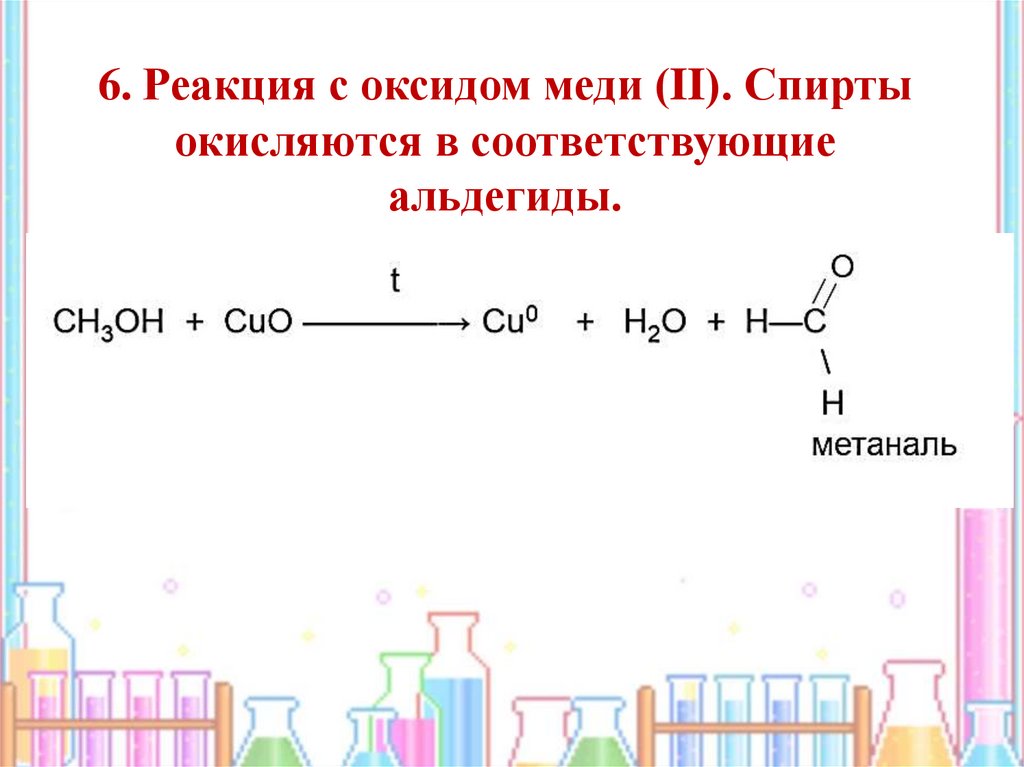
15.
6. Реакция с оксидом меди (II). Спиртыокисляются в соответствующие
альдегиды.
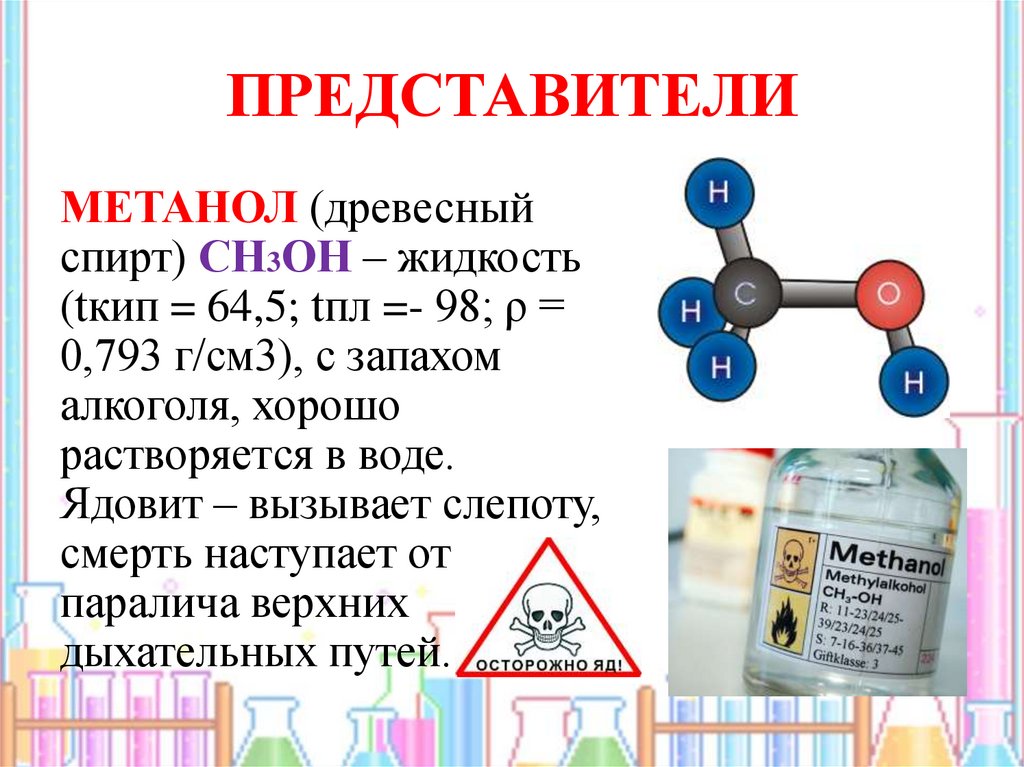
16. ПРЕДСТАВИТЕЛИ
МЕТАНОЛ (древесныйспирт) СН3ОН – жидкость
(tкип = 64,5; tпл =- 98; ρ =
0,793 г/см3), с запахом
алкоголя, хорошо
растворяется в воде.
Ядовит – вызывает слепоту,
смерть наступает от
паралича верхних
дыхательных путей.
17. ПРИМЕНЕНИЕ МЕТАНОЛА
• Метанол СН3ОН используют какрастворитель, а также в
производстве формальдегида,
применяемого для получения
фенолформальдегидных смол, в
последнее время метанол
рассматривают как перспективное
моторное топливо.
• Большие объемы метанола
используют при добыче и
транспорте природного газа.
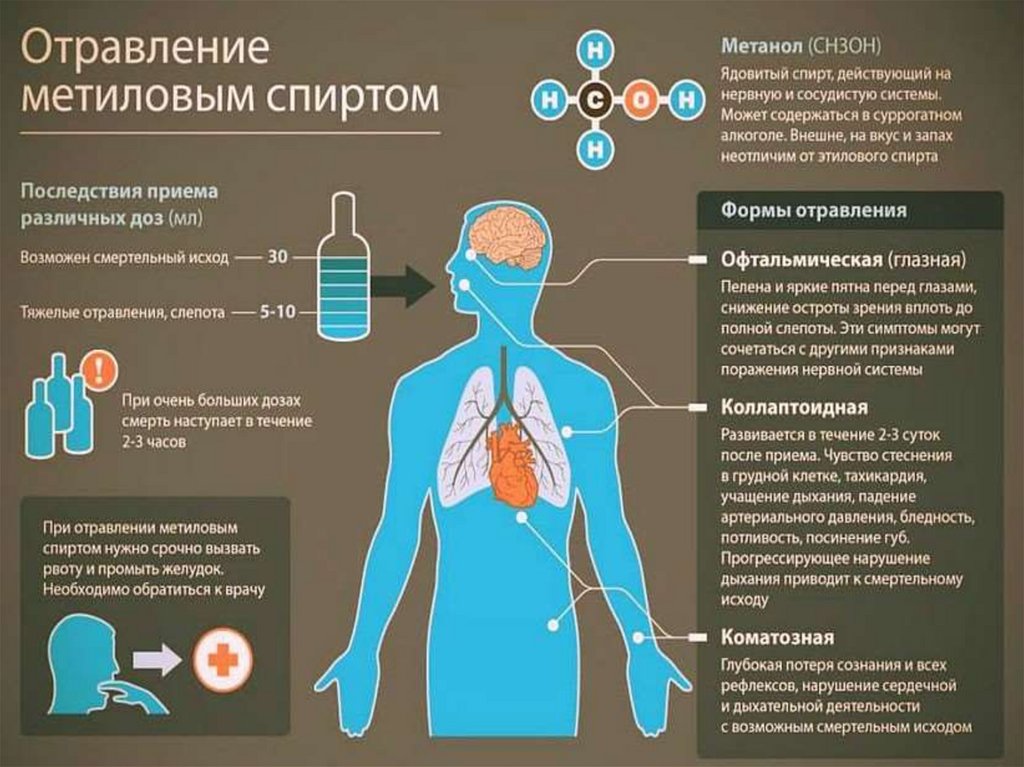
• Метанол – наиболее токсичное
соединение среди всех спиртов,
смертельная доза при приеме
внутрь – 100 мл.
18.
19.
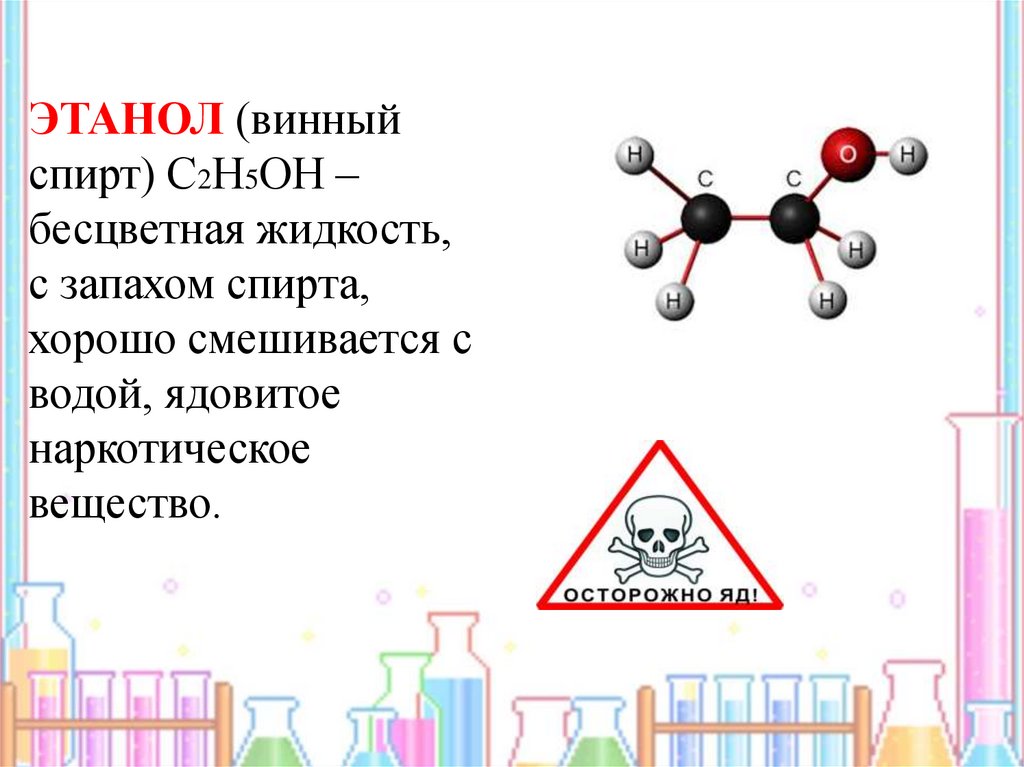
ЭТАНОЛ (винныйспирт) С2Н5ОН –
бесцветная жидкость,
с запахом спирта,
хорошо смешивается с
водой, ядовитое
наркотическое
вещество.
20. ПРИМЕНЕНИЕ ЭТАНОЛА
Этанол С2Н5ОН – исходное соединение для получения ацетальдегида,уксусной кислоты, а также для производства сложных эфиров
карбоновых кислот, используемых в качестве растворителей.
Кроме того, этанол – основной компонент всех спиртных напитков, его
широко применяют и в медицине как дезинфицирующее средство.
21. ПОЛУЧЕНИЕ ЭТАНОЛА
• спиртовое брожение глюкозы:C6H12O6 → 2C2H5OH + 2CO2↑
глюкоза → спирт этанол
получение спирта из алкена:
CH2= CH2 + H2O → C2H5OH
этилен
этанол
гидратация алкена → спирт
22. Открытия
23. Проверь себя
1. Общая формула предельных одноатомныхспиртов
а) CnH2n+2
б) CnH2n
в) CnH2n-2
г) CnH2n+1OH
24.
2. Функциональная группа предельныходноатомных спиртов
а) - СНО
б) - СООН
в) - ОН
г) - СН3
25.
3. Реакции по разрыву связи в гидроксогруппеа) с галогенами;
б) с кислородом;
в) с активными металлами;
г) с оксидом меди (ІІ);
26.
4. Реакция с отрывом гидроксогруппыа) окисление;
б) гидрирование;
в) гидратация;
г) дегидратация















 Химия
Химия