Похожие презентации:
Предельные одноатомные спирты
1. Предельные одноатомные спирты
2. План урока
Понятие о спиртахКлассификация спиртов
Номенклатура спиртов
Водородная связь
Химические свойства
спиртов
Отдельные представители,
их физические свойства,
получение и применение
Метанол
Этанол
Этиленгликоль
Глицерин
3. 1.Понятие о спиртах. Классификация и номенклатура спиртов
Прочитай § 9 стр. 651. Дайте определение классу спиртов.
2. Напишите общую формулу.
3. Что называют функциональной группой
спиртов.
4. Напишите гомологический ряд спиртов
(5 гомологов). Дайте названия.
4.
Спирты́ (устаревшее алкого́ ли) —органические соединения,
содержащие одну или несколько
гидроксильных групп (гидроксил,
OH),непосредственно связанных с
атомом углерода в углеводородном
радикале.
Общая формула спиртов
СnH2n+1(OH) или СnH2n+2О
5. Изомерия и номенклатура спиртов.
Назвать спирты.а) СН3- CH2 - CH2 - CH2 - О H
CH3
|
б) CH3 — CH — CН2ОН
в) CH3 — CH — СН2 — СН3
|
ОH
CH3
|
г) CH3 — CН — СH2
|
ОH
СH3
|
д) СН3 — C — CH2ОH
|
СH3
д) СН3- CH2 - О- CH2 – CH3
6. Физические свойства спиртов
1. Рассмотрите выданный вам в пробирке образец этиловогоспирта, понюхайте его. Что ощущаете?
2. В другую пробирку отлейте несколько капель этилового
спирта с помощью пипетки добавьте 2 мл воды и
содержимое взболтайте. Что можно сказать о
растворимости этилового спирта в воде?
3. В одну пробирку налейте 1-2 дистиллированной воды, а во
вторую-2мл этилового спирта и добавьте в каждую по 2-3
капли подсолнечного масла. Перемешайте содержимое
пробирок. Что можно сказать о свойствах этилового спирта
как растворителя?
7. Физические свойства.
8. Физические свойства спиртов
Низшие и средние члены ряда предельныходноатомных спиртов, содержащие от
одного до одиннадцати атомов углерода,жидкие. Высшие спирты( начиная с
С12Н25ОН) при комнатной температуретвёрдые вещества. Низшие спирты имеют
характерный алкогольный запах и жгучий
вкус и хорошо растворяются в воде. По
мере увеличения углеводородного
радикала растворимость спиртов в воде
понижается.
9. Отдельные представители спиртов
10. 3. Физические свойства спиртов
Почему в гомологическом ряду спиртовотсутствуют газообразные вещества?
11.
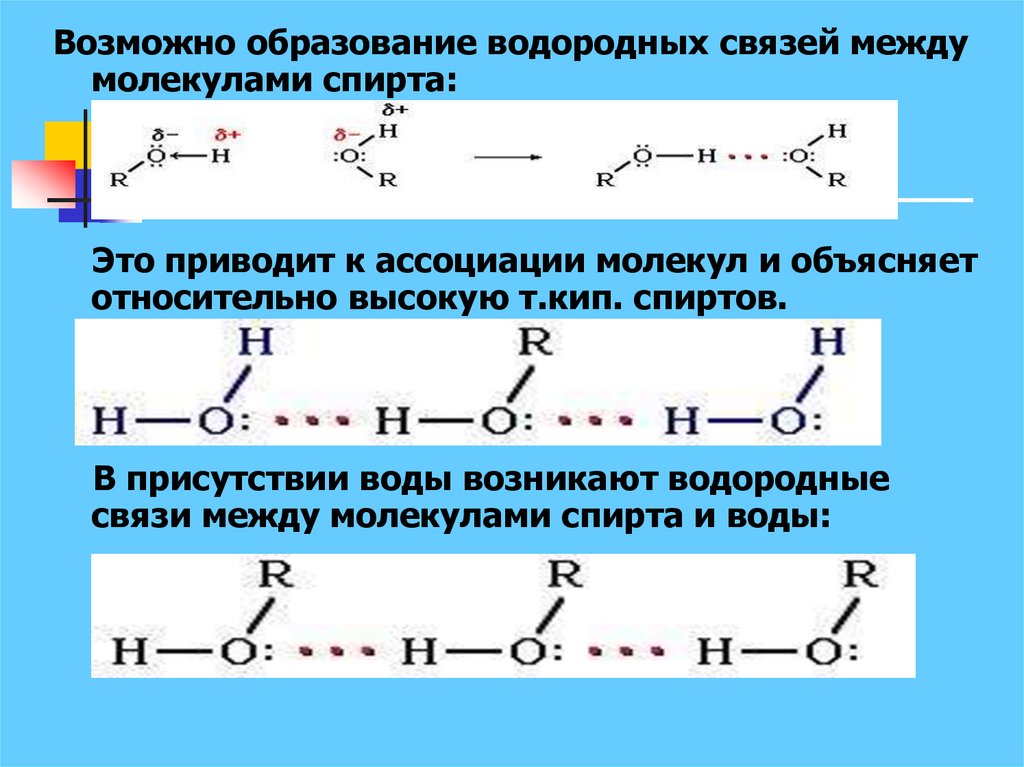
Возможно образование водородных связей междумолекулами спирта:
Это приводит к ассоциации молекул и объясняет
относительно высокую т.кип. спиртов.
В присутствии воды возникают водородные
связи между молекулами спирта и воды:
12. Химические свойства спиртов
Изучите учебник стр.69-70 учебникаОбобщите информацию о химических свойствах
одноатомных спиртов.
13. Химические свойства спиртов
1. Спирты горятС2H5ОH + 3O2 2СO2 + 3H2O
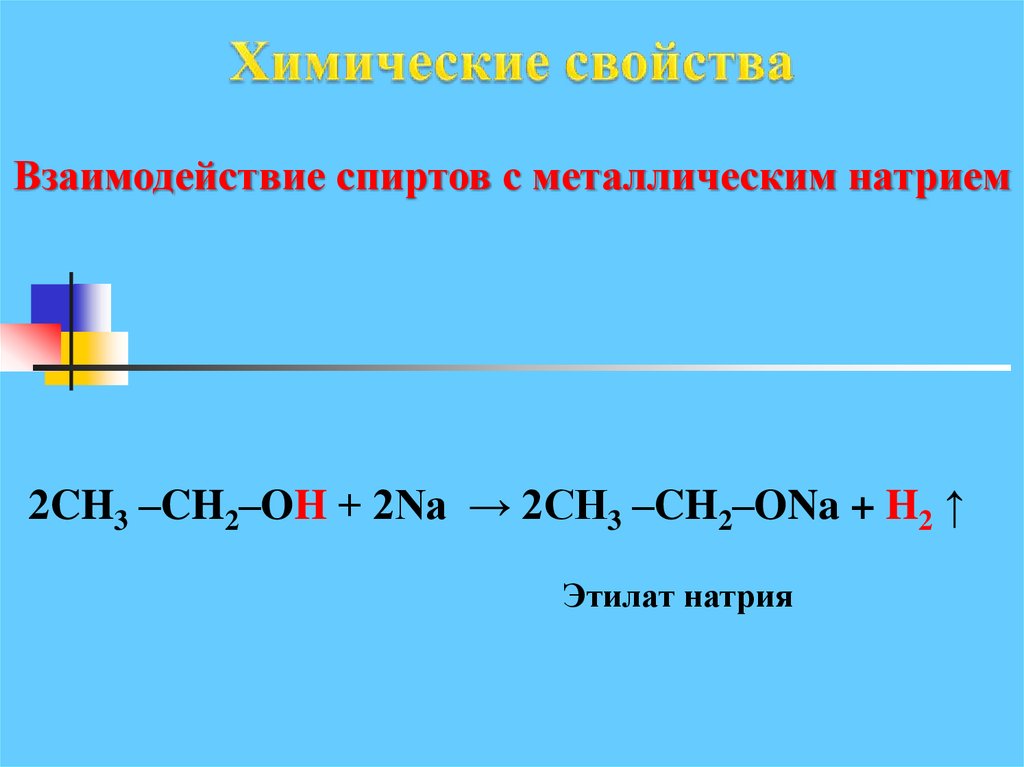
2. Взаимодействие спиртов с натрием.
2С2H5OH + 2Na 2С2H5ONa + H2
3. Дегидратация
а) внутримолекулярная CH3–CH2–OH CH2=CH2 + H2O
б) межмолекулярная C2H5 OH+OHC2H5 → C2H5 O C2H5 + H2O
14. Химические свойства спиртов
4. Реакция этерификацииCH3COOH+OH C2H5 → CH3COOC2H5 + H2O
15.
Цель работы: доказать, что спирт окисляется до альдегиОборудование и реактивы: 1 пробирка, этиловый
спирт, спиртовка, медная проволока.
Ход работы: Прокалить спираль из медной
проволоки в пламени спиртовки до появления
черного налета (оксида меди II) и опустить в
пробирку со спиртом. Повторить 2-3 раза.
Что наблюдаете?
16.
Вывод: Происходит восстановление меди иокисление спирта до альдегида
C2H5OH
CH3
O
C
H
17. Получение спиртов
Запишите в тетрадь уравнения реакцийполучения спиртов
А) Составьте уравнение реакции перехода
глюкоза → спирт этанол
Б) Составьте уравнение реакции получение
спирта из алкена
18. Получение спиртов
1.спиртовое брожение:C6H12O6 → 2C2H5OH + 2CO2↑
2. алкен → спирт:
CH2= CH2 + H2O → C2H5OH
19. Отдельные представители спиртов
Цель: Изучить свойства и применение этанола,метанола
Прочитайте текст учебника о метаноле и этаноле
Название спирта
Формула
Применение
20. Применение этанола
Этиловый спиртупотребляется при
приготовлении
различных спиртных
напитков.
В медицине для
приготовления
экстрактов из
лекарственных
растений, а также для
дезинфекции.
В косметике и
парфюмерии этанол —
растворитель для
духов и лосьонов.
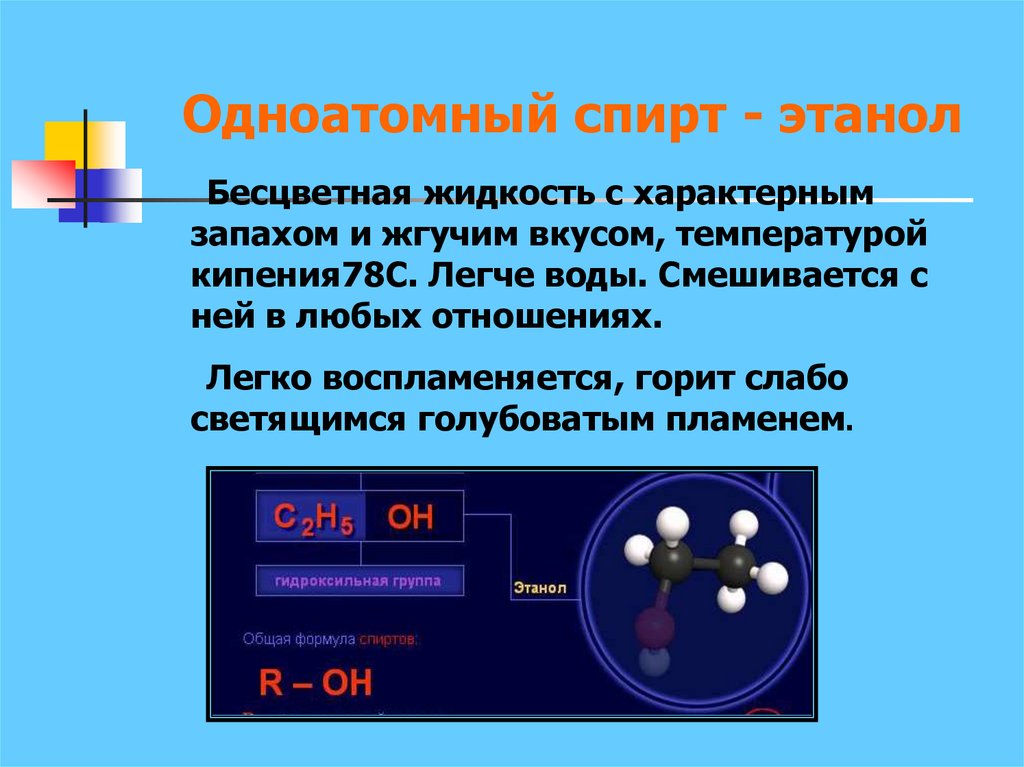
21. Одноатомный спирт - этанол
Бесцветная жидкость с характернымзапахом и жгучим вкусом, температурой
кипения78С. Легче воды. Смешивается с
ней в любых отношениях.
Легко воспламеняется, горит слабо
светящимся голубоватым пламенем.
22.
Взаимодействие спиртов с металлическим натрием2CH3 –CH2–OH + 2Na → 2CH3 –CH2–ONa + H2 ↑
Этилат натрия
23.
ВнутримолекулярнаяH2SO4, t
СН
Н3 - СН2 - ОН
+ СН2 = СН2
Этилен
Межмолекулярная
С2Н5 -ОН
НО- С2Н5
ОН + Н
H2SO4, t
+ С2Н5 -О-С2Н5
Диэтиловый
эфир
24. 3. Межмолекулярная дегидратация спиртов
- отщепление молекулы воды от двух молекулспирта при нагревании в присутствии
водоотнимающих средств:
В результате межмолекулярной
дегидратации спиртов образуются простые
эфиры. Так, при нагревании этилового
спирта с серной кислотой до температуры от
100 до 140 °С образуется диэтиловый
(серный) эфир.
C2H5OH + НОC2H5
C2H5 – О - C2H5 +H2O
25.
OR–C +
H2SO4 ,t0
HO
H -R
O
+ R–C
OH
ОH
Кислота
О-R
Спирт
Сложный эфир
CH3–CОOH + HОC2H5 ↔ CH3–СООC2H5 + H2О
уксусная
кислота
этиловый
спирт
этиловый эфир
уксусной кислоты
26. Получение спиртов
ЭтанолГидратация этилена
С2Н4 + Н2О = С2Н5ОН
Из глюкозы
C6H12O6 = 2С2Н5ОН + 2CO2
брожение
27. Одноатомный спирт - метанол
Жидкость безцвета с
температурой
кипения 64С,
характерным
запахом Легче
воды. Горит
бесцветным
пламенем.
Применяется в
качестве
растворителя и
топлива в
двигателях
внутреннего
сгорания.
28. Метанол - яд
Ядовитое действиеметанола основано на
поражении нервной и
сосудистой системы.
Приём внутрь 5—10
мл метанола приводит
к тяжёлому
отравлению, а 30 мл и
более — к смерти.

























 Химия
Химия








