Похожие презентации:
Алкины. Определение
1. План занятия
Лекция.1.
Определение АЛКИНЫ.
2.
Общая формулы АЛКИНОВ.
3.
Строения молекул АЛКИНОВ.
4.
Гомологический ряд АЛКИНОВ. Изомерия.
Номенклатура.
5.
Нахождение в природе (АЛКИНОВ НЕТ).
6.
Получение АЛКИНОВ.
7.
Физические свойства АЛКИНОВ.
8.
Химические свойства АЛКИНОВ.
9.
Применение АЛКИНОВ.
10. Генетическая связь.
Выполнение упражнений.
2.
3.
1. Алкины - это углеводороды содной тройной связью в
открытой углеродной цепи.
2. Общая формула АЛКИНОВ
CnH2n-2
4. 3.1. Гомологический ряд
Алкины СnН2n-2Формула Название
С 2Н 2
ЭТИН
С 3Н 4
ПРОПИН
С 4Н 6
БУТИН
С 5Н 8
ПЕНТИН
С6Н10
ГЕКСИН
С7Н12
ГЕПТИН
С8Н14
ОКТИН
С9Н16
НОНИН
С10Н18
ДЕКИН
3.2. Номенклатура
Названия алкинов
происходит от названия
соответствующего
алкана, только суффикс
-ан заменяется на -ИН.
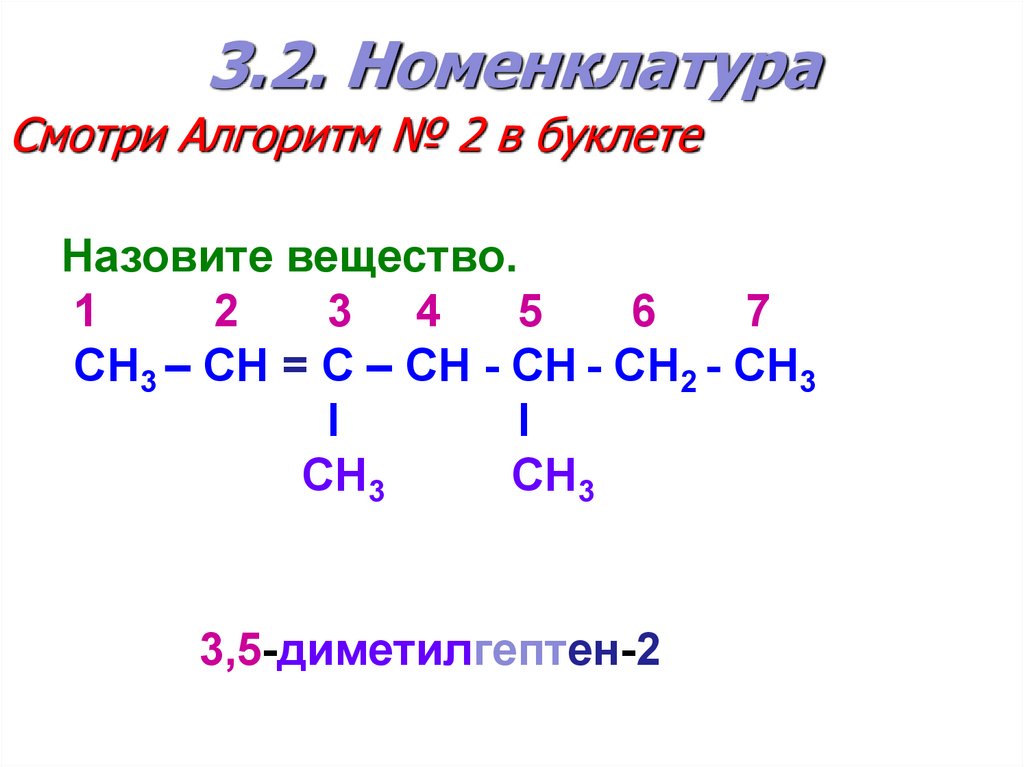
5. 3.2. Номенклатура
Смотри Алгоритм № 2 в буклетеНазовите вещество.
1
2
3 4
5
6
7
СН3 – СН = С – СН - СН - СН2 - СН3
l
l
СН3
СН3
3,5-диметилгептен-2
6.
3. 3. Изомерия алкинов1. Изомерия углеродного скелета (начиная с С5Н8):
2. Изомерия положения тройной связи (начиная с
С4Н6):
3. Межклассовая (алкины – алкадиенами –
циклоалкены), начиная с С4Н6:
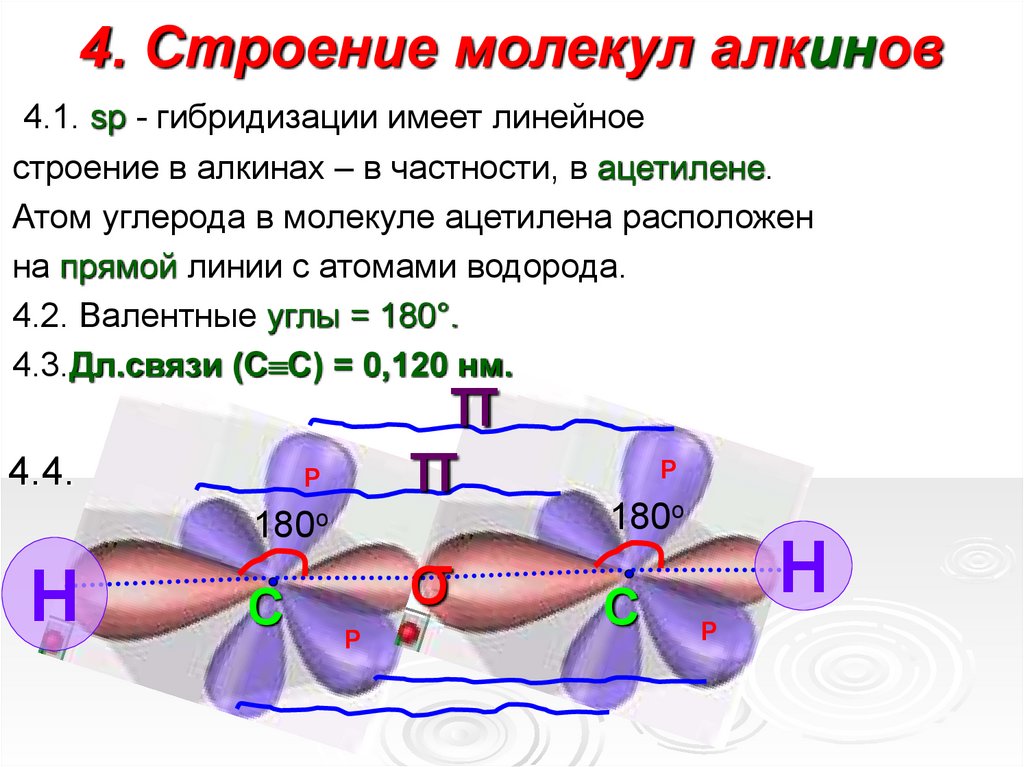
7. 4. Строение молекул алкинов
4.1. sp - гибридизации имеет линейноестроение в алкинах – в частности, в ацетилене.
Атом углерода в молекуле ацетилена расположен
на прямой линии с атомами водорода.
4.2. Валентные углы = 180°.
4.3.Дл.связи (С С) = 0,120 нм.
4.4.
π
π
Р
180о
Н
С
σ
Р
Р
180о
С
Н
Р
8. 5. Нахождение в природе АЛКИНОВ
Алкинов в природе нет, т.к. вмолекуле алкинов есть слабые
2 π-связи, которые определяют их хим.
активность.
9.
6. Получение алкинов1.Термический крекинг метана:
Метан
Ацетилен
2. Гидролиз карбида кальция (лабораторный):
Ацетилен
10. 7. Физические свойства алкинов
Т кип. и пл. алкинов увеличиваются с ростом ихмолекулярной массы.
При обычных условиях алкины:
С2-С4 – газы,
С5-С16 – жидкости,
с С17 – твердые вещества.
Т кип. и пл. алкинов выше, чем у соответствующих
алкенов.
Алкины плохо растворимы в воде, лучше – в
органических растворителях.
11. 8. Химические свойства алкинов
Атомы углерода удерживаютсяболее короткой тройной связью
и поэтому реакции присоединения к
алкинам протекают медленнее,
чем к алкенам.
12. 8. Химические свойства алкинов
1) Присоединение как у алкенов привзаимодействии
1. с водородом
2. с бромной водой
3. с галогеноводородами:
CH3-C CH + HBr CH3-CBr=CH2
Продукты присоединения к несимметричным алкинам
определяются правилом Марковникова
13. 8. Химические свойства алкинов
4. Гидратация (реакция Кучерова)Присоединение воды происходит в
присутствии катализатора соли ртути (II):
Ацетон
Уксусный альдегид
14. 8. Химические свойства алкинов
2) Полимеризация1. Димеризация
2. Тримеризация ацетилена приводит к образованию
бензола (реакция Зелинского):
15. 8. Химические свойства алкинов
3) Алкины сравнительно легко окисляютсяА) горение:
2C2H2 + 5O2 4CO2 + 2H2O
Ацетилен
Б) При окислении перманганатом калия
CH CH + 3[O] + H2O HCOOH + HCOOH
Ацетилен
Муравьиная кислота
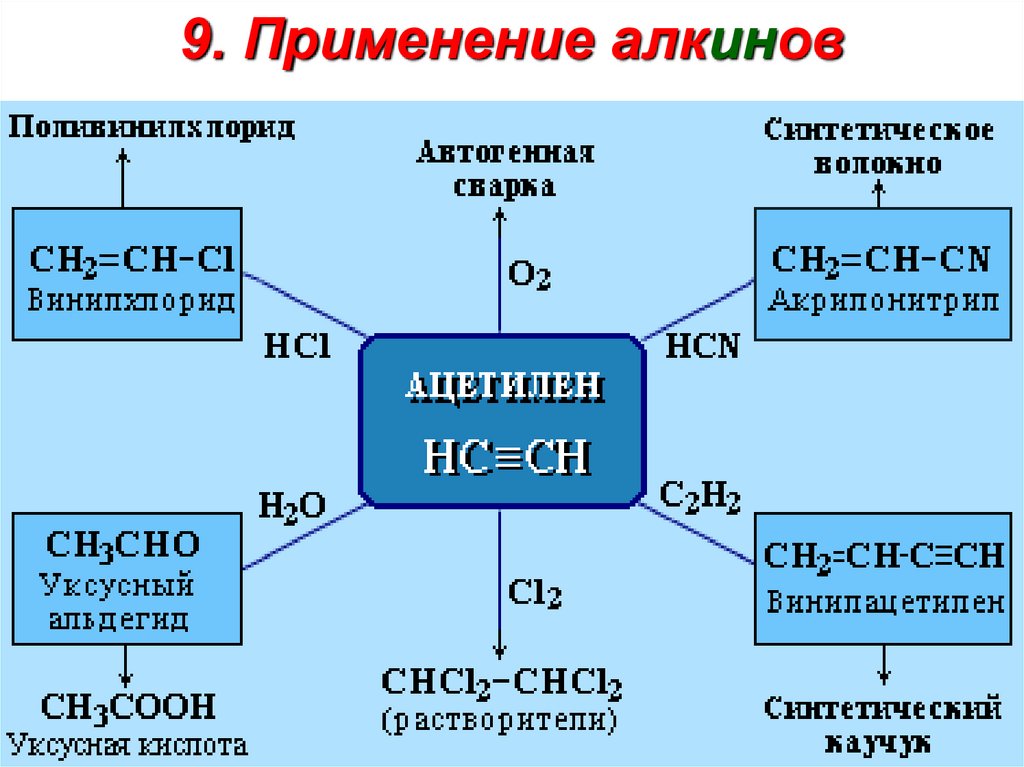
16. 9. Применение алкинов
17.
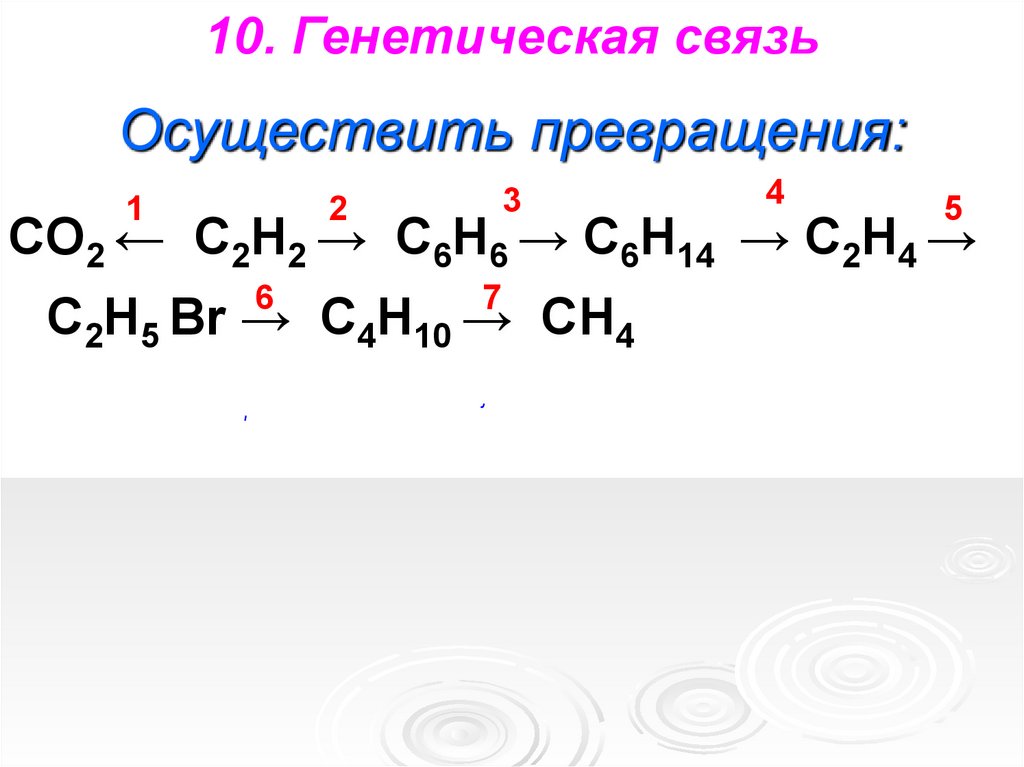
10. Генетическая связьОсуществить превращения:
1
3
2
4
5
CО2 ← C2H2 → C6H6 → C6H14 → C2H4 →
6
7
C2H5 Br → C4H10 → CH4













 Химия
Химия








