Похожие презентации:
Известковая вода
1.
11 классЕГЭ
2.
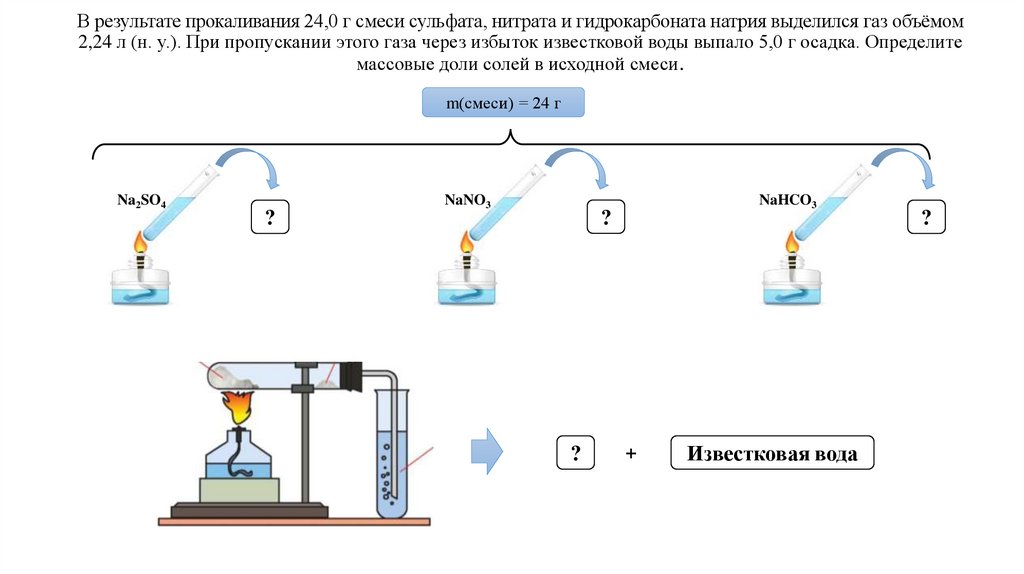
В результате прокаливания 24,0 г смеси сульфата, нитрата и гидрокарбоната натрия выделился газ объёмом2,24 л (н. у.). При пропускании этого газа через избыток известковой воды выпало 5,0 г осадка. Определите
массовые доли солей в исходной смеси.
m(смеси) = 24 г
Na2SO4
NaNO3
NaHCO3
?
?
?
?
+
Известковая вода
3.
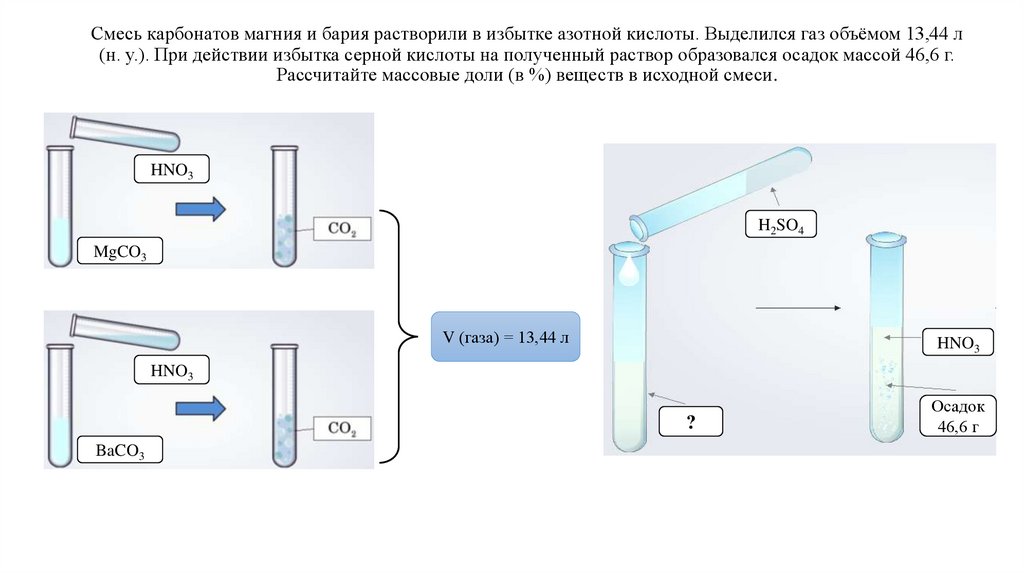
Смесь карбонатов магния и бария растворили в избытке азотной кислоты. Выделился газ объёмом 13,44 л(н. у.). При действии избытка серной кислоты на полученный раствор образовался осадок массой 46,6 г.
Рассчитайте массовые доли (в %) веществ в исходной смеси.
HNO3
H2SO4
MgCO3
V (газа) = 13,44 л
HNO3
HNO3
?
BaCO3
Осадок
46,6 г
4.
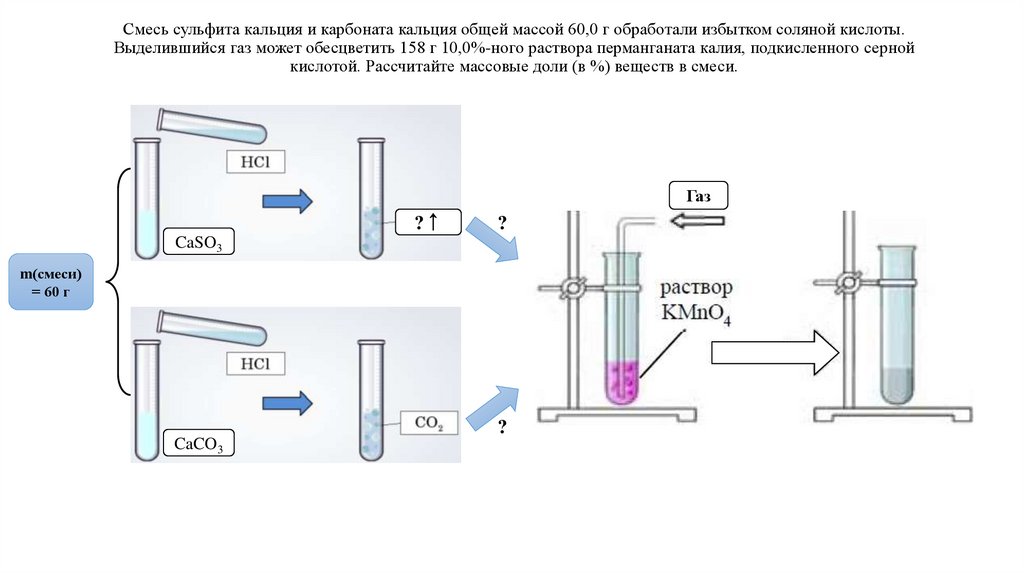
Смесь сульфита кальция и карбоната кальция общей массой 60,0 г обработали избытком соляной кислоты.Выделившийся газ может обесцветить 158 г 10,0%-ного раствора перманганата калия, подкисленного серной
кислотой. Рассчитайте массовые доли (в %) веществ в смеси.
Газ
?↑
?
CaSO3
m(смеси)
= 60 г
?
CaCO3
5.
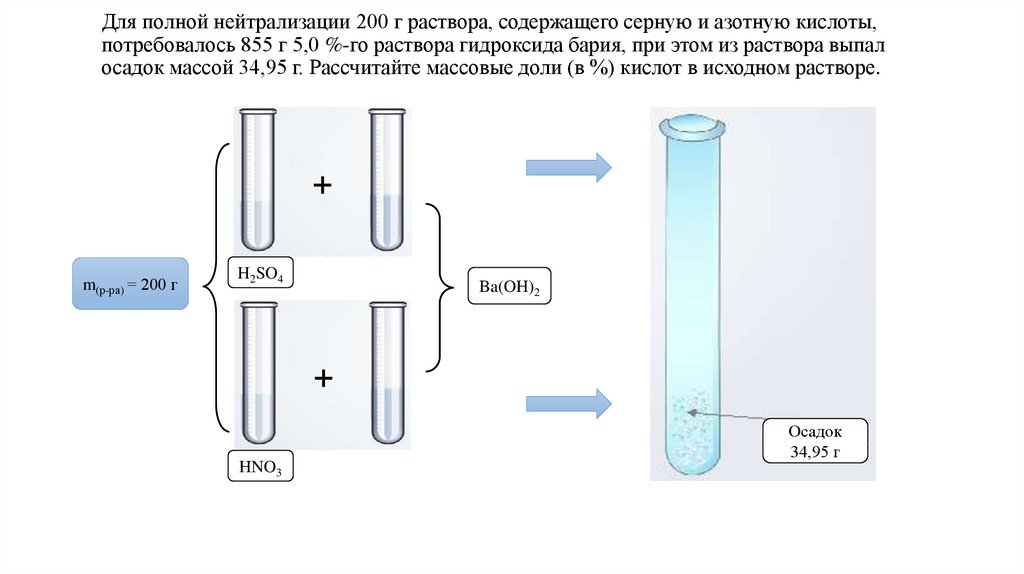
Для полной нейтрализации 200 г раствора, содержащего серную и азотную кислоты,потребовалось 855 г 5,0 %-го раствора гидроксида бария, при этом из раствора выпал
осадок массой 34,95 г. Рассчитайте массовые доли (в %) кислот в исходном растворе.
m(р-ра) = 200 г
H2SO4
HNO3
Ba(OH)2
Осадок
34,95 г
6.
Газ, полученный при взаимодействии 8,0 г меди с 60 г 80-процентного раствора азотной кислоты, пропустили на холоде через 25 мл 40-процентного раствора гидроксида калия (ρ = 1,4 г/мл). Рассчитайте массовые доли веществ в образовавшемся растворе.?↑
HNO3
KOH
Cu
m=8г
Cu
7.
9 классОГЭ
8.
К раствору силиката калия массой 20,53 г и массовой долей 15% прилили избытокраствора нитрата кальция. Вычислите массу образовавшегося осадка.
Ca(NO3)2
?
K2SiO3
Осадок↓
9.
Вычислите объём газа (н. у.), который выделится при действии избытка сульфида железа(II)на 490 г 10%-ного раствора серной кислоты.
H2SO4
?
FeS
10.
Через 40 г раствора с массовой долей гидроксида натрия 8% пропустили сернистый газ. При этомобразовался сульфит натрия. Вычислите объём (н. у.) вступившего в реакцию газа.
NaOH
SO2
11.
При взаимодействии 150 г раствора нитрата свинца с небольшим избытком раствора иодида калия выпало 10,45 госадка. Рассчитайте массовую долю нитрата свинца в исходном растворе
Pb(NO3)2
KI
.
?
Осадок
m = 10,45 г
12.
В избытке соляной кислоты растворили 1,506 г руды, содержащей 77% карбонатажелеза(II). Определите объём углекислого газа, выделившегося при этом.
CO2↑
Руда
13.
К 150 г раствора карбоната натрия добавили избыток разбавленной серной кислоты, и растворнагрели до окончания выделения газа. Всего выделилось 3,36 л газа (н. у.). Рассчитайте
массовую долю карбоната натрия в исходном растворе.
?↑
Na2CO3








 Химия
Химия








