Похожие презентации:
Аммиак: состав, строение, свойства, применение
1.
Аммиак:состав,
строение,
свойства,
применение
2. ИСТОРИЧЕСКАЯ СПРАВКА
Впервые аммиак был получен в чистомвиде в 1774 г.
английским химиком
Джозефом
Пристли.
В
1784
г.
французский химик Клод Луи Бертолле с
помощью
электрического
разряда
разложил
аммиак
на
элементы
и
установил таким образом состав этого
газа, который в 1787г.
получил
официальное название «аммониак» – от
латинского названия нашатыря – sal
ammoniac; эту соль получали близ храма
бога Амона в Египте.
Джозеф Пристли
Клод Луи Бертолле
3. Состав молекулы
Определите степень окисления азота вмолекуле аммиака? Поясните ответ.
4. Состав молекулы
-3-3
NH3 или H3N
5. Строение молекулы
6. Строение молекулы
Хим. связь - ?Кристалл. решётка - ?
7. Строение молекулы
Почему аммиак являясь газом, может легкорастворяться в воде и переходить в жидкое
состояние? Ответ обоснуйте.
8. Жидкий аммиак
Водородные связи9. Водородная связь
Это химическая связь между атомами водорода одноймолекулы и атомами очень электроотрицательных
элементов (фтора, кислорода, азота), имеющих
неподеленные электронные пары, другой молекулы.
10. Физические свойства (при н.у. )
• бесцветный газ• с резким характерным запахом (запах
нашатырного спирта)
• легче воздуха (М=17 г/моль)
• хорошо растворяется в воде (1200 объёмов
(при 0 °C) и 700 объёмов (при 20 °C) в 1
объёме воды
• Температура плавления: -77.73 °C
• Температура кипения:-33.34 °C
• Токсичен!
11. Биологическая роль
• Аммиак является конечным продуктом азотистого обмена ворганизме человека и животных. Он образуется при метаболизме
белков, аминокислот и других азотистых соединений. Большая часть
аммиака конвертируется печенью в более безвредное и менее
токсичное соединение — карбамид (мочевину). Мочевина затем
выводится почками, причём часть мочевины может быть
конвертирована печенью или почками обратно в аммиак.
12.
Донорно-акцепторный механизмобразования ковалентной
химической связи
13.
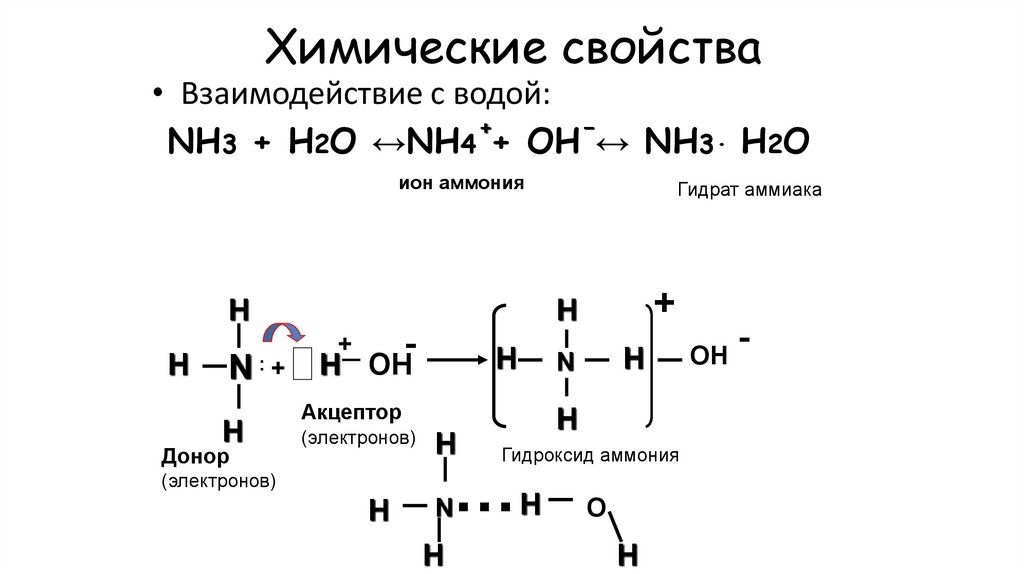
МЕХАНИЗМ:14. Химические свойства
• Взаимодействие с водой:+
−
NH3 + H2O ↔NH4 + OH ↔ NH3· H2O
ион аммония
H
H
-
H
N : + H ОН
Донор
+
H
+
H
Гидрат аммиака
Акцептор
(электронов)
H
H
Гидроксид аммония
N
О
…H
(электронов)
H
H
N
H
H
ОН
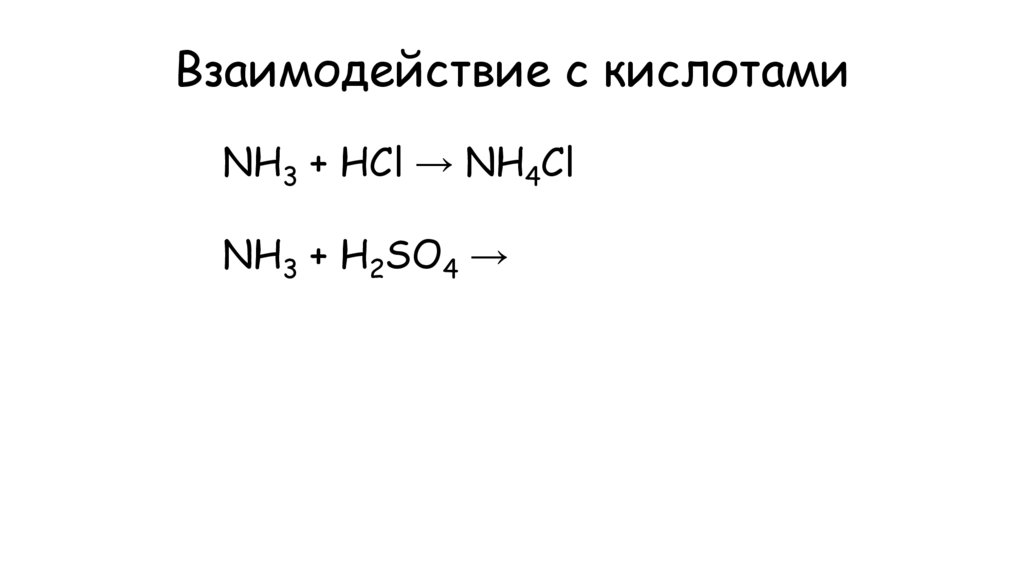
15. Взаимодействие с кислотами
NH3 + HCl → NH4ClNH3 + H2SO4 →
16. ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА (связанные с изменениями степени окисления азота)
1. Разложение аммиака при t = 1200 ֯C:N-3H3+ = N20 + H20
2. Горение аммиака:
N-3H3+ + О20 = N20 + H2O-2 + Q
3. Каталитическое окисление аммиака :
N-3H3+ + О20 = N+2O + H2O-2 + Q
Задание: уравняйте реакцию,
укажите окислитель/восстановитель
17. ПРОВЕРЬ СЕБЯ!
1) 2 N-3H3+ = N20 + 3 H201
2N -3 -6 е = N20 - окисление/восстановитель
3
2H+ +2e = H20 –восстановление/окислитель
2) 4 N-3H3+ + 3 О20 = 2 N20 + 6 H2O-2 + Q
2
2N -3 -6 е = N20 - окисление/восстановитель
3
О20 +4e = 2О-2 –восстановление/окислитель
3) 4 N-3H3+ + 5 О20 = 4 N+2O + 6 H2O-2 + Q
4
N -3 -5 е = N+2 - окисление/восстановитель
5
О20 +4e = 2О-2 –восстановление/окислитель
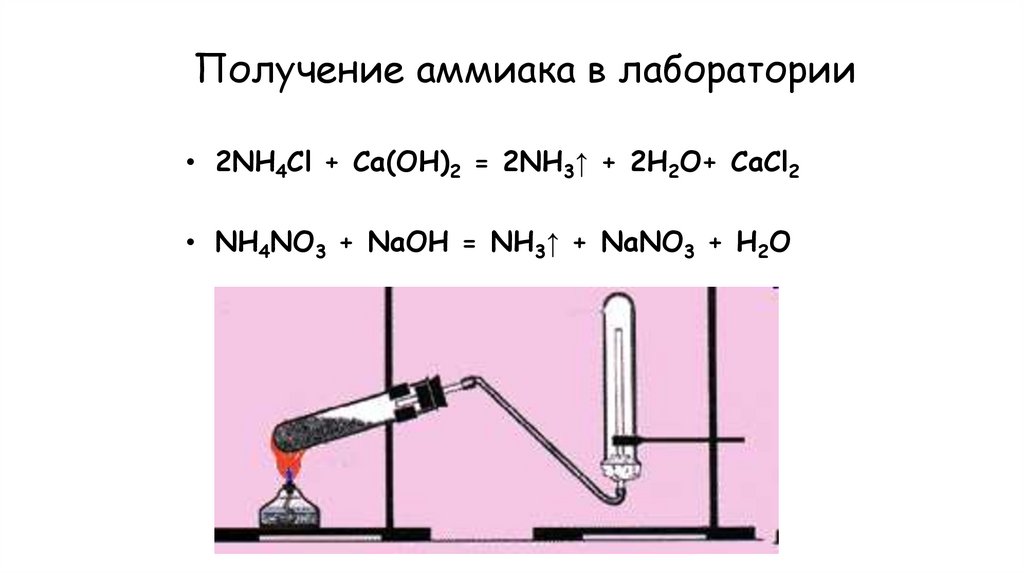
18. Получение аммиака в лаборатории
NH4Cl + Ca(OH)2 →NH4NO3 + NaOH →
19. Получение аммиака в лаборатории
• 2NH4Cl + Ca(OH)2 = 2NH3↑ + 2H2O+ CaCl2• NH4NO3 + NaOH = NH3↑ + NaNO3 + H2O
20.
Получение аммиака в промышленностиПромышленный способ получения аммиака
основан на прямом взаимодействии водорода и
азота:
N2 + H2 ↔
Данная реакция называется процессом
Габера (немецкий физик, разработал физикохимические основы метода).
Реакция обратима и происходит с выделением
тепла (р. экзотермическая)
21.
Получение аммиака в промышленностиПромышленный способ получения аммиака
основан на прямом взаимодействии водорода и
азота:
N2 + 3H2 ↔ 2NH3 + Q
Данная реакция называется процессом
Габера (немецкий физик, разработал физикохимические основы метода).
Реакция обратима и происходит с выделением
тепла (р. экзотермическая)
22.
23. Итоги урока:
24. Домашнее задание
• Параграф 25 учить (старый учебник). Параграф 17(новый учебник).
1) Упр № 8 после параграфа 25 (старый учебник)
2) Решить задачу: Азот объемом 56 л (при н.у.)
прореагировал с водородом. Выход аммиака
составило 50% от теоретически возможного.
Рассчитайте массу и объем полученного аммиака.
25. Cоли аммония
26.
Физические свойства:Твёрдые
кристаллические
вещества,
не
имеющие
окраски.
Почти
все
они
растворяются в воде, и им
характерны все те же свойства,
которые имеют известные нам
соли металлов.
Соли аммо́ния — соли,
содержащие одновалентный
ион аммония NH4+ растворимы в
воде и полностью диссоциируют
Они
взаимодействуют
со
в водном растворе.
щелочами,
при
этом
выделяется аммиак.
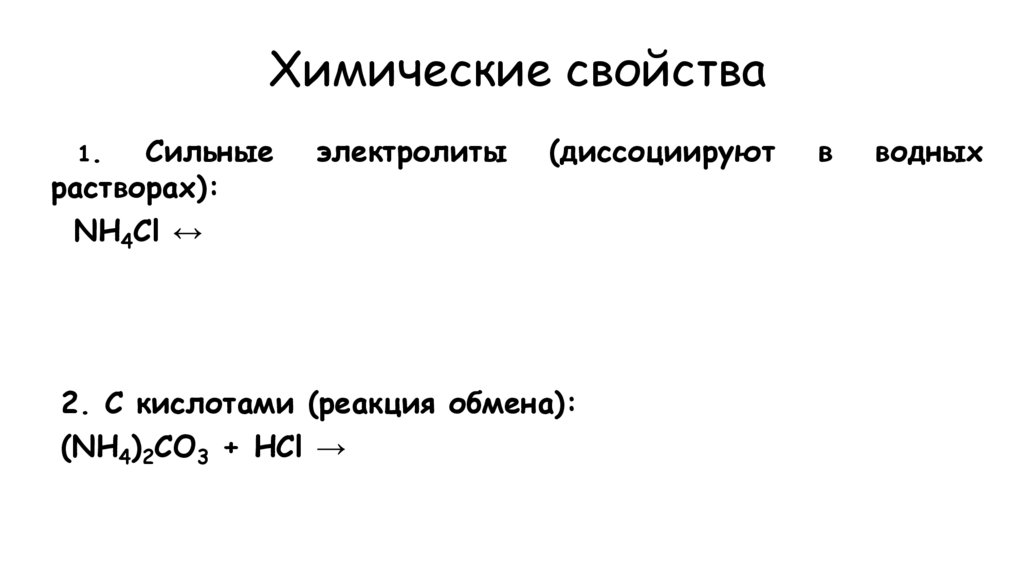
27. Химические свойства
1.Сильные
растворах):
NH4Cl ↔
электролиты
(диссоциируют
2. С кислотами (реакция обмена):
(NH4)2CO3 + НCl →
в
водных
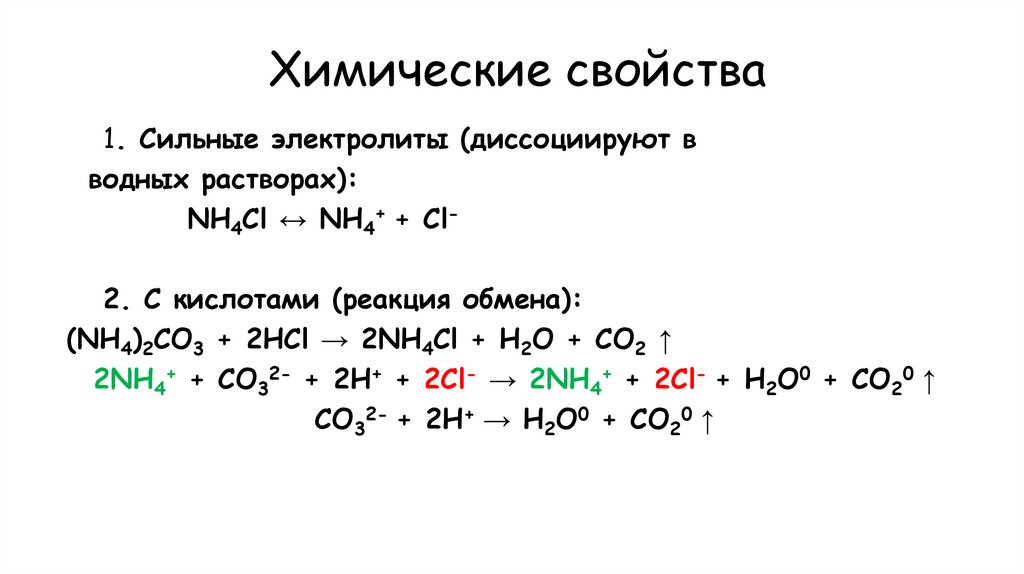
28. Химические свойства
1. Сильные электролиты (диссоциируют вводных растворах):
NH4Cl ↔ NH4+ + Cl2. С кислотами (реакция обмена):
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2 ↑
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O0 + CO20 ↑
CO32- + 2H+ → Н2O0 + CO20 ↑
29. Химические свойства
3.C солями (реакция обмена):
(NH4)2SO4 + Ba(NO3)2 →
4. При нагревании со щелочами выделяется аммиак
(качественная реакция на ион аммония):
NH4Cl + NaOH →
30. Химические свойства
3. C солями (реакция обмена):(NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3
2NH4++ SO42-+ Ba2++2NO3-→ BaSO4↓+ 2NH4++ 2NO3Ba2+ + SO42- → BaSO4 ↓
4.При нагревании со щелочами выделяется аммиак
(качественная реакция на ион аммония):
NH4Cl + NaOH → NaCl + NH3↑ + Н2O
31. Химические свойства
Термическое разложение солей аммония:а) разложение дихромата аммония под действие t:
(N-3H4)2Cr+62O7 → Cr+32O3 + N2 0 + 4H2O
Внутримолекулярная ОВР.
32.
33.
б)разложение нитрита аммония –
способ получения азота:
NH4NO2 → N2 + 2H2O
лабораторный
34. Применение солей аммония
В) Гидрокарбонат аммония NH4HCO3 и карбонатаммония (NH4)2CO3 применяют в кондитерском
деле, так как они легко разлагаются при нагревании
и образуют газы, разрыхляющие тесто и делающие
его пышным, например:
NH4HCO3 = NH3↑ + Н2O↑ + CO2↑
35. Применение солей аммония
• Нитрат аммония NH4NО3 в смеси с порошкамиалюминия и угля используют в качестве
взрывчатого вещества - аммонала , который
широко применяют при разработке горных пород.
36. Применение солей аммония
Соли аммонияиспользуются
в качестве удобрений






























 Химия
Химия








