Похожие презентации:
Аммиак. Физические и химические свойства. Получение и применение
1. Тема урока: Аммиак. Физические и химические свойства. Получение и применение.
Выполнила: учитель химииМКОУ « Дзержинская СОШ»
Каширского муниципального района
Дударева Т.Н.
2.
• Цели: формирование общеучебных умений и навыков.• Задачи:
• образовательные: изучить строение и свойства аммиака; рассмотреть
донорно – акцепторный механизм образования химической связи;
развить умения по составлению окислительно-восстановительного
баланса уравнений реакций
• воспитательные: формирование умений работать с учебной и
дополнительной литературой ; провести профориентационную
информацию.
• познавательные: развивать интерес к предмету, умение высказывать
свои мысли, логически рассуждать, соблюдать технику безопасности
при встрече с аммиаком в быту.
3. План
1.Состав молекулы аммиака2.Строение молекулы аммиака
3.Физические свойства аммиака
4.Химические свойства аммиака
5.Получение аммиака
6.Применение аммиака
4. 1.Состав молекулы аммиака
5. 2. Строение молекулы.
NH3Молекула полярная, имеет форму треугольной
пирамиды с атомом азота в вершине, HNH = 107,3 .
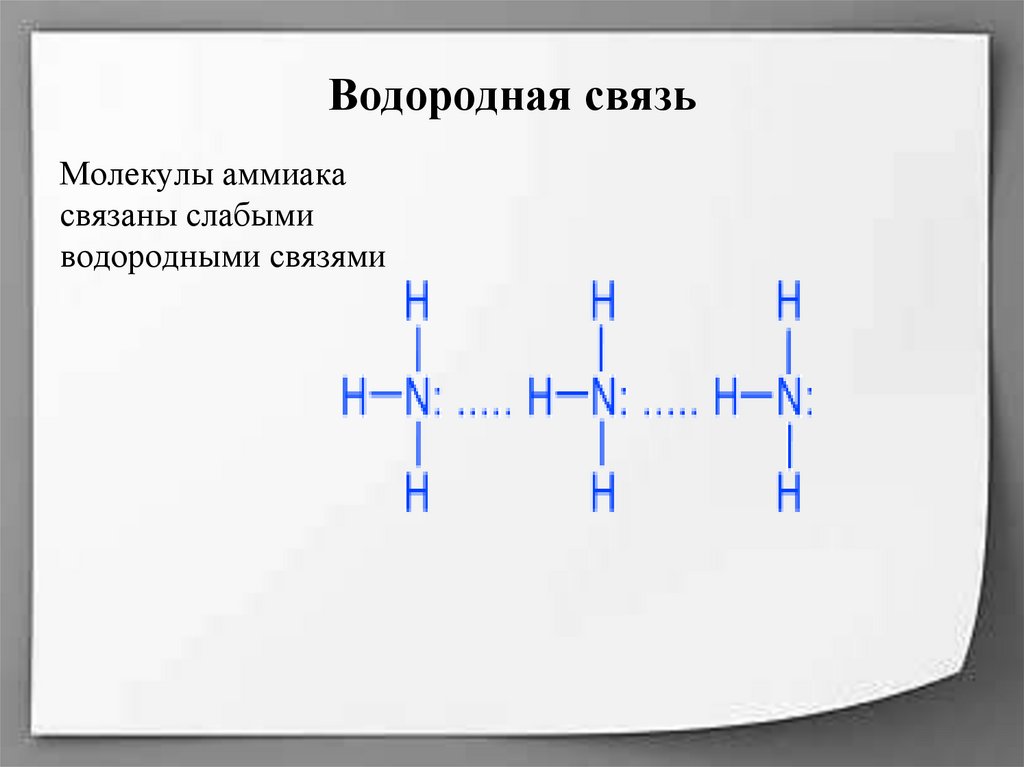
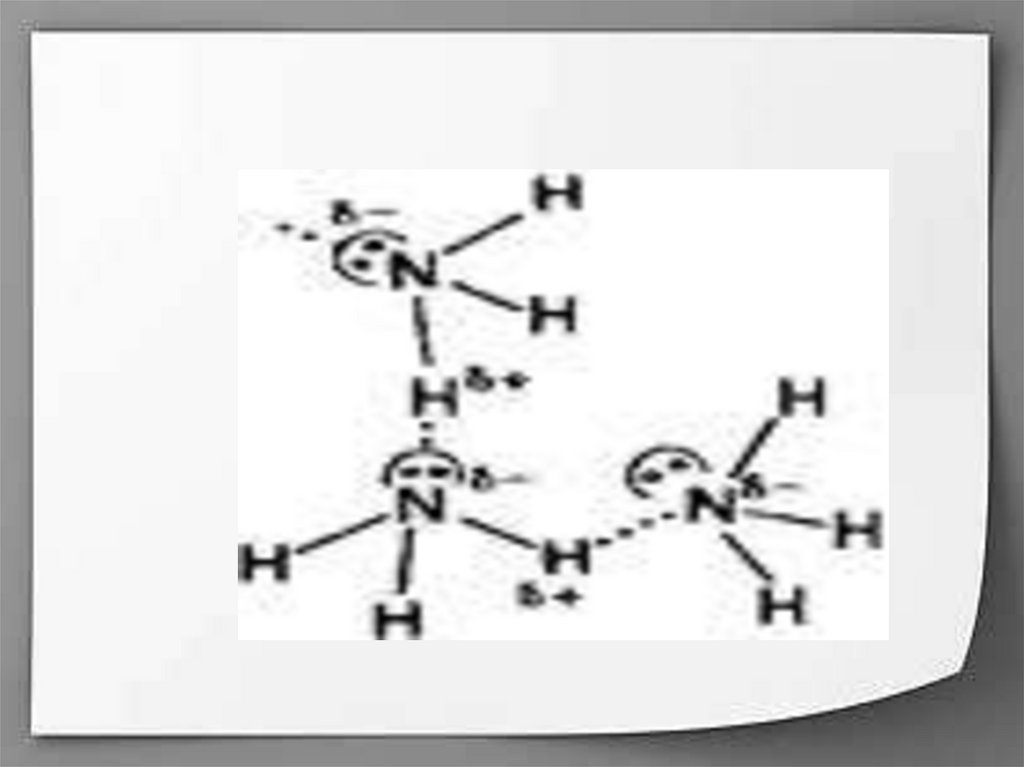
6. Водородная связь
Молекулы аммиакасвязаны слабыми
водородными связями
7.
8. 3. Физические свойства аммиака.
• изучите физические свойства аммиака поучебнику;
• рассчитайте его плотность по воздуху Dвозд
= 29/МNН3;
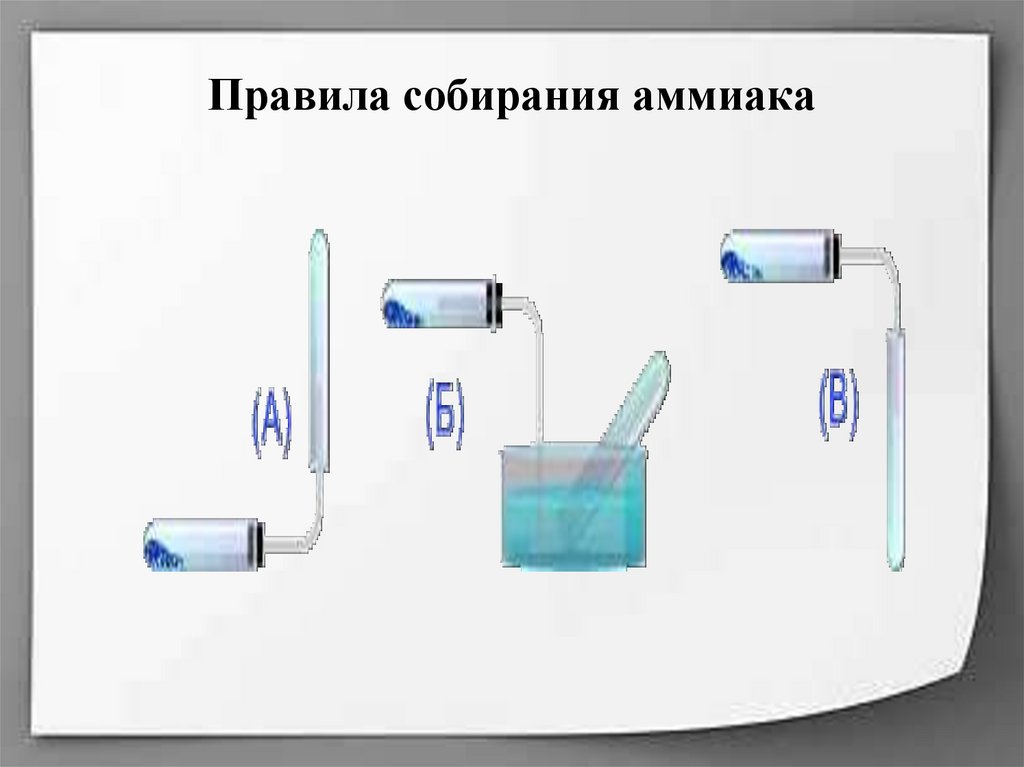
• предложите способ собирания газа в
лабораторных условиях.
9. 3.Физические свойства.
NH3 – газ без цвета, с резким запахом, почти вдва раза легче воздуха, при охлаждении до 33,6оС он сжижается, а при температуре 77,8оС превращается в твердое белое
вещество, хорошо растворим в воде.
10. Правила собирания аммиака
11. 4. Химические свойства аммиака
I.Реакции, идущие без изменения степениокисления.
1)Растворение аммиака в воде.
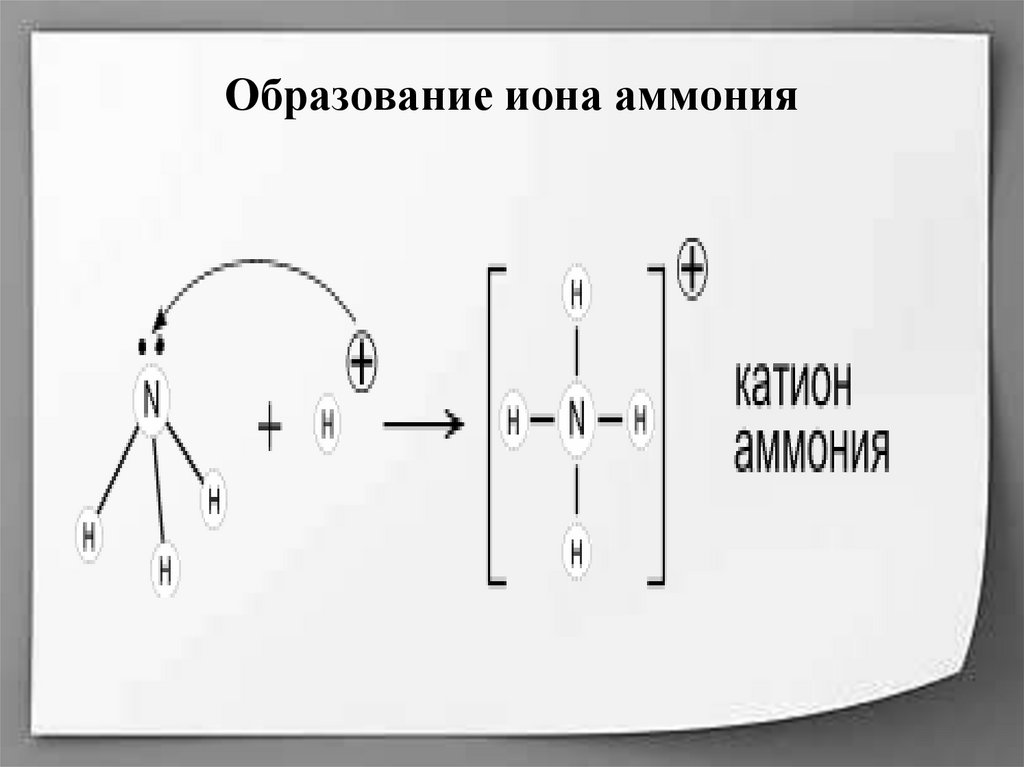
NH3 + Н2O NH4OH NH4+ + OH-
12. Растворение аммиака в воде.
13. Образование иона аммония
14. 2) Взаимодействие с кислотами.
15. Аммиак реагирует с кислотами с образованием солей аммония.
NH3 + HCl NH4Cl2NH3 + H2SO4 (NH4)2SO4
NH3 + HNO3 NH4NO3
16. II. Реакции, идущие с изменением степени окисления.
1.Аммиак- непрочное соединение и принагревании разлагается.
• 2N-3H3 t N20 + 3H2
17. 2.Горение аммиака в кислороде
18.
1. В отсутствии катализатора.4N-3H3 + 3O2 2N20 + 6Н2O
19. 3.Каталитическое окисление аммиака
20.
В присутствии катализатора4N-3H3 + 5O2 4N+2O + 6Н2O
21.
4.Аммиак способен восстанавливатьоксиды малоактивных металлов .
3Cu+2O + 2N-3H3 3Cu0 + N20 + 3Н2O
22. IV.Получение аммиака.
• Работа с учебником. Прочитайте с. 47-48учебника. Запишите уравнения реакций
получения аммиака а) в промышленности
б) в лаборатории.
23.
а) в промышленностиN2 + 3H2 2NH3
б) в лаборатории.
2NH4Cl + Ca(OH)2 –t CaCl2 + 2NH3 + 2Н2O
(NH4)2SO4 + 2KOH –t K2SO4 + 2NH3 + 2Н2O
24. Распознавание аммиака
25. Распознавание аммиака
Распознавание аммиака• а) по запаху;
• б) по посинению влажной лакмусовой
бумажки
• в) по появлению белого дыма от
поднесенной стеклянной палочки,
смоченной HCl( конц.)
26. 5. Применение аммиака
27. 5.Применение аммиака.
1) в холодильных установках;2) в медицине и быту;
3) для производства азотной кислоты, солей
аммония;
4) как удобрение
28. IV. Закрепление изученного материала.
• 1.Азот при обычных условиях – это:а) тяжелый металл; б) бесцветная маслянистая жидкость; в) одноатомный
инертный газ; г)газ без цвета и запаха, молекула двухатомная.
• 2.реакция между хлоридом аммония и гидроксидом кальция идет потому, что
а) выпадает осадок; б) выделяется газ – аммиак; в)образуется растворимая соль;
г) реакция не идет.
• 3.Аммиак горит в кислороде в присутствии катализатора с образованием?
а) азота; б)оксида азота (II); в)оксида азота (III); г) образуется азотная кислота.
• 4. степень окисления азота в молекуле аммиака?
а) 0; б) +3; в) -3; г)+5.
• 5.Нашатырь –это:
А) раствор аммиака в воде; б) раствор аммиака в спирте; в) хлорид аммония;
г) поваренная соль
29. V.Домашнее задание:
§17.; упр. 6-8, задача 1 с.52• Домашнее исследование: почему
нашатырный спирт обезболивает?
Смочите место укуса муравья
нашатырным спиртом. Боль утихнет.
Почему?

























 Химия
Химия








