Похожие презентации:
Фенолы. Кислородсодержащие органические вещества
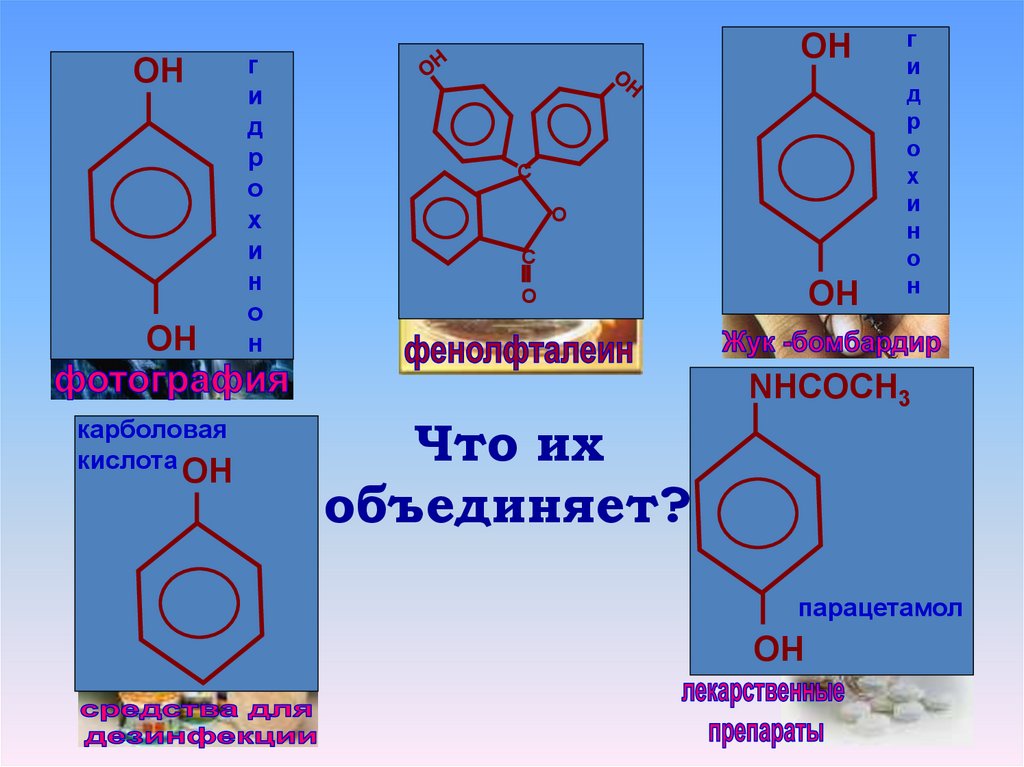
1. Что их объединяет?
ги
д
р
о
х
и
н
о
н
С
О
С
НО
ОН
ОН
О
г
и
д
р
о
х
и
н
о
н
НО
NHCОCH3
ОН
Что их
объединяет?
парацетамол
НО
карболовая
кислота
2.
3.
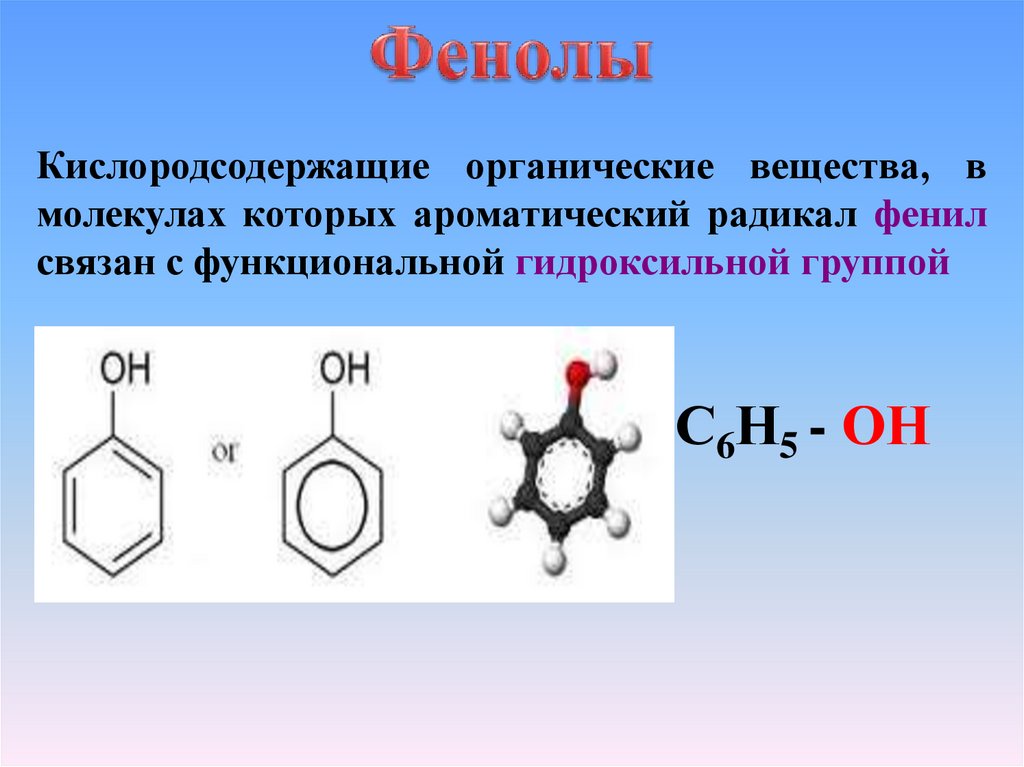
Кислородсодержащие органические вещества, вмолекулах которых ароматический радикал фенил
связан с функциональной гидроксильной группой
С6Н5 - ОН
4.
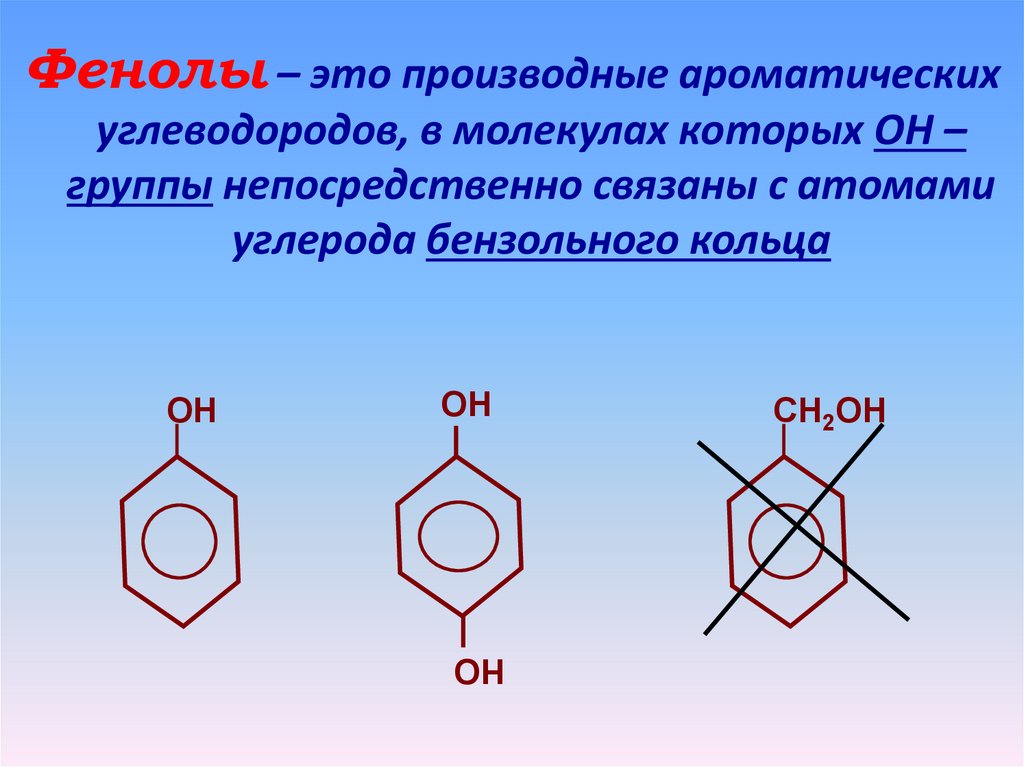
Фенолы – это производные ароматическихуглеводородов, в молекулах которых ОН –
группы непосредственно связаны с атомами
углерода бензольного кольца
ОН
НО
ОН
СН2ОН
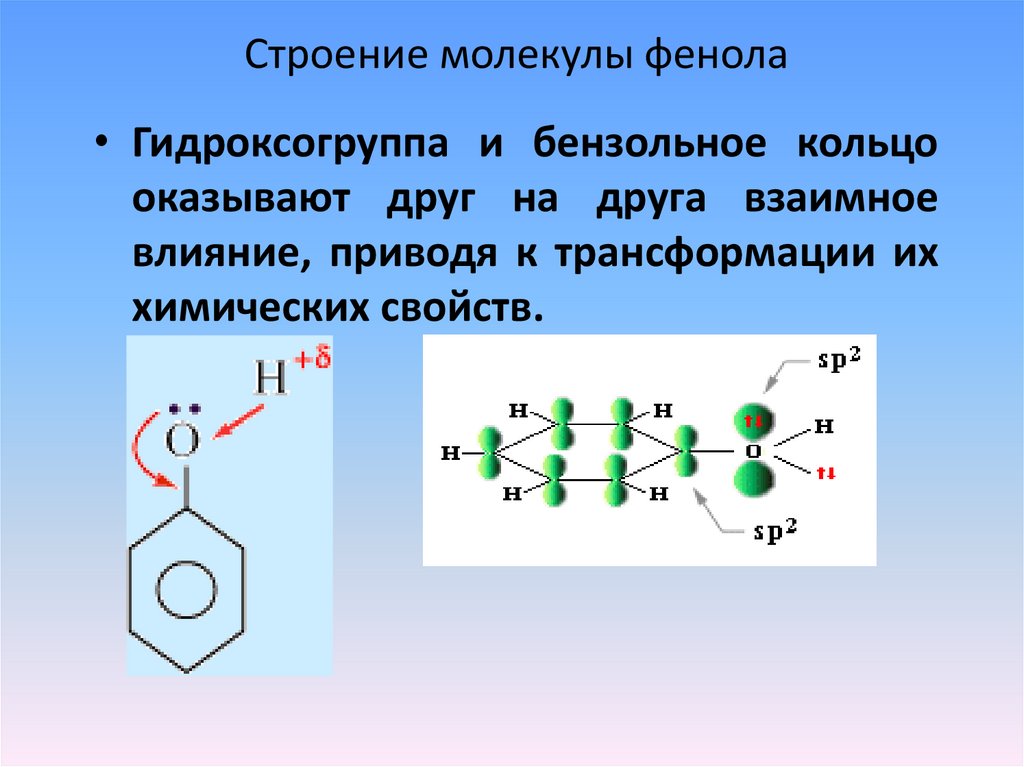
5. Строение молекулы фенола
• Гидроксогруппа и бензольное кольцооказывают друг на друга взаимное
влияние, приводя к трансформации их
химических свойств.
6.
1. Коксование каменного угля2. Из бензола (устаревший способ)
+Cl2
+NaOH
С6Н6 → С6Н5Сl →
С6Н5OH
3. Кумольный способ
7.
Коксование каменногоугля проводят в
коксовых печах.
Кокс сортируют и направляют
на металлургические заводы
8. При коксовании, то есть при нагревании без доступа воздуха, из каменного угля получают четыре основных продукта:
• Кокс – твердый остаток, практически чистыйуглерод (производство чугуна)
• Каменноугольная смола, содержащая несколько
сотен орг. соед. (бензол, фенол)
• Аммиачная вода, содержащая аммиак, фенол и
др.
• Коксовый газ, состоящий из метана
9.
Игольчатыекристаллы
с
характерным запахом (розовеют
на
воздухе
в
результате
окисления), мало растворим в
холодной воде, неограниченно – в
горячей
10.
Физические свойстваФенол ядовит! При
попадании на кожу вызывает
ожоги, при этом он
всасывается через кожу и
вызывает отравление!
11.
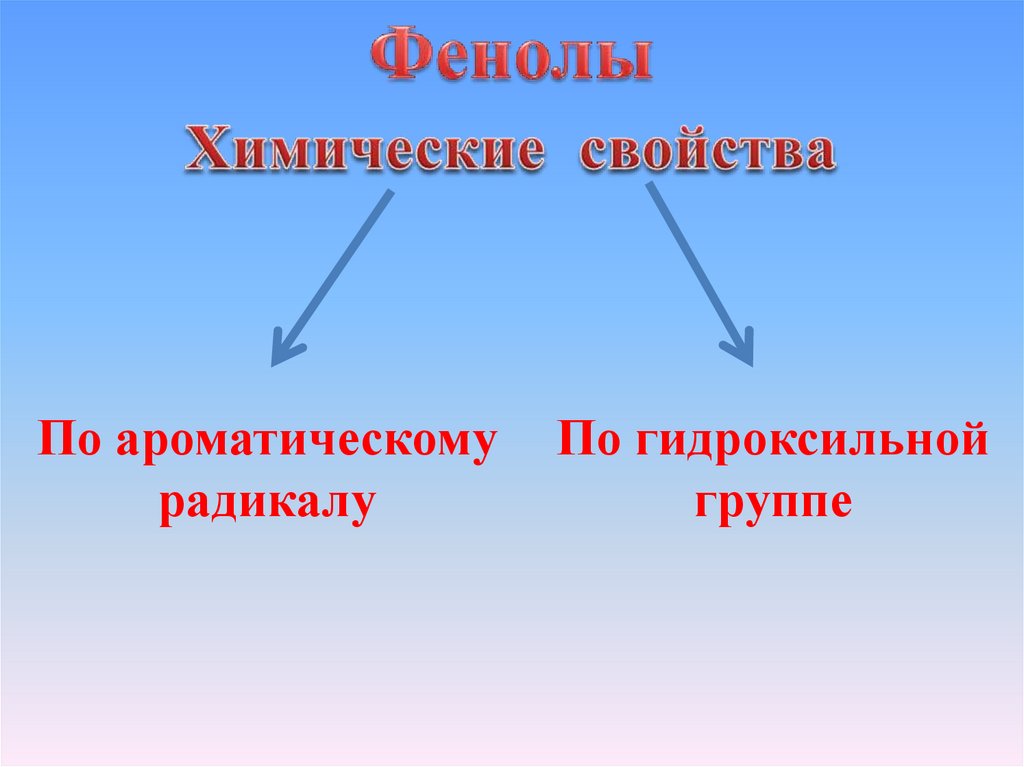
По ароматическомурадикалу
По гидроксильной
группе
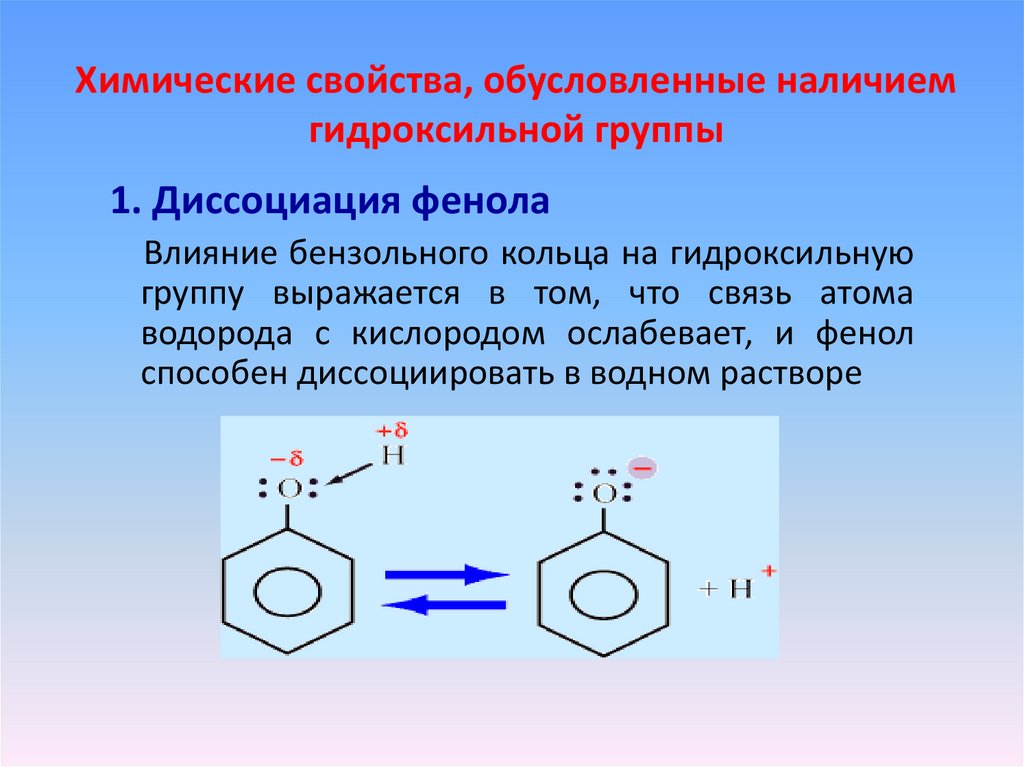
12. Химические свойства, обусловленные наличием гидроксильной группы
1. Диссоциация фенолаВлияние бензольного кольца на гидроксильную
группу выражается в том, что связь атома
водорода с кислородом ослабевает, и фенол
способен диссоциировать в водном растворе
13.
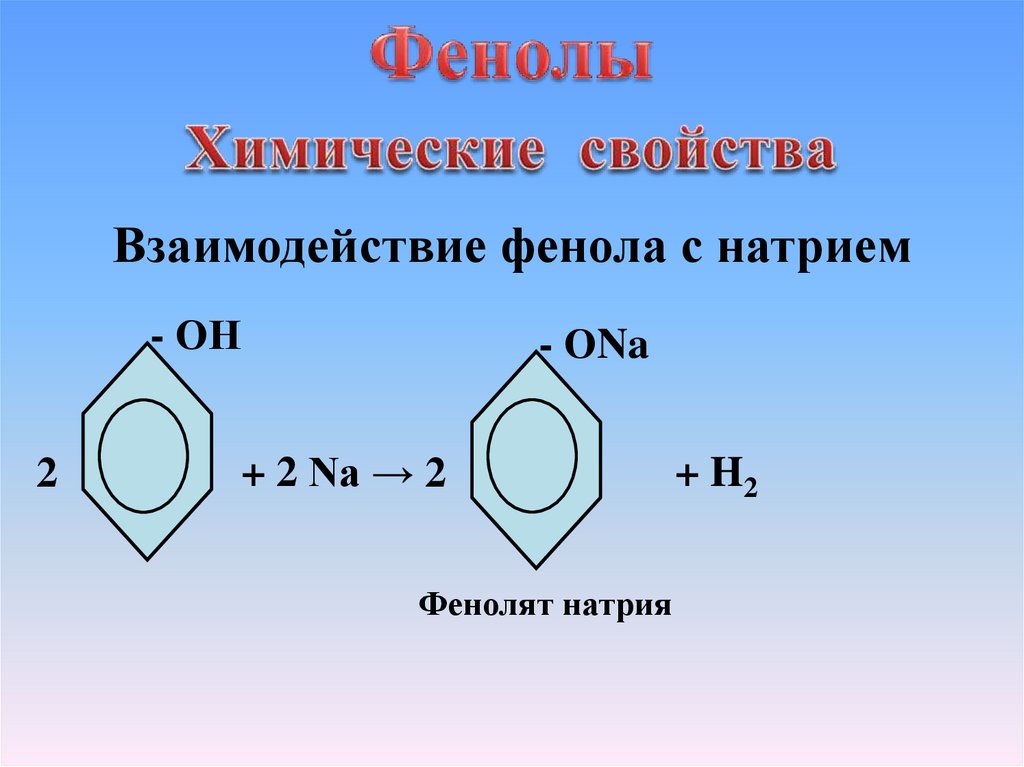
Взаимодействие фенола с натрием- ОН
2
- ОNa
+ 2 Na → 2
Фенолят натрия
+ H2
14.
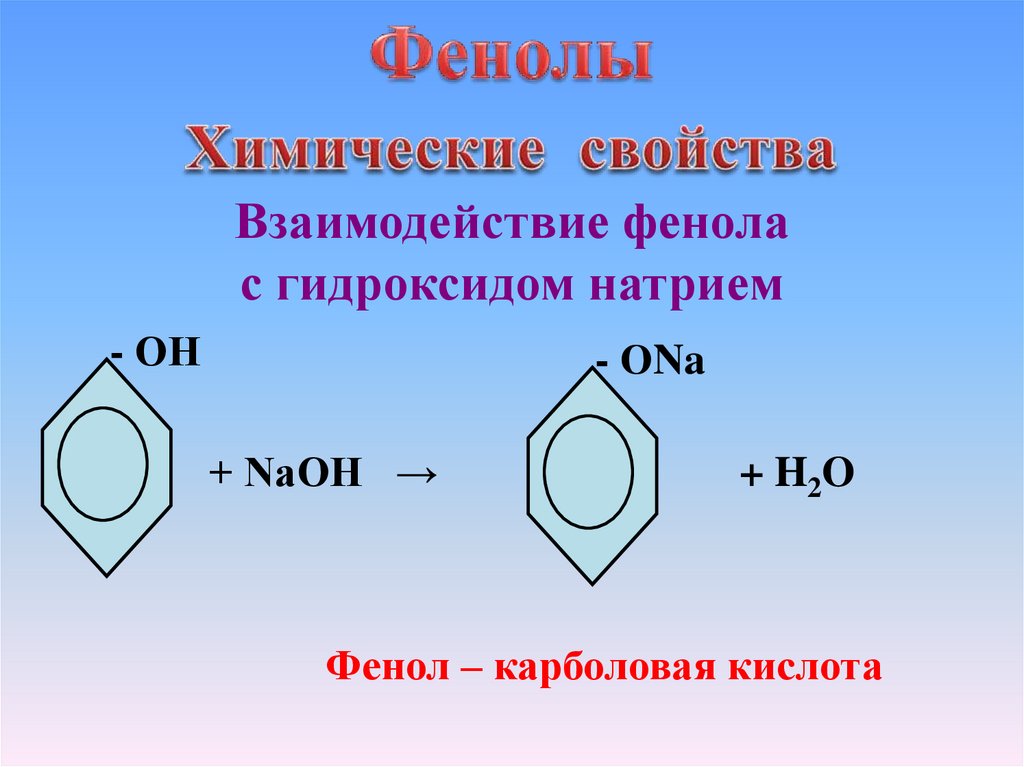
Взаимодействие фенолас гидроксидом натрием
- ОН
- ОNa
+ NaOH →
+ H2O
Фенол – карболовая кислота
15. Химические свойства, обусловленные наличием бензольного ядра
Отличия от ароматическихуглеводородов:
1. Реакции окисления
Фенол окисляется кислородом воздуха,
приобретая фиолетовую окраску.
16.
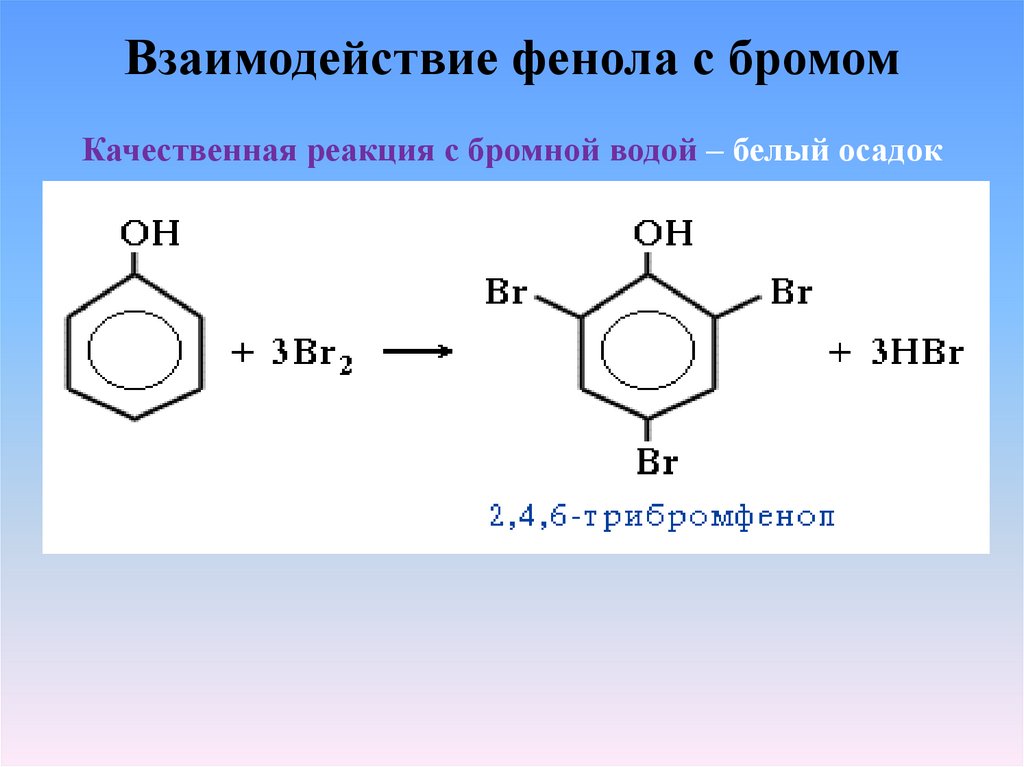
Взаимодействие фенола с бромомКачественная реакция с бромной водой – белый осадок
17.
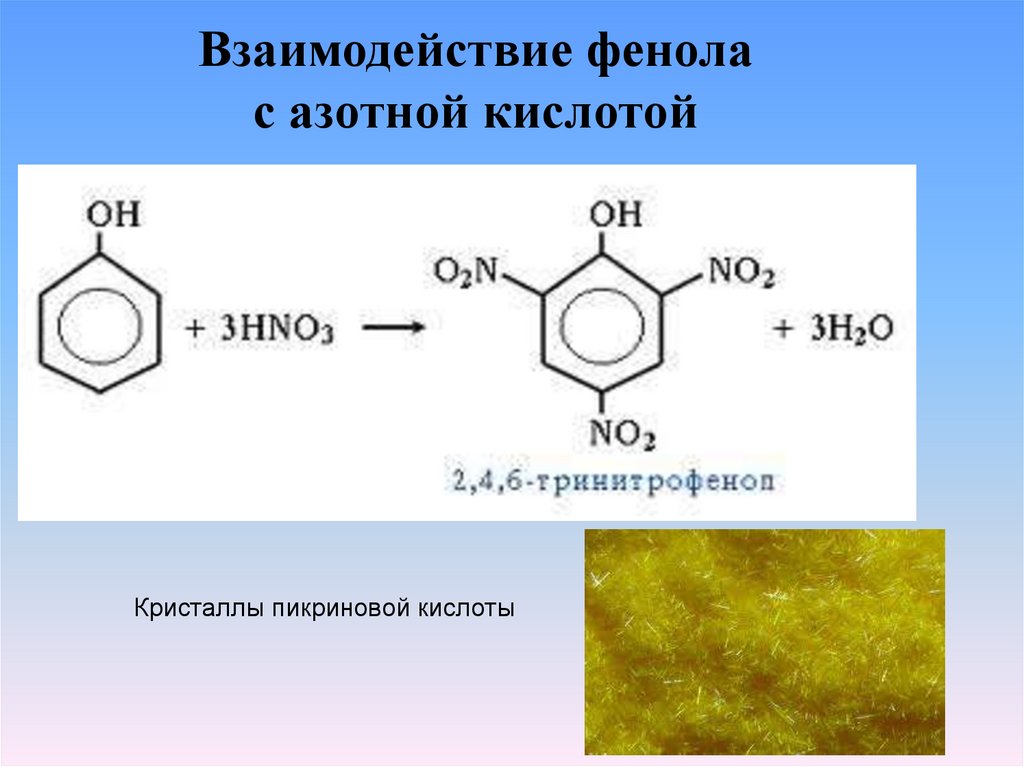
Взаимодействие фенолас азотной кислотой
Кристаллы пикриновой кислоты
18.
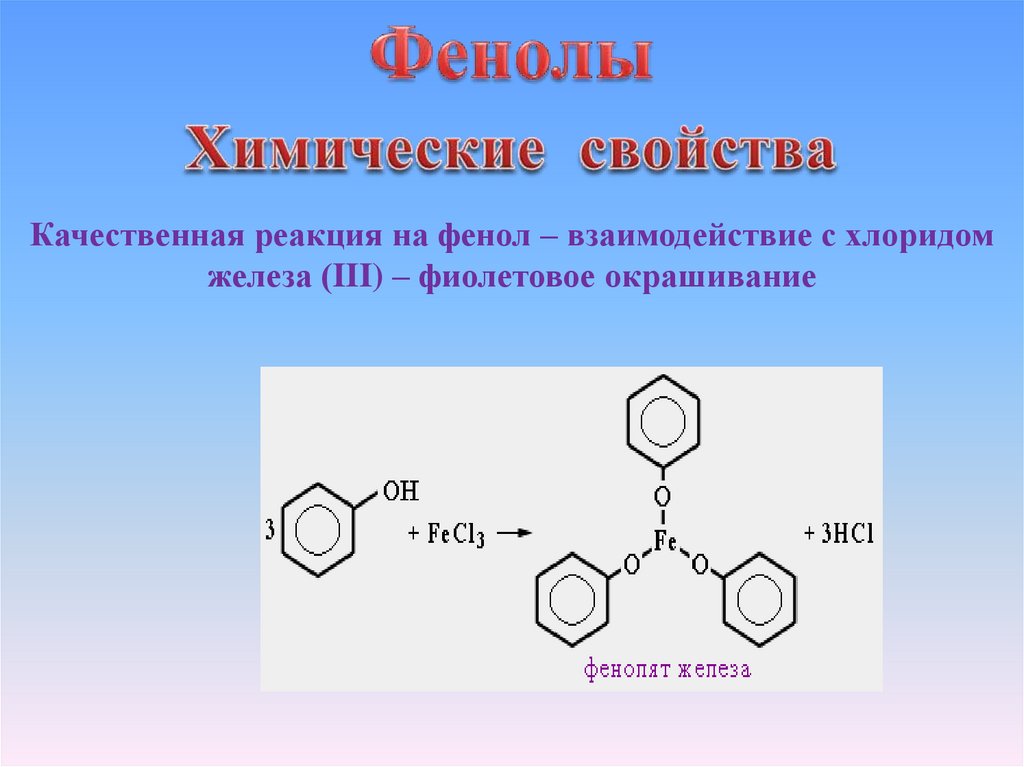
Качественная реакция на фенол – взаимодействие с хлоридомжелеза (III) – фиолетовое окрашивание
19.
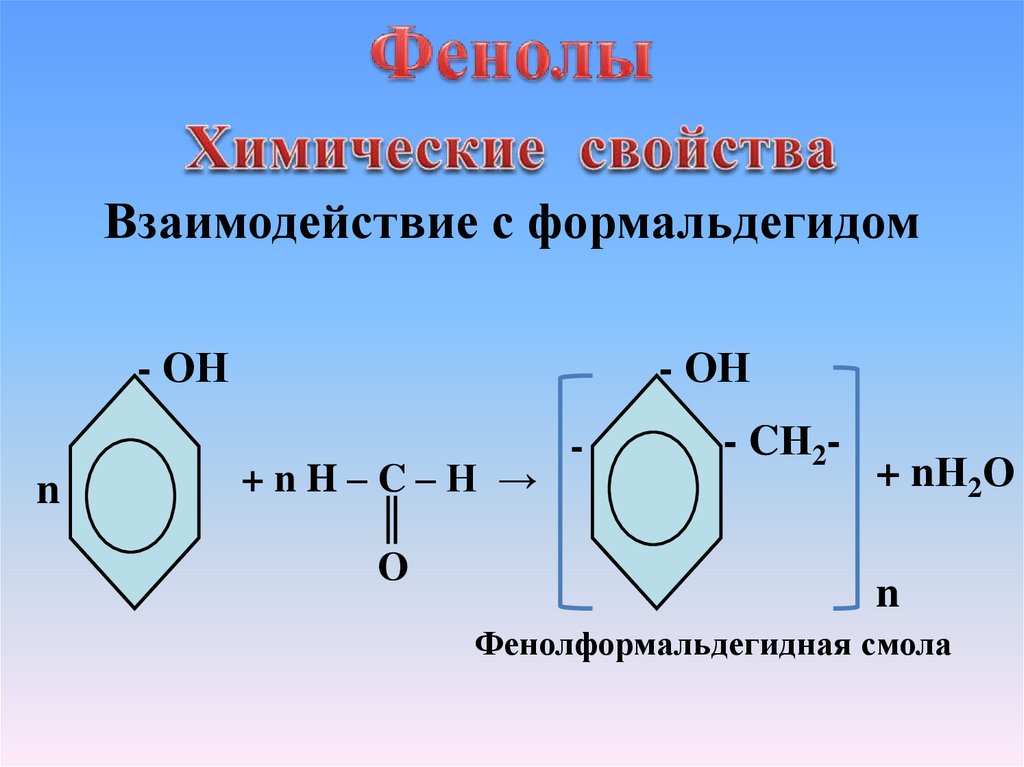
Взаимодействие с формальдегидом- ОН
n
- ОН
+nH–C–H →
║
O
-
- CН2-
+ nН2О
n
Фенолформальдегидная смола
20.
Взаимодействие с формальдегидом –реакция поликонденсации
21.
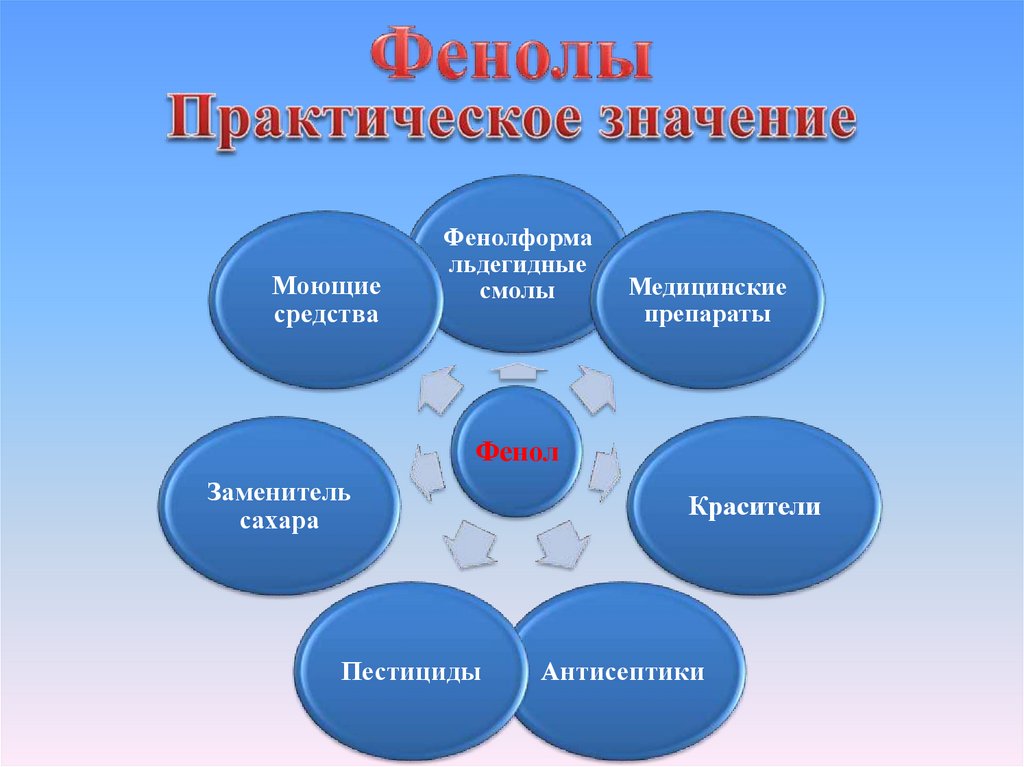
Моющиесредства
Фенолформа
льдегидные
смолы
Медицинские
препараты
Фенол
Заменитель
сахара
Пестициды
Красители
Антисептики
22. Фенолы в природе.
23.
По данным на 2006 год мировое потребление фенола имеет следующуюструктуру:
44 % фенола расходуется на производство бисфенола А, который
используется для производства поликарбона и эпоксидных смол;
30 % фенола расходуется на производство фенолформальдегидных
смол;
12 % фенола гидрированием превращается в циклогексанол,
используемый для получения искусственных волокон — нейлона и
капрона;
остальные 14 % расходуются на другие нужды, в том числе на
производство антиоксидантов, неионогенных ПАВ, других фенолов
(крезолов), лекарственных препаратов (аспирин), антисептиков и
пестицидов.
24.
Домашнее задание:§10, упражнение 3 (стр. 79)
Подготовить презентацию или
сообщение на тему: «Какие
свойства фенола лежат в основе
его применения?»











 Химия
Химия








