Похожие презентации:
Кислоты в свете теории электролитической диссоциации
1.
Кислоты в свете теорииэлектролитической
диссоциации.
Д Е Н И С О ВА Н И Н А ВА С И Л Ь Е В Н А
МУНИЦИПАЛЬНОЕ
О Б Щ Е О Б РА З О ВАТ Е Л Ь Н О Е У Ч Р Е Ж Д Е Н И Е
СОШ №2 ПОСЕЛОК СПИРОВО
2.
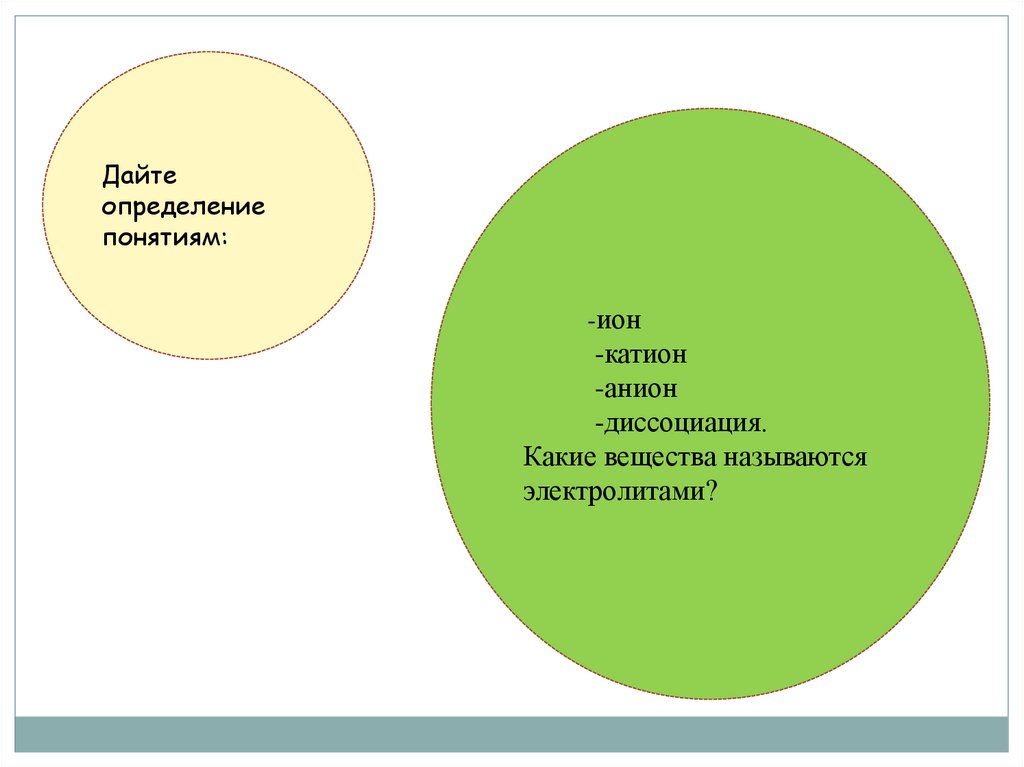
Дайтеопределение
понятиям:
-ион
-катион
-анион
-диссоциация.
Какие вещества называются
электролитами?
3.
Вещества, растворы которых проводятэлектрический ток, относятся к электролитам.
Электролитами являются соли, кислоты и основания.
Процесс распада электролита на ионы называется
электролитической диссоциацией.
Положительно заряженные ионы называют
катионами (при помещении в раствор электродов
движутся к отрицательно заряженному электроду катоду).
Отрицательно заряженные ионы называют анионами
(движутся к положительно заряженному электроду аноду
4.
Цель урока:ПОЗНАКОМИТЬСЯ С КЛАССИФИКАЦИЯМИ И
ОБЩИМИ ХИМИЧЕСКИМИ СВОЙСТВАМИ
КИСЛОТ В СВЕТЕ ТЕОРИИ
ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ.
5.
Что мы узнаем?Как отличить кислоты от других веществ?
Какие бывают кислоты?
Какими свойствами обладают кислоты?
Где применяются кислоты?
6.
Чему мы научимся?Осуществлять химические реакции с участием кислот.
Составлять уравнения этих реакций в молекулярной и ионной
форме.
7.
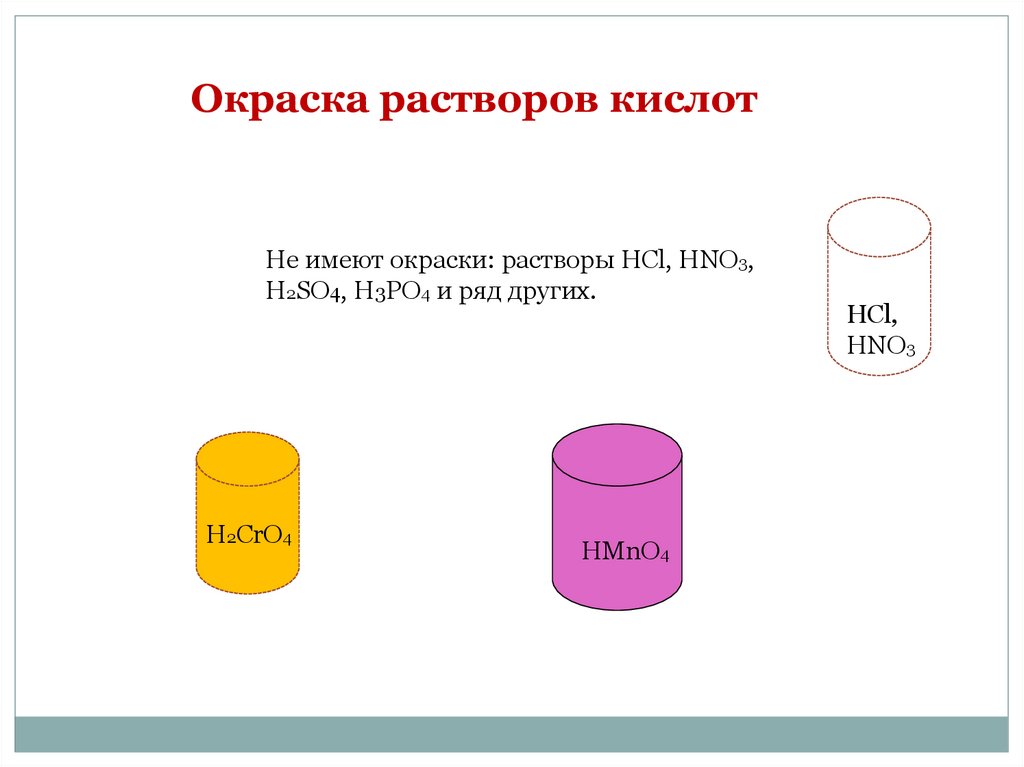
Окраска растворов кислотНе имеют окраски: растворы HCl, HNO3,
H2SO4, H3PO4 и ряд других.
H2CrO4
HMnO4
HCl,
HNHO
HCl,
YYYY
HNO33
8.
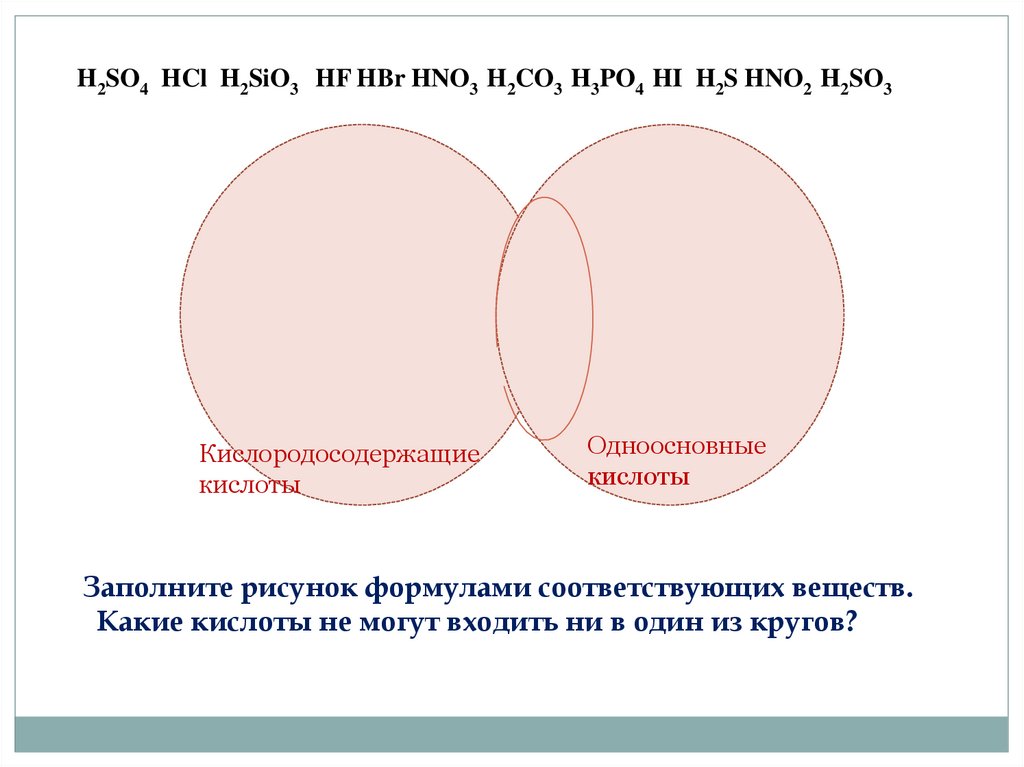
H2SO4 HCl H2SiO3 HF HBr HNO3 H2CO3 H3PO4 HI H2S HNO2 H2SO31.Бескислородные
кислоты
2.Одноосновные
кислоты
Заполните рисунок формулами соответствующих веществ.
Какие кислоты не могут входить ни в один из кругов?
9.
H2SO4 HCl H2SiO3 HF HBr HNO3 H2CO3 H3PO4 HI H2S HNO2 H2SO3Кислородосодержащие
кислоты
Одноосновные
кислоты
Заполните рисунок формулами соответствующих веществ.
Какие кислоты не могут входить ни в один из кругов?
10.
H2SO4 HCl H2SiO3 HF HBr HNO3 H2CO3 H3PO4 HI H2S HNO2 H2SO3Сильные
кислоты
Летучие
кислоты
Заполните рисунок формулами соответствующих веществ.
Какие кислоты не могут входить ни в один из кругов?
11.
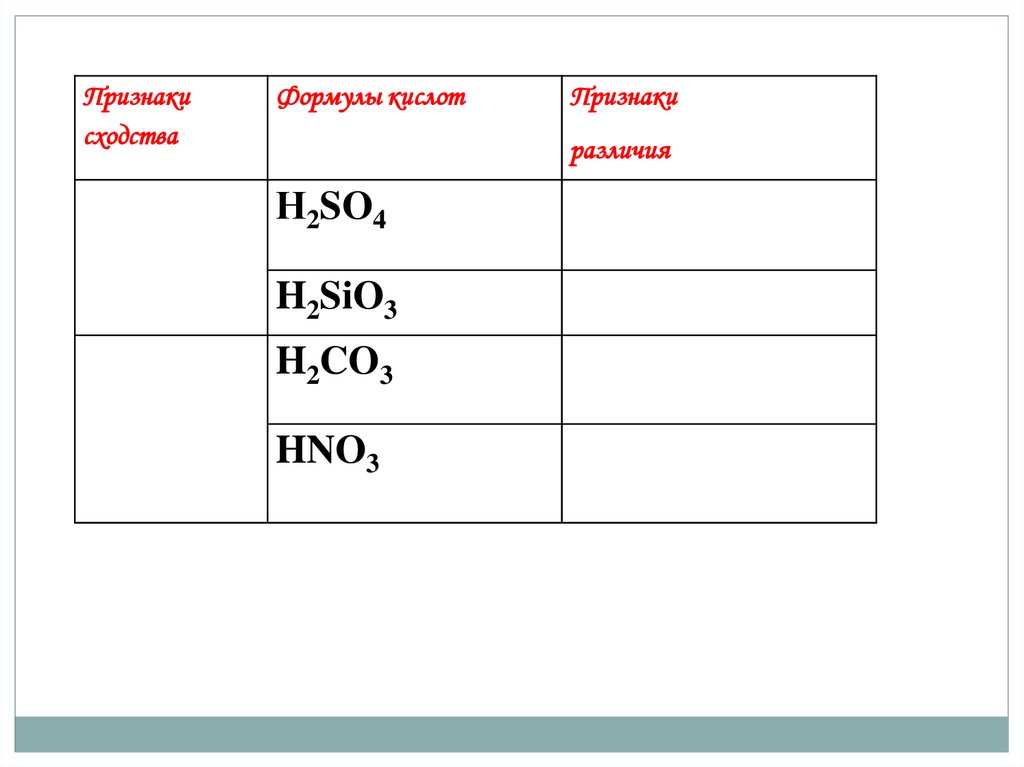
Признакисходства
Формулы кислот
Признаки
различия
Н2SO4
H2SiO3
H2CO3
HNO3
12.
Химические свойства кислот.1. Проделать реакции,
характерные для кислот на примере
серной кислоты, соляной кислоты.
2.Сделать вывод о химических свойствах
кислот,
3.Закрепить навыки безопасного
обращения с реактивами.
13.
14.
15.
Вывод.Кислоты
проявляют
общие
химические свойства и вступают в
реакции с металлами, оксидами
металлов, основаниями, солями.
16.
Первичная проверка знанийД О П И Ш И Т Е В О З М О Ж Н Ы Е У РА В Н Е Н И Я Х И М И Ч Е С К И Х
Р Е А К Ц И Й В М О Л Е К УЛ Я Р Н О М И И О Н Н О М В И Д Е :
А ) Н 2S O 4 + N A О Н →
Б ) Н 2S O 4 + A L 2O 3 →
В ) Н С L + САС О 3 →
2 . С К А К И М И И З В Е Щ Е С Т В Б УД Е Т В З А И М О Д Е Й С Т В О ВАТ Ь
С ОЛ Я Н А Я К И С Л О ТА ?
А ) Н С L + С О 2; →
Б ) Н С L + ВА ( О Н ) 2 →
В ) Н С L + K 2S O 4→
Г ) Н С L + К 2С О 3→
17.
ЗакреплениеСоставьте краткий план-конспект «Химические
свойства кислот в свете теории
электролитической диссоциации»
- Напишите уравнения реакций в полном и
сокращенном ионном виде.
- Чем обусловлены общие химические свойства
кислот в свете теории электролитической
диссоциации? Cтр156. последний абзац
Перечислите все вещества, с которыми
вступают в реакцию кислоты.
18.
Подведение итогов урока:Что нового вы узнали сегодня о кислотах?
Какие из изученных сегодня вопросов вызвали
наибольшие трудности при усвоении?
Как вы думаете, почему?
Какие задания вам выполнить не удалось?
Почему?
19.
Домашнее заданиеВЫПОЛНИТЕ ПРЕДЛОЖЕННЫЕ УПРАЖНЕНИЯ:
1. С КАКИМИ ИЗ ПЕРЕЧИСЛЕННЫХ ВЕЩЕСТВ
М ОЖ Е Т В С Т У П И Т Ь В О В З А И М ОД Е Й С Т В И Е
С Е Р Н А Я К И С Л О Т А , Н А ХО Д Я Щ А Я С Я В В О Д Н О М
РА С Т В О Р Е : О К С И Д М А Г Н И Я , Х Л О Р И Д Б А Р И Я ,
С Е Р Е Б Р О , О К С И Д У ГЛ Е Р О Д А ( I V ) , А Л Ю М И Н И Й ,
Г И Д Р О К С И Д К А Л И Я , Н И Т РАТ Н АТ Р И Я ?
2.
Н А П И Ш И Т Е У РА В Н Е Н И Я О С У Щ Е С Т В И М Ы Х
Р Е А К Ц И Й В М О Л Е К УЛ Я Р Н О М И И О Н Н О М В И Д А Х .
УКАЖИТЕ ТИП РЕАКЦИИ.
20.
21.
ЛитератураЛитература.
1. Габриелян О.С. Химия 9 класс. Москва. 2019 Дрофа
2. Габриелян О.С., Остроумов И.Г. Настольная книга для учителя 9 класс. Москва. 2013 Дрофа
3. Габриелян О.С, Яшукова А.В. Методическое пособие 8-9 классы. Москва. 2018г. Дрофа.
4. Габриелян О.С., Решетов П.В.Остроумов И.Г. Задачи по химии и способы их решения
8-9классы. Москва. 2007г Дрофа
5. Горковенко М.Ю. Поурочные разработки по химии к учебникам Габриеляна О.С. 9класс Москва.2015.
«ВАКО»
ЭОР
использованные по теме «Кислоты в свете ТЭД».
№ п/п Карточка ресурса
1 1. Классификация кислот
http://files.school-collection.edu.ru/dlrstore/617fdbd0-8cff-11db-b606-0800200c9a66/ch08_38_01.swf
2 Правила техники безопасности при работе с кислотами
http://files.school-collection.edu.ru/dlrstore/0ab6f5aa-4185-11db-b0de-0800200c9a66/ch08_20_05.swf
3 Химические свойства кислот.
http://files.school-collection.edu.ru/dlrstore/617fdbd1-8cff-11db-b606-0800200c9a66/ch08_38_02.swf
Задание можно использовать для проверки усвоения новых знаний.
















 Химия
Химия








