Похожие презентации:
Непредельные углеводороды. Алкены
1. Непредельные углеводороды АЛКЕНЫ
2. Определение
Алкены – непредельные углеводороды,в молекулах которых между атомами
углерода имеется одна двойная связь.
Общая формула: СnH2n , где n ≥2
3. Номенклатура алкенов
СН2 = СН2этен (этилен)
СН3 – СН = СН2 пропен (пропилен)
4
3
2
1
1
2
3
4
СН3 – СН2 – СН = СН2
СН3 – СН = СН – СН3
бутен -1 (бутилен-1)
бутен -2 (бутилен-2)
5
4
3
2
1
СН3 – СН – CH2 – CH=CH2
|
CH3
4 – метилпентен -1
4. Изомерия алкенов
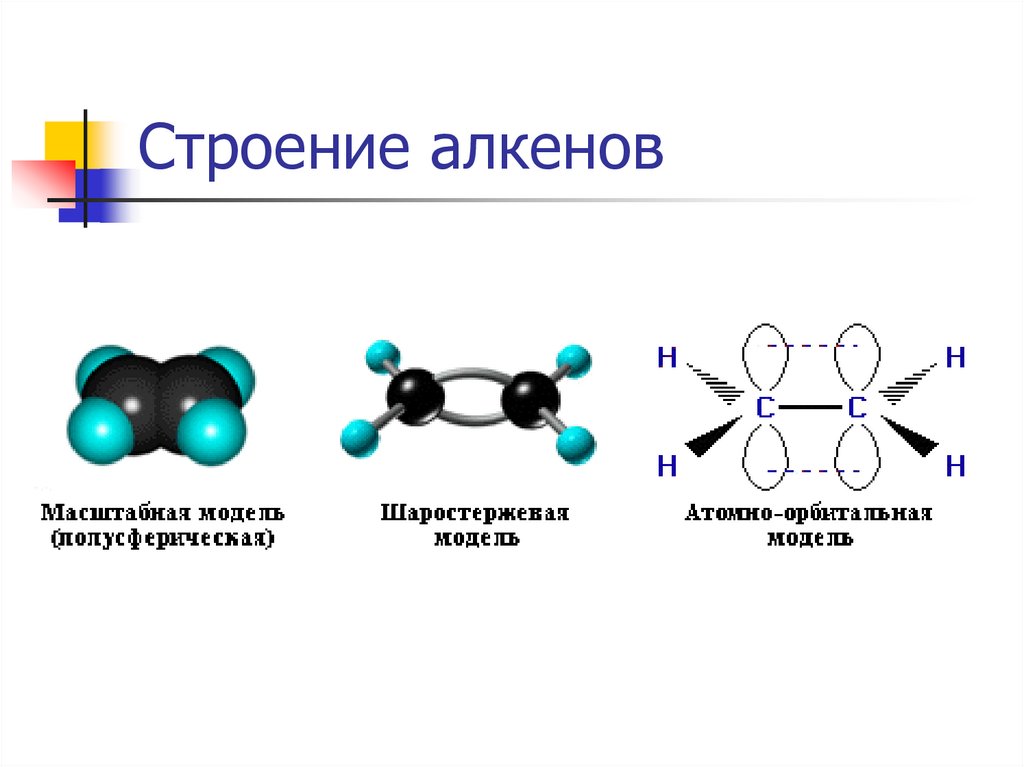
5. Строение алкенов
СН2 = СН2 этилен (этен)Двойная связь: σ-связь+π-связь
Тип гибридизации: sp²
Валентный угол: 120°
Форма молекулы:
плоскостная
6. Строение алкенов
7.
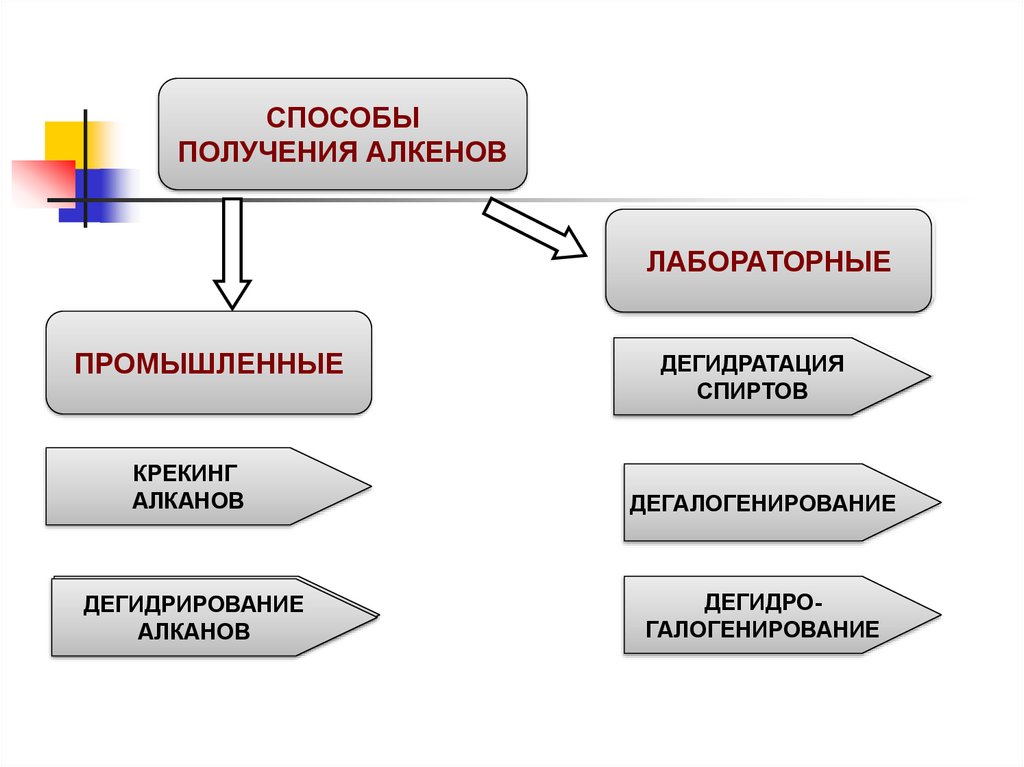
СПОСОБЫПОЛУЧЕНИЯ АЛКЕНОВ
ЛАБОРАТОРНЫЕ
ПРОМЫШЛЕННЫЕ
ДЕГИДРАТАЦИЯ
ДЕГИДРАТАЦИЯ
СПИРТОВ
СПИРТОВ
КРЕКИНГ
АЛКАНОВ
ДЕГАЛОГЕНИРОВАНИЕ
ДЕГИДРИРОВАНИЕ
ДЕГИДРИРОВАНИЕ
АЛКАНОВ
АЛКАНОВ
ДЕГИДРОГАЛОГЕНИРОВАНИЕ
8.
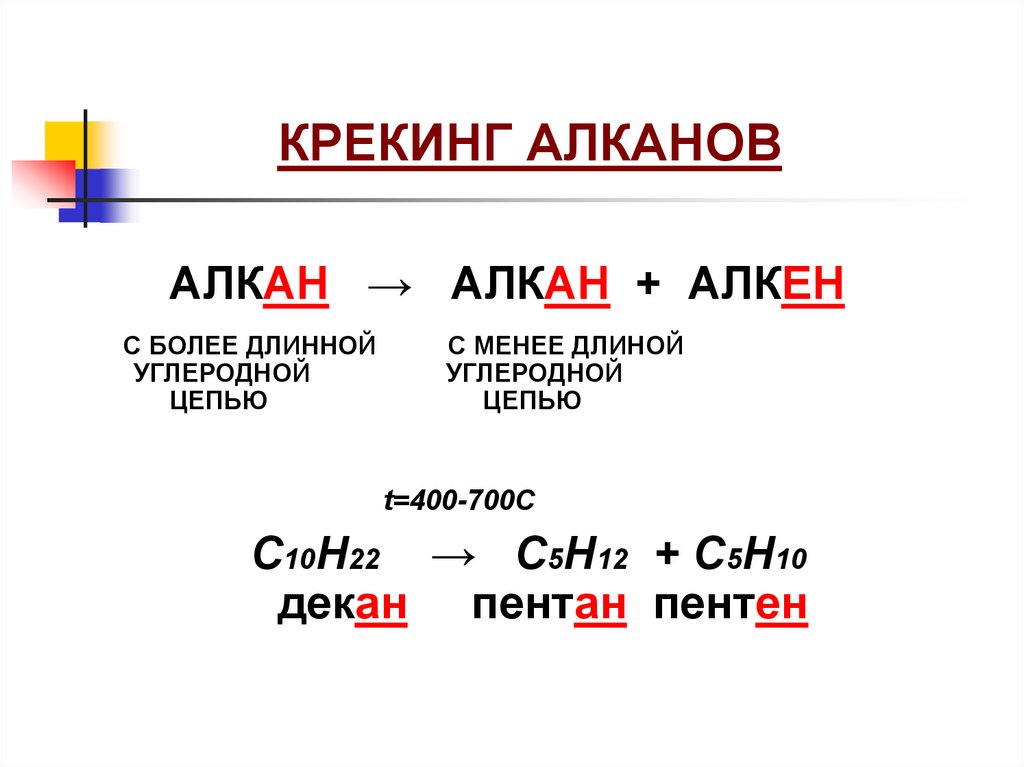
КРЕКИНГ АЛКАНОВАЛКАН → АЛКАН + АЛКЕН
С БОЛЕЕ ДЛИННОЙ
УГЛЕРОДНОЙ
ЦЕПЬЮ
С МЕНЕЕ ДЛИНОЙ
УГЛЕРОДНОЙ
ЦЕПЬЮ
t=400-700C
С10Н22 → C5H12 + C5H10
декан пентан пентен
9.
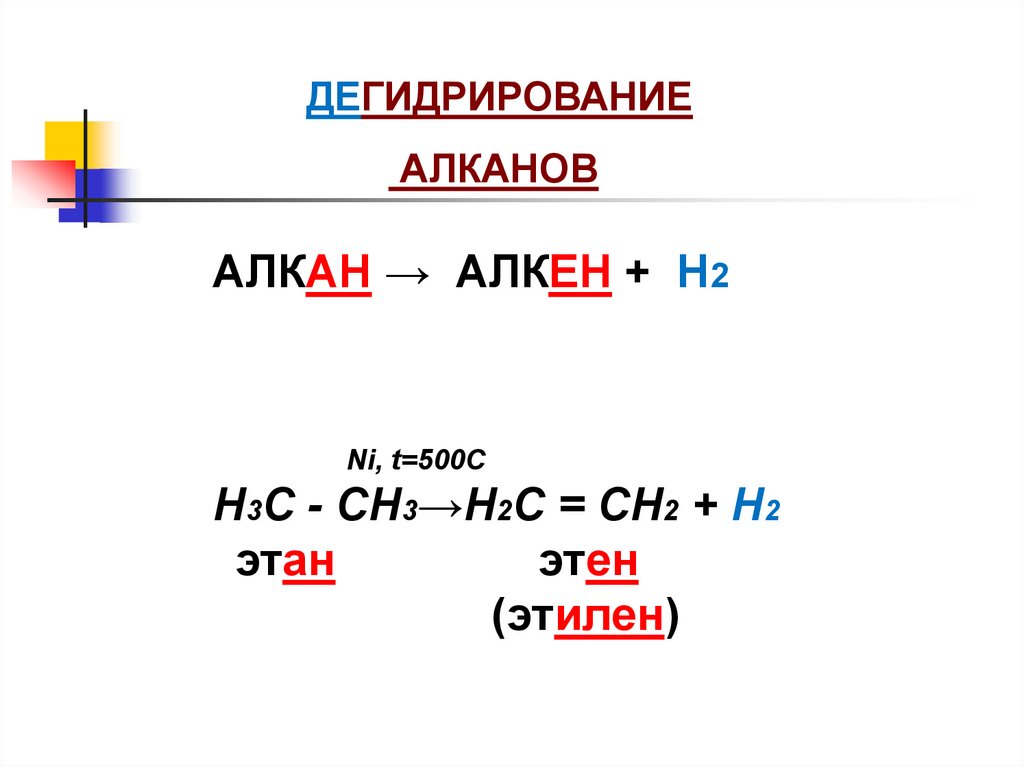
ДЕГИДРИРОВАНИЕАЛКАНОВ
АЛКАН → АЛКЕН + Н2
Ni, t=500C
Н3С - СН3→Н2С = СН2 + Н2
этан
этен
(этилен)
10.
ДЕГИДРАТАЦИЯСПИРТОВ
СПИРТ→АЛКЕН+ВОДА
условия: t≥140C, Н2SO4(конц.)
Н
Н
Н-С – С-Н →Н2С = СН2 + Н2О
Н
ОН
этен
(этилен)
11.
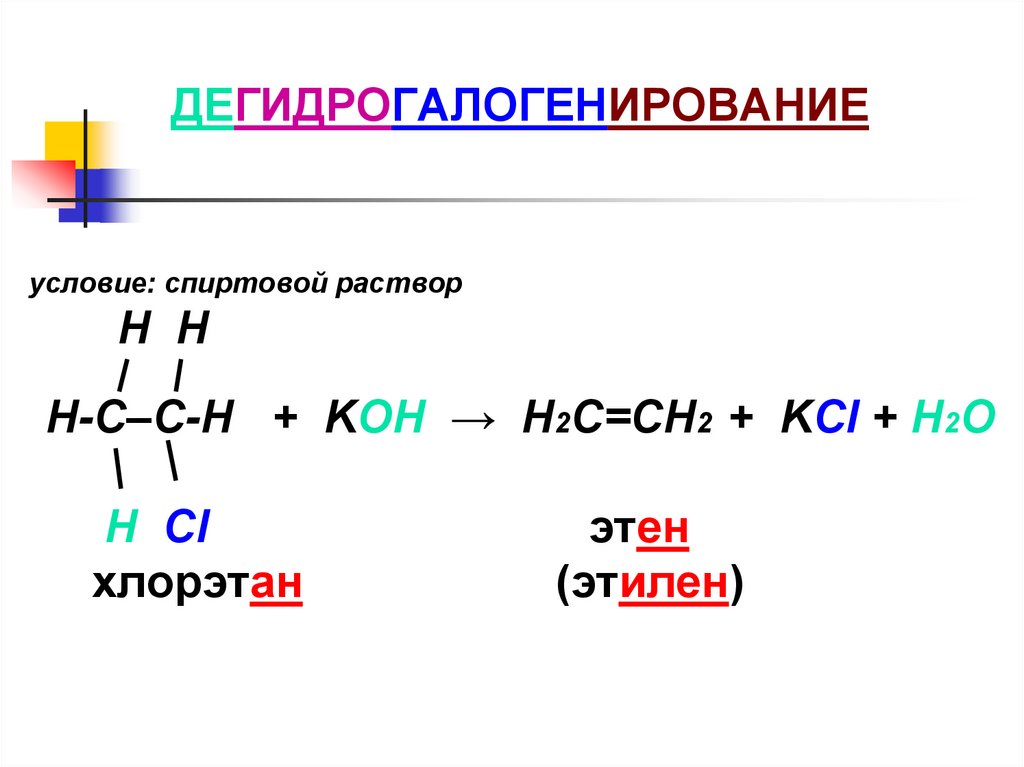
ДЕГИДРОГАЛОГЕНИРОВАНИЕусловие: спиртовой раствор
H H
Н-С–С-Н + KOH → Н2С=СН2 + KCl + H2O
Н Cl
хлорэтан
этен
(этилен)
12.
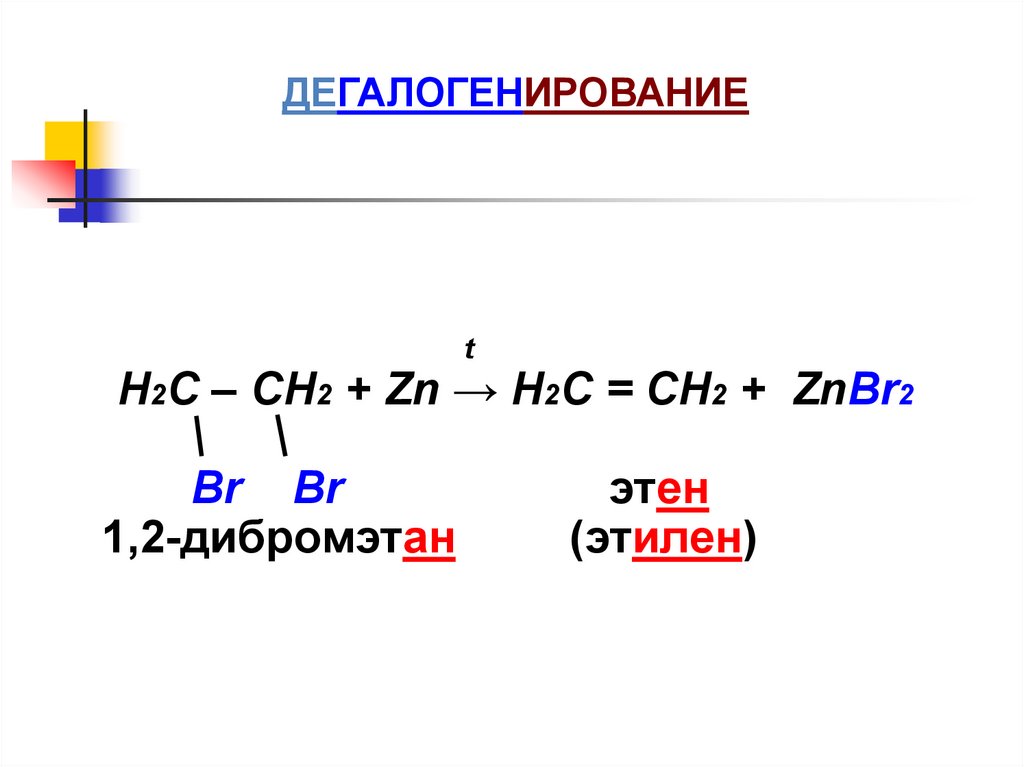
ДЕГАЛОГЕНИРОВАНИЕt
Н2С – СН2 + Zn → Н2С = СН2 + ZnBr2
Br Br
1,2-дибромэтан
этен
(этилен)
13. Физические свойства
Этен,пропен, бутен – газыС5Н10 – С16Н32 - жидкости
Высшие алкены – тв.вещества
14. Химические свойства
I.Реакции присоединения:1.Гидрирование :
CH2=CH-CH3+Н2 → CH3-CH2-CH3
2.Галогенирование:
CH2=CH-CH3+Cl2 → CH2Cl-CHCl-CH3
3.Гидрогалогенирование:
CH2=CH-CH3+НCl → CH3-CHCl-CH3
15. Химические свойства
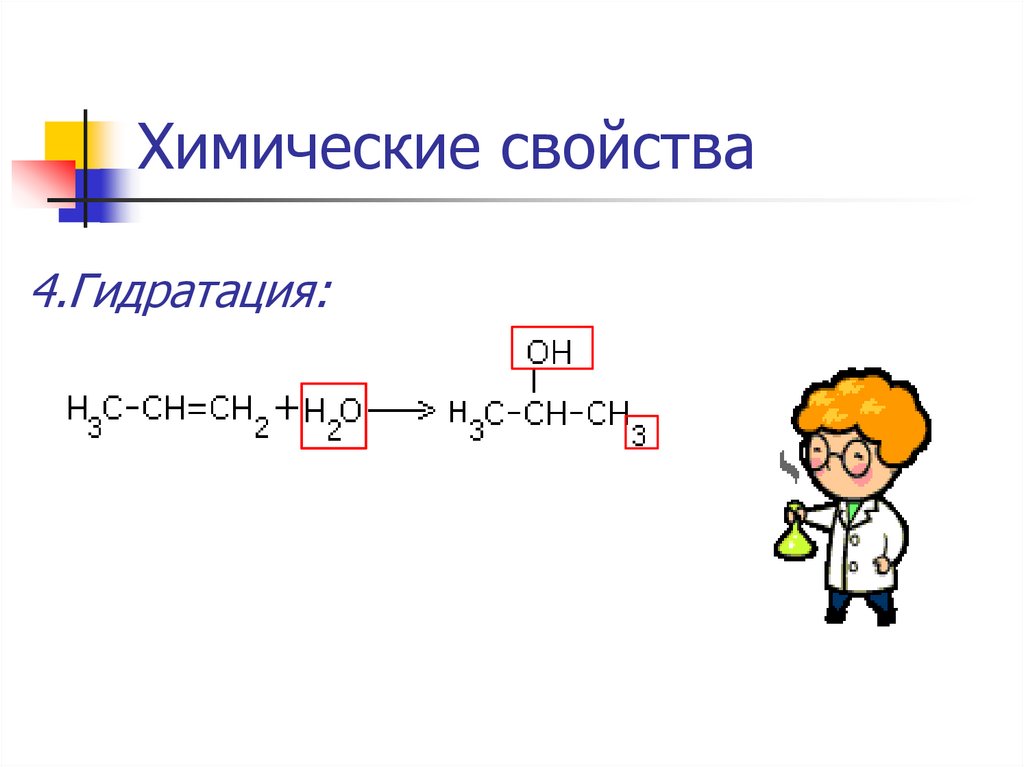
4.Гидратация:5.Полимеризация:
16. Химические свойства
II.Реакции окисления:1.Полное окисление (горение):
С2Н4 + 3О2 → 2СО2 + 2Н2О
2.Неполное окисление:
3С2Н4 + 2KMnO4 +4Н2О →3HOCH2-CH2OH +
+2MnO2 + 2KOH
17. Применение алкенов
18. Домашнее задание
Задача: Определите молекулярнуюформулу алкена, если его плотность
по воздуху равна 2,89. Напишите три
структурные формулы его возможных
изомеров, назовите их.











 Химия
Химия








