Похожие презентации:
Оксиды азота
1.
Оксиды азота2.
+1+2
N2O
NO
Оксид азота (I)
/ Веселящий газ
Оксид азота (II) /
монооксид азота
несолеобразующие
+3
+4
+5
N2O3
NO2
N2O5
Оксид азота (III) / Оксид азота (IV) / Оксид азота (V) /
Азотный
Азотистый
диоксид азота
ангидрид
ангидрид
солеобразующие
3.
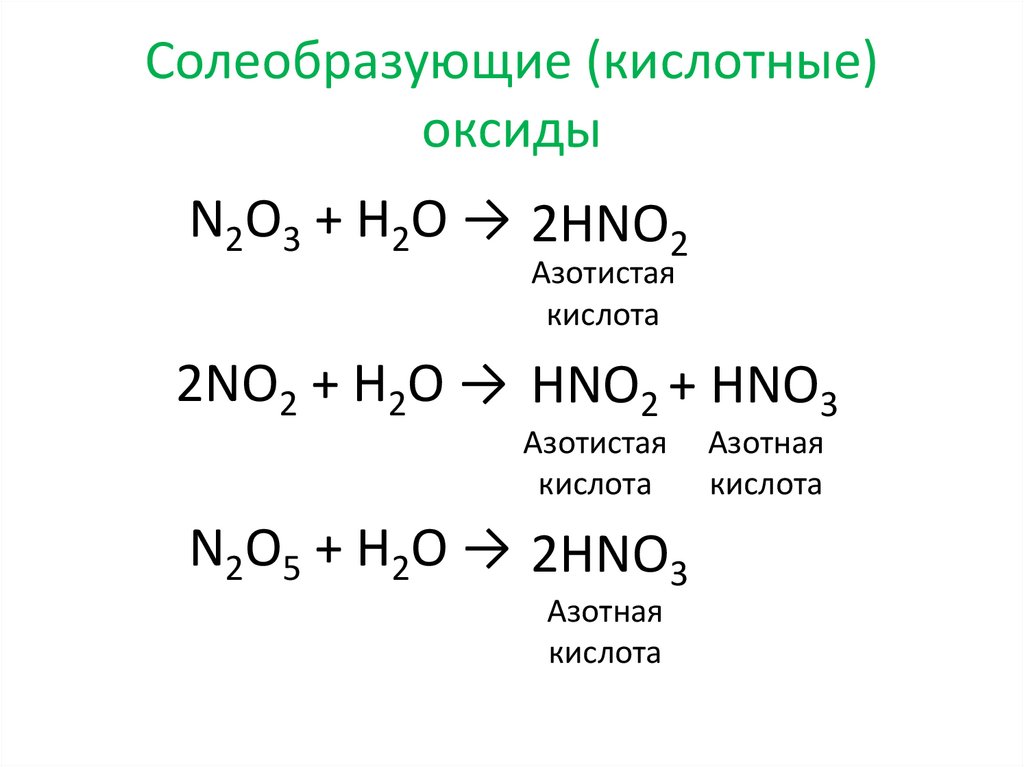
Солеобразующие (кислотные)оксиды
N2O3 + H2O → 2HNO2
Азотистая
кислота
2NO2 + H2O → HNO2 + HNO3
Азотистая
кислота
N2O5 + H2O → 2HNO3
Азотная
кислота
Азотная
кислота
4.
Оксид азота (II) / монооксид азотаФизические свойства:
• газ без цвета и запаха
• малорастворим в воде.
! В твердом состоянии
димер N2O2
5.
Получение1. В промышленности: каталитическое окисление
аммиака.
t, Pt
4NH3 + 5O2 →4NO + 6H2O
2. В лаборатории
• Взаимодействие малоактивных металлов с
разбавленной азотной кислотой.
2HNO3 (разбавл.) + Cu = Cu(NO3 )2+ NO↑ + H2O
• Восстановление нитритов
2NaNO2 + 2H2SO4 + 2NaI = 2NO + I2 + 2Na2SO4 + 2H2O
• Взаимодействие азота с кислородом.
t > 20000C
N2 + O2 ↔ 2 NO – Q
6.
Химические свойства1. Не реагирует: с водой, с оксидами
металлов, с основаниями.
2. С кислородом
2NO + O2 → 2NO2 + 123 кДж.
3. С углеродом
t
2NO + C(графит.) = N2 + СO2
4. С фосфором
t
10NO + 4P(красн.) = 5N2 + 2Р2O5
7.
Оксид азота (IV) / диоксид азотаФизические свойства:
• Газ бурого цвета с резким
запахом.
• Сжижается при
температуре 21,3 0С.
!!! Ядовит. В небольших
концентрациях раздражает
дыхательные пути, в
больших концентрациях
вызывает отёк лёгких.
8.
Получение1. Окисление оксида азота (II)кислородом
воздуха.
2NO + O2 → 2NO2
2. Взаимодействие меди с концентрированной
азотной кислотой.
Cu + 4HNO3(конц) → Cu(NO3)2 + 2NO2 + 2H2O
3. Взаимодействие концентрированной азотной
кислоты с неметаллами.
S + 6HNO 3(конц. гор.) = H2SO4 + 6NO2 + 2H2О
P+5HNO3(конц. гор.) = H3PO4 + 5NO2 + H2O
9.
Химические свойства1. - Растворение в воде
2NO2 + H2O → HNO2 + HNO3
- В присутствии кислорода
4NO2 + 2H2O + О2 = 4HNO3
2. С растворами щелочей
2NO2 + 2KOH(разб.) → KNO2 + KNO3 + H2O
В присутствии кислорода
2NO2 + O2 + KOH → KNO3 + 2H2O








 Химия
Химия








