Похожие презентации:
Кислородсодержащие соединения азота. Оксиды азота
1.
Кислородсодержащиесоединения азота
Оксиды азота
2.
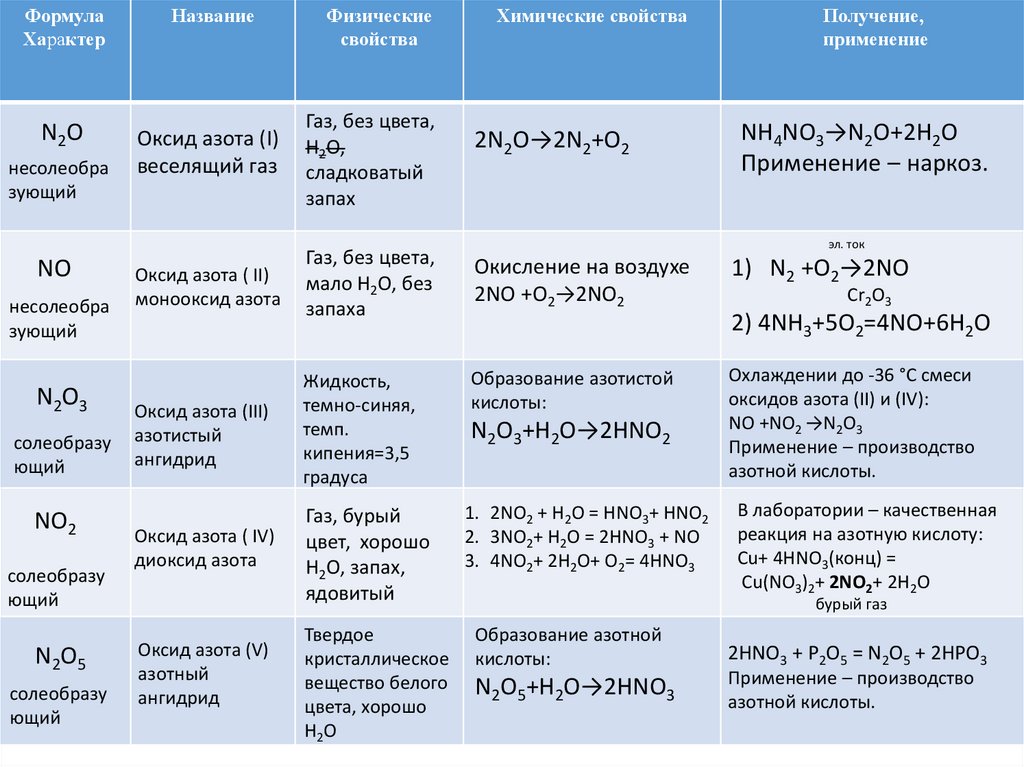
ФормулаХарактер
Название
N2 O
Оксид азота (I)
веселящий газ
Газ, без цвета,
H2O,
сладковатый
запах
Оксид азота ( II)
монооксид азота
Газ, без цвета,
мало H2O, без
запаха
Окисление на воздухе
2NO +O2→2NO2
Оксид азота (III)
азотистый
ангидрид
Жидкость,
темно-синяя,
темп.
кипения=3,5
градуса
Образование азотистой
кислоты:
Оксид азота ( IV)
диоксид азота
Газ, бурый
цвет, хорошо
H2O, запах,
ядовитый
несолеобра
зующий
NO
несолеобра
зующий
N2O3
солеобразу
ющий
NO2
солеобразу
ющий
N2O5
солеобразу
ющий
Оксид азота (V)
азотный
ангидрид
Физические
свойства
Твердое
кристаллическое
вещество белого
цвета, хорошо
H2 O
Химические свойства
2N2O→2N2+O2
Получение,
применение
NH4NO3→N2O+2H2O
Применение – наркоз.
эл. ток
1) N2 +O2→2NO
Cr2O3
2) 4NH3+5O2=4NO+6H2O
N2O3+H2O→2HNO2
1. 2NO2 + H2O = HNO3+ HNO2
2. 3NO2+ H2O = 2HNO3 + NO
3. 4NO2+ 2H2O+ O2= 4HNO3
Охлаждении до -36 °С смеси
оксидов азота (II) и (IV):
NO +NO2 →N2O3
Применение – производство
азотной кислоты.
В лаборатории – качественная
реакция на азотную кислоту:
Cu+ 4HNO3(конц) =
Сu(NO3)2+ 2NO2+ 2H2O
бурый газ
Образование азотной
кислоты:
N2O5+H2O→2HNO3
2HNO3 + P2O5 = N2O5 + 2HPO3
Применение – производство
азотной кислоты.

 Химия
Химия








