Похожие презентации:
Алкены. Гомологический ряд алкенов
1.
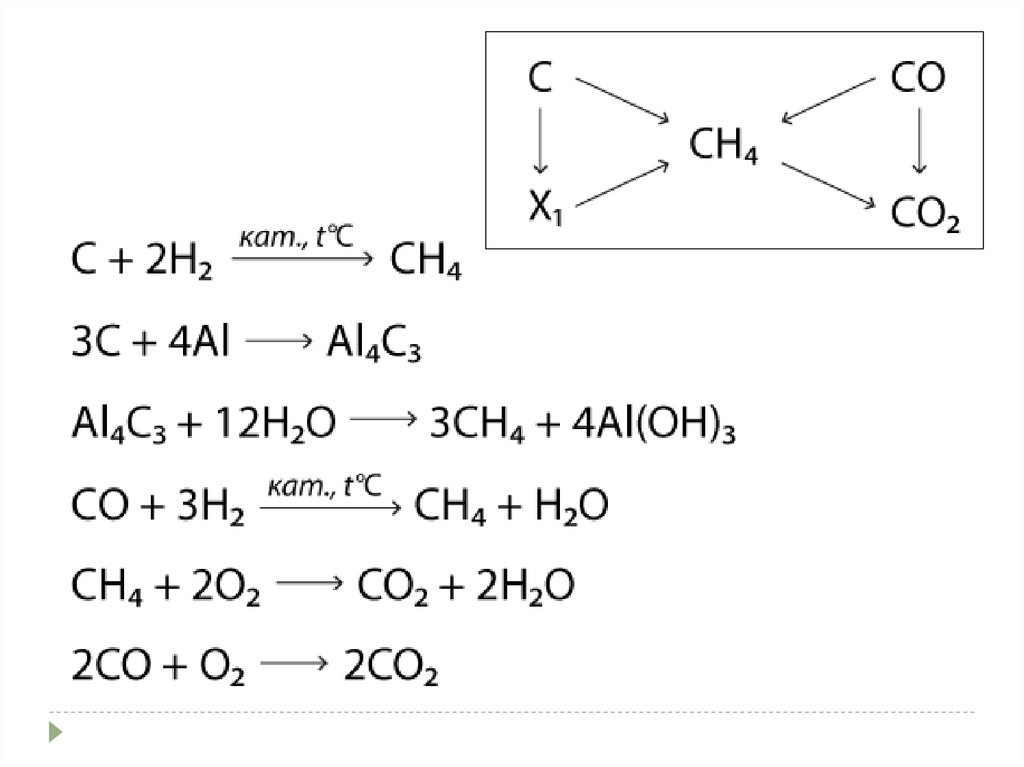
Проверка домашнего заданияНапишите уравнения реакций, с помощью которых
можно осуществить следующие превращения:
2.
3.
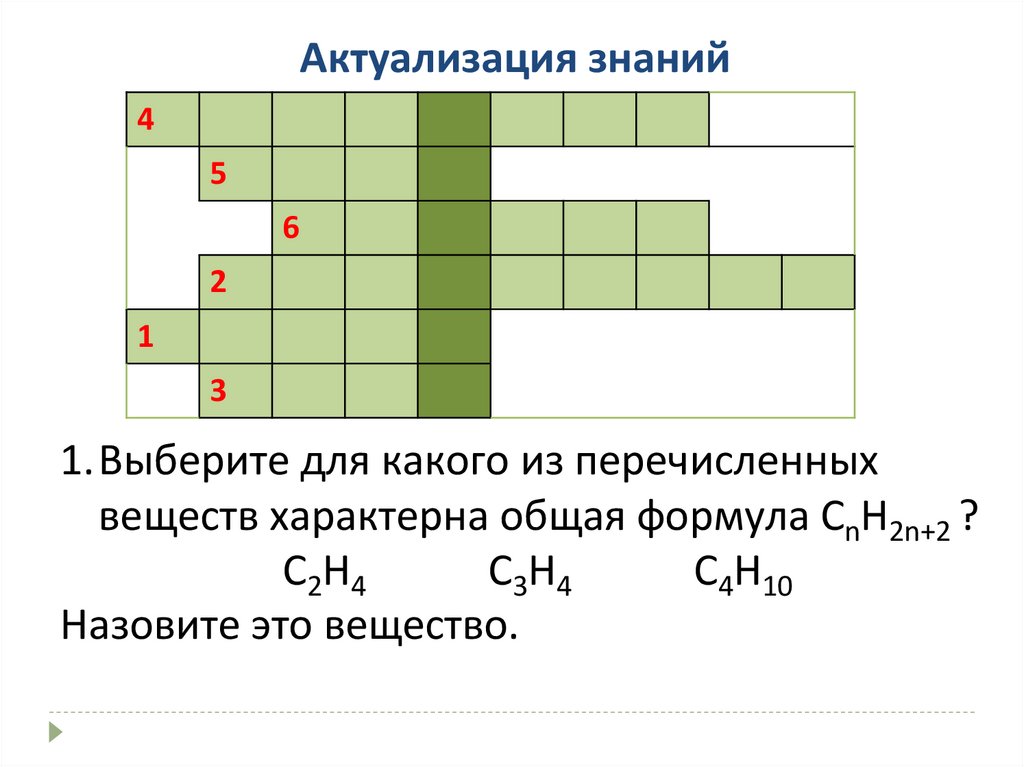
Актуализация знаний4
5
6
2
1
3
1.Выберите для какого из перечисленных
веществ характерна общая формула СnH2n+2 ?
С2Н4
С3Н4
С4Н10
Назовите это вещество.
4.
Актуализация знаний4
5
6
2
1Б У
Т
А
Н
3
2. Какая наиболее характерная группа
реакций для алканов?
5.
Актуализация знаний4
5
6
2З А
1Б У
Т
М Е
А Н
Щ Е
Н
И
Е
3
2. Какая наиболее характерная группа
реакций для алканов?
Напишите что получится в результате
реакции: СН3 – СН3 + Сl2 →
6.
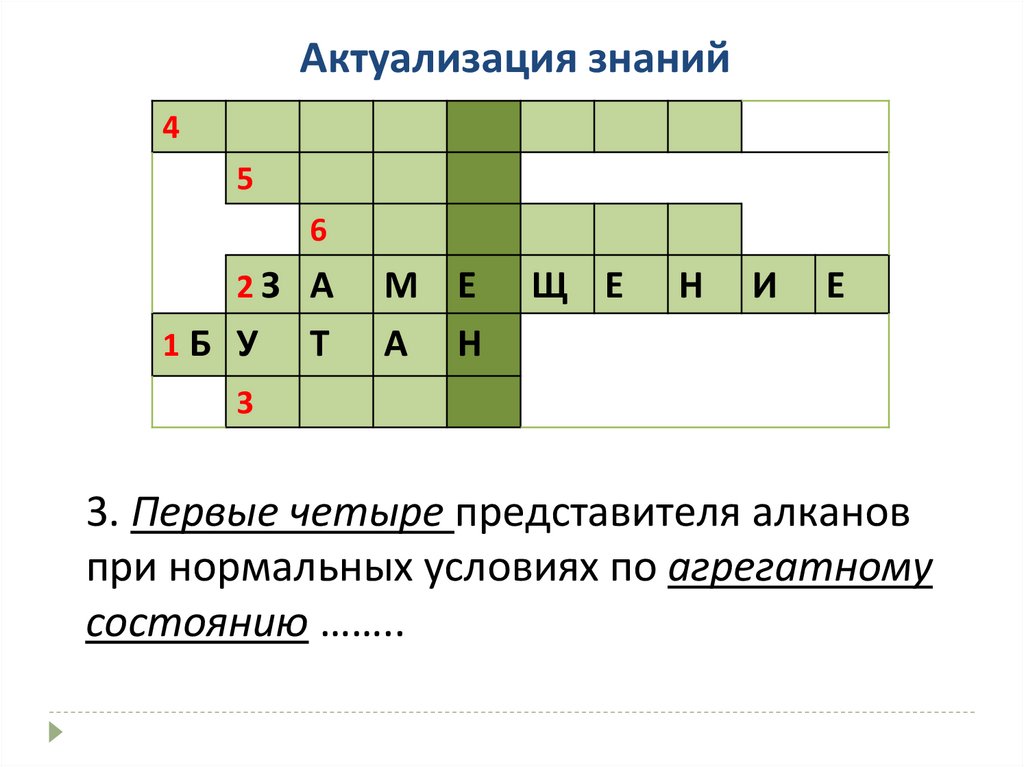
Актуализация знаний4
5
6
2З А
1Б У
Т
М Е
А Н
Щ Е
Н
И
Е
3
3. Первые четыре представителя алканов
при нормальных условиях по агрегатному
состоянию ……..
7.
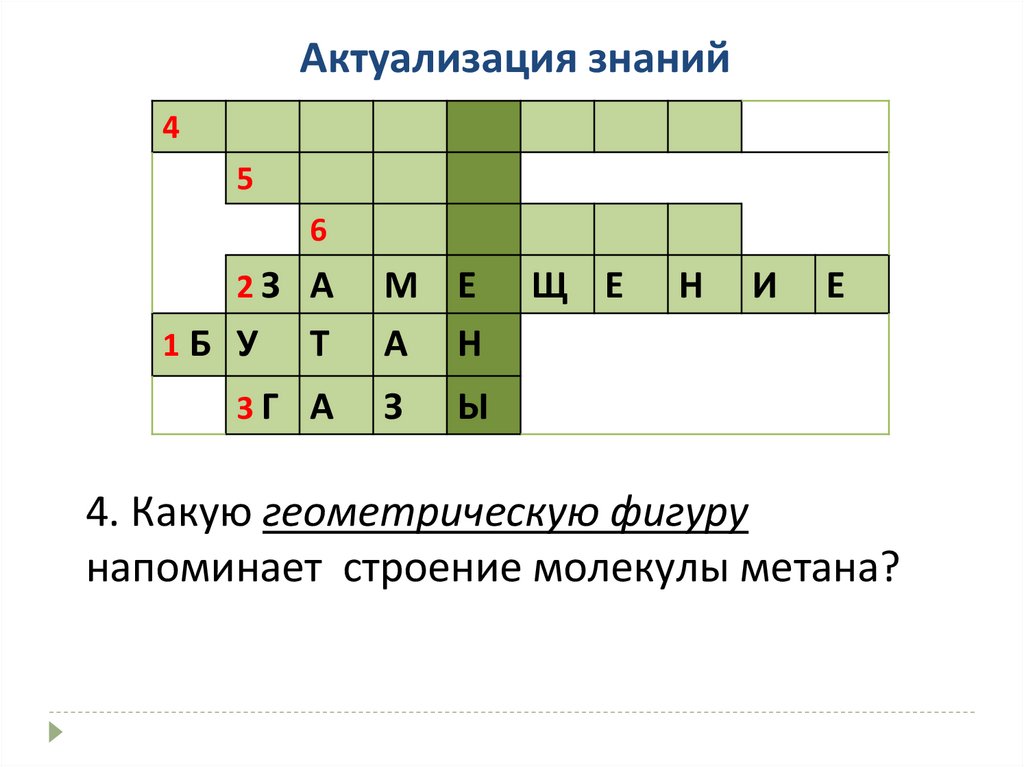
Актуализация знаний4
5
6
2З А
1Б У
Т
3Г А
М Е
А Н
З
Щ Е
Н
И
Е
Ы
4. Какую геометрическую фигуру
напоминает строение молекулы метана?
8.
Актуализация знаний4Т Е
Т
Р
А
Э
Д
Р
Щ Е
Н
5
6
2З А
1Б У
Т
3Г А
М Е
А Н
З
И
Е
Ы
5. Как называется углеводородный радикал
СН3 – СН2 – ?
9.
Актуализация знаний4Т Е
Т
5Э Т
Р
И
А
Л
Э
Д
Р
Щ Е
Н
6
2З А
1Б У
Т
3Г А
М Е
А Н
З
И
Е
Ы
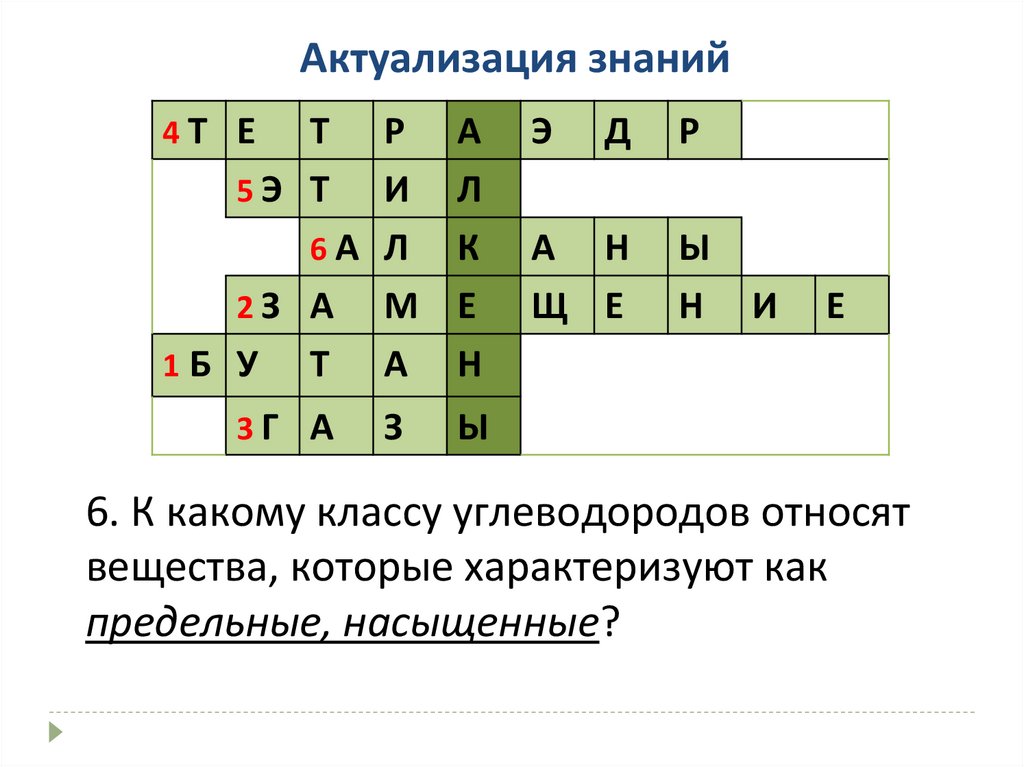
6. К какому классу углеводородов относят
вещества, которые характеризуют как
предельные, насыщенные?
10.
Актуализация знаний4Т Е
Т
5Э Т
Р
И
6А Л
2З А М
1Б У
Т А
А
Л
К
Е
Н
3Г А
Ы
З
Э
Д
Р
А Н
Щ Е
Ы
Н
И
Е
6. К какому классу углеводородов относят
вещества, которые характеризуют как
предельные, насыщенные?
11.
Алкены12.
План изучения классаорганических соединений:
1.Определение
2.Общая формула
3.Строение
4.Гомологический ряд
5.Номенклатура
6.Изомерия
7.Физические свойства
8.Химические свойства
9.Получение
10.Применение
13.
Алкены✔непредельные
✔одну двойную С=С связь
✔общая формула СnH2n
14.
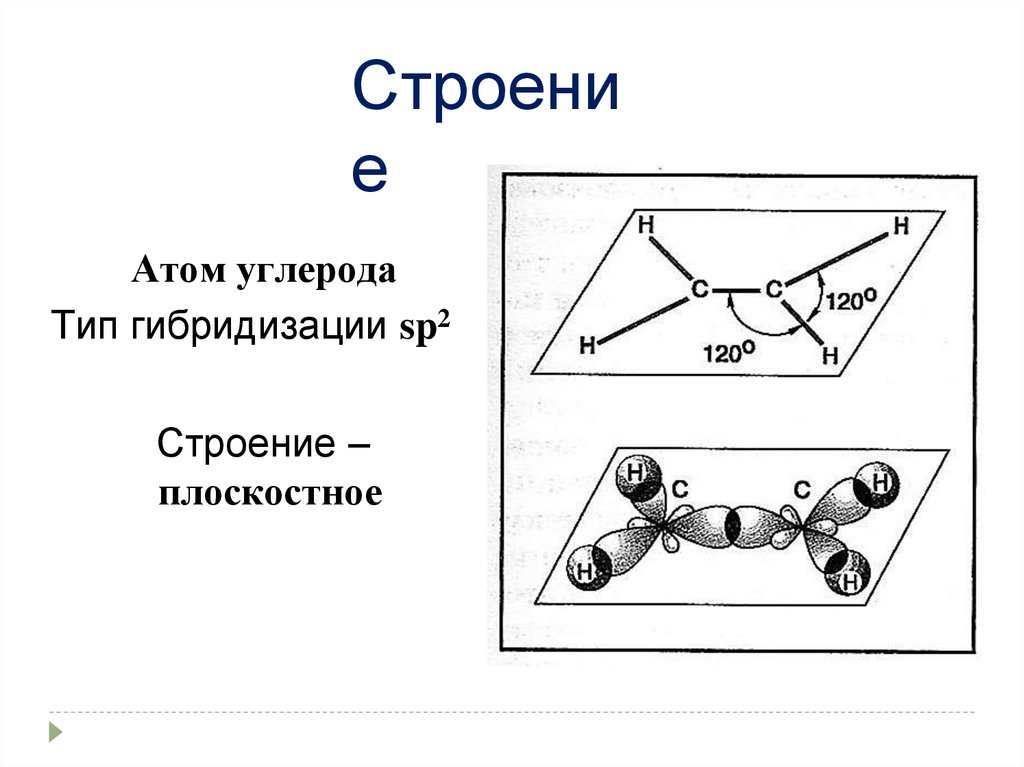
Строение
Атом углерода
Тип гибридизации sp2
Строение –
плоскостное
15.
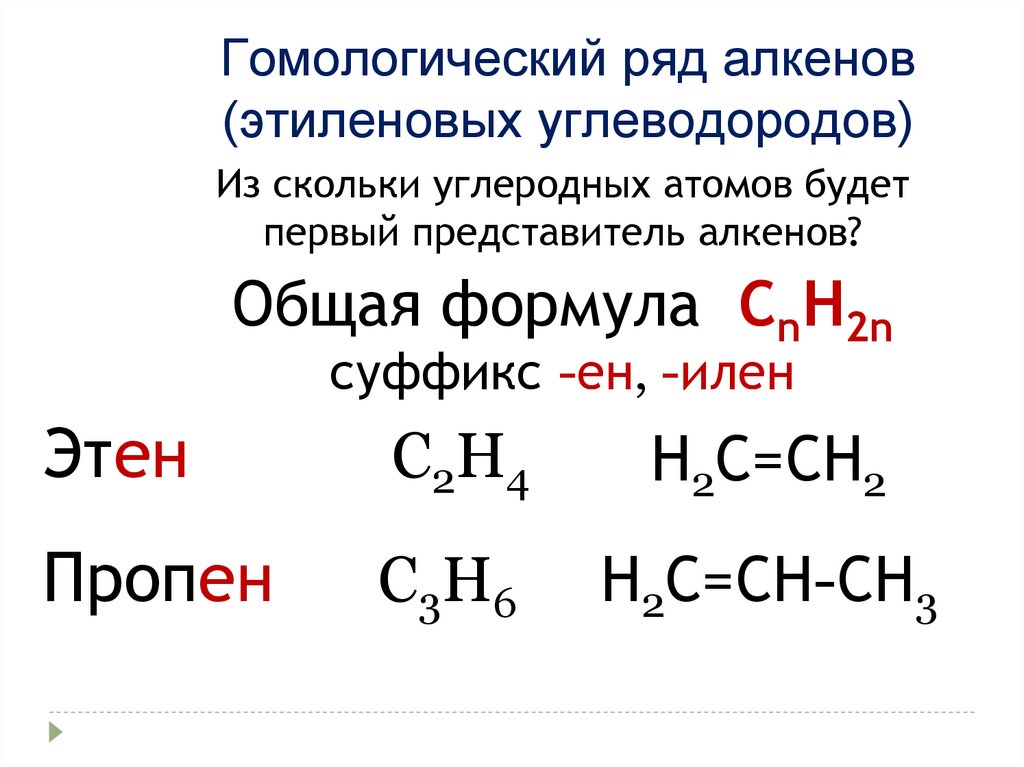
Гомологический ряд алкенов(этиленовых углеводородов)
Из скольки углеродных атомов будет
первый представитель алкенов?
Общая формула СnН2n
суффикс -ен, -илен
Этен
C2H4
Н2С=СН2
Пропен
C3H6
Н2С=СН-СН3
16.
1.Номенклатура
алкенов
Выбрать
главную углеродную цепь.
2. Пронумеровать атомы углерода( = связь
предпочтение).
3. Формируют название алкена от названия
соответствующего алкана, заменяя суффикс
–ан на –ен, цифрой указывается номер того
атома углерода, от которого начинается
двойная связь.
3- метилпентен-1
17.
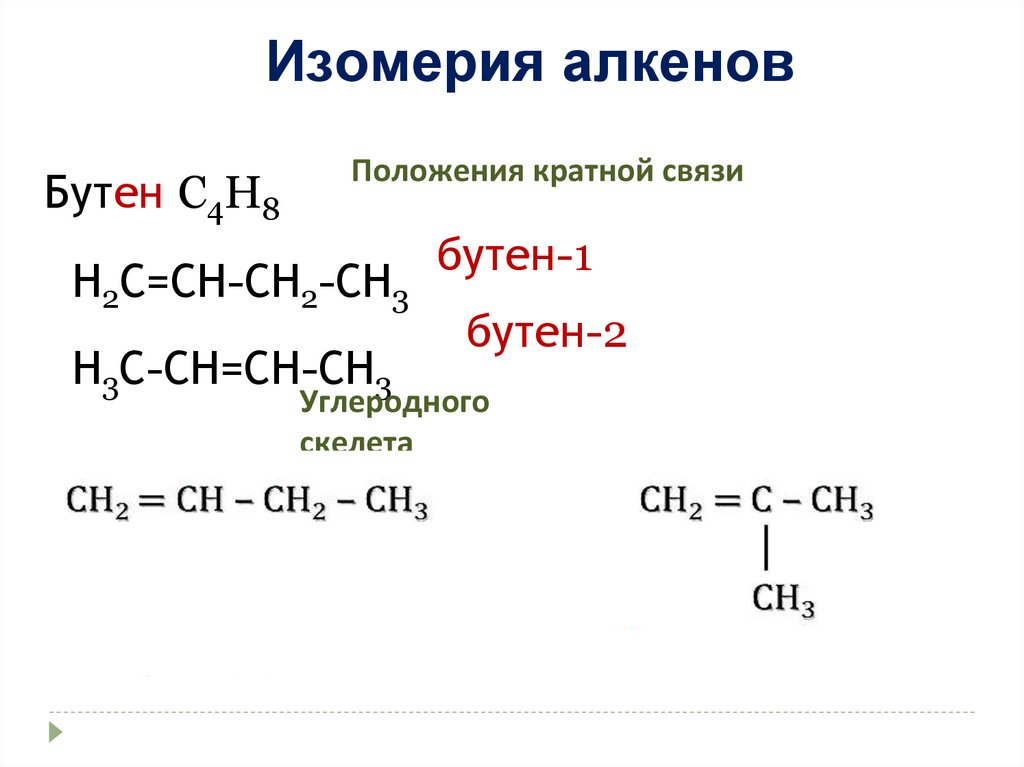
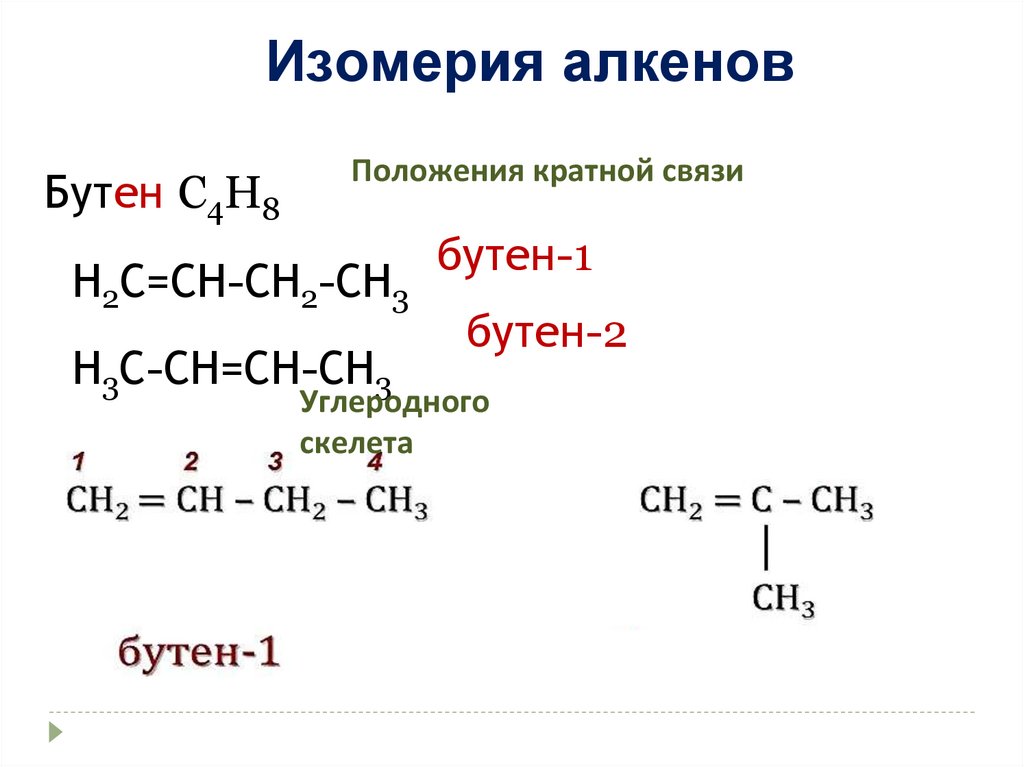
Изомерия алкеновБутен C4H8
Положения кратной связи
Н2С=СН-СН2-СН3
Н3С-СН=СН-СН3
бутен-1
бутен-2
Углеродного
скелета
18.
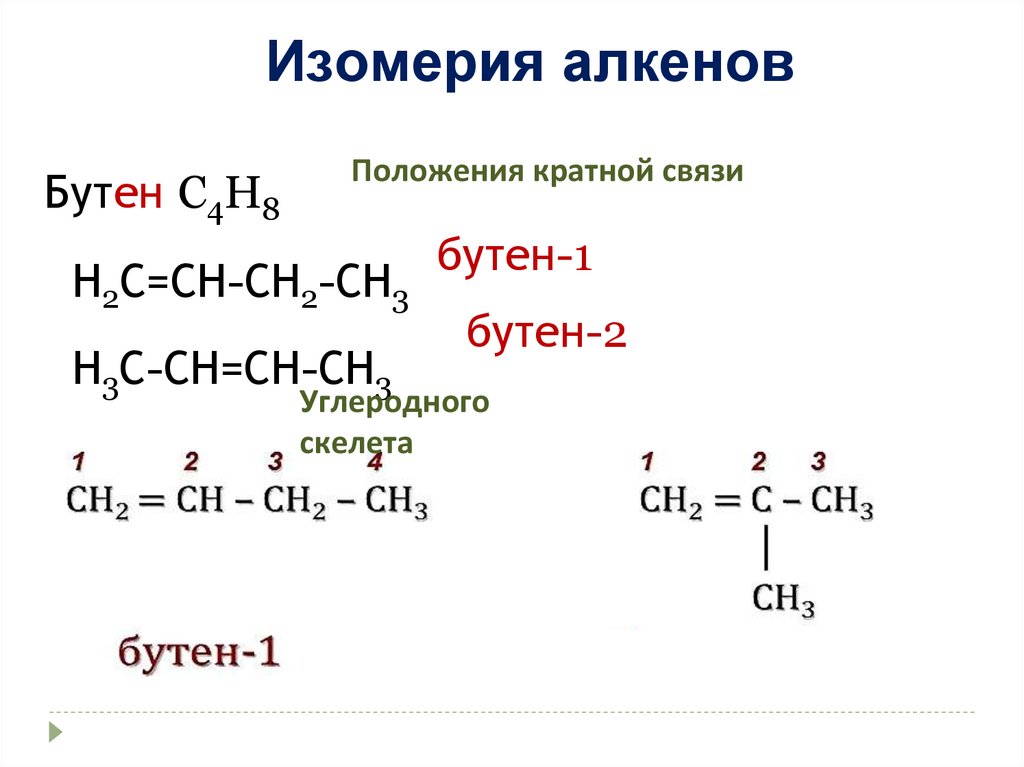
Изомерия алкеновБутен C4H8
Положения кратной связи
Н2С=СН-СН2-СН3
Н3С-СН=СН-СН3
бутен-1
бутен-2
Углеродного
скелета
19.
Изомерия алкеновБутен C4H8
Положения кратной связи
Н2С=СН-СН2-СН3
Н3С-СН=СН-СН3
бутен-1
бутен-2
Углеродного
скелета
20.
Изомерия алкеновБутен C4H8
Положения кратной связи
Н2С=СН-СН2-СН3
Н3С-СН=СН-СН3
бутен-1
бутен-2
Углеродного
скелета
21.
Изомерия алкеновБутен C4H8
Положения кратной связи
Н2С=СН-СН2-СН3
Н3С-СН=СН-СН3
бутен-1
бутен-2
Углеродного
скелета
22.
Физические свойстваэтилена
✔ без цвета
✔ без запаха
✔ нерастворим в воде
✔ ускоряет созревание плодов и
овощей
23.
Химические свойстваалкенов
Горение
С2Н4 + 3О2 → 2СО2 + 2Н2О
24.
Химические свойстваалкенов
Реакции присоединения
разрыва двойной связи):
а)
Гидрирование(+Н2)
(по месту
25.
Химические свойстваалкенов
б)Галогенирование (+Г2)
Это качественная реакция на алкены –
бромная вода Br2 (бурая жидкость)
обесцвечивается.
26.
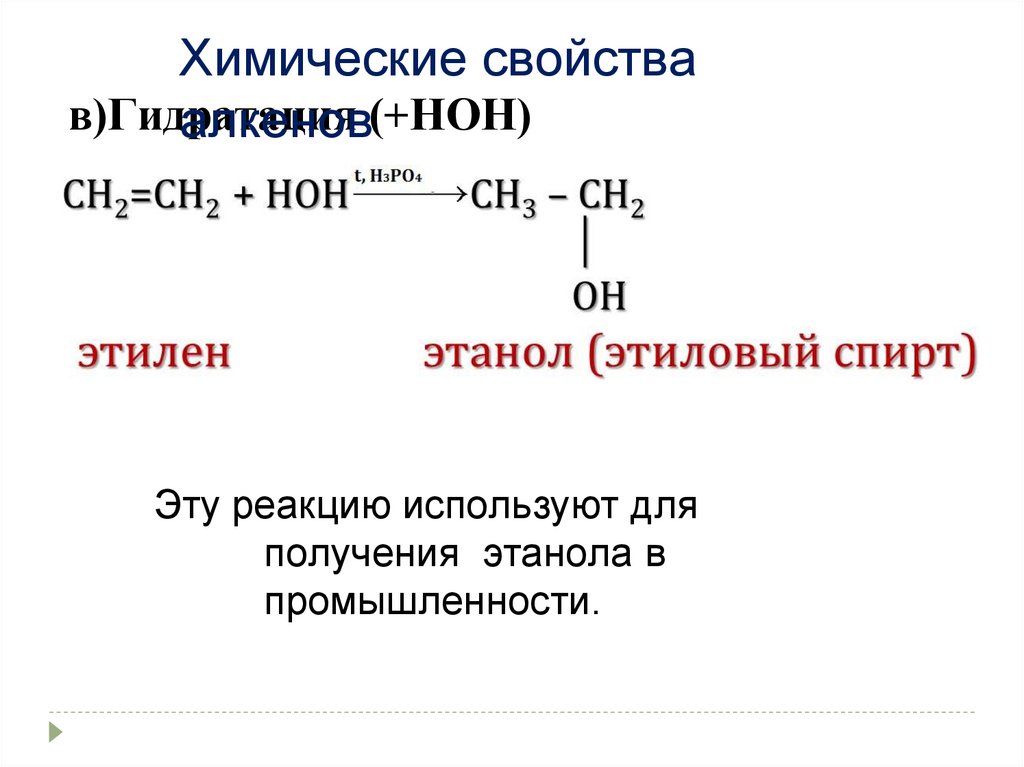
Химические свойствав)Гидратация
алкенов(+НОН)
Эту реакцию используют для
получения этанола в
промышленности.
27.
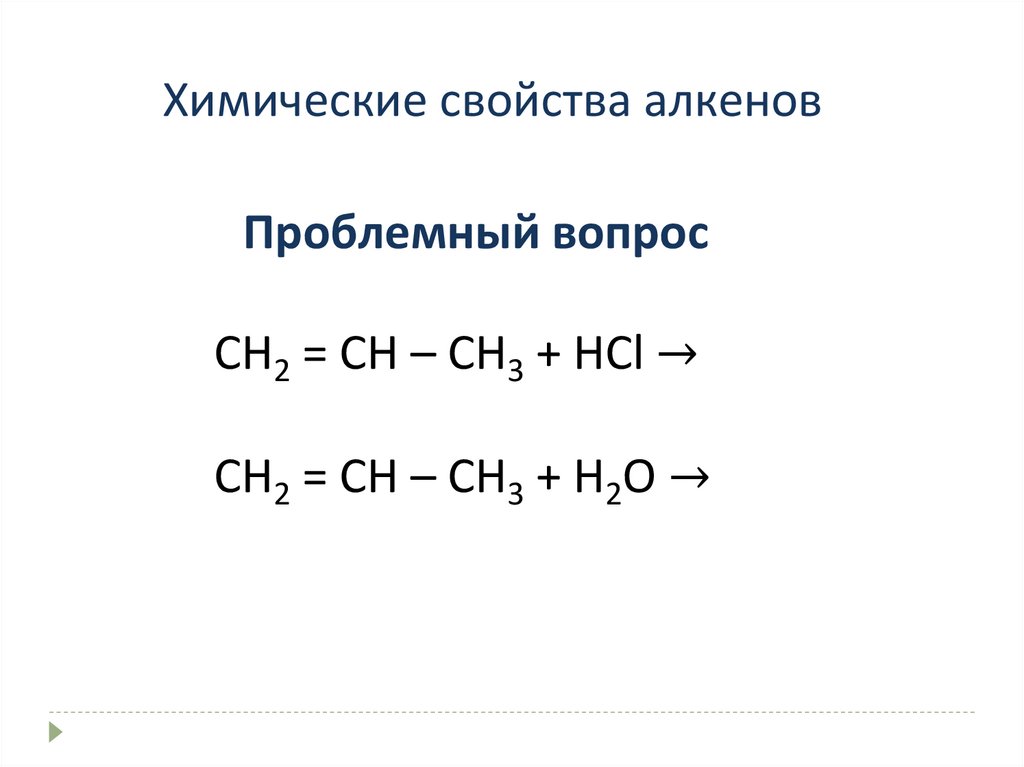
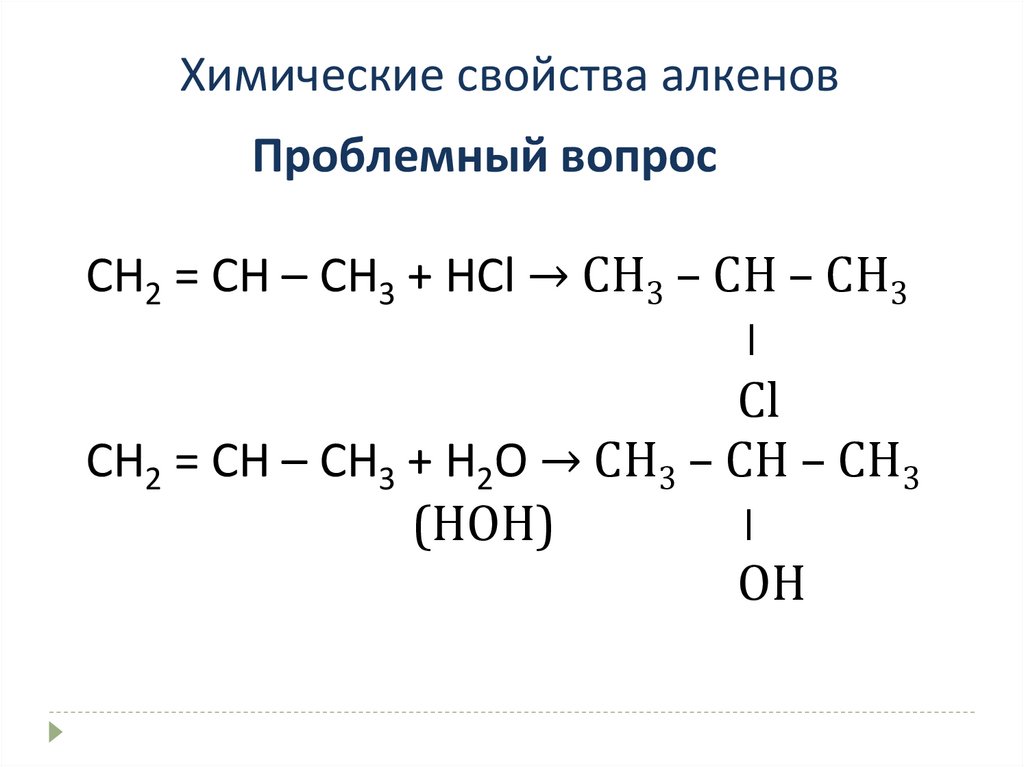
Химические свойства алкеновПроблемный вопрос
СН2 = СН – СН3 + НСl →
СН2 = СН – СН3 + Н2O →
28.
Химические свойства алкеновПроблемный вопрос
СН2 = СН – СН3 + НСl → СН3 – СН – СН3
⃓
Сl
СН2 = СН – СН3 + Н2O → СН3 – СН – СН3
(HOH)
⃓
OH
29.
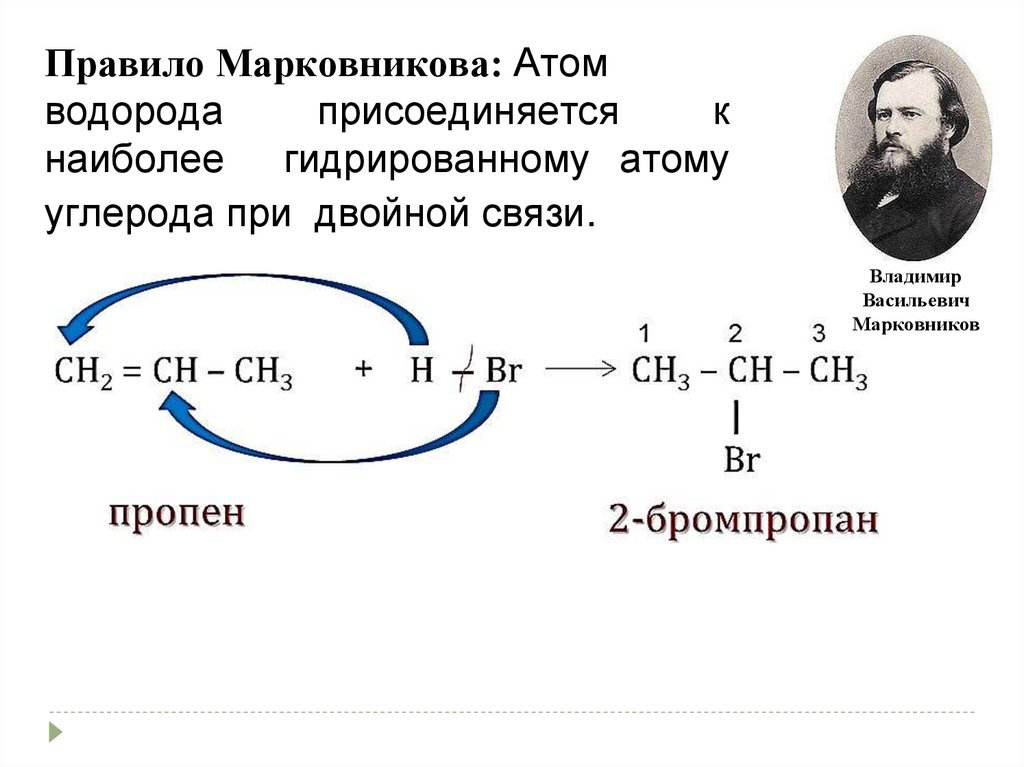
Правило Марковникова: Атомводорода
присоединяется
к
наиболее гидрированному атому
углерода при двойной связи.
Владимир
Васильевич
Марковников
30.
Химические свойстваалкенов
Полимеризация
n
степень
полимеризации
-СН2-СН2- структурное
звено
31.
32.
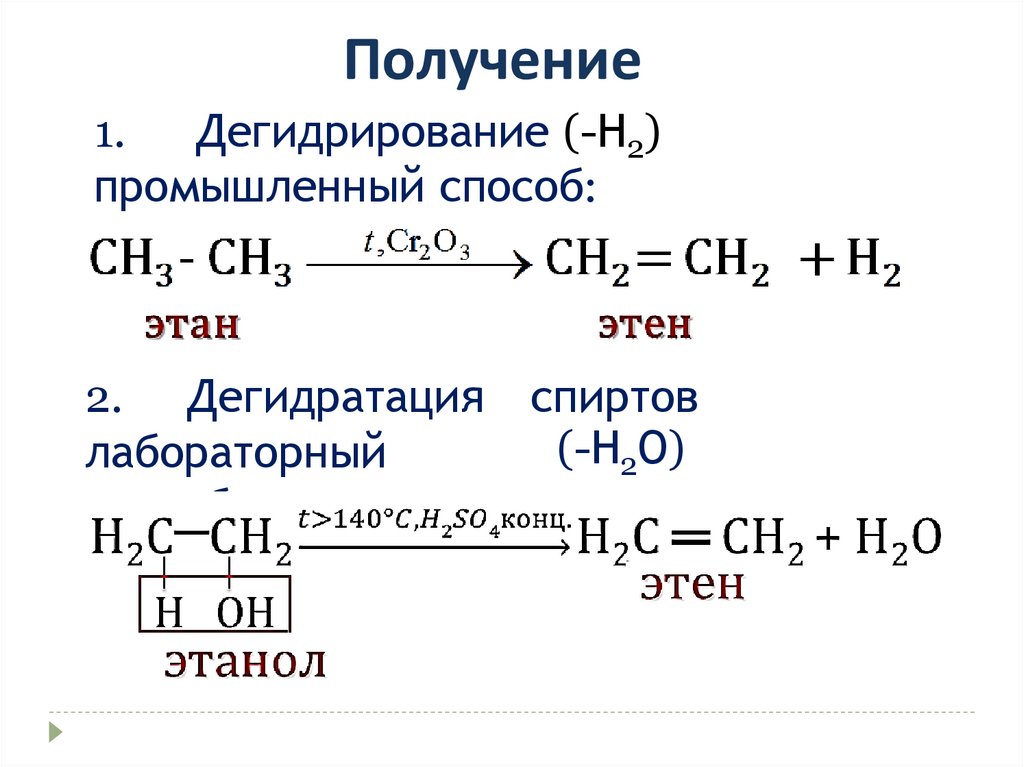
Получение1.
Дегидрирование (-Н2)
промышленный способ:
2. Дегидратация
лабораторный
способ:
спиртов
(-Н2О)
33.
План изучения классаорганических соединений:
1.Определение
2.Общая формула
3.Строение
4.Гомологический ряд
5.Номенклатура
6.Изомерия
7.Физические свойства
8.Химические свойства
9.Получение
10.Применение
34.
ЗакреплениеНапишите уравнения реакций, с помощью которых
можно осуществить следующие превращения:
Этан → этилен → этанол → этилен → 1,2 - дибромэтан



















 Химия
Химия








