Похожие презентации:
Биологическая химия-биохимия полости рта
1.
СЗГМУ им. И. И. МЕЧНИКОВАКАФЕДРА КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ,
БИОЛОГИЧЕСКОЙ И ОБЩЕЙ ХИМИИ им. В.В. СОКОЛОВСКОГО.
БИОЛОГИЧЕСКАЯ ХИМИЯ-БИОХИМИЯ ПОЛОСТИ РТА
Раздел V
ЛЕКЦИЯ
СТРОЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ.
БИОСИНТЕЗ БЕЛКА.
Доц. Антонова Ж.В., доц. Соколова М. Н.,
доц. Павлова Р.Н.
2023/2024
2.
План лекции1. Строение нуклеиновых кислот.
2. Основные типы РНК.
3. Гены. Экспрессия генов.
4. Генетический код, его характеристика.
5. Этапы биосинтеза белка: транскрипция мРНК, рРНК и тРНК
на матрице ДНК; посттранскрипционная модификация пре- РНК в
ядре; активация аминокислот в цитоплазме; трансляция белковой молекулы на
полисомах; посттрансляционная модификация белка.
6. Ингибиторы трансляции.
7. Посттрансляционная модификация белка
8. Регуляция экспрессии генов у эукариот
9. Молекулярные механизмы мутаций.
10. Система антимутагенной защиты. Ферменты репарации в ядре.
2
3.
Строение нуклеиновых кислотПоследовательность чередования мононуклеотидов
в полинуклеотидной цепи составляет
первичную структуру нуклеиновой кислоты.
Мононуклеотид содержит гетероциклическое азотистое
основание, пентозу (рибозу, дезоксирибозу) и остаток
фосфорной кислоты.
Нуклеиновые кислоты делятся на два типа в зависимости от
того, какой моносахарид входит в их состав.
Нуклеиновая кислота называется
рибонуклеиновой (РНК), если в ее состав входит рибоза,
или дезоксирибонуклеиновой (ДНК), если в ее состав
входит дезоксирибоза.
Азотистые основания делятся на пуриновые (аденин и
гуанин) и пиримидиновые (цитозин, тимин и урацил)
3
4.
Строение пуриновых азотистых основанийЛактамная форма
Лактимная форма
В состав нуклеиновых кислот входит лактамная форма гуанина
как более устойчивая
4
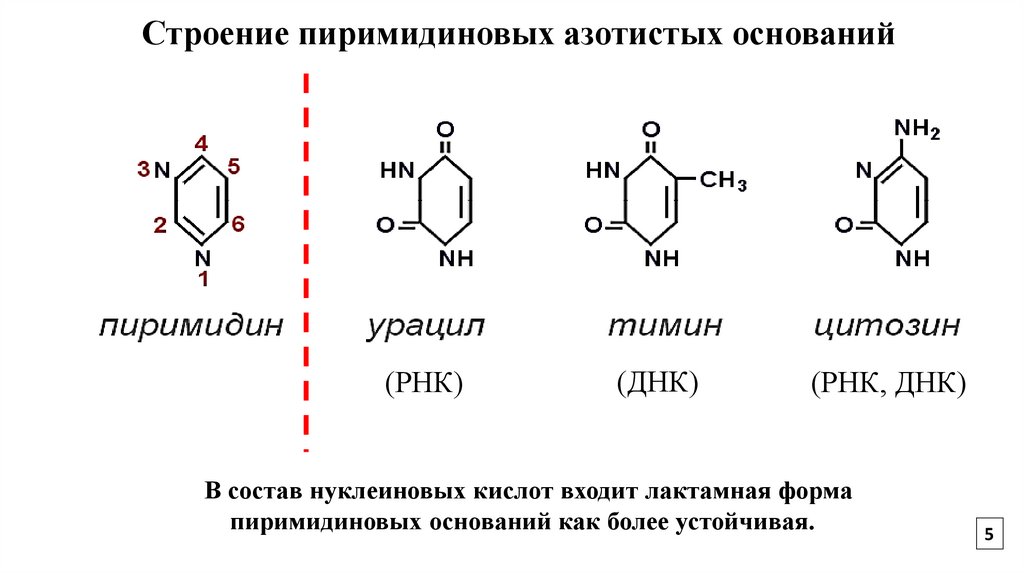
5.
Строение пиримидиновых азотистых оснований(РНК)
(ДНК)
(РНК, ДНК)
В состав нуклеиновых кислот входит лактамная форма
пиримидиновых оснований как более устойчивая.
5
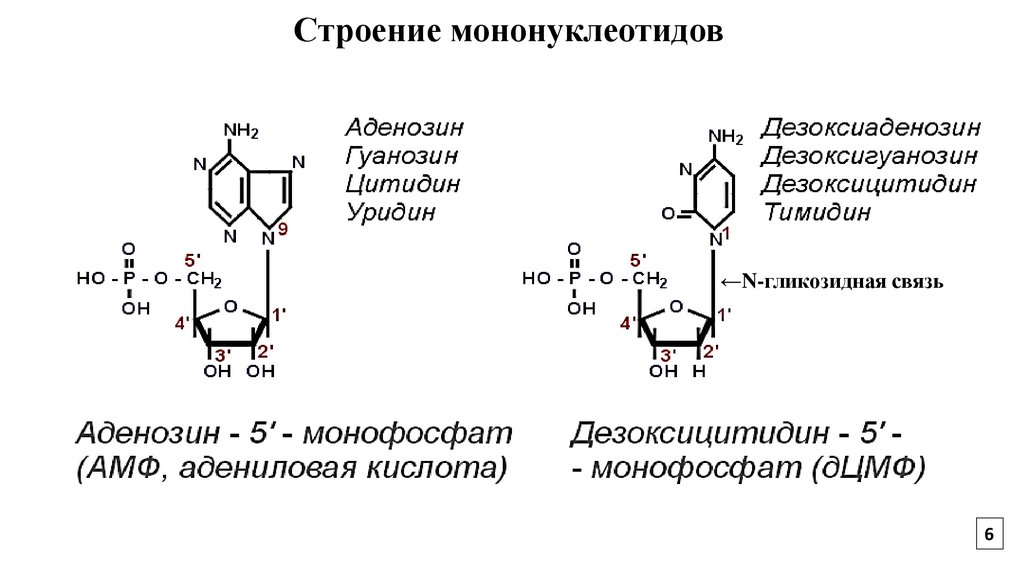
6.
Строение мононуклеотидов←N-гликозидная связь
6
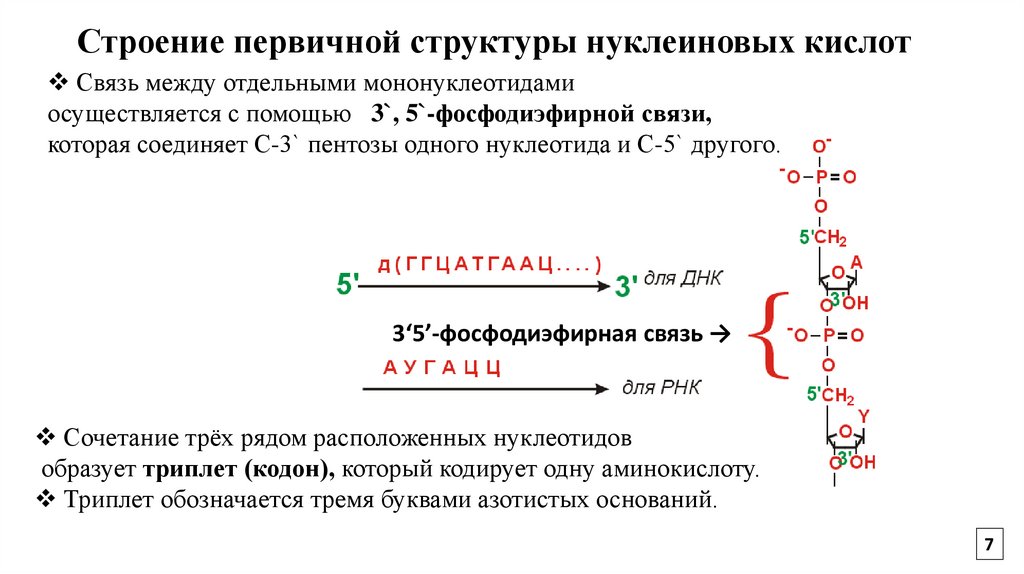
7.
Строение первичной структуры нуклеиновых кислотСвязь между отдельными мононуклеотидами
осуществляется с помощью 3`, 5`-фосфодиэфирной связи,
которая соединяет С-3` пентозы одного нуклеотида и С-5` другого.
3‘5’-фосфодиэфирная связь →
Сочетание трёх рядом расположенных нуклеотидов
образует триплет (кодон), который кодирует одну аминокислоту.
Триплет обозначается тремя буквами азотистых оснований.
7
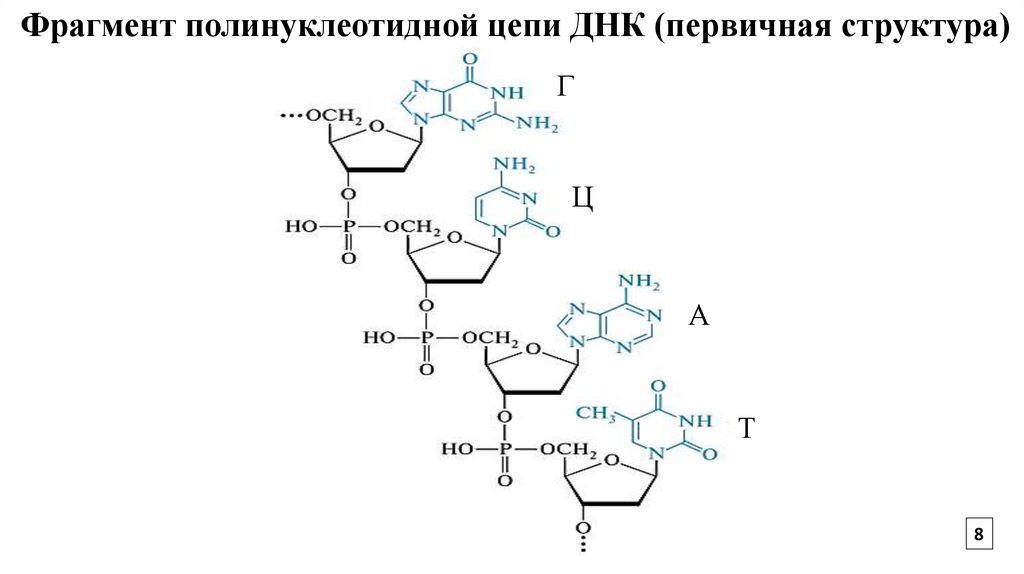
8.
Фрагмент полинуклеотидной цепи ДНК (первичная структура)Г
Ц
А
Т
8
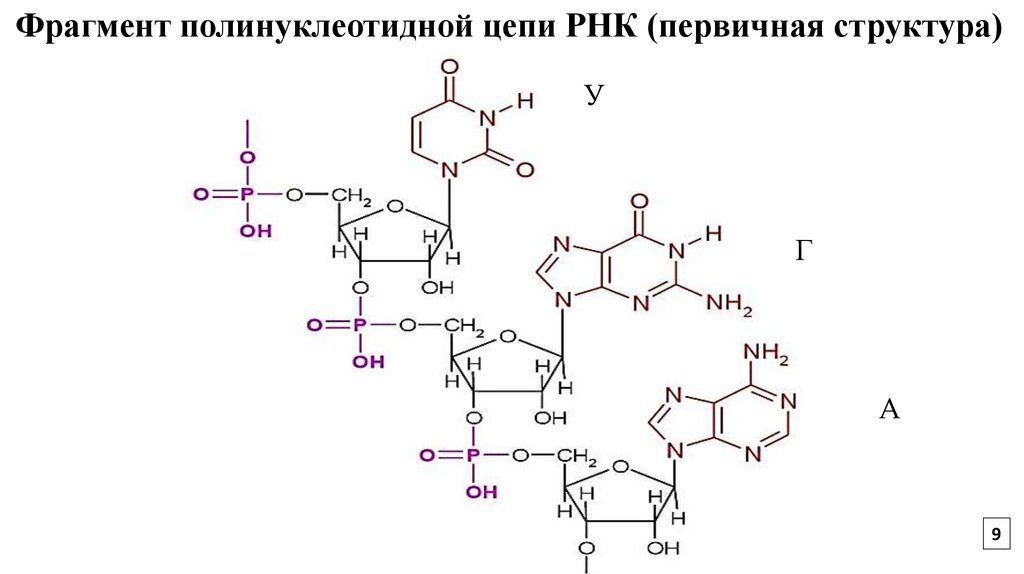
9.
Фрагмент полинуклеотидной цепи РНК (первичная структура)У
Г
А
9
10.
Джеймс Уотсон и Френсис Крик (1953 г.) предложили модельпространственной (2-й) структуры ДНК.
10
11.
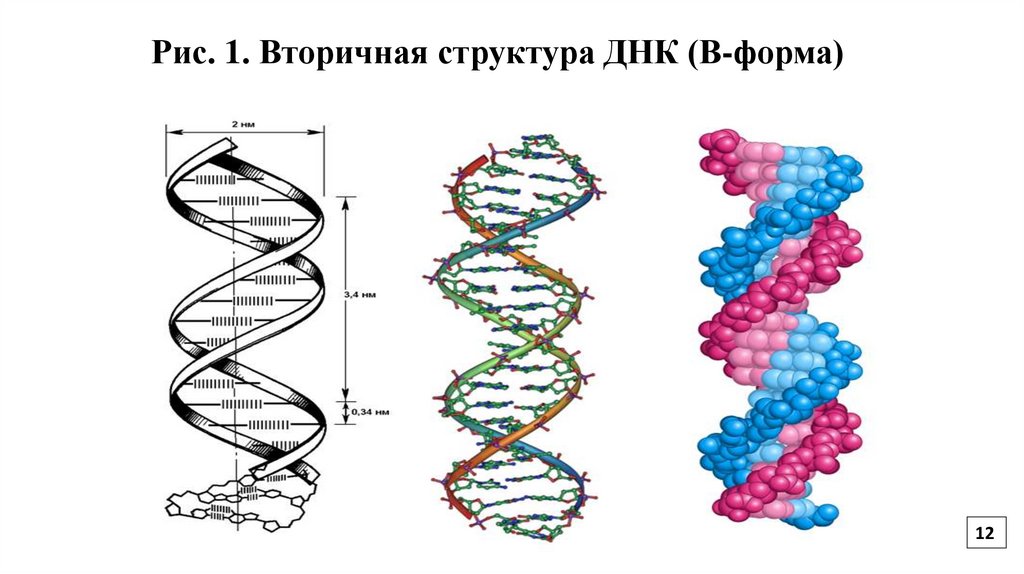
Вторичная структура ДНКСогласно модели Уотсона и Крика, молекула ДНК имеет форму спирали, образованную
двумя полинуклеотидными цепями, закрученными относительно друг друга и вокруг
общей оси (Рис.1).
Двойная спираль правозакрученная, полинуклеотидные цепи в ней антипараллельны
(Рис. 2). На каждом из концов молекулы ДНК расположены 5`- конец одной цепи и 3`конец другой цепи.
Все основания цепей ДНК расположены внутри двойной спирали, а пентозофосфатный
остов – снаружи. Между основаниями двухцепочечной молекулы в стопке возникают
гидрофобные взаимодействия (стекинг-взаимодействия), стабилизирующие двойную
спираль.
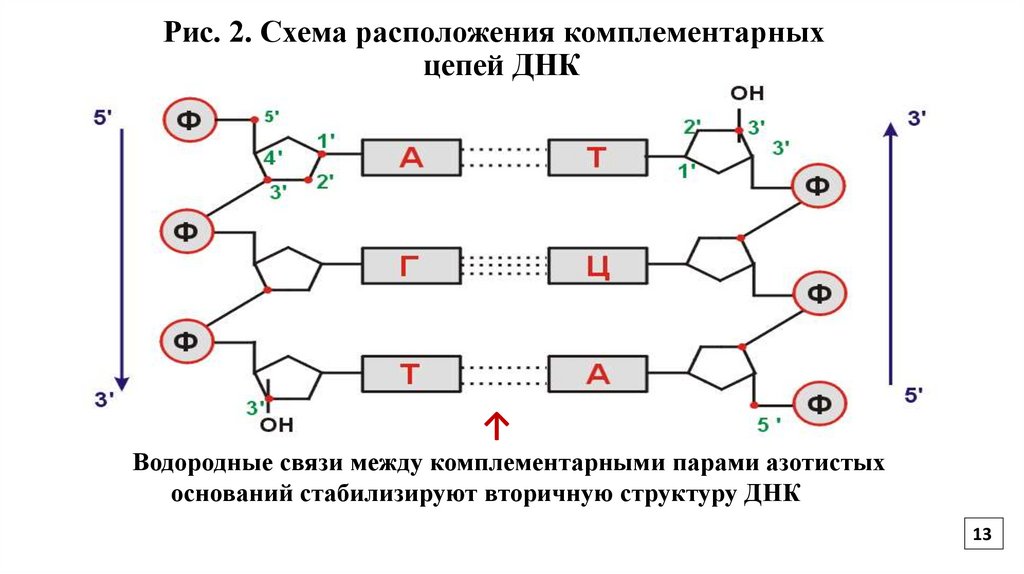
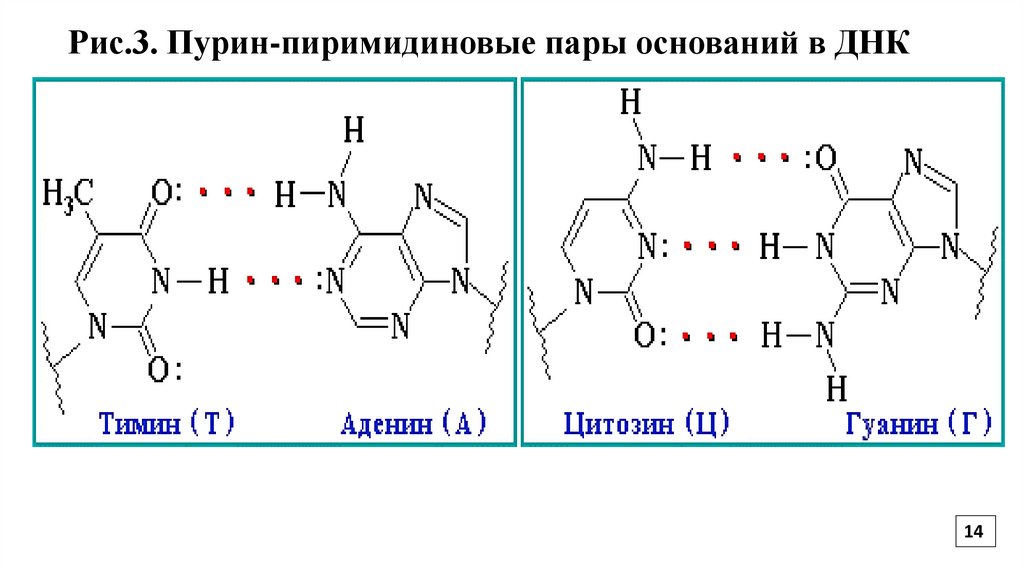
Полинуклеотидные цепи удерживаются относительно друг друга за счет
стабилизирующих водородных связей между комплементарными пуриновыми и
пиримидиновыми основаниями аденин-тимин, гуанин-цитозин (Рис.3)
Э. Чаргафф (1951 г.) установил закономерность в соотношении пуриновых и
пиримидиновых оснований в молекуле ДНК (правило Чаргаффа)
11
12.
Рис. 1. Вторичная структура ДНК (В-форма)12
13.
Рис. 2. Схема расположения комплементарныхцепей ДНК
↑
Водородные связи между комплементарными парами азотистых
оснований стабилизируют вторичную структуру ДНК
13
14.
Рис.3. Пурин-пиримидиновые пары оснований в ДНК14
15.
Правила Эрвина Чаргаффа (1951 г.)1. Количество пуриновых оснований равно количеству пиримидиновых
оснований
(А+Г = Ц+Т)
2. Количество аденина и цитозина равно количеству гуанина и тимина
( А+Ц = Г+Т)
3. Количество аденина равно количеству тимина, а количество гуанина
равно количеству цитозина (А=Т, Г=Ц)
4. Коэффициент специфичности
Г+ Ц / А+Т для эукариот – ниже единицы, для прокариот – выше
единицы
15
16.
Третичная структура ДНК - нуклеосомаВозникновение третичной структуры ДНК, обусловлено
необходимостью более плотной упаковки наследственного материала.
У эукариотов ДНК находится в составе хроматиновых волокон, которые
состоят из нуклеосом (Рис.4, 5).
Нуклеосома представляет собой комплекс, состоящий из дуплекса ДНК,
который дважды обвивает октамер из восьми молекул
низкомолекулярных белков- гистонов.
Выделяют 5 классов гистонов, которые различаются по соотношению
остатком лизина и аргинина: Н1 (Лиз » Арг); Н2А (Арг ≈ Лиз);
Н2В (Лиз >Арг); Н3 (Арг >Лиз); Н4 (Арг >Лиз).
В каждую нуклеосомную сердцевину («нуклеосомное ядро») входит по 2
молекулы Н2А, Н2В, Н3, Н4 гистонов.
16
17.
Третичная структура ДНК - нуклеосомаМолекулы Н1 гистона связываются с ДНК в межнуклеосомных
участках (линкерных последовательностях) и защищают эти участки
от действия нуклеаз.
Гистоны несут на своей поверхности значительный положительный
заряд, обусловленный наличием в пептидной цепочке до 30% остатков
лизина и аргинина.
Прочность комплекса гистонов с ДНК обусловлена возникновением
большого количества ионных связей между отрицательно
заряженными фосфатными группами в молекулах ДНК и
положительно заряженными молекулами гистонов.
17
18.
Рис. 4. Строение нуклеосом(30-40 пар нуклеотидов)
Отдельные
нуклеосомы
соединены м/у
собой линкерной
ДНК, с которой
связан гистон Н1.
Восемь молекул
гистонов (Н2А, Н2В,
Н3, Н4) образуют
ядро нуклеосомы,
вокруг которого ДНК
делает примерно 1,75
витка.
18
19.
Рис. 5. Схема упаковки молекул ДНК в хроматинеЦепочки из
нуклеосом
сворачиваются в
фибрилы (d=30 нм)
Упаковка фибрилл
приводит к
образованию нитей
хроматина.
Различают участки
гетеро - и
эухроматина
19
20.
Структура РНКПервичная структура РНК- чередование рибонуклеозидмонофосфатов в
полинуклеотидной цепи.
Вторичная структура РНК. Молекула построена из одной
полинуклеотидной цепи. Отдельные участки цепи РНК образуют петли –
«шпильки» за счет водородных связей между комплементарными
азотистыми основаниями А-У и Г-Ц (Рис.6.). Участки цепи РНК в таких
спиральных структурах антипараллельны, но не всегда полностью
комплементарны, в них встречаются неспаренные нуклеотидные остатки
или даже одноцепочечные петли, не вписывающиеся в двойную спираль.
Наличие спирализованных участков характерно для всех типовРНК (Рис.7).
Рис. 6.
20
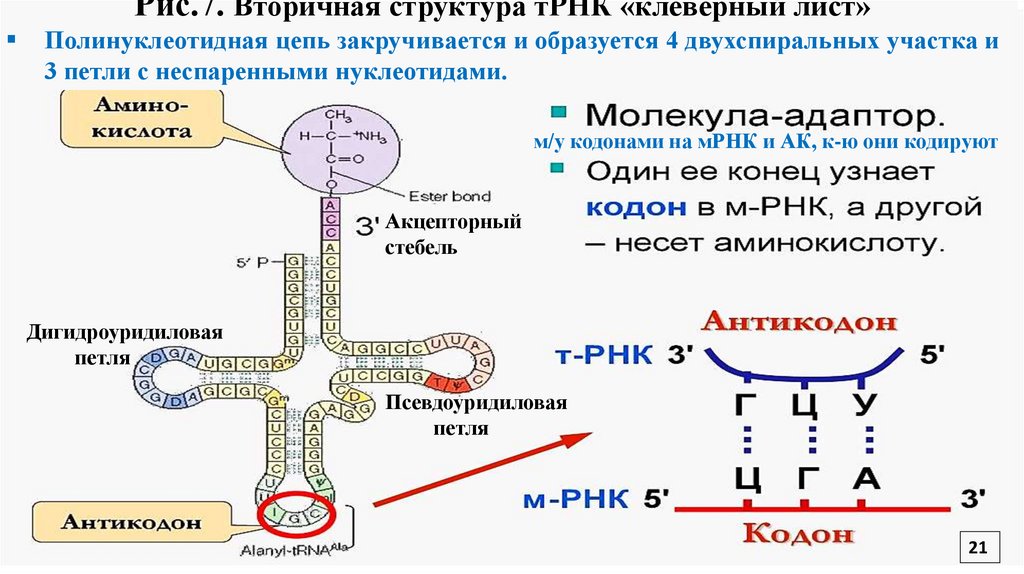
21.
Рис.7. Вторичная структура тРНК «клеверный лист»Полинуклеотидная цепь закручивается и образуется 4 двухспиральных участка и
3 петли с неспаренными нуклеотидами.
м/у кодонами на мРНК и АК, к-ю они кодируют
Акцепторный
стебель
Дигидроуридиловая
петля
Псевдоуридиловая
петля
21
22.
Третичная структура РНКОбразуется на основе элементов вторичной структуры с
помощью водородных связей внутри молекулы.
Спирали и неспаренные участки строго определенно
располагаются друг относительно друга в пространстве, образуя
так называемые третичные взаимодействия (Рис. 8).
Третичная структура РНК может быть стабилизирована ионами
двухвалентных металлов, например ионами магния,
связывающимися не только с фосфатными группами, но и с
основаниями.
Третичная структура тРНК образуется путем сближения
отдельных ветвей «клеверного листа» за счет дополнительных
водородных связей и стэкинг-взаимодействий с образованием
L-образной структуры («локтевого сгиба») (Рис.8)
22
23.
Рис. 8. Третичная структура тРНК (L-форма)(Псевдоуридиловая
петля)
Дигидроуридиловая
петля/ветвь – отвечает за
связывание с аминоацилтРНК-синтетазой.
Псевдоуридиловая
петля/ветвь отвечает за
связывание с рибосомой.
Антикодоновая петля/ветвь
связывается с кодоном на
мРНК.
Акцепторная ветвь –
связывает аминокислоту.
23
24.
Основные типы РНКВ цитоплазме клеток есть 3 типа РНК. Они различаются по первичной
структуре, молекулярной массе, конформации, продолжительности
жизни, функциональной активности.
м РНК (и РНК)- матричная, информационная, отвечает за перенос
информации о первичной структуре белков от ДНК к месту синтеза
белка (на рибосомах);
т РНК - транспортная, осуществляет транспорт аминокислот к месту
синтеза белка и участвует в наращивании полипептидной цепи.
р РНК – рибосомальная, необходима для сборки и функционирования
рибосом.
24
25.
Гены.Наследственная информация, закрепленная в молекуле
ДНК, разбита на гены.
Ген - это участок ДНК, который кодирует синтез одного
полипептида.
Гены, кодирующие полипептиды и РНК, называют
структурными генами.
Регуляторные гены участвуют в регуляции передачи
генетической информации.
25
26.
Экспрессия генов.(проявление генетической информации в форме
фенотипических признаков) осуществляется в два этапа.
Сначала в ходе транскрипции переписывается информация с
матрицы ДНК на матрицу РНК.
А затем информация транслируется (считывается) в виде
специфической последовательности аминокислот в
полипептидной цепи.
ДНК
транскрипция
РНК
трансляция
белок
Передача генетической информации осуществляется с
помощью генетического кода.
26
27.
Генетический кодЭто последовательность расположения кодонов (триплетов) в молекуле
ДНК, кодирующих последовательность аминокислот в белке
Характеристика генетического кода
1. Триплетный – аминокислоты кодируются триплетами. (всего 64 триплета,
АУГ – инициирующий триплет, определяет начало синтеза белка, кодирует
аминокислоту метионин; УАА, УАГ, УГА – терминирующие триплеты, не
кодируют аминокислот, указывают окончание трансляции)
2. Вырожденный – одна аминокислота может кодироваться несколькими
триплетами.
3. Универсальный – аминокислоты кодируются одними и теми же триплетами у
всех эукариот.
4. Специфический – триплет кодирует одну аминокислоту.
5. Линейный – считывание информации происходит по триплетам непрерывно.
6. Неперекрываемый – одно и то же азотистое основание цепи мРНК не может
одновременно входить в два триплета
27
28.
Этапы биосинтеза белка1. Транскрипция мРНК, рРНК и тРНК
на матрице ДНК.
2. Посттранскрипционная модификация
пре- РНК в ядре (посттрансляционный процессинг)
3. Активация аминокислот в цитоплазме.
4. Трансляция белковой молекулы на
полисомах.
5. Посттрансляционная модификация белка.
28
29.
1.ТранскрипцияТранскрипция – синтез пре-РНК на матрице ДНК в ядре.
Ферменты транскрипции - ДНК-зависимые-РНК-полимеразы
РНК-полимераза I - катализирует матричный синтез
предшественников р-РНК
РНК-полимераза II – пре-м-РНК
РНК-полимераза III – пре-т-РНК
Этапы транскрипции
• Инициация
• Элонгация
• Терминация
29
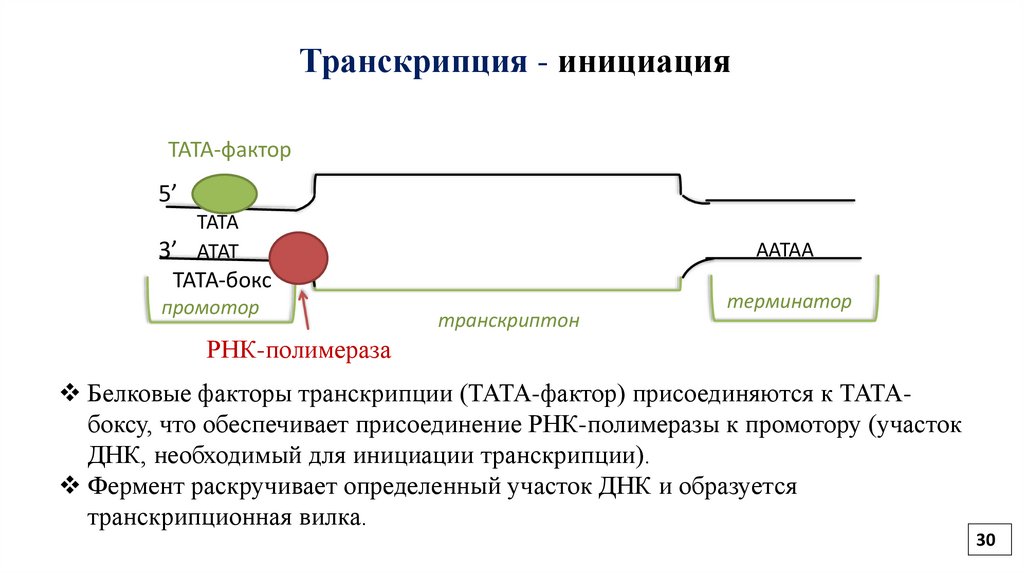
30.
Транскрипция - инициацияТАТА-фактор
5’
ТАТА
3’ АТАТ
ААТАА
ТАТА-бокс
промотор
транскриптон
терминатор
РНК-полимераза
Белковые факторы транскрипции (ТАТА-фактор) присоединяются к ТАТАбоксу, что обеспечивает присоединение РНК-полимеразы к промотору (участок
ДНК, необходимый для инициации транскрипции).
Фермент раскручивает определенный участок ДНК и образуется
транскрипционная вилка.
30
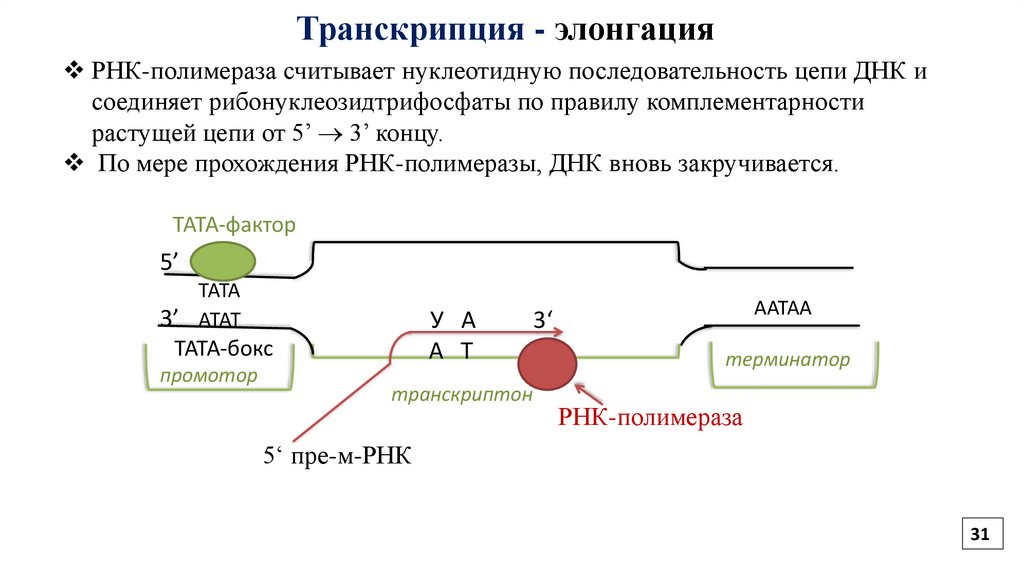
31.
Транскрипция - элонгацияРНК-полимераза считывает нуклеотидную последовательность цепи ДНК и
соединяет рибонуклеозидтрифосфаты по правилу комплементарности
растущей цепи от 5’ 3’ концу.
По мере прохождения РНК-полимеразы, ДНК вновь закручивается.
ТАТА-фактор
5’
ТАТА
3’ АТАТ
У А
А Т
ТАТА-бокс
промотор
транскриптон
ААТАА
3‘
терминатор
РНК-полимераза
5‘ пре-м-РНК
31
32.
Транскрипция - терминацияРНК-полимераза движется вдоль цепи ДНК до сайта терминации .
Факторы терминации облегчают отделение пре-РНК и РНК-полимеразы от
матрицы ДНК.
ТАТА-фактор
5’
ТАТА
3’ АТАТ
ТАТА-бокс
промотор
У А
А Т
3‘
транскриптон
ААТАА
терминатор
РНК-полимераза
5‘ пре-м-РНК
30
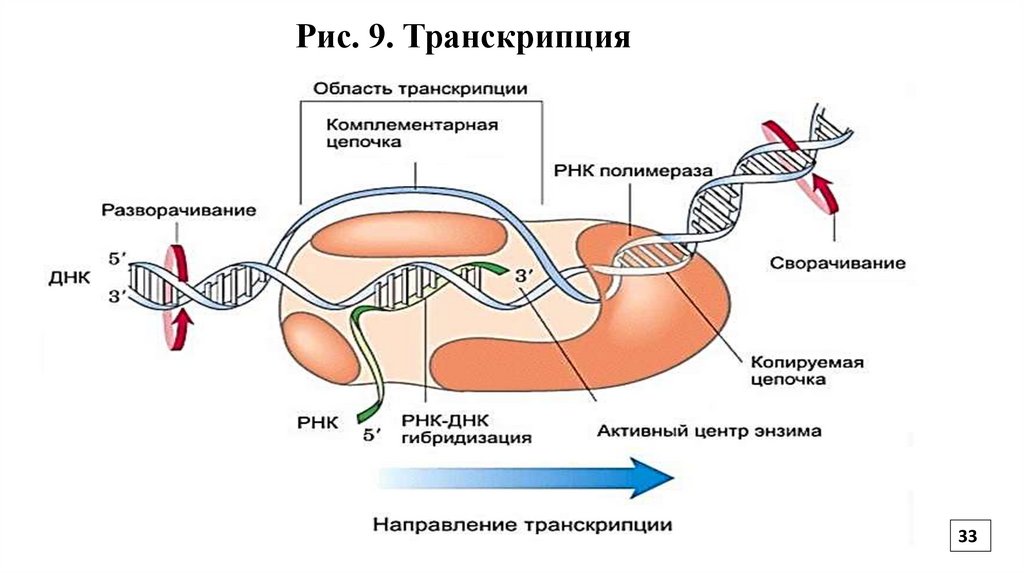
33.
Рис. 9. Транскрипция33
34.
Ингибиторы транскрипции▪ Актиномицин Д, акридин, бензпирен и др. способны
интеркалировать (встраиваться между азотистыми основаниями) в
двойную спираль ДНК, что нарушает работу РНК-полимеразы.
▪ Антибиотик рифампицин специфически ингибирует
прокариотическую (бактериальную) РНК-полимеразу. Рифампицин
применяется при лечении туберкулеза.
▪ 1- аманитин, токсин бледной поганки ингибирует
РНК-полимеразу II эукариот, и блокирует синтез белка.
34
35.
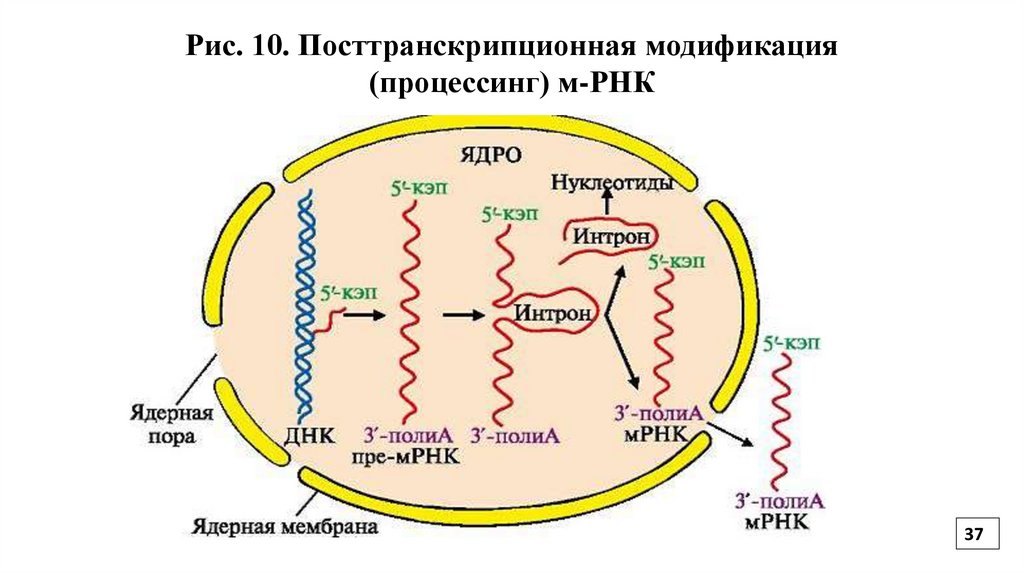
2.Посттранскрипционная модификация м-РНК включает1.Отрезание "лишних" концевых последовательностей.
2. "Вырезание" участков транскрибированных с интронов и сшивание
экзонов (информативных последовательностей) в ходе сплайсинга (Рис.10).
3. Присоединение к 5` концу КЭПа.
Роль КЭПа
а) защита от действия экзонуклеаз
б) обеспечивает инициацию трансляции (узнавание малой субъединицы рибосомы)
4. Присоединение к 3`концу полиаденилового фрагмента
(20-250 остатков АМФ).
Роль полиА
а) защита от действия экзонуклеаз
б) переход м-РНК из ядра в цитоплазму
в) отвечает за количество копий белка с данной м-РНК
5. Модификация оснований в транскрипте.
35
36.
м-РНК (2%)Эукариоты – моноцистронная м-РНК
5` КЭП
АУГ
УГА
поли А 3`
УАА
АААААА
УАГ
(20-250 остатков АМФ)
цистрон
(цистрон -участок мРНК-последовательность триплетов, содержащий информацию
о первичной структуре белка)
Роль посттранскрипционной модификации – образуется зрелая мРНК, которая служит матрицей для синтеза белка
36
37.
Рис. 10. Посттранскрипционная модификация(процессинг) м-РНК
37
38.
Посттранскрипционная модификация т-РНК включает:1. Отрезание "лишних" концевых последовательностей.
2. Сплайсинг, в ходе которого образуется антикодон,
обеспечивает взаимодействие т-РНК с кодоном м-РНК по
правилу комплементарности и специфичность аминокислоты в
ходе трансляции (Рис.11).
3. Присоединение к 3`концу ССА- триплета, к которому
присоединяется соответствующая аминокислота
4. Модификация азотистых оснований в транскрипте (10-15%).
Роль посттранскрипционных модификаций – образуется тРНК, которая участвует в переносе активированных
аминокислот к рибосоме в ходе трансляции.
38
39.
Рис. 11. Процессинг тРНК39
40.
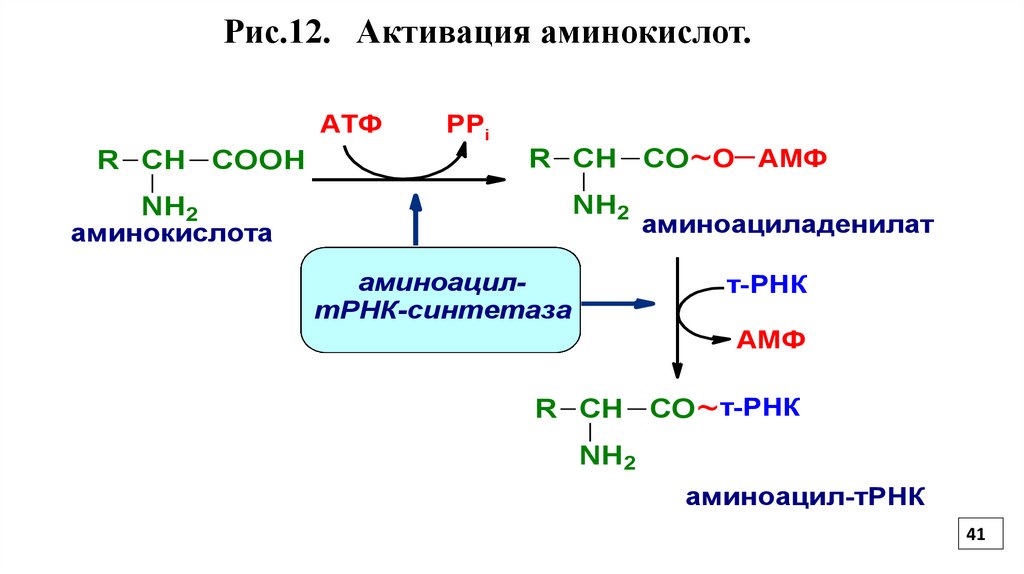
3.Активизация аминокислот, или образованиеаминоацил-тРНК протекает в цитозоле.
Аминокислоты активируются ферментами аминоацил-тРНКсинтетазами (Рис.12).
Каждый фермент имеет 4 специфических участка
С первым участком связывается аминокислота
Со вторым - соответствующая ей тРНК
С третьим участком - кофермент- молекула АТФ
С четвертым - молекула воды
Первые два участка служат для распознавания и связывания
субстратов
Третий - для катализа
Четвертый - для исправления ошибок
40
41.
Рис.12. Активация аминокислот.АТФ
R СН
COOH
РPi
R СН
NH2
NH2
аминокислота
аминоацилтРНК-синтетаза
CO ~О АМФ
аминоациладенилат
т-РНК
АМФ
R СН
CO ~ т-РНК
NH2
аминоацил-тРНК
41
42.
4.ТрансляцияЭто перевод информации нуклеотидной
последовательности в аминокислотную
последовательность, т.е. синтез белка на
матрице РНК.
Процесс трансляции включает стадии
• инициации
• элонгации
• терминации
42
43.
Трасляция- инициацияиз отдельных компонентов собирается аппарат для
синтеза белка и протекают подготовительные реакции.
Для этого процесса необходимо
наличие мРНК, ГТФ, ионов Mg2+, рибосомных
субчастиц (малой и большой), трех факторов
инициации белковой природы и, наконец, метионил-тРНК.
Инициирующим кодоном является АУГ, с ним связывается
метионил-тРНК, находящийся в пептидильном участке
рибосомы.
43
44.
Трансляция - элонгацияПроцесс, в ходе которого
различные аминоацил-тРНК, комплементарные очередному
кодону, встраиваются в аминоацильный участок
с помощью рибосомной пептидилтрансферазы происходит
образование пептидной связи между аминокислотами, находящимися
в пептидильном и аминоацильном участке
а с помощью транслоказы мРНК передвигается на один кодон
процесс повторяется многократно и требует затраты 2-х молекул
ГТФ на каждую аминокислоту
необходим также полный набор аминоацил-тРНК, ионов Mg 2+и двух
факторов элонгации (Рис. 13).
44
45.
Рис.13.45
46.
Трансляция –терминация (окончание синтеза белка)Для терминации и освобождения полипептидной цепи
требуется факторы терминации (Рис.14).
Терминирующими кодонами мРНК являются УАА, УАГ,
УГА.
В А-участке появляется терминирующий кодон, к которому
присоединяются белковые факторы терминации и при
участии пептидилтрансферазы происходит гидролитическое
отщепление синтезированного полипептида, т-РНК,
диссоциация субъединиц рибосомы.
46
47.
Рис.1447
48.
Ингибиторы трансляцииАнтибиотики
▪ Тетрациклин - блокирует связывание аминоацил-тРНК с акцепторным
участком рибосомо-матричного комплекса.
▪ Хлорамфеникол - ингибирует пептидилтрансферазную реакцию
▪ Стрептомицин – связывается с 30S субъединицей рибосомы,
ингибирует инициацию синтеза пептидной цепи
▪ Эритромицин – присоединяется к 50S субъединице рибосомы,
останавливает процесс наращивания пептидной цепи, нарушает
транслокацию.
Токсины
Бактериальный дифтерийный токсин – связывает фактор элоргации EF2, блокирует транслокацию рибосом.
Рицин-токсин клещевины обыкновенной способствует удалению аденина
из одной из рРНК эукариот, что вызывает инактивацию большой
субчастицы рибосом.
48
49.
Посттрансляционная модификация белка1. Включает модификацию N и C-концов, удаление сигнальных
последовательностей.
2. Аминокислотные радикалы гидроксилируются (пролин, лизин в
коллагене), фосфорилируются (ОН-группы серина, треонина),
карбоксилируются (глутамат), метилируются, гликозилируются.
3. В состав сложных белков включаются кофакторы, коферменты и
простетические группы.
4. Формирование вторичной, третичной и четвертичной структуры
белка.
49
50.
Уровни регуляции экспрессии генов у эукариот• Претранскрипционный
• Транскрипционный
• Посттранскрипционный
• Трансляционный
• Посттрансляционный
50
51.
Претранскрипционный уровеньОрганизация хроматина:
1) участки гетерохроматина ДНК упакованы очень компактно за счет
метилирования дезоксицитидина и связывания ДНК с гистонами и
недоступны для транскрипции;
2) участки эухроматина (1% от всей ДНК) связаны с гистонами, у
которых ɛ-аминогруппа лизина метилирована или ацетилирована, что
снижает суммарный положительный заряд гистонов и сродство к ДНК,
таким образом участки эухроматина имеют рыхлую укладку и
способны связывать РНК-полимеразу и транскрибируются.
Амплификация – увеличение копий генов при определённых
условиях (при повышении концентрации тяжелых металлов в крови).
51
52.
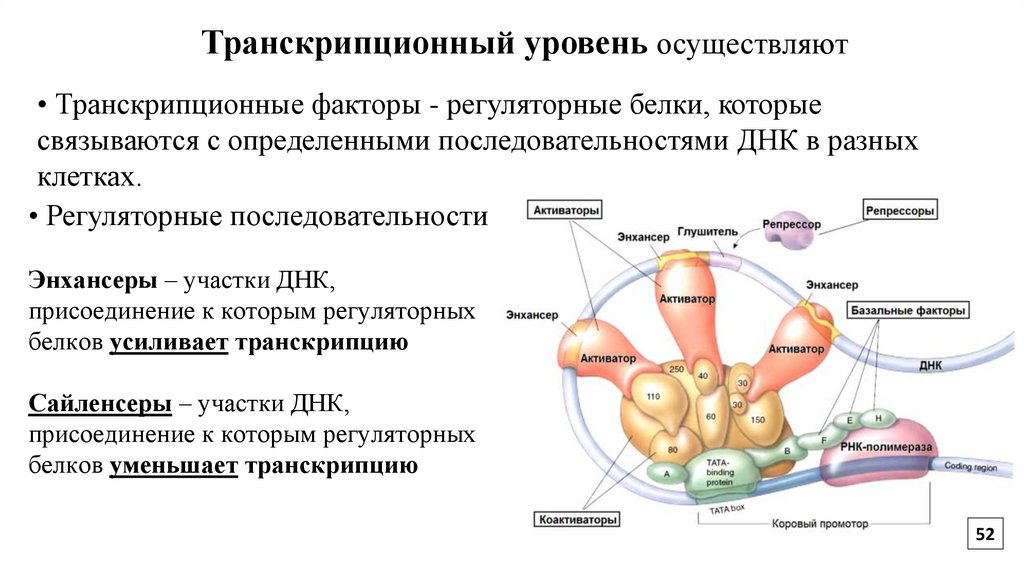
Транскрипционный уровень осуществляют• Транскрипционные факторы - регуляторные белки, которые
связываются с определенными последовательностями ДНК в разных
клетках.
• Регуляторные последовательности
Энхансеры – участки ДНК,
присоединение к которым регуляторных
белков усиливает транскрипцию
Сайленсеры – участки ДНК,
присоединение к которым регуляторных
белков уменьшает транскрипцию
52
53.
Транскрипционный уровень53
54.
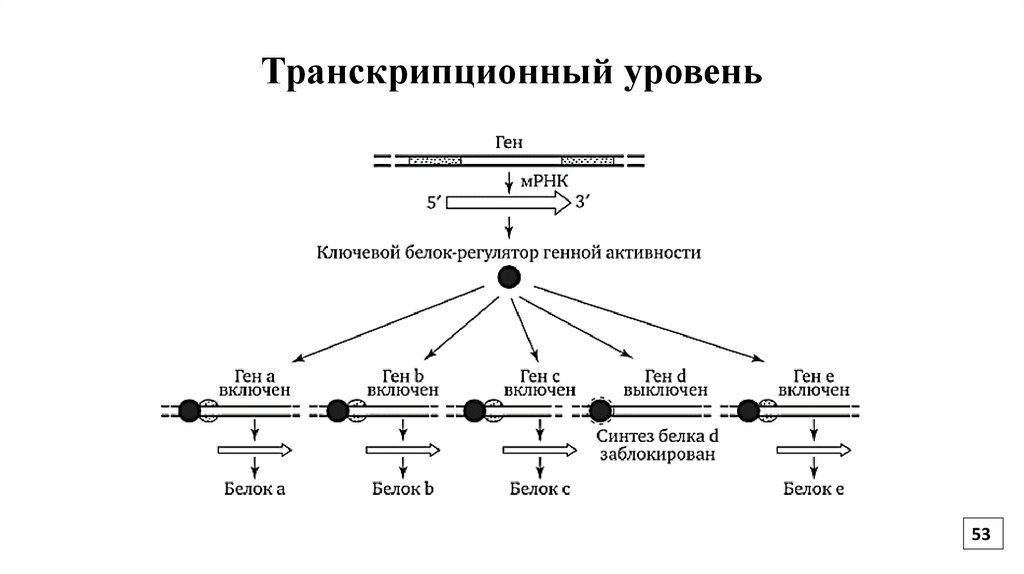
Транскрипционный уровеньПрисоединение регуляторных белков с ДНК (рядом с промотором)
может вызвать либо транскрипцию расположенного рядом гена
(позитивная регуляция), либо подавить её (негативная регуляция).
Группы генов содержат регуляторные участки ДНК – cis-элементы,
к которым присоединяются индукторы или регуляторные белки и
активируют транскрипцию. Такая группа координированно
экспрессируемых генов формирует генную сеть.
54
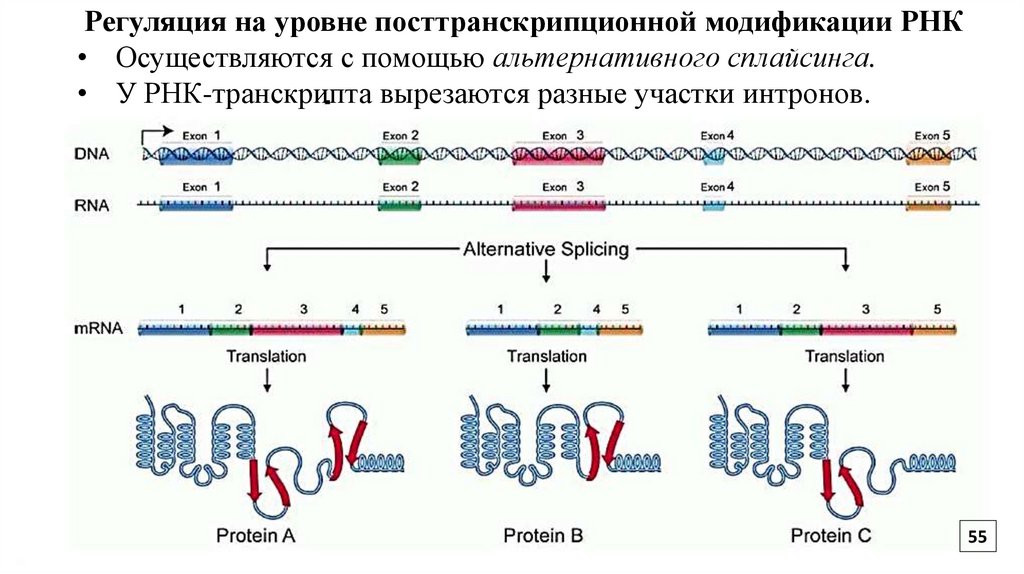
55.
Регуляция на уровне посттранскрипционной модификации РНК• Осуществляются с помощью альтернативного сплайсинга.
• У РНК-транскрипта вырезаются разные участки интронов.
55
56.
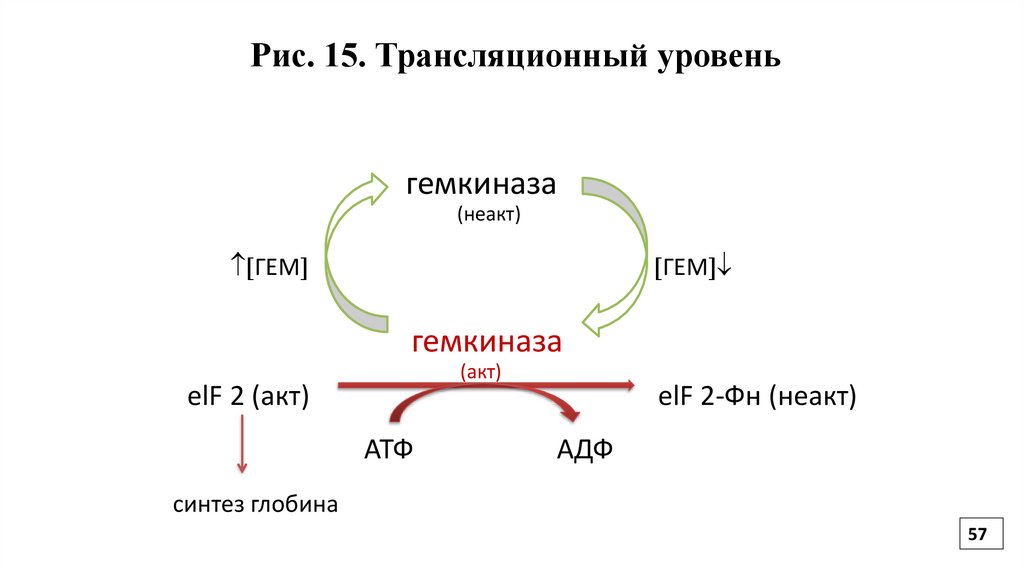
Регуляция на уровне трансляцииОпределяется регуляторными факторами и активностью
белковых факторов трансляции за счет их фосфорилирования/
дефосфорилирования.
Например, если уровень гема в клетке высок, то фактор
инициации не фосфорилирован и активен, происходит синтез цепи глобина. При снижении содержания гема в клетке, фактор
инициации фосфорилируется, инактивируется и синтез
глобиновой цепи снижается (Рис.15).
56
57.
Рис. 15. Трансляционный уровеньгемкиназа
(неакт)
ГЕМ
ГЕМ
гемкиназа
(акт)
elF 2 (акт)
АТФ
elF 2-Фн (неакт)
АДФ
синтез глобина
57
58.
Молекулярные механизмы мутацийМутации – изменения в структуре азотистых оснований, и (или)
изменения в нуклеотидной последовательности в ДНК,
передающиеся по наследству. Мутации могут быть врожденные и
приобретенные.
Действие физических факторов
• Под действием УФ-излучения между соседними
пиримидиновыми основаниями (между соседними тиминами)
возникает ковалентная связь, в результате чего образуются
тиминовые димеры. Результатом облучения могут быть разрывы одной
или двух цепей ДНК, образование поперечных сшивок.
Образование димеров является непреодолимым препятствием для
процесса репликации и трансляции. Рентгеновские и -лучи
помимо прямого влияния на ДНК вызывают образование в тканях
свободных радикалов.
Все это лежит в основе мутагенного и канцерогенного эффекта облучения
58
59.
Действие химических мутагенных факторов1) Дезаминирующие агенты (азотистая кислота и вещества,– нитраты,
нитриты, нитрозамин). Они вызывают дезаминирование азотистых
оснований. Например, цитозин превращается в урацил/
2) Алкилирующие агенты (диметилсульфат, диметилнитрозамин,
азотистый иприт, циклофосфамид) вызывают метилирование азотистых
оснований.
3) Аналоги азотистых оснований по своей структуре похожи на
азотистые основания и способны их заменять в структуре ДНК.
Например,5-Бромурацил, 2-Аминопурин.
4) Интеркалирующие агенты (гидрофобные планарные соединения –
акридин, диоксины, бензпирен и др.) встраиваются между соседними
азотистыми основаниями.
59
60.
Виды мутацийТочечные мутации, или мутации замены оснований, приводят к
изменению состава аминокислот, а не количества аминокислот в белке.
• Транзиции – замена пуриновых оснований на пуриновые, а
пиримидиновых на пиримидиновые.
• Трансверсии – замена пуриновых оснований на пиримидиновые и
наоборот.
В результате точечных мутаций имеет место миссенс-эффект, когда одна
аминокислота вследствие замены нуклеотида замещается другой аминокислотой. Такая
аминокислотная замена может быть приемлемой, частично приемлемой и неприемлемой
в отношении функции данного белка.
• Мутации сдвига рамки считывания. Вызываются делециями
(исчезновение нуклеотидов) или вставками нуклеотидов (инсерция) в
последовательность гена.
60
61.
Антимутагенная защитаСвязывание мутагена с альбуминами и глобулинами
плазмы затрудняет их проникновение в клетку
Детоксикация гидрофобных ксенобиотиков в печени
с участием микросомальной системы детоксикации
(цит.Р-450, цит.b5, система конъюгации)
Процессы антиоксидантной защиты в клетке
Работа системы репарации в ядре
61
62.
Ферменты репарации1. Эндонуклеаза и экзонуклеаза – вырезают нуклеотид,
ДНК-полимераза β и ДНК-лигаза
2. ДНК-инсертаза достраивает АП-сайт (апуриновый сайт) азотистым
основанием
3. ДНК-N-гликозилаза – формирует АП-сайт
АП-эндонуклеаза и АП-экзонуклеаза - вырезают АП-нуклеотид
ДНК-полимераза β и ДНК-лигаза
4. Фотолиазы – разрушают тиминовые димеры
(дефект фермента – пигментная ксеродерма)
62
63.
Рекомендуемая литература1. Биохимия : учебник/ под ред. Е.С. Северина. – М. : ГЭОТАР-Медиа, 2011. – С. 140–226. (
Раздел 4)
2. Биохимия [Электронный ресурс] : учебник / под ред. Е. С. Северина. – 5-е изд., испр. и доп. – М.
: ГЭОТАР-Медиа, 2015. – http://www.studmedlib.ru / book / ISBN9785970433126.html (Разд. 4).
3. Биологическая химия. Биохимия полости рта : учебник / Т.П. Вавилова, А.Е. Медведев. – М. :
ГЭОТАР-Медиа, 2014. – C. 101–112, 405–446.
4. Биологическая химия. Биохимия полости рта [Электронный ресурс]: учебник / Т.П. Вавилова,
А.Е. Медведев. – М. : ГЭОТАР-Медиа, 2014. – http://www.studmedlib.ru / book /
ISBN9785970430392.html (ч. VI, гл. 19–21; с. 101–112, 405–446).
5. Биологическая химия : учебник / Т.Т. Березов, Б.Ф. Коровкин. – 3-е изд., перераб. и доп.– М. :
Медицина, 1998. – С. 96–113; 509–544.
6. Обмен белков. Матричные биосинтезы : учебно-методическое пособие к практическим и
лабораторным занятиям по биологической химии – биохимии полости рта для студентов
стоматологического факультета / под ред. Ж.В. Антоновой, Р.Н. Павловой, В.А. Дадали. – СПб. : Издво СЗГМУ им. И.И. Мечникова, 2019. – С. 71–88.
63
64.
БЛАГОДАРЮ ЗА ВНИМАНИЕ!ПРОЙДИТЕ ТЕСТИРОВАНИЕ.
64













































 Биология
Биология








