Похожие презентации:
Молекулярно-кинетическая теория
1.
Основы мкт• Молекулярно-кинетическая теория
• Масса и размеры молекул
• Количество вещества
• Строение газов, жидкостей и твердых тел
• Идеальный газ
• Среднее значение квадрата скорости молекул
• Основное уравнение мкт
2.
Молекулярно-кинетическаятеория
• МКТ объясняет свойства макроскопических тел
и тепловых процессов, на основе представлений о
том, что все тела состоят из отдельных,
беспорядочно движущихся частиц.
• Макроскопические тела – тела, состоящие из
большого количества частиц.
• Микроскопические тела – тела, состоящие из
малого количества частиц.
3.
Основные положения мкт• Вещество состоит из частиц
• Частицы непрерывно и хаотически
движутся
• Частицы взаимодействуют друг с другом
4.
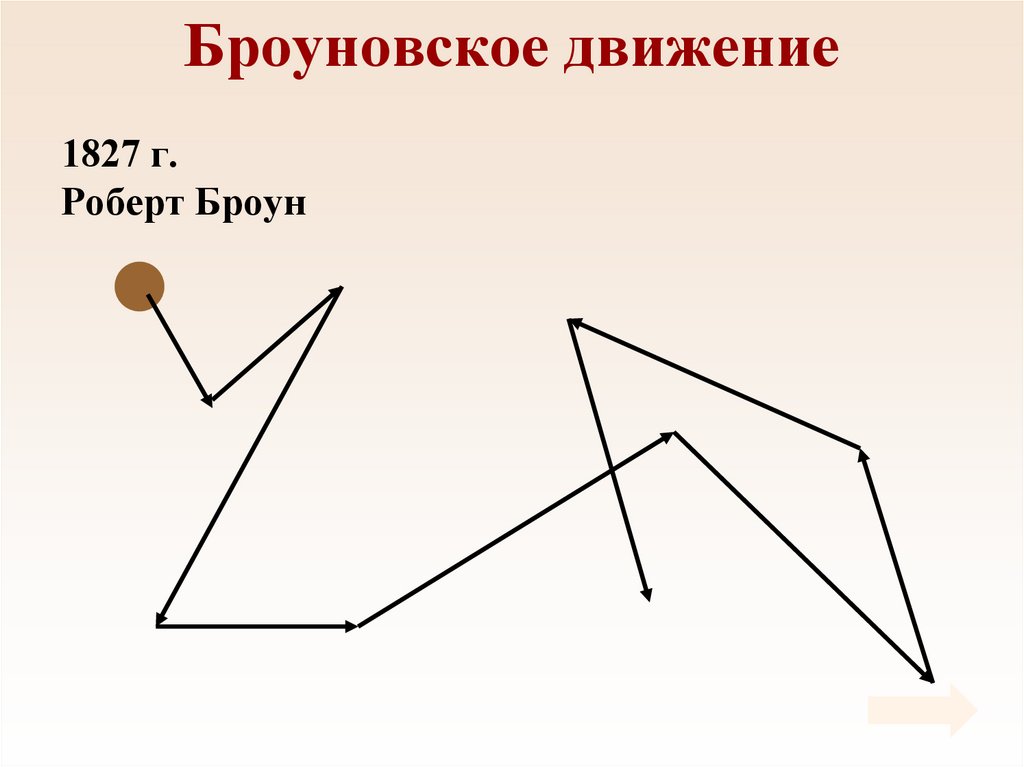
Броуновское движение1827 г.
Роберт Броун
5.
Броуновское движение• Причина броуновского
движения состоит в том,
что удары молекул
жидкости о частицу не
компенсируют друг друга.
• 1905 г. Альберт
Эйнштейн.
6.
Масса и размеры молекулV 1 мм
3
S 0,6 м
2
V
d
S
10
d 1,7 10 м
7.
Масса и размеры молекул22
В 1 г воды содержится 3,7 * 10 молекул.
m0 воды
1г
3,7 10
22
2,7 10
23
г
Массы молекул в макроскопических масштабах
чрезвычайно малы.
8.
Масса и размеры молекулкофе
этанол
9.
Масса и размеры молекул1961 год
Относительной молекулярной (или атомной)
массой вещества (Мr) называют отношение массы
молекулы (или атома) m0 данного вещества к 1/12
массы атома углерода m0C.
Mr
m0
1
m0C
12
10.
Количество веществаКоличество вещества наиболее естественно было бы
измерять числом молекул или атомов в теле. Но число
частиц в любом макроскопическом теле так велико, что в
расчетах используют не абсолютное число частиц, а
относительное.
моль
Один моль – это количество вещества, в котором
содержится столько же молекул или атомов, сколько
содержится в углероде массой 12 г.
11.
Количество веществаВ 1 моле любого вещества содержится одно и то же
число атомов или молекул.
1
- постоянная
N A 6,022 10
моль Авогадро
23
Количество вещества равно отношению числа
молекул в данном теле к постоянной Авогадро.
N
NA
12.
Количество веществаМолярной массой вещества называют массу
вещества, взятого в количестве
1 моль.
M m0 N A
кг
M
моль
m0 - масса одной молекулы или атома
M
m0
NA
13.
Количество веществаm m0 N
m – масса вещества
m
M
m
N N A N A
M
- формула для расчета
числа частиц в теле
14.
ТаблицаСвойства газов, жидкостей и
твердых тел
15.
Строение газов, жидкостей итвердых тел
свойства
твердые
тела
жидкости
газы
расположение
движение и
частиц
взаимод. частиц
16.
Свойства• Твердые тела сохраняют объем и форму.
17.
Свойства• Жидкости сохраняют объем и принимают форму
сосуда.
• Обладают текучестью.
18.
Свойства• Газы не имеют формы, занимают весь
предоставленный объем.
19.
Расположение частиц• Частицы расположены в строгом порядке
вплотную друг к другу.
• Кристаллическая решетка.
20.
Расположение частиц• Частицы расположены вплотную друг к другу,
образуют только ближний порядок.
21.
Расположение частиц• Частицы расположены на значительных
расстояниях (расстояния между частицами
во много раз больше размеров самих
частиц).
22.
Движение и взаимодействиечастиц
• Частицы совершают колебательные движения
около положения равновесия
• Силы притяжения и отталкивания
значительны
23.
Движение и взаимодействиечастиц
• Частицы совершают колебательные движения
около положения равновесия, изредка совершая
скачки на новое место
• Силы притяжения и отталкивания значительны
24.
Движение и взаимодействиечастиц
• Частицы свободно перемещаются по всему
объему, двигаясь поступательно
• Силы притяжения почти отсутствуют, силы
отталкивания проявляются при соударениях
25.
Идеальный газИдеальный газ – это газ, в котором
• Частицы – материальные точки
• Частицы взаимодействуют только при
соударениях
• Удары абсолютно упругие
26.
Среднее значение квадратаскорости молекул
• Скорость – величина векторная, поэтому средняя
скорость движения частиц в газе равна нулю.
ср
1 2 3 ...
N
0
27.
Среднее значение квадратаскорости молекул
2
2 3 ...
2
1
2
2
N
x y z
2
2
2
x y z
2
2
1 2
x
3
2
2
2
0
28.
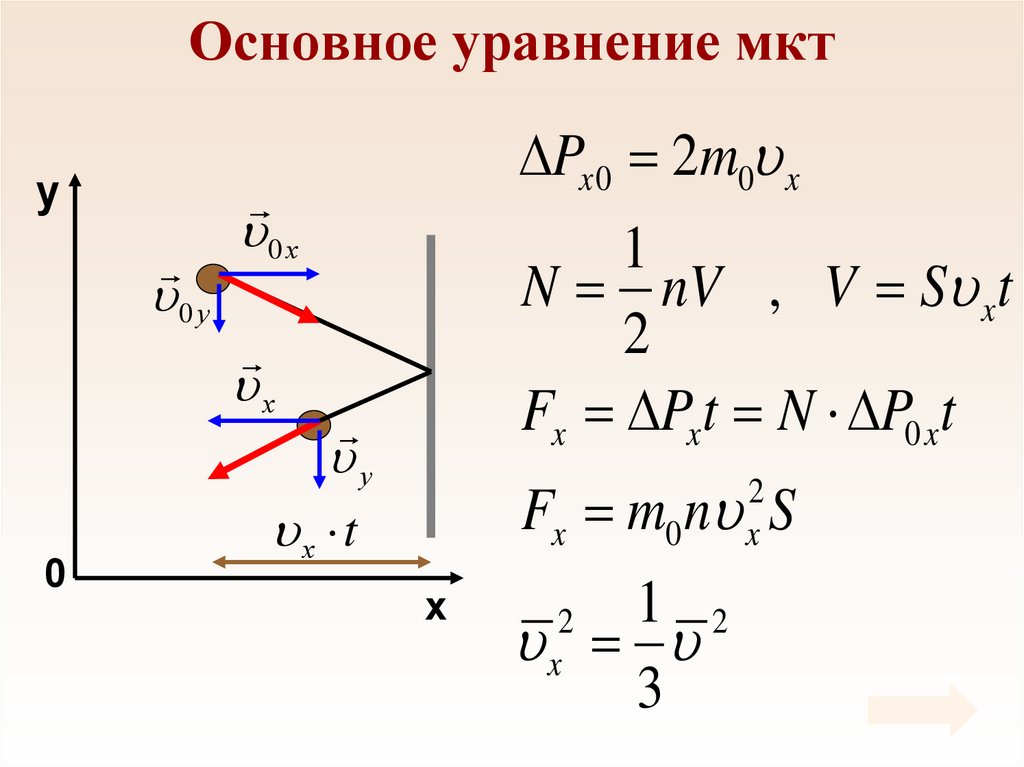
Основное уравнение мкт•Основное уравнение мкт устанавливает
зависимость давления газа от средней кинетической
энергии его молекул.
•Газ оказывает давление на стенки сосуда путем
многочисленных ударов молекул (или атомов).
29.
Основное уравнение мктy
Px 0 2m0 x
0 у
0 х
1
N nV , V S xt
2
Fx Px t N P0 xt
х
0
у
Fx m0 n S
2
x
х t
x
1 2
3
2
x
30.
Основное уравнение мкт1
1
2
F nm0 S p m0 n 2
3
3
2
F
p
p nE k 0
3
S
2
m0
N
m
Ek 0
m n m
0
0
2
V V
1
2
p
3
31.
Температура и тепловоеравновесие
• Макроскопические параметры
(макропараметры) – величины,
характеризующие состояние
макроскопических тел без учета
молекулярного строения. (V, p, t ).
• Тепловым равновесием называют такое
состояние, при котором все макроскопические
параметры всех тел системы остаются
неизменными сколь угодно долго.
32.
Температура и тепловоеравновесие
• Любое макроскопическое тело или группа
макроскопических тел при неизменных внешних
условиях самопроизвольно переходит в
состояние теплового равновесия.
• Все тела системы, находящиеся друг с другом в
тепловом равновесии имеют одну и ту же
температуру.
33.
Температура и тепловоеравновесие
• Термометр – прибор для измерения
температуры тела.
• Термометр входит в состояние теплового
равновесия с исследуемым телом и показывает
свою температуру.
34.
Температура и тепловоеравновесие
• Основная деталь термометра –
термометрическое тело, то есть тело,
макропараметры которого изменяются при
изменении температуры. (Например, в ртутных
термометрах термометрическим телом является
ртуть – при изменении температуры изменяется
ее объем.)
35.
Температура и тепловоеравновесие
• Изобретателем термометра является
Галилео Галилей (ок. 1600 г.)
• Термометрическим телом в его термометре
являлся газ – при повышении температуры
его объем увеличивался, вытесняя
жидкость.
• Недостатком термометра Галилея являлось
отсутствие температурной шкалы.
36.
Температурные шкалы0
0
С
0
F
K
R
100
212
80
373
0
32
0
273
шкала
Цельсия
шкала
Фаренгейта
шкала
Реомюра
шкала
Кельвина
37.
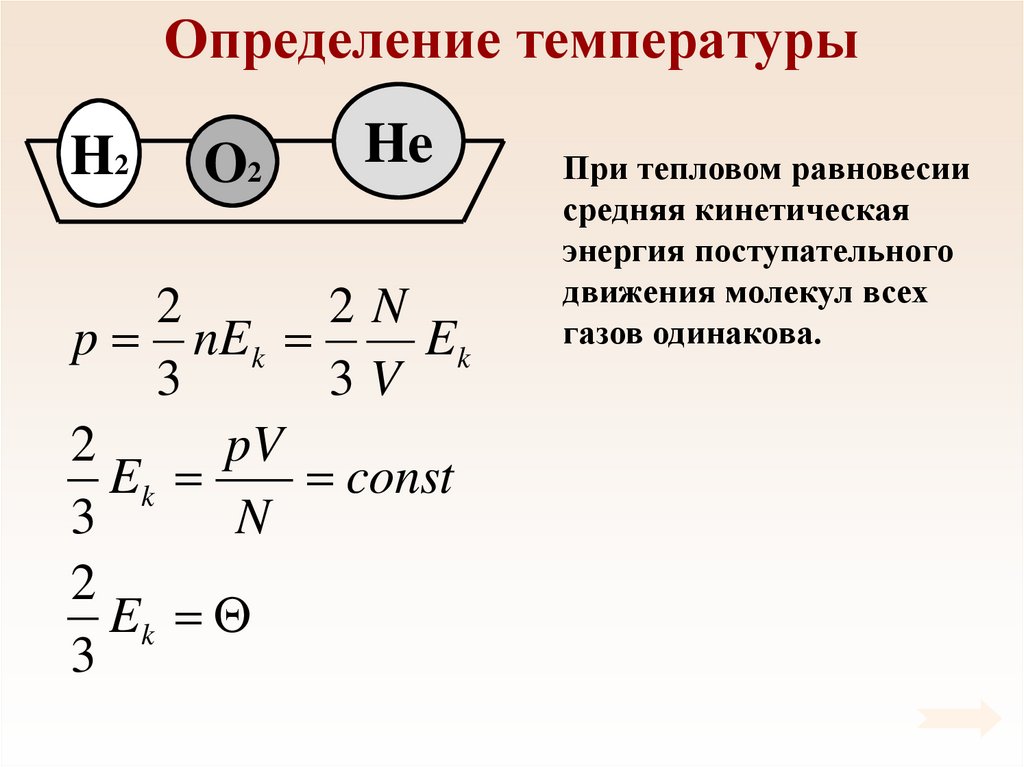
Определение температурыH2
O2
He
2
2N
p nEk
Ek
3
3V
2
pV
Ek
const
3
N
2
Ek
3
При тепловом равновесии
средняя кинетическая
энергия поступательного
движения молекул всех
газов одинакова.
38.
Определение температурыH2
O2
Дж
He
pV
t const
N t
0 3,76 10
21
100 5,10 10
Дж
21
Дж
- Энергетический
эквивалент
температуры.
~T
39.
Определение температурыH2
O2
He
kT
100 0
k
100 0
k 1,38 10
23
Дж
- постоянная
К Больцмана
40.
Температура – мера среднейкинетической энергии молекул
kT
3
2
Ek kT
2
Ek
3
T K кельвин
T t 273
t T 273
t T
41.
Зависимость давления газа оттемпературы и концентрации
молекул газа
3
Ek kT
2
p nkT
2
p nE k
3
42.
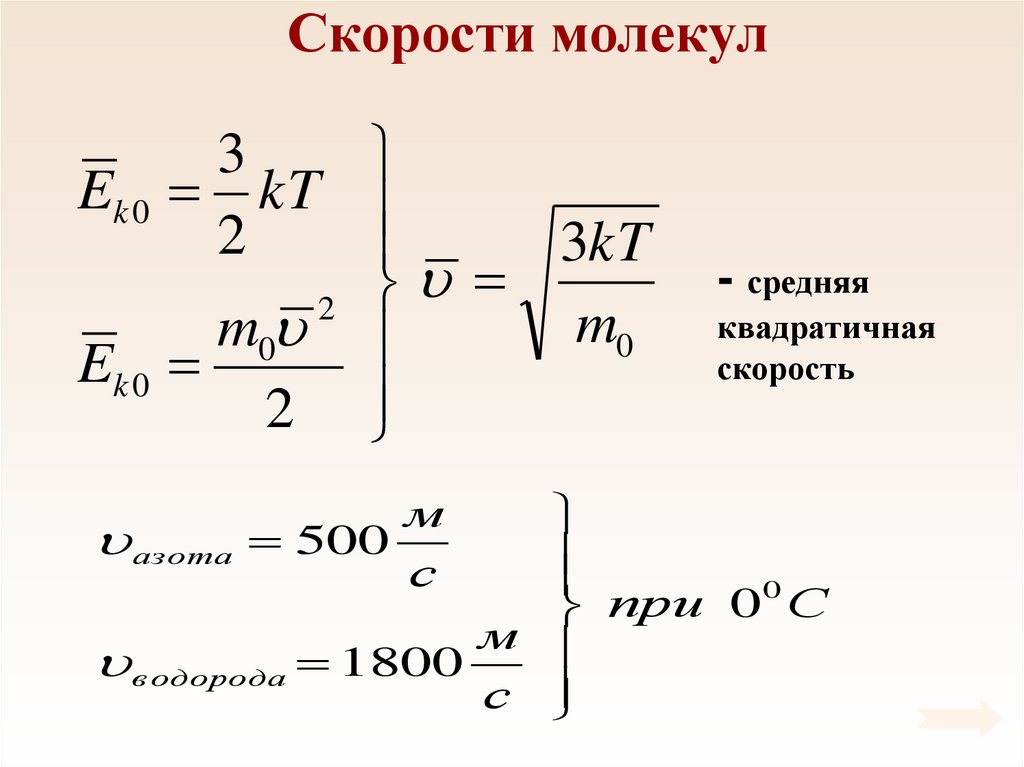
Скорости молекул3
Ek 0 kT
2
3kT
2
m0
m0
Ek 0
2
- средняя
квадратичная
скорость
0
при 0 С
м
в одорода 1800
с
м
азота 500
с
43.
Уравнение состояния идеальногогаза
(ур-е Менделеева – Клапейрона)
N
p nkT kT
V
m
N N A N A
M
m
pV
RT
M
Дж
N A k R 8,31
моль К
- универсальная
газовая постоянная
44.
Уравнение состояния идеальногогаза
(ур-е Менделеева – Клапейрона)
Если в ходе процесса масса газа
остается неизменной, то
pV m
R const
T
M
p1V1 p2V2 p3V3
...
T1
T2
T3
45.
Изопроцессы- Изотермический процесс
- Изобарный процесс
- Изохорный процесс
46.
Изотермический процесс• Процесс, происходящий с газом
неизменной массы при постоянной
температуре называется изотермическим.
• Изотермический процесс описывается
законом Бойля – Мариотта (конец 17 века):
pV
const
T
p1V1 p2V2
47.
Изобарный процесс• Процесс, происходящий с газом
неизменной массы при постоянном
давлении называется изобарным.
• Изобарный процесс описывается законом
Гей-Люссака (1802 г.):
pV
const
T
V1 V2
T1 T2
48.
Изохорный процесс• Процесс, происходящий с газом
неизменной массы при постоянном объеме
называется изохорным.
• Изохорный процесс описывается законом
Шарля (1787 г.):
pV
const
T
p1 p2
T1 T2
49.
Графики изопроцессовизотерма
изобара
p
V
p
p
изохора
p
V
p
T
V
p
T
T
V
T
V
V
T
T













































 Физика
Физика








