Похожие презентации:
Молекулярная физика
1. Молекулярная физика
2. Молекулярно-кинетическая теория
• МКТ объясняет свойства макроскопических тели тепловых процессов, на основе представлений о
том, что все тела состоят из отдельных,
беспорядочно движущихся частиц.
• Макроскопические тела – тела, состоящие из
большого количества частиц.
• Микроскопические тела – тела, состоящие из
малого количества частиц.
3. Основные положения мкт
• Все вещества состоят из мельчайших частиц(молекул и атомов), которые разделены
промежутками.
• Все эти частицы находятся в беспрерывном
хаотическом движении.
• Между атомами и молекулами существуют
силы взаимодействия (притяжение и
отталкивание).
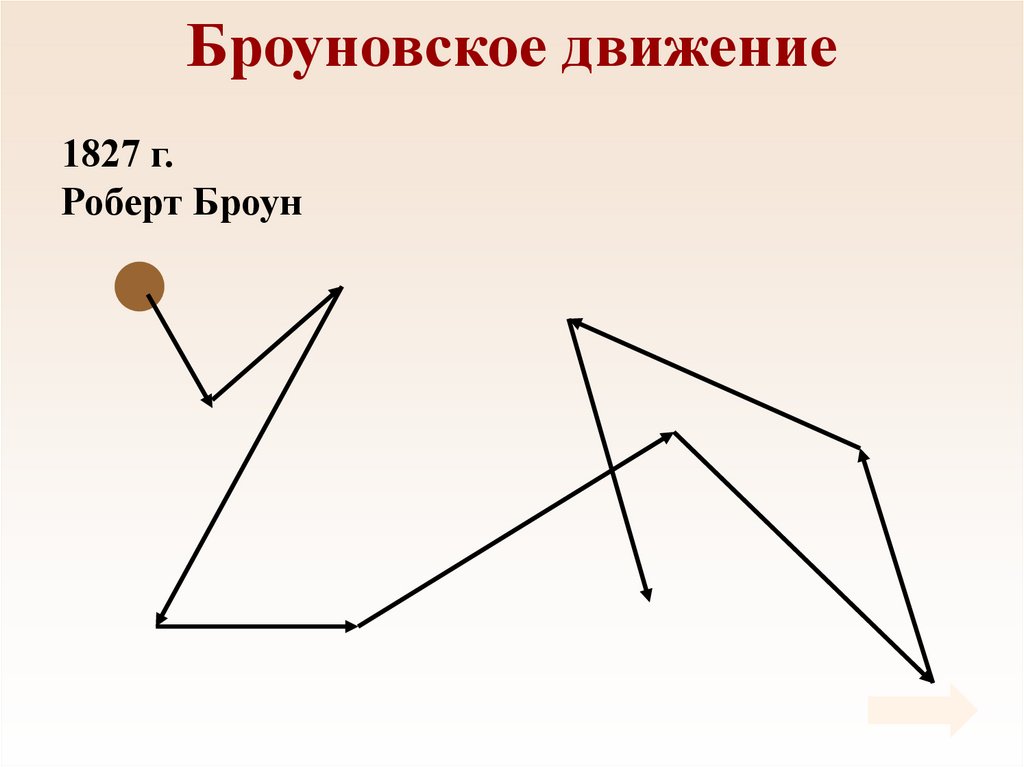
4. Броуновское движение
1827 г.Роберт Броун
5. Броуновское движение
• Причина броуновскогодвижения состоит в том,
что удары молекул
жидкости о частицу не
компенсируют друг друга.
• 1905 г. Альберт
Эйнштейн.
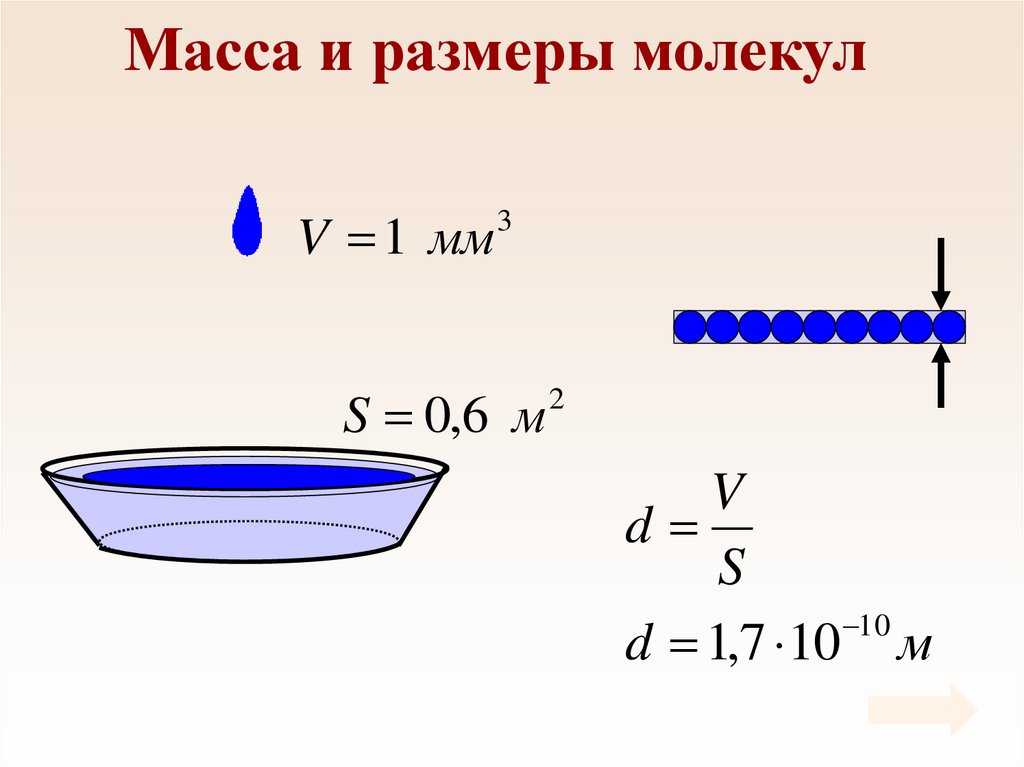
6. Масса и размеры молекул
V 1 мм3
S 0,6 м
2
V
d
S
10
d 1,7 10 м
7. Масса и размеры молекул
22В 1 г воды содержится 3,7 * 10 молекул.
m0 воды
1г
3,7 10
22
2,7 10
23
г
Массы молекул в макроскопических масштабах
чрезвычайно малы.
8.
Масса и размеры молекулкофе
этанол
9. Масса и размеры молекул
1961 годОтносительной молекулярной (или атомной)
массой вещества (Мr) называют отношение массы
молекулы (или атома) m0 данного вещества к 1/12
массы атома углерода m0C.
Mr
m0
1
m0C
12
10. Количество вещества
Количество вещества наиболее естественно было быизмерять числом молекул или атомов в теле. Но число
частиц в любом макроскопическом теле так велико, что в
расчетах используют не абсолютное число частиц, а
относительное.
моль
Один моль – это количество вещества, в котором
содержится столько же молекул или атомов, сколько
содержится в углероде массой 12 г.
11. Количество вещества
В 1 моле любого вещества содержится одно и то жечисло атомов или молекул.
1
- постоянная
N A 6,022 10
моль Авогадро
23
Количество вещества равно отношению числа
молекул в данном теле к постоянной Авогадро.
N
NA
12. Количество вещества
Молярной массой вещества называют массувещества, взятого в количестве
1 моль.
m0 N A
кг
моль
m0 - масса одной молекулы или атома
m0
NA
13. Количество вещества
m m0 Nm – масса вещества
m
N
N N A N A
m
- формула для расчета
числа частиц в теле
14. Таблица
Свойства газов, жидкостей итвердых тел
15. Строение газов, жидкостей и твердых тел
свойстватвердые
тела
жидкости
газы
расположение
движение и
частиц
взаимод. частиц
16. Свойства
• Твердые тела сохраняют объем и форму.17. Свойства
• Жидкости сохраняют объем и принимают формусосуда.
• Обладают текучестью.
18. Свойства
• Газы не имеют формы, занимают весьпредоставленный объем.
19. Расположение частиц
• Частицы расположены в строгом порядкевплотную друг к другу.
• Кристаллическая решетка.
20. Расположение частиц
• Частицы расположены вплотную друг к другу,образуют только ближний порядок.
21. Расположение частиц
• Частицы расположены на значительныхрасстояниях (расстояния между частицами
во много раз больше размеров самих
частиц).
22. Движение и взаимодействие частиц
• Частицы совершают колебательные движенияоколо положения равновесия
• Силы притяжения и отталкивания значительны
23. Движение и взаимодействие частиц
• Частицы совершают колебательные движенияоколо положения равновесия, изредка совершая
скачки на новое место
• Силы притяжения и отталкивания значительны
24. Движение и взаимодействие частиц
• Частицы свободно перемещаются по всемуобъему, двигаясь поступательно
• Силы притяжения почти отсутствуют, силы
отталкивания проявляются при соударениях
25. Идеальный газ
Идеальный газ – это газ, в котором• Частицы – материальные точки
• Частицы взаимодействуют только при
соударениях
• Удары абсолютно упругие
26. Среднее значение квадрата скорости молекул
• Скорость – величина векторная, поэтому средняяскорость движения частиц в газе равна нулю.
ср
1 2 3 ...
N
0
27. Среднее значение квадрата скорости молекул
22 3 ...
2
1
2
2
N
x y z
2
2
2
x y z
2
2
1 2
x
3
2
2
2
0
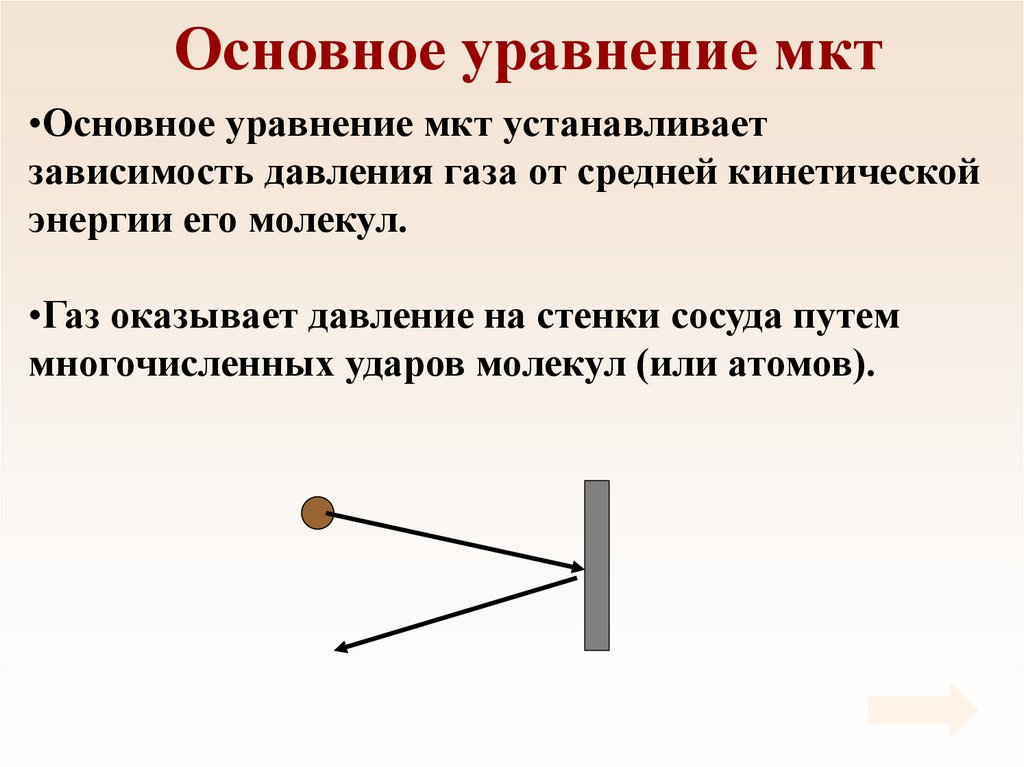
28. Основное уравнение мкт
•Основное уравнение мкт устанавливаетзависимость давления газа от средней кинетической
энергии его молекул.
•Газ оказывает давление на стенки сосуда путем
многочисленных ударов молекул (или атомов).
29. Основное уравнение мкт
yPx 0 2m0 x
0 у
0 х
1
N nV , V S xt
2
Fx Px t N P0 xt
х
0
у
Fx m0 n S
2
x
х t
x
1 2
3
2
x
30. Основное уравнение мкт
11
2
F nm0 S p m0 n 2
3
3
2
F
p
p nE k 0
3
S
2
m0
N
m
Ek 0
m n m
0
0
2
V V
1
2
p
3
31. Температура и тепловое равновесие
• Макроскопические параметры(макропараметры) – величины,
характеризующие состояние
макроскопических тел без учета
молекулярного строения. (V, p, t ).
• Тепловым равновесием называют такое
состояние, при котором все макроскопические
параметры всех тел системы остаются
неизменными сколь угодно долго.
32. Температура и тепловое равновесие
• Любое макроскопическое тело или группамакроскопических тел при неизменных внешних
условиях самопроизвольно переходит в состояние
теплового равновесия.
• Все тела системы, находящиеся друг с другом в
тепловом равновесии имеют одну и ту же
температуру.
33. Температура и тепловое равновесие
• Термометр – прибор для измерения температурытела.
• Термометр входит в состояние теплового
равновесия с исследуемым телом и показывает
свою температуру.
34. Температура и тепловое равновесие
• Основная деталь термометра –термометрическое тело, то есть тело,
макропараметры которого изменяются при
изменении температуры. (Например, в ртутных
термометрах термометрическим телом является
ртуть – при изменении температуры изменяется
ее объем.)
35. Температура и тепловое равновесие
• Изобретателем термометра являетсяГалилео Галилей (ок. 1600 г.)
• Термометрическим телом в его термометре
являлся газ – при повышении температуры
его объем увеличивался, вытесняя
жидкость.
• Недостатком термометра Галилея являлось
отсутствие температурной шкалы.
36. Температурные шкалы
00
С
0
F
K
R
100
212
80
373
0
32
0
273
шкала
Цельсия
шкала
Фаренгейта
шкала
Реомюра
шкала
Кельвина
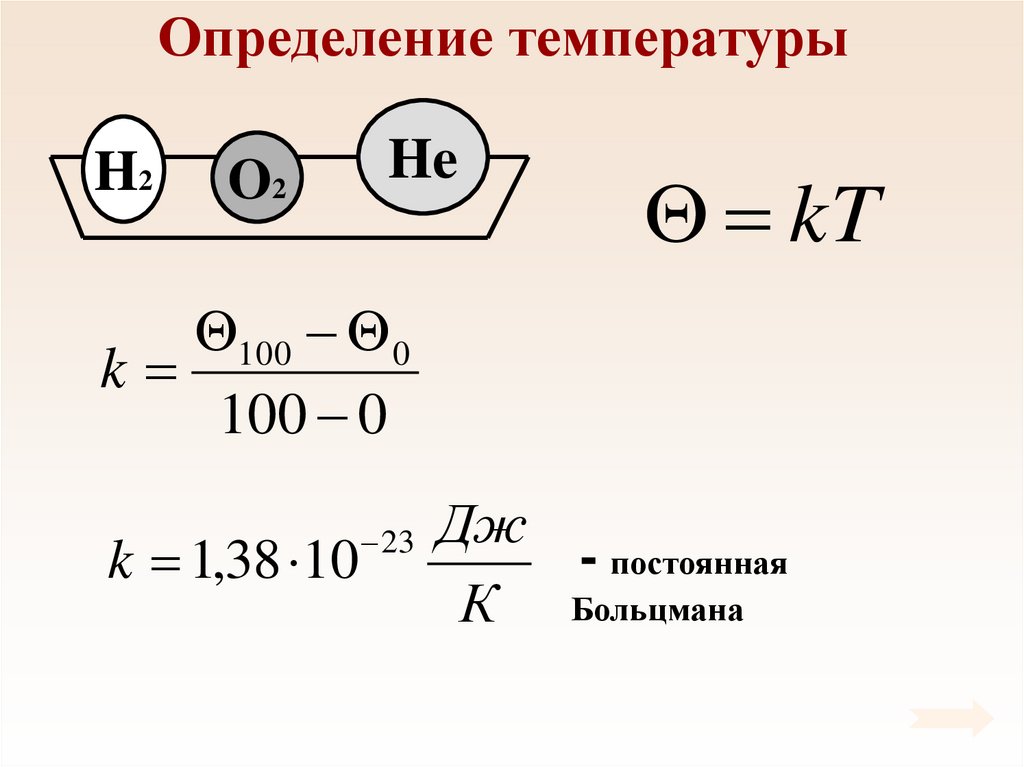
37. Определение температуры
H2O2
He
2
2N
p nEk
Ek
3
3V
2
pV
Ek
const
3
N
2
Ek
3
При тепловом равновесии
средняя кинетическая
энергия поступательного
движения молекул всех
газов одинакова.
38. Определение температуры
H2O2
Дж
He
pV
t const
N t
0 3,76 10
21
100 5,10 10
Дж
21
Дж
- Энергетический
эквивалент
температуры.
~T
39. Определение температуры
H2O2
He
kT
100 0
k
100 0
k 1,38 10
23
Дж
- постоянная
К Больцмана
40. Температура – мера средней кинетической энергии молекул
kT3
2
Ek kT
2
Ek
3
T K кельвин
T t 273
t T 273
t T
41.
Опыт показывает, что давление газа зависит оттемпературы и для любых веществ справедливо
соотношение
рV
кТ ,
N
где k – коэффициент пропорциональности, называемый
постоянной Больцмана
23 Дж
k 1,38 10
К
Предельную температуру, при которой давление идеального
газа обращается в ноль при
фиксированном объеме (или объем стремиться к нулю
при постоянном давлении) называют
АБСОЛЮТНЫМ НУЛЁМ ТЕМПЕРАТУРЫ.
42.
Средняя кинетическая энергия молекул:m
Екин
2
2
Средняя кинетическая энергия прямо пропорциональна
абсолютной температуре.
3
Екин kT
2
ТЕМПЕРАТУРА - мера средней кинетической энергии молекул.
Связь давления и температуры:
p nkT
43.
Температурные шкалы:•Шкала Реомюра. 00С - 00R, 1000С - 800R. → 10R=1,250С.
•Шкала Фаренгейта. 00С=320F, 1000С=2120F → t0C=5/9(t0F-32).
•Шкала Цельсия. 00С – таяние льда, 1000С – кипение воды.
Английский учёный У. Кельвин ввел абсолютную шкалу
температур – шкалу Кельвина.
в СИ: [Т]=К (Кельвин)
44.
Р~m045.
р~n46.
2р~υ
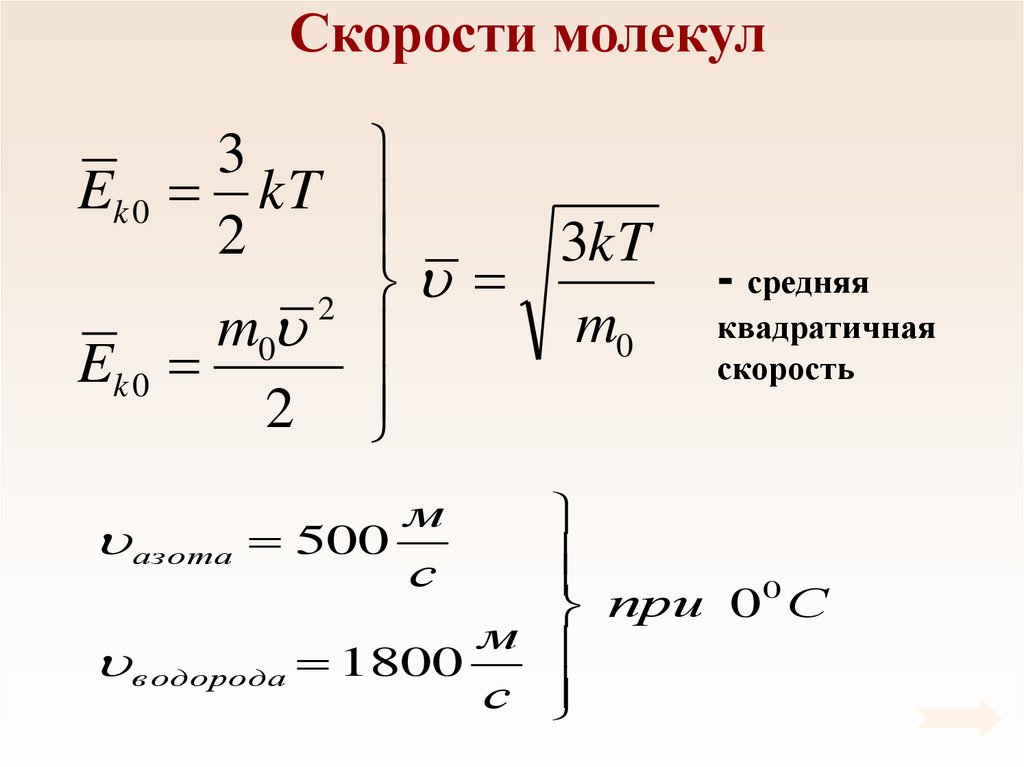
47. Скорости молекул
3Ek 0 kT
2
3kT
2
m0
m0
Ek 0
2
- средняя
квадратичная
скорость
0
при 0 С
м
в одорода 1800
с
м
азота 500
с
48.
Домашнее заданиеЗадача 1. В закрытом сосуде находится идеальный
газ. Во сколько раз изменится его давление, если
мы увеличим его объем в 2 раза. Средняя скорость
молекул при изменении объема осталась
неизменной.
Задача 2. Средняя скорость молекул идеального
газа составляет 360 км/ч, а плотность газа равна
780 мкг/см3. Найти давление.
Задача 3. Идеальный газ массой 12 мг занимает
сосуд площадью 6 мм2 и высотой 0.4 м. Давление
газа в сосуде составляет 250 МПа. Найти чему
равен квадрат средней скорости молекул газа в
сосуде.










































 Физика
Физика








