Похожие презентации:
Железо и его соединения. 9 непрофильный класс
1.
Железо и его соединения9 непрофильный класс
2.
4 период№ 26
VIII В
группа
ставшее
международным,
латинское
название
«Ferrum», от
греко-латинского
«быть твердым»
четвертый
по распространенности в
земной коре, второй среди
металлов
3.
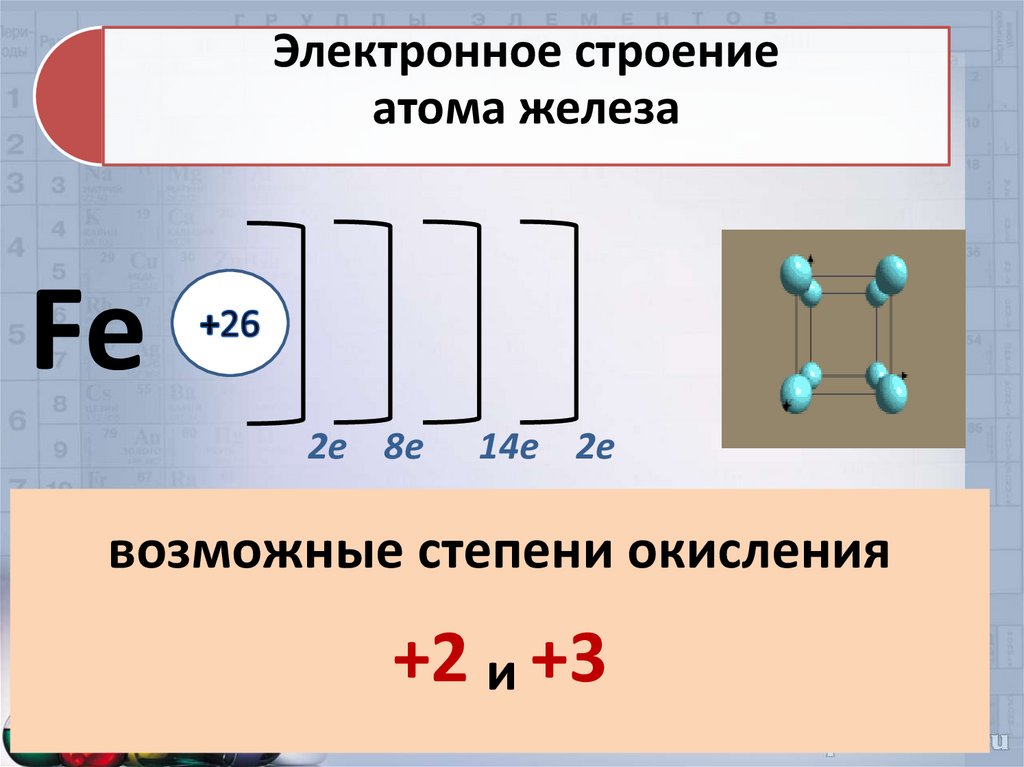
Электронное строениеатома железа
Fe
2е 8е
14е 2е
возможные степени окисления
+2 и +3
4.
Физические свойстваЖелезо - сравнительно мягкий, ковкий,
блестящий, серебристо-серый металл.
Температура плавления – 1539 0С
Температура кипения около 2800 0С
Пластичный, легко куётся, прокатывается,
штапуется.
При температуре ниже 770 0С железо обладает
ферромагнитными свойствами (оно легко
намагничивается, и из него можно изготовить
магнит).
Выше этой температуры ферромагнитные
свойства железа исчезают, железо
«размагничивается».
5.
Первое металлическое железо, попавшее в рукичеловека, имело, явно, метеоритное
происхождение.
Железные изделия из метеоритного железа
найдены в захоронениях, относящихся к очень
давним временам (IV - V тысячелетиях до н.э.).
Их и сейчас находят у жителей Северной и
Южной Америки, Гренландии и Ближнего
Востока, а также при археологических
раскопках на всех континентах. Подбирая
упавшие с неба камни — железные метеориты
люди превращали их в украшения, орудия
труда и охоты.
6.
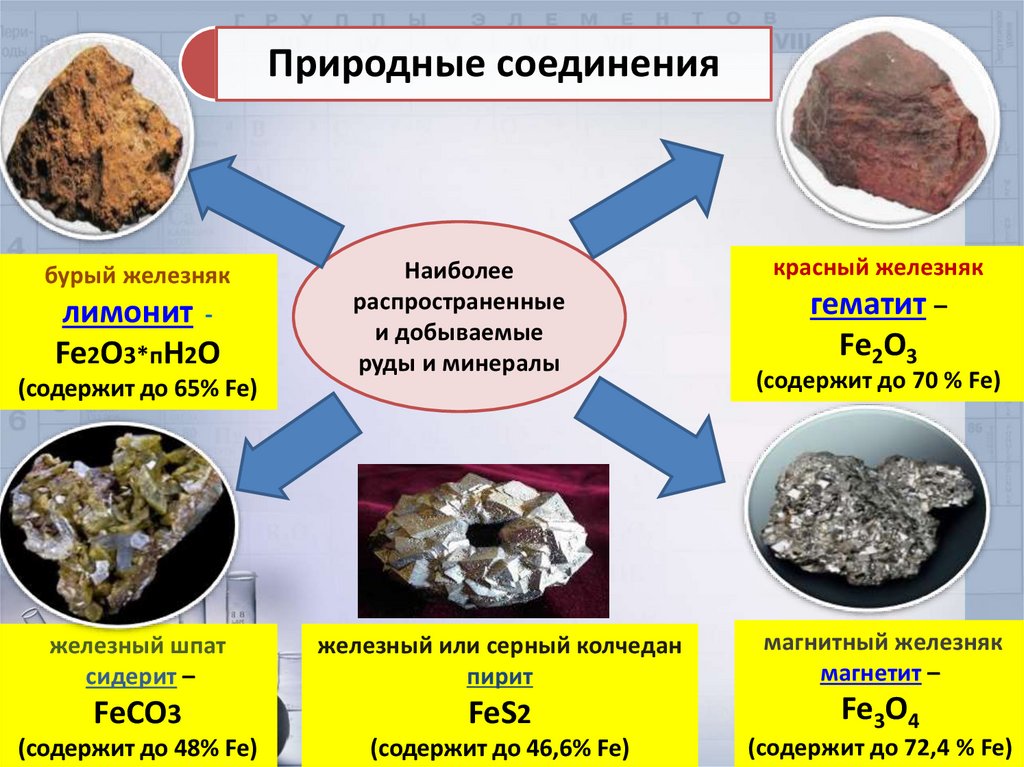
Природные соединениябурый железняк
лимонит Fe2О3*пН2О
(содержит до 65% Fe)
Наиболее
распространенные
и добываемые
руды и минералы
красный железняк
гематит –
Fe2O3
(содержит до 70 % Fe)
железный шпат
сидерит –
железный или серный колчедан
пирит
магнитный железняк
магнетит –
FeCO3
FeS2
Fe3O4
(содержит до 48% Fe)
(содержит до 46,6% Fe)
(содержит до 72,4 % Fe)
7.
Химические свойства1. Реакции с простыми веществами
При сгорании железа на воздухе образуется оксид Fe2О3 :
4Fe +3O2=2Fe2O3
Железо сгорает в чистом кислороде при нагревании,
образуется железная окалина Fe3O4:
3Fe +2O2=Fe3O4
Реагирует с порошком серы при нагревании: Fe +S = FeS
С углеродом образует карбид:
3Fe + C = Fe3C (цементит)
Реагирует с галогенами при нагревании:
2Fe + 3CL2=2FeCL3
железо в галогенидах, кроме йода имеет С.О. +3
8.
Химические свойстваВзаимодействие железа с хлором
2Fe + 3Cl2 = 2FeCl3
9.
Химические свойстваВзаимодействие железа с кислородом:
3 Fe + 2 O2 = Fe3O4(FeO*Fe2O3)
10.
Химические свойства2. Реакции со сложными веществами
С кислотами:
А) с соляной кислотой
2HCL(разб.) + Fe = FeCL2 + H2
Б) с серной кислотой
H2SO4 (разб.) + Fe = FeSO4 + H2
С солями:
Fe + CuSO4= Cu + FeSO4
С водой(при высокой температуре):
3Fe + 4H2O=Fe3O4 +4H2 (железная окалина)
При кипячении порошка железа с концентрированным раствором
щёлочи в инертной атмосфере образуются синие растворы:
Fe + 2NaOH + 2H2O = Na2[Fe(OH)4 ] + H2↑
11.
Допишите уравнение реакции и расставьтекоэффициенты методом электронного баланса
• Fe + HNO3(конц) = ….. + H2O + ……
• Fe + HNO3(разб) = ….. + H2O + NO
• Fe + HNO3(разб) = ….. + H2O + NH3
• Fe + HNO3(разб) = ….. + H2O + NH4NO3
• Fe + H2SO4(конц) = ….. + H2O + SO2
12.
Получение железаВ настоящее время железную руду восстанавливают коксом в доменных
печах, при этом расплавленное железо частично реагирует с углеродом,
образуя карбид железа Fe3C (цементит), а частично растворяет его. При
затвердевании расплава образуется чугун. Лишний углерод, содержащийся в
чугуне необходимо выжечь. Этого добиваются, пропуская над расплавленным
чугуном воздух, обогощённный кислородом.
Существует и прямой метод получения железа, основанный на
восстановлении окатышей магнитного железняка природным газом,
водородом или алюминием (алюмотермия)
Fe3 O4 + CH4 →3Fe + CO2 + 2H2O
Fe2O3 + 2Al = 2Fe + Al2O3
Fe3O4 + 4H2 = 3Fe + 4H2O
(t = 1 000°C)
Очень чистое железо в виде порошка получают разложением карбонила
Fe(CO)5. Пентакарбонил железа - жидкость, которую можно легко отделить от
примесей перегонкой. При температуре около 250° карбонил разлагается,
образуя порошок железа:
Fе(СО)5 = Fе + 5СО
13.
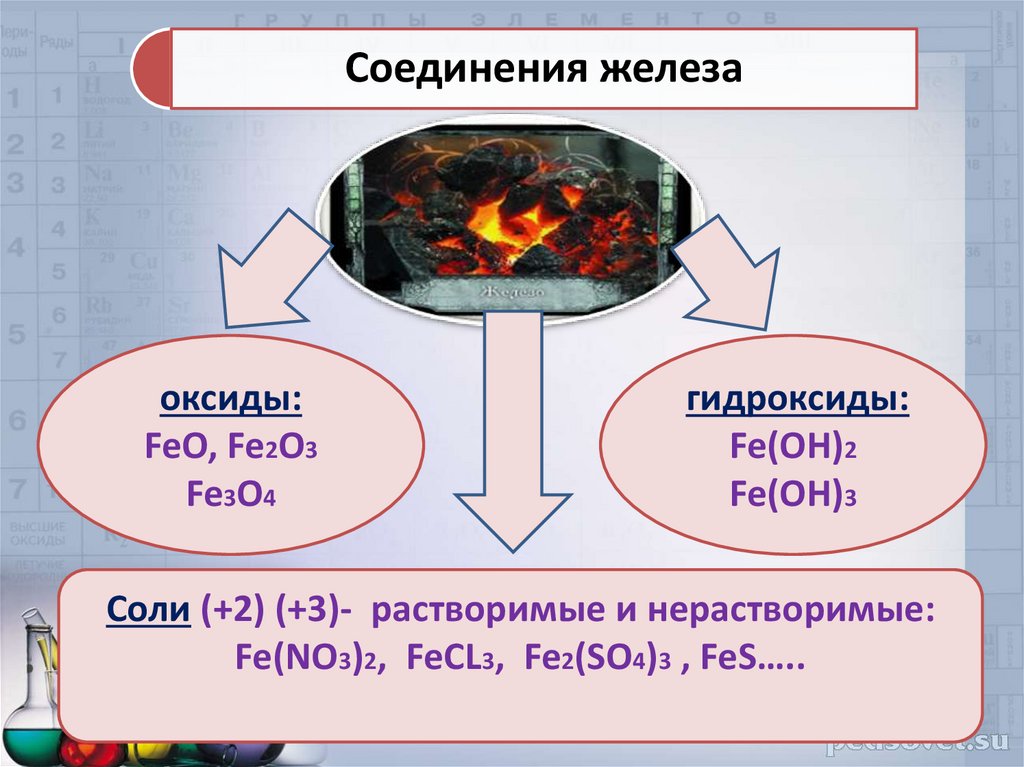
Соединения железаоксиды:
FeO, Fe2O3
Fe3O4
гидроксиды:
Fe(OH)2
Fe(OH)3
Соли (+2) (+3)- растворимые и нерастворимые:
Fe(NO3)2, FeCL3, Fe2(SO4)3 , FeS…..
14.
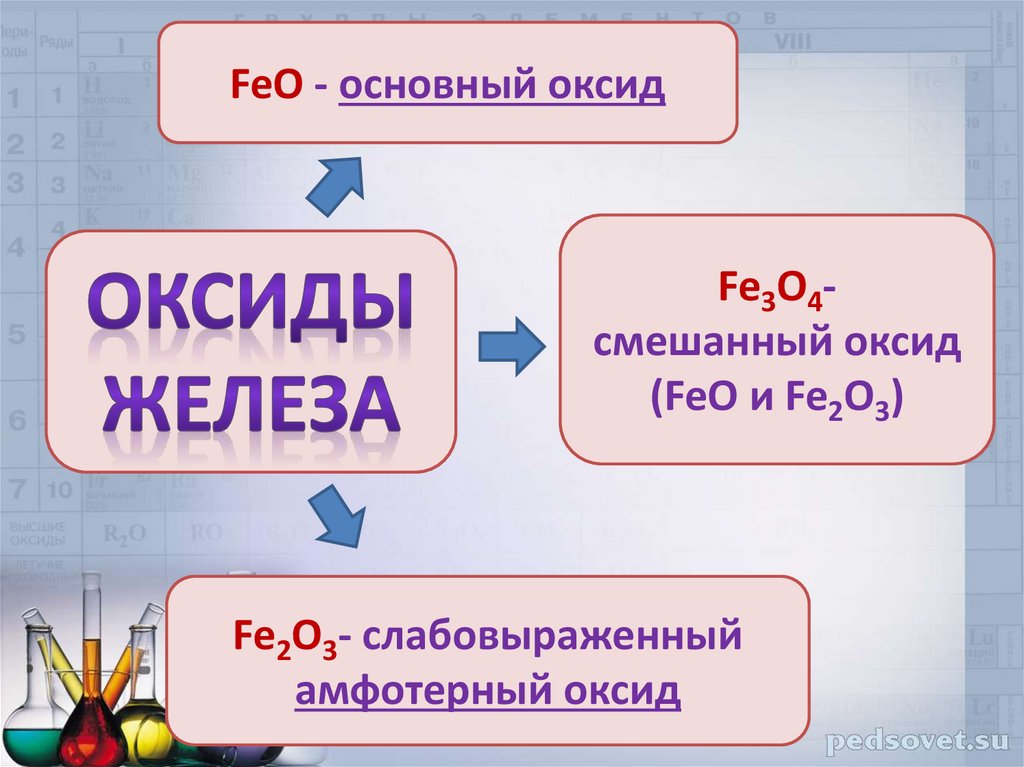
FeO - основный оксидFe3O4смешанный оксид
(FeO и Fe2O3)
Fe2O3- слабовыраженный
амфотерный оксид
15.
Химические свойства FeO1)
с кислотами:
FeO + 2HCL=FeCL2 + H2O
2) с более активными металлами:
3FeO + 2Al = 3Fe + Al2O3
Химические свойства Fe3O4
1) с кислотами
Fe3O4 + 8HCL=FeCL2 +2FeCL3 + 4H2O
2) также с более активными металлами
Fe3O4 +4 Zn=4 ZnO +3Fe
Химические свойства Fe2O3
1) с кислотами:
Fe2O3 + 3H2SO4=Fe2(SO4)3 + 3H2O
2) с более активными металлами
Fe2O3 + 3Mg=3MgO +2Fe
16.
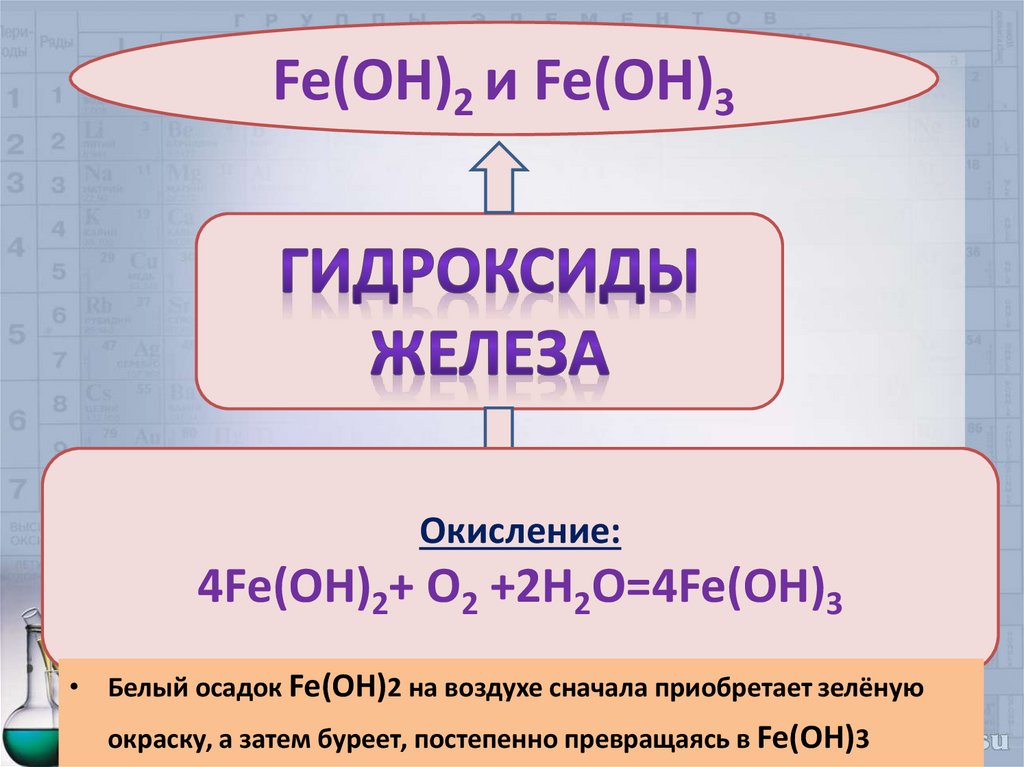
Fe(OH)2 и Fe(OH)3Окисление:
4Fe(OH)2+ O2 +2H2O=4Fe(OH)3
• Белый осадок Fe(OH)2 на воздухе сначала приобретает зелёную
окраску, а затем буреет, постепенно превращаясь в Fe(OH)3
17.
Fe(OH)2 и Fe(OH)31)Реагируют с кислотами:
Fe(OH)2 + 2HNO3= Fe(NO3)2 + 2H2O
Fe(OH)3 + 3HCL=FeCl3+3H2O
2)Разлагаются при нагревании:
2Fe(OH)3 = Fe2O3+3H2O
Fe(OH)2=FeO + H2O
Fe(OH)3 реагирует с конц.
щелочами
Fe(OH)3 + NaOH=Na[Fe(OH)4]
18.
Реагируют с щелочами:FeCL2 + 2NaOH= Fe(OH)2 + 2 NaCL
Реагируют с более активными металлами:
FeCL2 + Mg= MgCL2+ Fe
Реагируют с другими солями:
Fe2(SO4)3 + 3BaCL2=3BaSO4 + 2FeCL3
Реагируют с кислотами:
FeS + 2HCl=FeCL2 + H2S
19.
Качественные реакции на ионы Fe²⁺ и Fe³⁺FeCl2 + 2NaOH=Fe(OH)2 +2NaCL
Fe2+ +2CL- + 2Na+ + 2OH-=Fe(OH)2 + 2Na+ + 2OHFe2+ + 2OH- = Fe(OH)2
Сначала белый осадок, затем становится зелёным
(видео)
FeCL3+3KOH=Fe(OH)3 +3KCL
Fe3+ +3CL- +3K+ +3OH-=Fe(OH)3 +3K+ +3OHFe3+ +3OH- =Fe(OH)3
Бурый осадок
20.
Качественные реакции на ионы Fe²⁺ и Fe³⁺Fe³⁺
реактив – роданид калия KSCN или
роданидом аммония NH4SCN
Fe³⁺
реактив – желтая кровяная соль K₄[Fe(CN)₆]
Fe²⁺
реактив – красная кровяная соль K₃[Fe(CN)₆]
21.
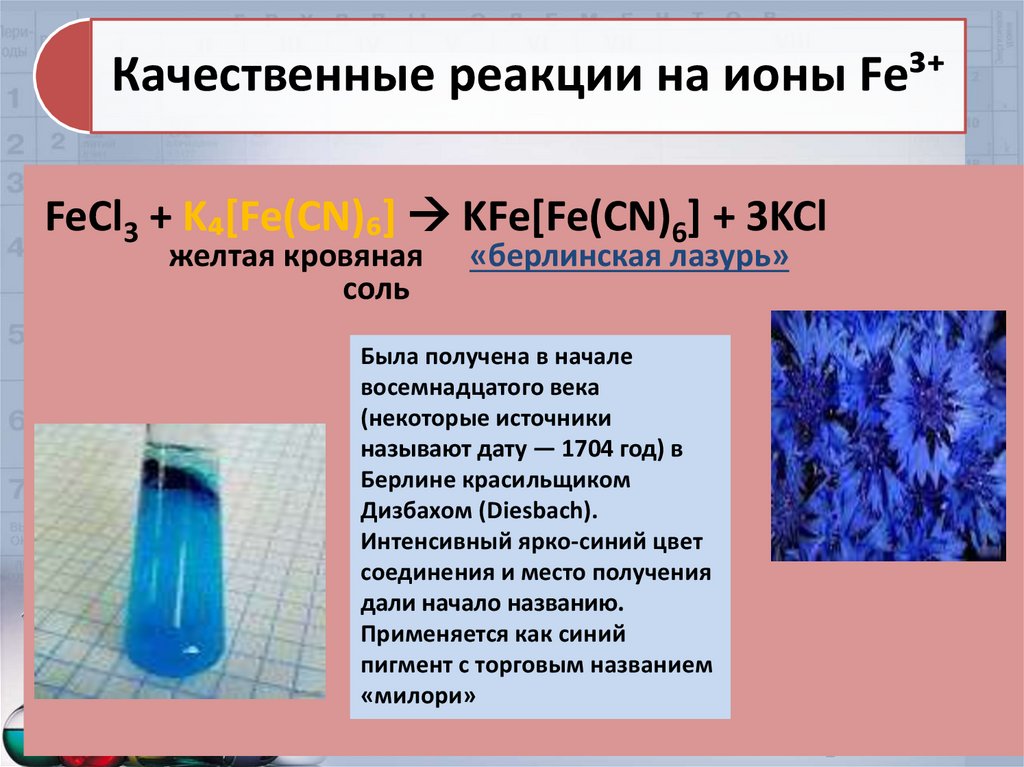
Качественные реакции на ионы Fe³⁺FeCl3 + K₄[Fe(CN)₆] KFe[Fe(CN)6] + 3KCl
желтая кровяная
соль
«берлинская лазурь»
Была получена в начале
восемнадцатого века
(некоторые источники
называют дату — 1704 год) в
Берлине красильщиком
Дизбахом (Diesbach).
Интенсивный ярко-синий цвет
соединения и место получения
дали начало названию.
Применяется как синий
пигмент с торговым названием
«милори»
22.
Качественные реакции на ионы Fe³⁺FeCl3 + 3KSCN Fe(SCN)3 +3KCl
роданид калия
Fe+3CI3+3NH4SCN Fe(SCN)3↓+3NH4CI
роданид аммония
применение роданидов - для имитации
крови (видео)
кроваво-красного цвета
23. Качественные реакции
Качественные реакции на ионы Fe²⁺• На ион Fe2+ - взаимодействие с красной кровяной
солью гексацианоферратом (III)калия
Fe+2SO4+K3[Fe(CN)6]=KFe+3[Fe+2(CN)6]↓+K2SO4
синего цвета «турнбулева синь»
(видео)
Название «турнбулева синь» происходит от
названия шотландской фирмы «Артур и
Турнбуль», которая в конце
восемнадцатого века производила краски.
Окончательно тот факт, что «берлинская
лазурь» и «турнбулева синь» это одно и то
же вещество был установлен только в
двадцатом веке.
24.
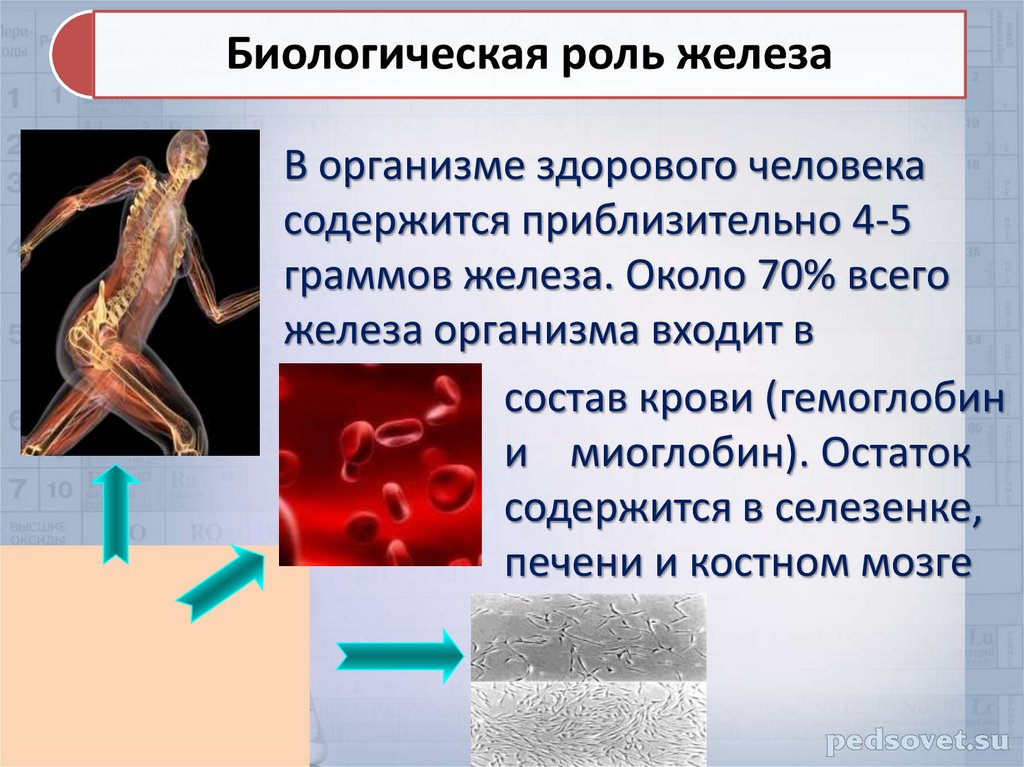
Биологическая роль железаВ организме здорового человека
содержится приблизительно 4-5
граммов железа. Около 70% всего
железа организма входит в
состав крови (гемоглобин
и миоглобин). Остаток
содержится в селезенке,
печени и костном мозге
25.
Сколько железа требуется человеку?• В нашем теле содержится от 2
до 5 г железа в зависимости от
уровня гемоглобина, веса,
роста, пола, возраста.
Особенно его много в
гемоглобине крови - 2/3 от
общего количества, остальное запасено в тканях и
внутренних органах, в основном в печени. Чтобы
усвоился 1 мг, нужно из разных продуктов
получить 10 мг железа. Это и есть норма взрослого
человека
26. Железо в продуктах животного и растительного происхождения
27.
Недостаток железа в организмеВ случае недостатка железа наблюдаются такие
симптомы:
• Усталость
Ломкость ногтей
Депрессия
28.
• Нервныерасстройства
Выпадение
и поседение волос
Ожирение
29.
Осуществите превращенияДомашнее задание
• Fe →FeCI2→Fe(OH)2→FeO→Fe
• Fe→FeCI3→Fe(OH)3→Fe2O3→Fe
↑X1 →Fe(OH)2→FeSO4
Fe3O4→Fe
↓
↓X2→Fe(OH)3→Fe2(SO4)3




















 Химия
Химия








