Похожие презентации:
Металлургия цинка
1. Металлургия цинка
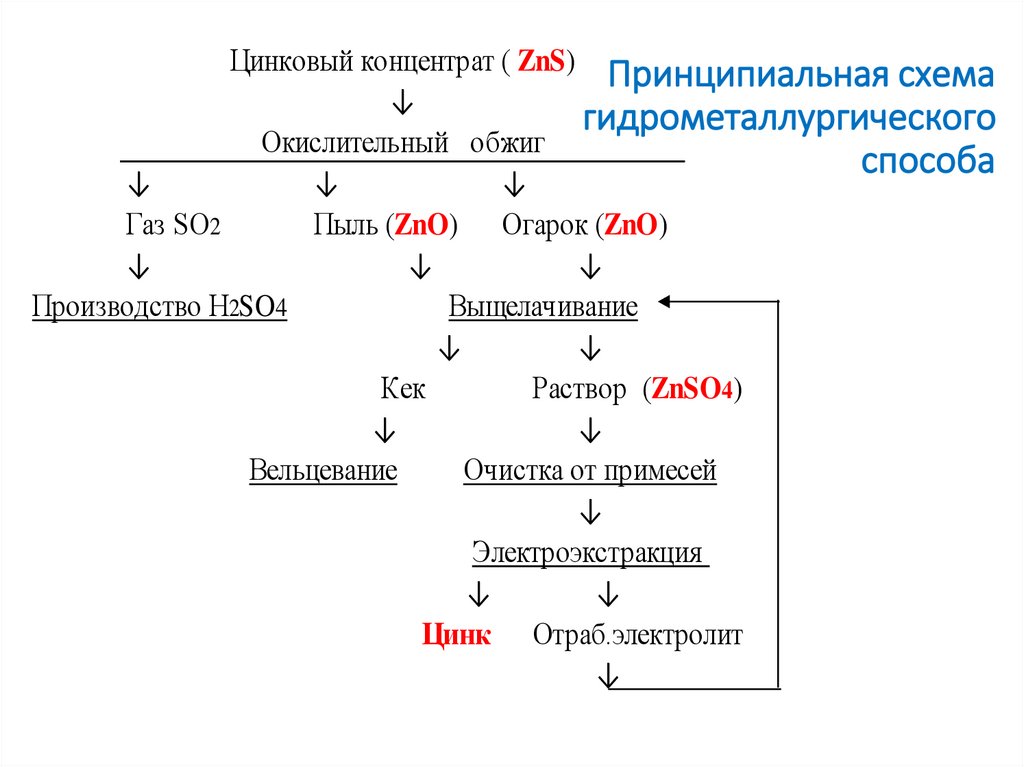
к.т.н. Колмачихина О.Б.2. Принципиальная схема гидрометаллургического способа
Цинковый концентрат ( ZnS) Принципиальная схема↓
гидрометаллургического
Окислительный обжиг
способа
↓
↓
↓
Газ SO2
Пыль (ZnO) Огарок (ZnO)
↓
↓
↓
Производство H2SO4
Выщелачивание
↓
↓
Кек
Раствор (ZnSO4)
↓
↓
Вельцевание
Очистка от примесей
↓
Электроэкстракция
↓
↓
Цинк Отраб.электролит
↓
3. Электроцинк (Владикавказ)
4. ЧЦЗ
5. обжиг цинковых концентратов перед выщелачиванием
ZnS + 1,5O2 ZnO + SO2 + 890 кДжZnS + 2О2
ZnSO4 + 775 кДж
Реакция ферритообразования:
ZnО + Fe2O3 = ZnO · Fe2O3
выше 600 С
6.
Состав огарка:Кислоторастворимый цинк 89-95 % от общего
Сульфидная сера
0,2 – 0,3 %
Сульфатная сера
1,5 – 2,0 %
Кислоторастворимый SiO2 70 % от общего
Кислоторастворимое железо 2 – 3 % от общего
Крупность (в том числе 10 % класса +1 мм) – 2 мм
Редкие металлы (In, Ga, Ge, Tl)
10 – 100 г/т
Кислоторастворимая медь 50 – 55 % от общего
Оптимальная крупность огарка, направляемого на
выщелачивание
0,15 мм.
7. Печь КС
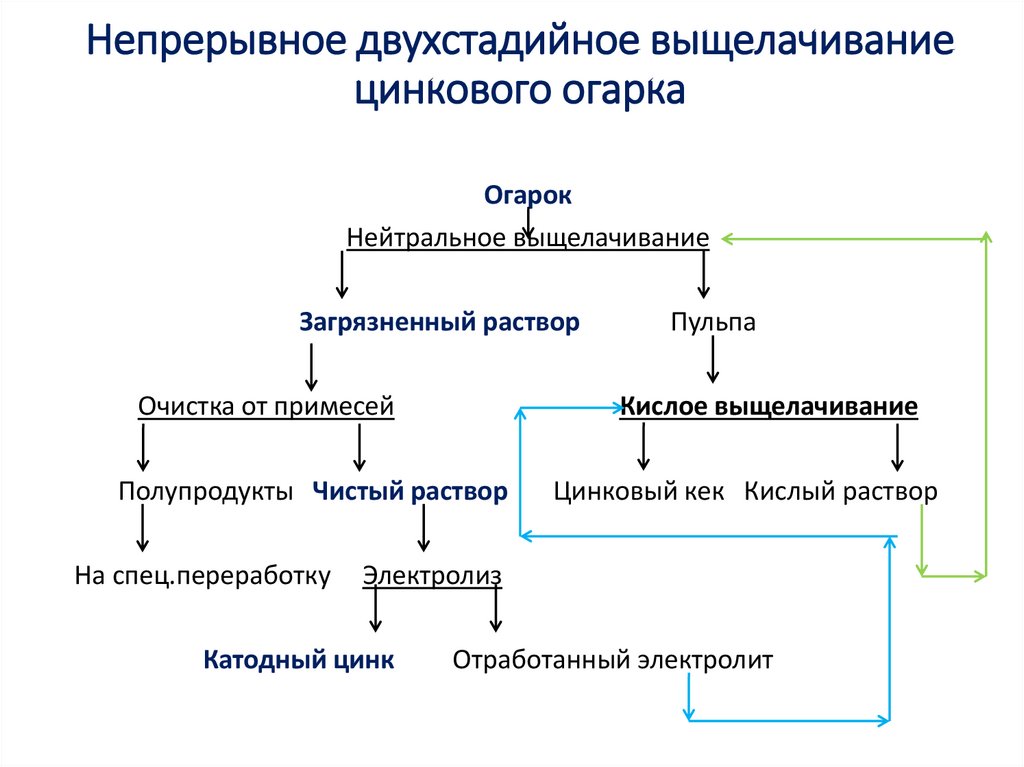
8. Непрерывное двухстадийное выщелачивание цинкового огарка
ОгарокНейтральное выщелачивание
Загрязненный раствор
Очистка от примесей
Кислое выщелачивание
Полупродукты Чистый раствор
На спец.переработку
Пульпа
Цинковый кек Кислый раствор
Электролиз
Катодный цинк
Отработанный электролит
9.
Выщелачивание огаркаZnO + H2SO4 → ZnSO4 + H2O
Механический
агитатор
1 – корпус
агитатора;
2 – пропеллерная
мешалка;
3 – загрузочное
отверстие для
огарка.
10. Пачук
11. Сгуститель с центральным приводом
12. Участок фильтрации цинковых кеков. Фильтр "НЕТЧ" (Усть-Каменогорский металлургический комплекс, Казахстан)
Участок фильтрации цинковых кеков. Фильтр "НЕТЧ"(Усть-Каменогорский металлургический комплекс,
Казахстан)
13.
ЦИНКОВЫЕ КЕКИСостав цинковых кеков, %:
23-27 Zn; 0,3-1,5 Cu; 0,2-0,3 Cd; 3-7 Pb;
11-20 Fe;
6-9 S; As, Sb, благородные и
редкие металлы, компоненты пустой породы
Выход
цинковых
кеков:
25-50% от
количества
исходного
огарка
14.
Химические реакции, идущие при вельцеванииЭндотермические (идут внутри шихты):
ZnO + C ↔ Znпар + CO
ZnO + СО ↔ Znпар + СО2
Экзотермические (идут на поверхности шихты):
2 Znпар + O2 = 2 ZnO
2СО+О2=2СО2
Реакции с участием железа:
2ZnO·SiO2 + 2Fe →2FeO·SiO2 + 2Znпар
ZnS + Fe → FeS + Znпар
15. Вельц-печь
16. Цех вельцевания (Риддерский металлургический комплекс, Казахстан)
17. Цех вельцевания. Выпуск клинкера (Риддерский металлургический комплекс, Казахстан)
18.
Продукты вельцевания цинковых кеков- свинцово-цинковые возгоны (вельц-окись):
50-55 % Zn ; 10-15 % Pb, Cd, редкие
металлы;
- клинкер: Fe до 50 %; C 20-40 % ;
до 1 % Zn; 0,3 % Pb; 2-3 % Сu; Au; Ag и
шлакообразующие.
19. Ярозит- процесс
1 СтадияВысокотемпературное выщелачивание (ВТВ):
температура 90-95оС,
продолжительность 4-5 ч,
растворитель - оборотный электролит (180-200 г/дм3 H2SO4)
Zn, Cu и Cd из кека переходят в раствор :
MeO*Fe2O3+ 4 H2SO4 = MeSO4+ Fe 2(SO4)3 + 4H2O
MeS + H2SO4 +1/2O2 = MeSO4+ H2O +S
20.
2 СтадияОсаждения ярозита:
- Нейтрализация цинковым огарком до рН 1,5;
- Добавка ярозит-образующих реагентов (Na2SO4, К2SO4, (NН4)2SO4)
из расчета 0,25 М/М Fe
- Осаждение железа в виде ярозитового соединения:
3Fe2(SO4)3 + Na2SO4 +12H2O = 2NaFe3(SO4)2*(OH)6 + 6H2SO4
Типичный состав ярозитового осадка, %:
5 Zn; 0,3 Cu; 0,05 Cd; 2 Pb; 24 Fe; 12 S
21.
ГЁТИТ-ПРОЦЕСС1 стадия ВТВ
Температура 95оС,
продолжительность 6-8 ч,
растворитель - отработанный электролит (180-200 г/дм3 H2SO4)
Остаточное содержание H2SO4 50г/дм3.
MeO*Fe2O3+ 4 H2SO4 = MeSO4+ Fe 2(SO4)3 + 4H2O
2 стадия Восстановления ионов Fe(III) до ионов Fe(II).
Добавки
- цинковый концентрат
- для нейтрализации избытка кислоты - огарок (остаточное
содержание кислоты до 3 г/дм3 ):
4Fe2(SO4)3 + МеS + 4H2O = МеSO4 + FeSO4+ 4H2SO4
22.
3 стадия Осаждение гётитаПродувка полученного раствора (рН=1,5-2,5, 90-95оС)
воздухом
Fe(II) переходит в нерастворимый гетитный осадок:
6FeSO4 + 3/2О2 +H2O = 2Fe2(SO4)3 + 2FeООН
Суммарная реакция для железа – реакция гидролиза
Fe2(SO4)3 + Н2О = 2FeOOH +3H2SO4
Состав гётитного осадка:
40-50% Fe, 3-4% Zn, As, Sb, Ge, Ga, In
23. Очистка растворов перед электролизом
1 операция: гидролитическое осаждение железа2FeSO4 + MnO2 + 2H2SO4 = Fe2(SO4)3 + MnSO4 + 2H2O
сульфат железа (III) гидролизует по реакции
Fe2(SO4)3 + 6H2O ⇄ 2Fe(OH)3 + 3H2SO4
2 операция: цементация
Zn + МеSO4 →ZnSO4 + Me
Здесь Ме – медь, кадмий, никель
1 стадия цементации: Cu2+ + Zn = Cu + Zn2+
2 стадия цементации:
Cd2+ + Zn = Cd + Zn2+
3 операция: Химическая очистка от кобальта Co(C2*H2OCS2)3
24.
Состав раствора сульфата цинка послеочистки от примесей, мг/дм3
120 – 180 Zn г/дм3;
0,05 – 0,2 As;
0,1 – 2,0 Cd;
0,1 – 4,0 Co;
20 – 50 F;
0,05 – 0,12 Cu;
2 – 10 Mn г/дм3;
0,01 – 0,015 Sb;
0,2 – 5,0 Fe;
20 – 300 Cl;
0,01 – 0,5 Ni;
0,05 – 0,1 Ge.
25. Электрохимический ряд напряжений металлов
Равновесиеметалл-ионы
Cu-Cu2+
Sb-Sb3+
Ge-Ge4+
Н2-Н+
Ni-Ni2+
Co-Co2+
Cd-Cd2+
Fe-Fe2+
Zn-Zn2+
Mn-Mn2+
Электродный
потенциал при 25°С, В
(восстановительный
потенциал)
+0,337
+0,240
+0,124
0
-0,236
-0,250
-0,403
-0,444
-0,763
-1,185
26. Электроэкстракция цинка из растворов
На катоде - восстановление ионов Zn2+ израствора до металлического состояния:
Zn2+ + 2е → Zn0
На аноде - разложение воды с образованием
газообразного кислорода:
Н2О – 2е → 0,5О2 ↑ + 2Н+
Образование серной кислоты при электролизе:
ZnSO4 + H2O = Zn + 0,5O2 + H2SO4
27. Свинцовые аноды
28.
Катодныеосновы (Al)
29. Выгрузка катодов
30.
31.
Слой цинка на катоде32. Сдирка катодного цинка (Усть-Каменогорский металлургический комплекс, Казахстан)
33. Карусельная разливочная машина (ЧЦЗ)
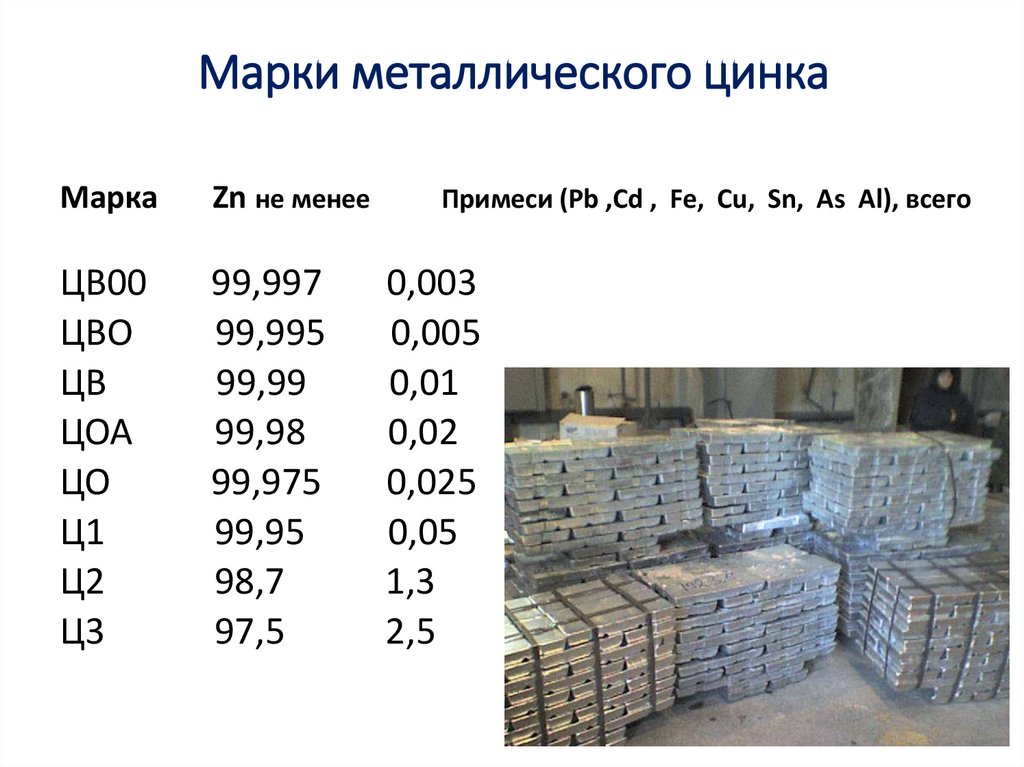
34. Марки металлического цинка
МаркаZn не менее
ЦВ00
ЦВО
ЦВ
ЦОА
ЦО
Ц1
Ц2
Ц3
99,997
99,995
99,99
99,98
99,975
99,95
98,7
97,5
Примеси (Pb ,Cd , Fe, Cu, Sn, As Al), всего
0,003
0,005
0,01
0,02
0,025
0,05
1,3
2,5
35. Мельница для сверхтонкого измельчения
36. Мельница IsaMill™ для сверхтонкого измельчения
37.
Выщелачивание пиритаFeS2 + 7Fe2(SO4)3 + 8H2O = 15FeSO4 + 8H2SO4
Окисление Fe(II) до Fe(III)
2FeSO4 + ½ O2 + H2SO4 = Fe2(SO4)3 + H2O
Выщелачивание сфалерита и галенита
ZnS + Fe2(SO4)3 = ZnSO4 + 2 FeSO4 + S
PbS + Fe2(SO4)3 = PbSO4 + 2 FeSO4 + S
Осаждение железа в виде ярозитового соединения
3Fe2(SO4)3 + Na2SO4 +12H2O = 2NaFe3(SO4)2*(OH)6 + 6H2SO4




































 Химия
Химия








