Похожие презентации:
Молекулы. Химические формулы. Молекулярные массы
1.
План занятия:Часть I
Молекулы.
Химические
формулы. Молекулярные
массы.
Простые
и сложные вещества.
Валентность
Моль.
элементов.
Молярная масса.
2.
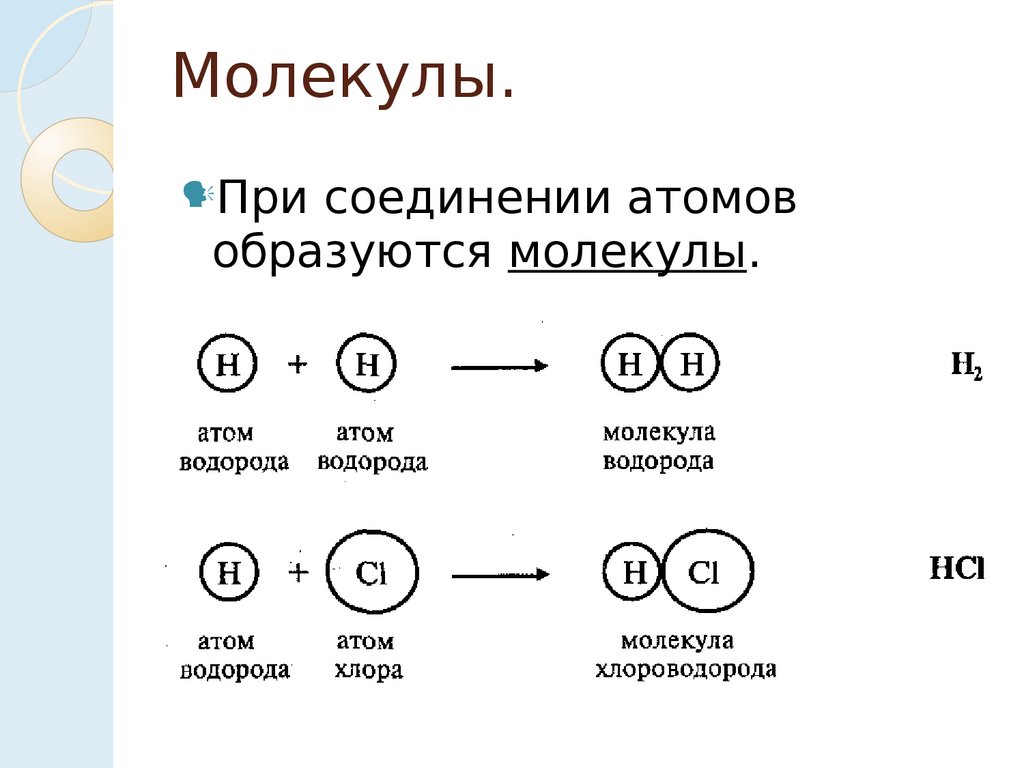
Молекулы.При
соединении атомов
образуются молекулы.
3.
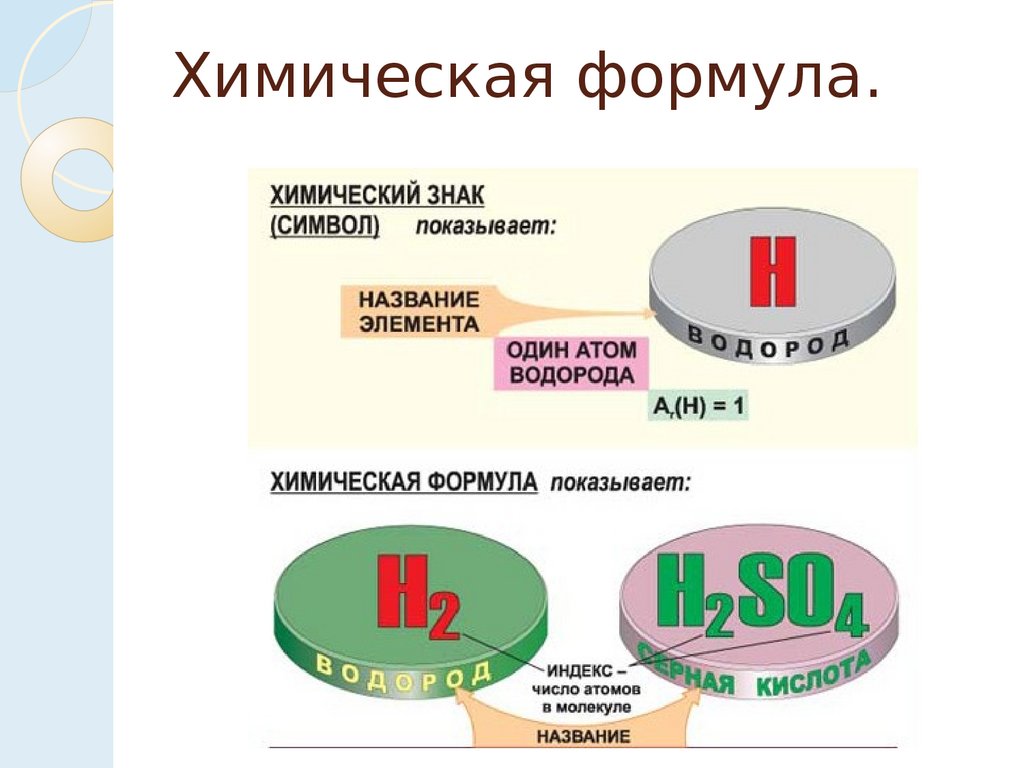
Химическая формула.Химическая формула условное обозначение
химического состава и
структуры соединений с
помощью
символов химических элементо
в
, числовых и вспомогательных
знаков.
4.
Химическая формула.5.
Химическая формула.6.
Молекулярные массы.Масса
любой молекулы равна
сумме образующих ее атомов.
Mr
– относительная
молекулярная масса.
Рассчитайте
Mr: азотной кислоты,
серной кислоты, гидроксида
натрия, оксида кальцияоксида
фосфора (V), судьфида
алюминия.
7.
Молекулярные массы.Mr
По
велечина безразмерная!
формуле вещества можно
рассчитать массовую долю
каждого химического
элемента, который входит в
состав вещества.
8.
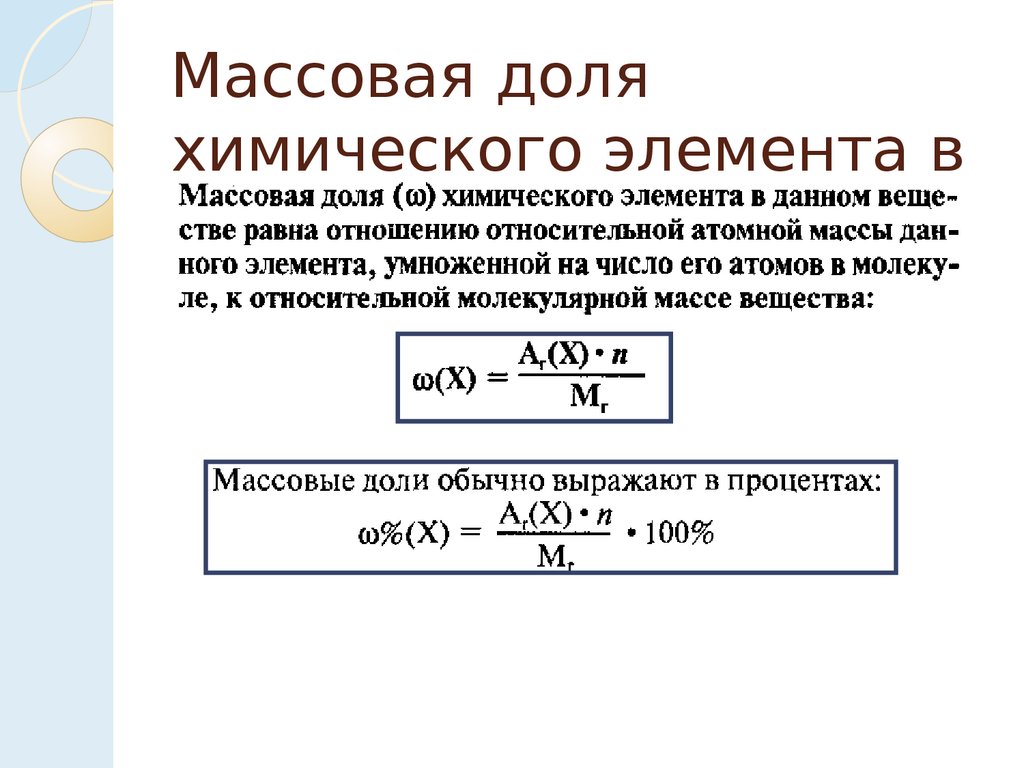
Массовая доляхимического элемента в
веществе.
9.
Простые и сложныевещества.
Все
вещества делятся на
простые и сложные.
Простые
Стожные
10.
Простые и сложныевещества.
Простые
вещества имеют:
1)
Молекулярное строение:
(фтор, хлор, азот, кислород)
2)
Атомное строение (железо,
медь, натрий)
3)
Или являются благородными
газами (ксенон, неон, аргон)
Название простых веществ
совпадают с названием
11.
Простые и сложныевещества.
Простые
вещества имеют:
1)
Молекулярное строение:
(фтор, хлор, азот, кислород)
2)
Атомное строение (железо,
медь, натрий)
3)
Или являются благородными
газами (ксенон, неон, аргон)
Название простых веществ
совпадают с названием
12.
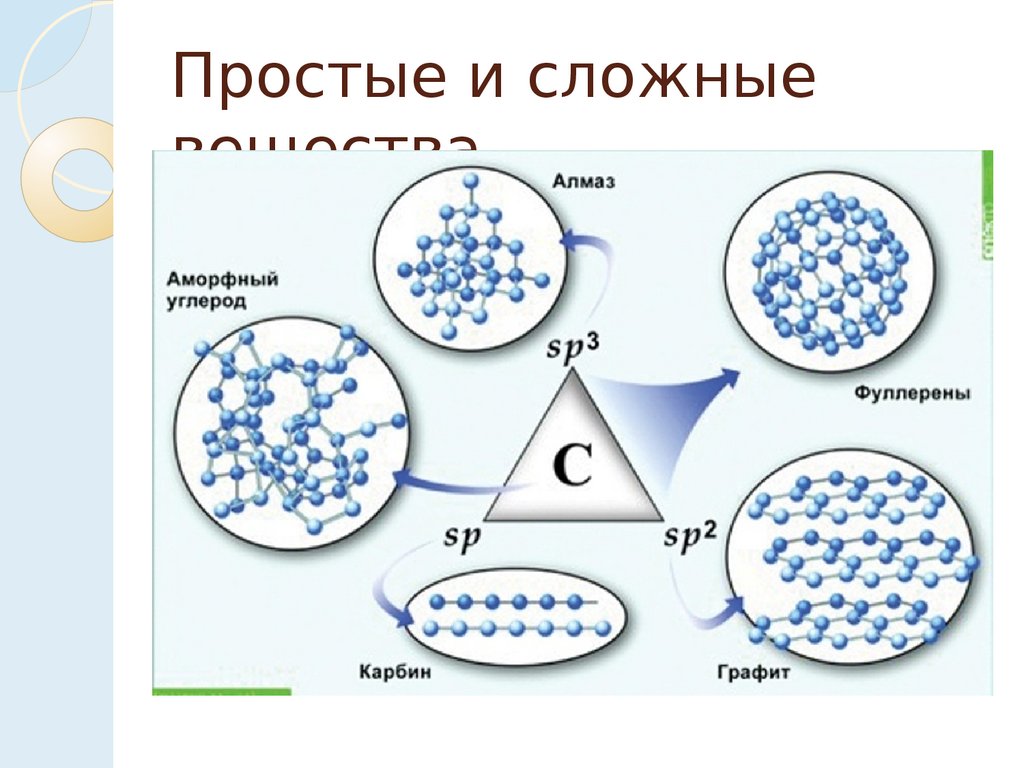
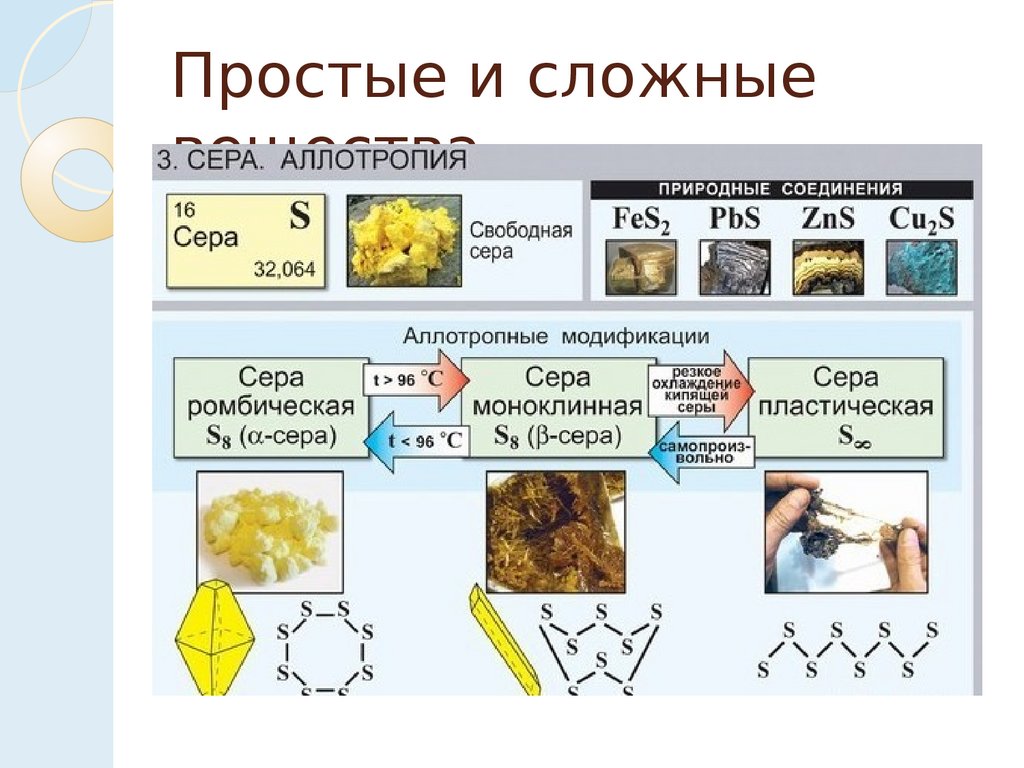
Простые и сложныевещества.
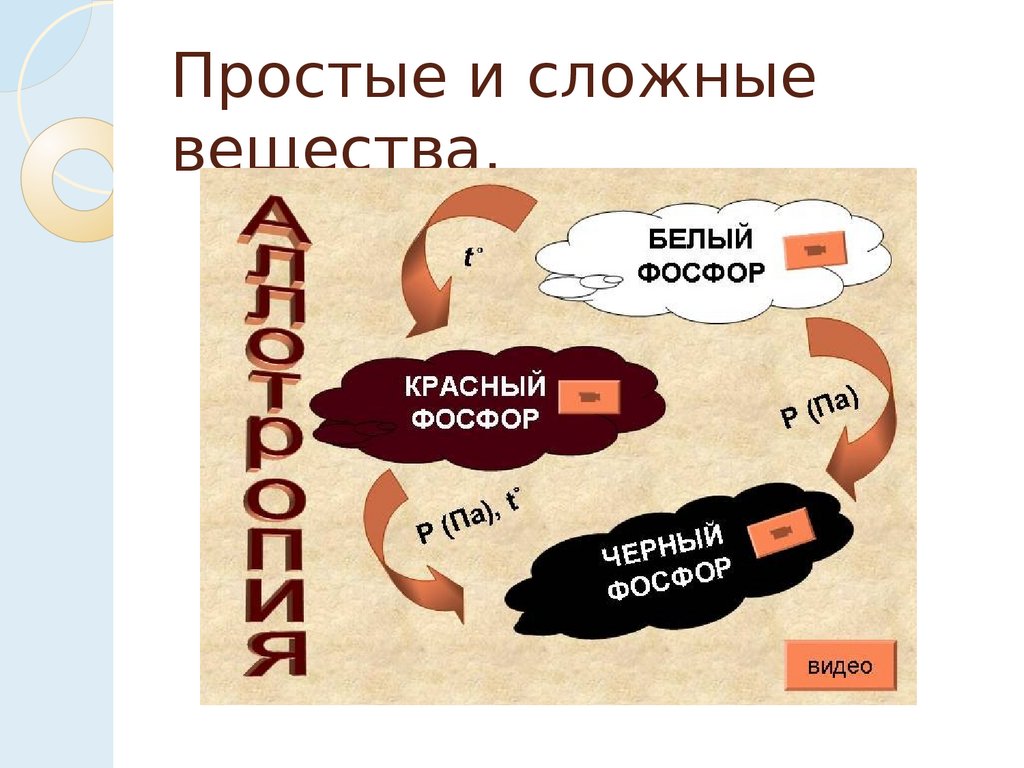
Аллотропия
– явление
образования нескольких
простых веществ одним
элементом.
Разные
простые вещества,
которые образуются одним и
тем же химическим элементом,
называются аллотропными
видоизменениями
(модификациями).
13.
Простые и сложныевещества.
14.
Простые и сложныевещества.
15.
Простые и сложныевещества.
16.
Простые и сложныевещества.
Сложные
вещества.
17.
Валентность элементов.Валентность обозначается римскими цифрами:
I, II, III, IV, V, VI, VII, VIII
18.
Валентность элементов.Элементы с постоянной
валентностью I:
H, F, щелочные металлы: Li, Na, K –
образуют только одну химическую
связь.
Элементы с постоянной
валентностью II:
19.
Валентность элементов.Атомы
этих элемнтов в разных
соединениях могут
образовывать разное число
химических связей.
20.
Валентность элементов.21.
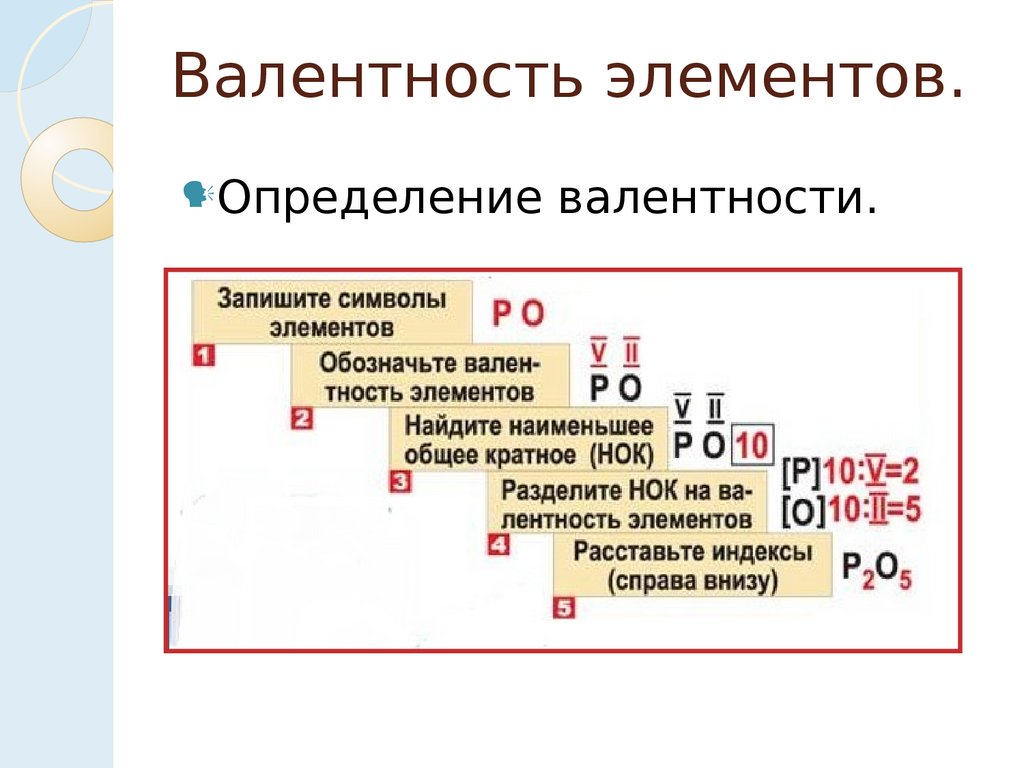
Валентность элементов.Определение
валентности.
22.
Валентность элементов.Правило
валентности:
Определить
валентность
элементов в соединениях: PH3,
P2O5 ,H2S, SiH4
23.
Моль. Молярная масса.Один
моль любого вещества
содержит столько молекул,
сколько содержится в 12
граммах углерода!
Число Авогадро
24.
Моль. Молярная масса.Если
вещество состоит из
молекул, то 1 моль это
молекул этого
вещества.
Если
вещество состоит из
атомов, 1 моль это
атомов этого вещества.
Следовательно:
25.
Моль. Молярная масса.26.
Моль. Молярная масса.Задача:
Решение:
27.
Моль. Молярная масса.Масса
одного моля вещества
называется молярной массой.
Молярная
г/моль.
масса выражается в
28.
Моль. Молярная масса.Определим
молярные массы:
Водорода
Глюкозы
Железа
Зная молярную массу вещества
М, можно рассчитать
количества вещества (число
молей) в любой данной массе
вещества:
29.
Моль. Молярная масса.Формула
для расчета числа
молекул (атомов), которое
содержится в данной массе к-л
вещества.






















 Химия
Химия








