Похожие презентации:
Структурная организация белков
1.
СЗГМУ им. И. И. МЕЧНИКОВАКАФЕДРА БИОЛОГИЧЕСКОЙ И ОБЩЕЙ ХИМИИ
БИОЛОГИЧЕСКАЯ ХИМИЯ-БИОХИМИЯ ПОЛОСТИ РТА
ЛЕКЦИЯ
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ
Доцент Антонова Ж.В.
2021/2022
2.
План лекции1. Характеристика протеиногенных аминокислот (классификация, посттрансляционная
модификация АК).
2. Первичная структура белков (определение понятия, образование пептидной связи и её
характеристика, строение полипептидной цепи, биологическая роль первичной
структуры белков).
3. Вторичная структура белков (определение понятия, виды вторичной структуры; связи,
стабилизирующие вторичную структуру, биологическая роль).
4. Третичная структура белков (определение понятия, виды структур; связи,
стабилизирующие третичную структуру; биологическая роль).
5.Четвертичная структура (определение понятия, биологическая роль, кооперативный
эффект на примере оксигенации гемоглобина).
6.Биологическая роль белков.
7.Классификация белков по строению (простые и сложные).
2
3.
ХАРАКТЕРИСТИКА ПРОТЕИНОГЕННЫХ АМИНОКИСЛОТ1. Белки – важнейшие биополимеры, мономерами которых являются
-аминокислоты, относящиеся к L – стереохимическому ряду.
2. В настоящее время в составе белков человека обнаружена 21 L – АК.
3. Каждая из этих АК генетически закодирована одним или несколькими
триплетами азотистых оснований – кодонами. Поэтому АК, кодируемые
кодонами и входящие в состав белков, называются протеиногенные.
4. Для записи аминокислотной последовательности в составе белков и
пептидов используются трехбуквенные или однобуквенные сокращения,
например Арг-Гли-Асп (Arg-Gly-Asp), или R-G-D.
5. Протеиногенные - АК классифицируются на основе физикохимических свойств боковых радикалов (слайд 4 и 5).
3
4.
Классификация протеиногенных аминокислотПо химическому строению - АК делятся на 5 групп
АК с алифатическими радикалами (Гли, Ала, Вал, Лей, Иле)
АК, содержащие в алифатическом радикале дополнительную
функциональную группу (гидроксильную – Сер, Тре;
карбоксильную- Асп, Глу; амидную- Асн, Глн; аминогруппу –
Лиз; гуанидиновую группу- Арг; содержащие серу- Цис, Мет)
АК, содержащие ароматический радикал (Фен, Тир)
АК с гетероциклическими радикалами (Три, Гис)
Иминокислота (Про)
4
5.
Классификация протеиногенных аминокислотПо полярности (заряду) и растворимости в воде (гидрофильности или
гидрофобности) боковых радикалов - АК подразделяются на 4 группы
АК с неполярными (гидрофобными) радикалами
АК с полярными (гидрофильными) незаряженными радикалами (Гли,
Сер, Тре, Тир, Цис, Se-Цис, Асн, Глн)
АК с полярными (гидрофильными) положительно заряженными
радикалами (Лиз, Арг, Гис)
АК с полярными (гидрофильными) отрицательно заряженными
радикалами (Асп, Глу)
6. Протеиногенные - АК по возможности синтеза в организме делятся на
заменимые и незаменимые. Незаменимые АК для взрослого здорового
человека: Вал, Иле, Лей, Лиз, Мет, Тре, Три, Фен; к условно незаменимым
относят Гис и Арг вследствие недостаточности синтеза в организме,
5
особенно у детей.
6.
Посттрансляционная модификация протеиногенных АК7. После синтеза белковой цепи, некоторые АК в составе белка могут
подвергаться посттрансляционной модификации, превращаясь в
фосфорилированные, гидроксилированные, карбоксилированные,
гликозилированные, метилированные, ацилированные и др. производные
этих АК. Введение дополнительных групп в структуру АК придает белкам
свойства, необходимые для выполнения ими специфических функций.
Например:
гидроксилирование Про и Лиз в ходе внутриклеточной стадии синтеза
коллагена необходимо для последующей стабилизации тройной спирали
проколлагена, т.к. НО- группы гидроксипролина участвуют в
образовании водородных связей между цепями. А гидроксилизин очень
важен для образования ковалентных связей между молекулами
коллагена в ходе сборки коллагеновых фибрилл.
6
7.
Посттрансляционная модификация протеиногенных АКгликозилирование по ОН – группам Сер или Тре (О-гликозилирование)
или по Асн (N-гликозилирование) идет у белков , входящих в состав
плазматических мембран или секретирующихся из клеток; белков эмали
зуба в ходе ее созревания;
гамма-карбоксилирование радикалов Глу в составе кальций
связывающих белков минерализованных тканей костей и зубов
(остеокальцин, Gla-белки), а также в составе различных факторов
свертывания крови (фактор IIа – тромбин);
фосфорилирование по ОН –группам Сер и/или Тре идет у белков
дентина (фосфофорин) и белков эмали в ходе ее созревания; у
гистоновых белков; в ходе регуляции активности ферментов
(фосфорилирование/дефоффорилирование) и др.
7
8.
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКОВПервичная структура белка –это уникальная, генетически
детерминированная линейная последовательность
аминокислотных остатков, связанных пептидными связями.
Условно принято считать, что аминокислотные
последовательности, содержащие до десяти аминокислотных
остатков, - это олигопептиды, от десяти до пятидесяти –
полипептиды, а более пятидесяти – белки.
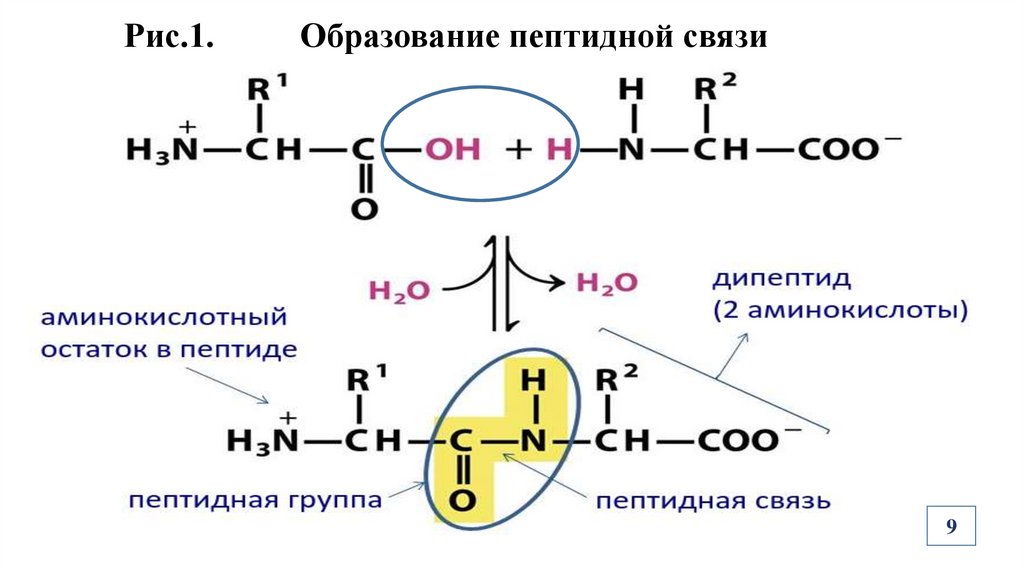
Образование ковалентной пептидной (амидной) связи происходит
в результате взаимодействия карбоксильной группы одной АК с аминогруппой другой АК с выделением молекулы воды (Рис. 1).
Радикалы АК не участвуют в образовании пептидных связей в
молекулах белков!
8
9.
Рис.1.Образование пептидной связи
9
10.
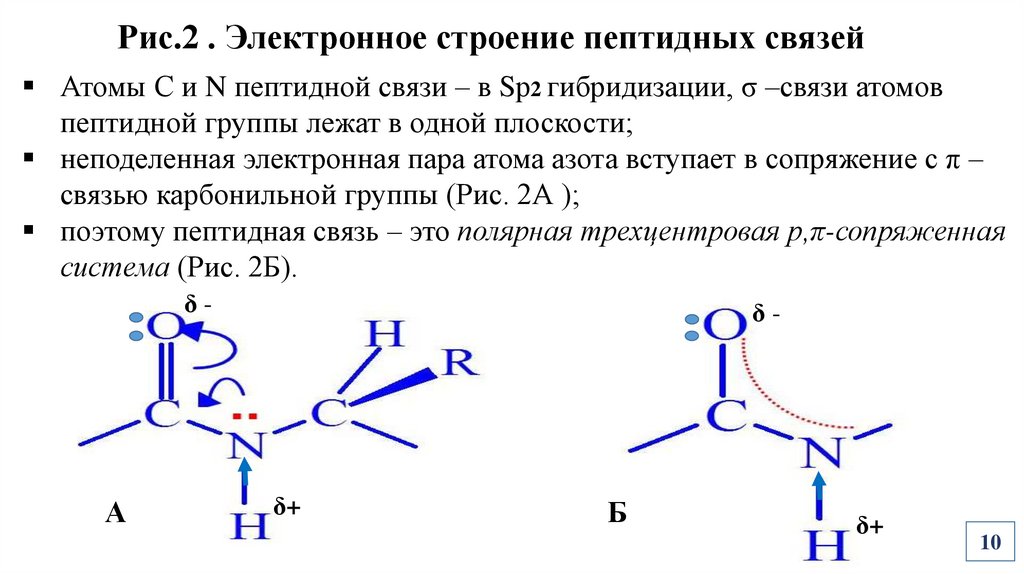
Рис.2 . Электронное строение пептидных связейАтомы С и N пептидной связи – в Sр2 гибридизации, σ –связи атомов
пептидной группы лежат в одной плоскости;
неподеленная электронная пара атома азота вступает в сопряжение с π –
связью карбонильной группы (Рис. 2А );
поэтому пептидная связь – это полярная трехцентровая р,π-сопряженная
система (Рис. 2Б).
δ-
А
δ-
δ+
Б
δ+
10
11.
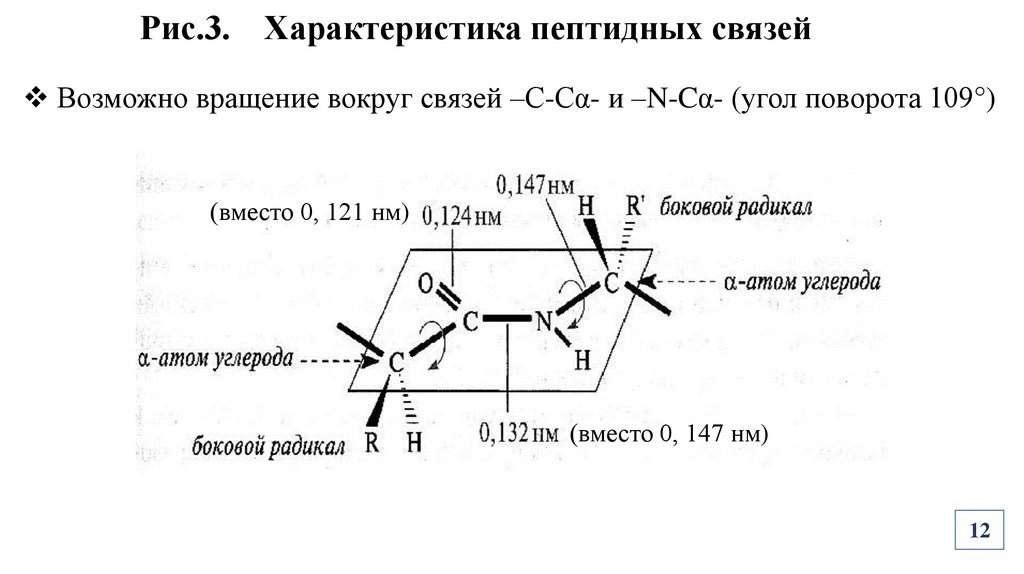
Характеристика пептидных связейВ результате сопряжения связи «выравниваются» (-С-Nукорачивается, –С=О –удлиняется), связь -С-N приобретает характер
двоесвязанности, становится «полуторной».
Вращение вокруг пептидной связи – затруднено, следовательно она –
жесткая, планарная.
Есть лактим-лактамная таутомерия. За счет лактимной формы
пептидных связей пептиды и белки дают качественную биуретовую
реакцию с ионами Cu 2+, используемую для качественного и
количественного определения общего белка в биологических
жидкостях.
Транс- конфигурация пептидной связи более энергетически выгодна и
позволяет образовать 2 водородные связи для стабилизации 2-й
структуры.
11
12.
Рис.3. Характеристика пептидных связейВозможно вращение вокруг связей –С-Сα- и –N-Cα- (угол поворота 109°)
(вместо 0, 121 нм)
(вместо 0, 147 нм)
12
13.
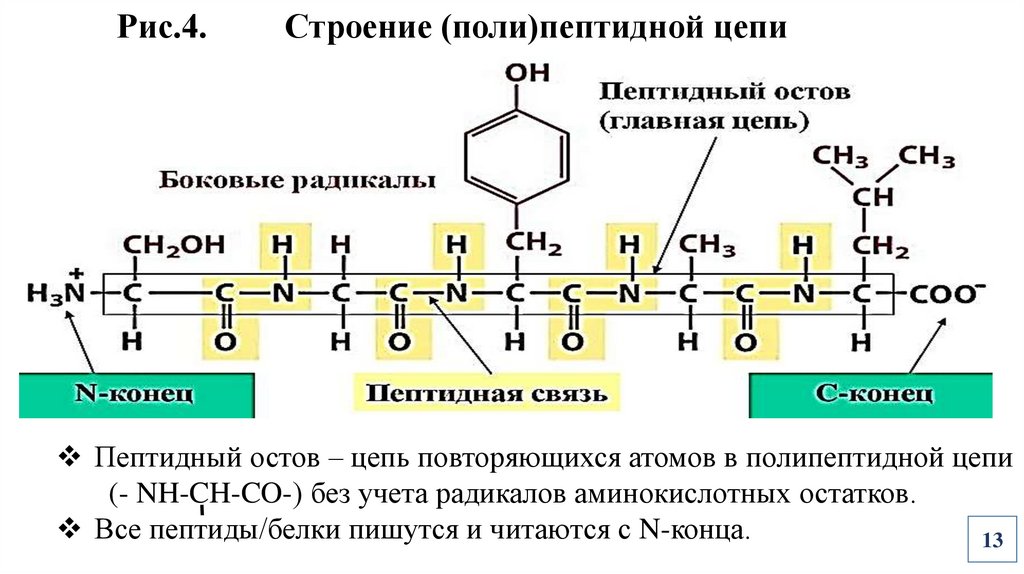
Рис.4.Строение (поли)пептидной цепи
Пептидный остов – цепь повторяющихся атомов в полипептидной цепи
(- NH-CH-CO-) без учета радикалов аминокислотных остатков.
Все пептиды/белки пишутся и читаются с N-конца.
13
14.
Биологическая роль первичной структуры белковопределяет дальнейшую укладку белка в пространстве, т.е.
вторичную, третичную и четвертичную структуру белка
определяет физико-химические свойства белков
определяет биологическую роль белка
определяет видовую специфичность белка
Гомологичные белки выполняют одинаковые функции в организме
разных биологических видов, например гемоглобин. У таких белков
есть инвариантные участки в первичной структуре, имеющие
одинаковую аминокислотную последовательность и отвечающие за
функцию данного белка. А есть вариабельные участки,
отличающиеся аминокислотными последовательностями у разных
видов и определяющие видовую специфичность этого белка.
14
15.
Установление первичной структуры белковОсуществляется путем определения их состава и аминокислотной
последовательности – «секвенирование». Первоначально
секвенирование проводили последовательным гидролизом пептидных
связей исследуемого белка, затем определяли концевые
аминокислотные остатки с помощью различных химических реакций.
Современные роботизированные приборы секвенаторы позволяют
быстро установить аминокислотную последовательность, для чего
необходимо не более 1 нг (!) белка.
Установление первичной структуры белков и пептидов необходимо для
понимания механизмов патогенеза различных заболеваний, создания
синтетических лекарственных средств и других медико-биологических
задач.
15
16.
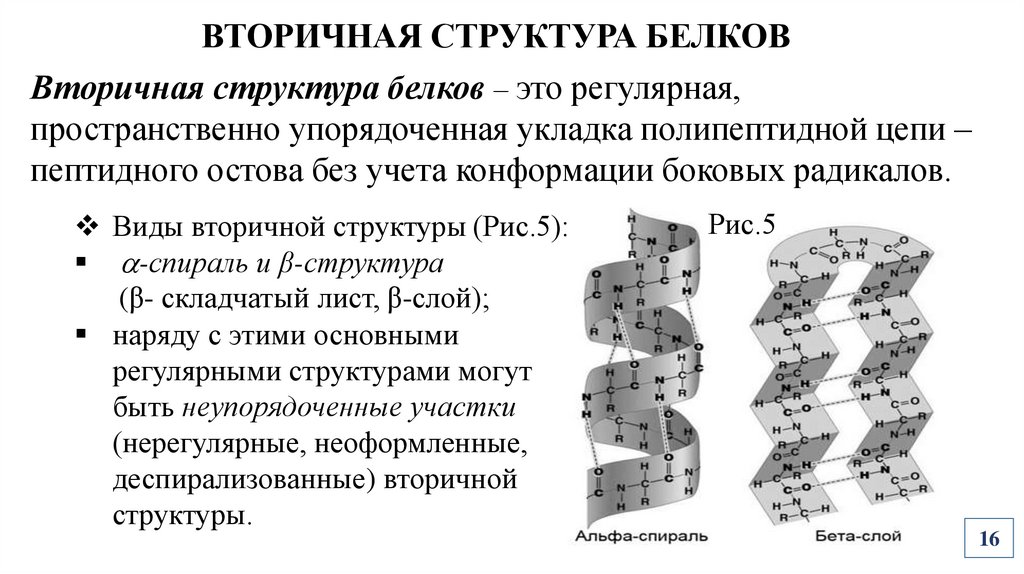
ВТОРИЧНАЯ СТРУКТУРА БЕЛКОВВторичная структура белков – это регулярная,
пространственно упорядоченная укладка полипептидной цепи –
пептидного остова без учета конформации боковых радикалов.
Виды вторичной структуры (Рис.5):
-спираль и β-структура
(β- складчатый лист, β-слой);
наряду с этими основными
регулярными структурами могут
быть неупорядоченные участки
(нерегулярные, неоформленные,
деспирализованные) вторичной
структуры.
Рис.5
16
17.
Связи, стабилизирующие вторичную структуру.Связи, стабилизирующие -Спираль и β- структуру, – водородные.
Образованы атомами пептидных групп полипептидного остова:
в -спирали каждая -NH группа полипептидного остова образует
δ- δ+
водородную связь ( -С=О … Н-N- ) с группой –С=О четвертого от нее
аминокислотного остатка;
в -спирали водородные связи направлены параллельно оси молекулы,
поэтому -спирали устойчивы к деформации (сжатию и растяжению);
в β- структуре водородные связи формируются между атомами
пептидных групп линейных областей одной полипептидной цепи,
делающей изгиб (Рис.5), или между разными цепями;
в β- структуре водородные связи направлены перпендикулярно оси
молекулы, поэтому структура подвержена сжатию и растяжению.
17
18.
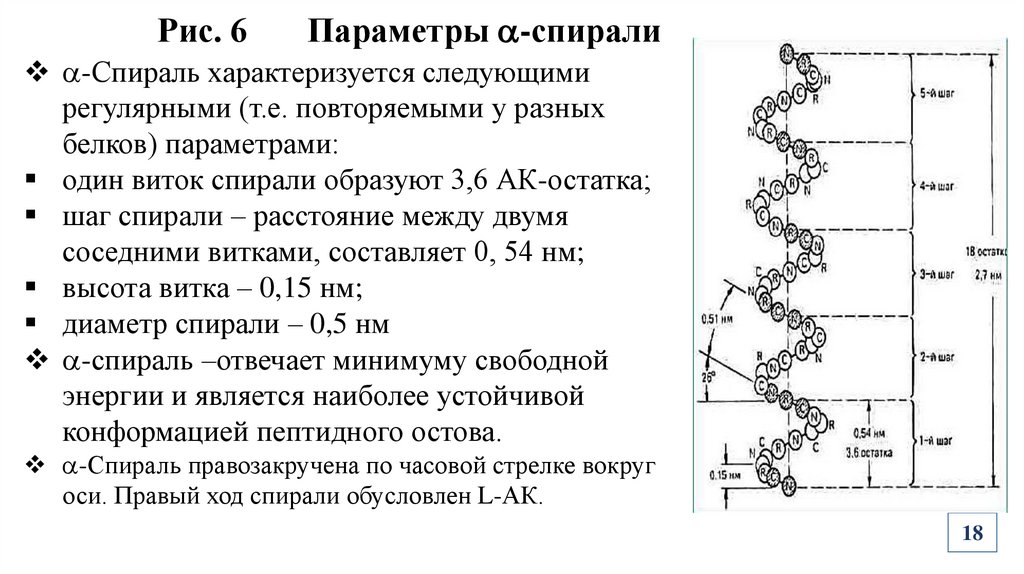
Рис. 6Параметры -спирали
-Спираль характеризуется следующими
регулярными (т.е. повторяемыми у разных
белков) параметрами:
один виток спирали образуют 3,6 АК-остатка;
шаг спирали – расстояние между двумя
соседними витками, составляет 0, 54 нм;
высота витка – 0,15 нм;
диаметр спирали – 0,5 нм
-спираль –отвечает минимуму свободной
энергии и является наиболее устойчивой
конформацией пептидного остова.
-Спираль правозакручена по часовой стрелке вокруг
оси. Правый ход спирали обусловлен L-АК.
18
19.
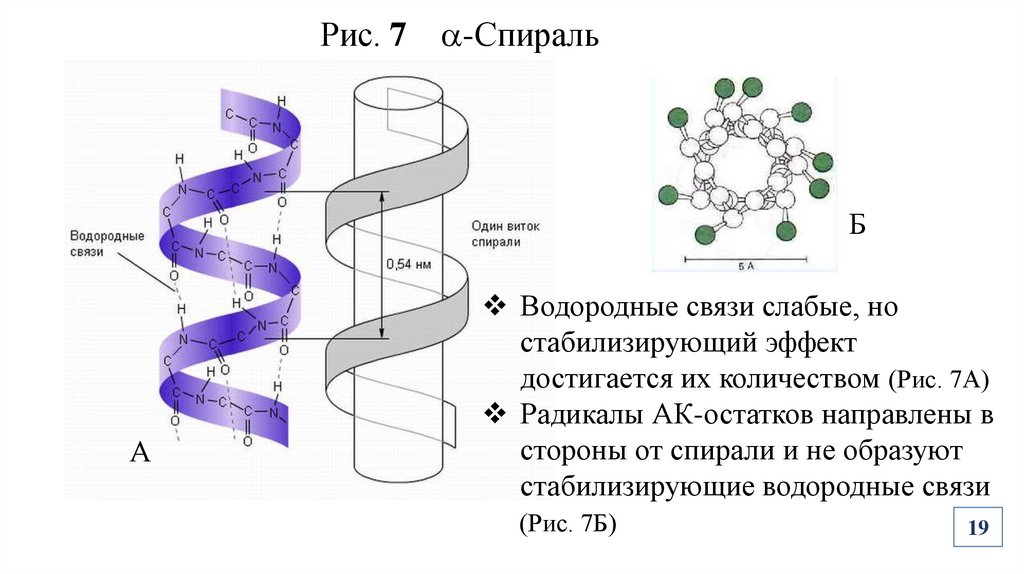
Рис. 7 -СпиральБ
А
Водородные связи слабые, но
стабилизирующий эффект
достигается их количеством (Рис. 7А)
Радикалы АК-остатков направлены в
стороны от спирали и не образуют
стабилизирующие водородные связи
(Рис. 7Б)
19
20.
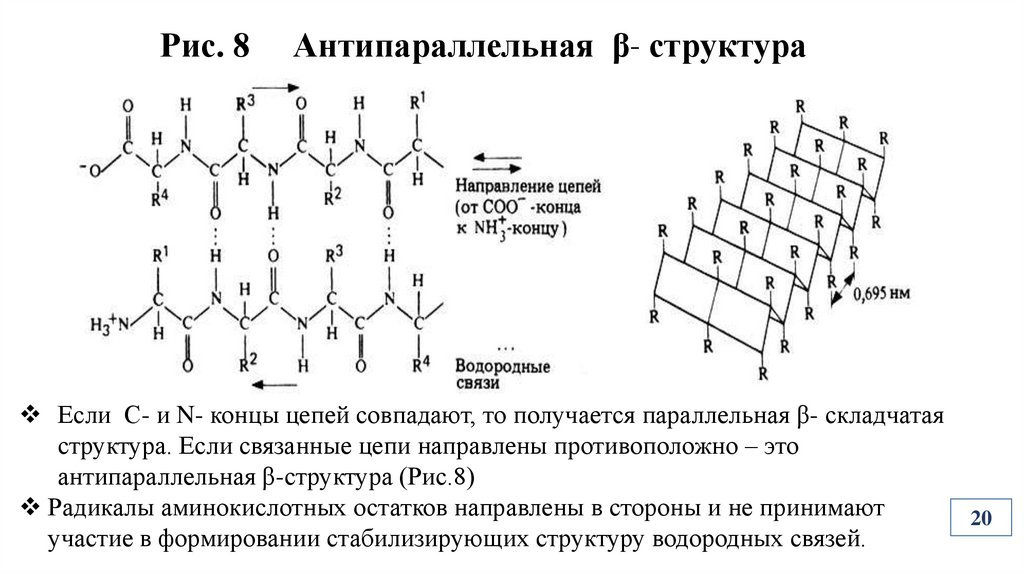
Рис. 8Антипараллельная β- структура
Если С- и N- концы цепей совпадают, то получается параллельная β- складчатая
структура. Если связанные цепи направлены противоположно – это
антипараллельная β-структура (Рис.8)
Радикалы аминокислотных остатков направлены в стороны и не принимают
участие в формировании стабилизирующих структуру водородных связей.
20
21.
Нерегулярные, (неупорядоченые, неспирализованные) участкивторичный структуры.
Факторы нарушающие спирализацию:
• включение пролина вызывает угол поворота цепи 135°
• одноименно заряженные радикалы аминокислот
• объемные радикалы изменяют шаг спирали
• гидрофобные радикалы
• образование -S-S- связей
Биологическая роль неспирализованных (неупорядоченных,
нерегулярных) структур заключается в том, что в этих участках
полипептидная цепь может сделать изгиб, поворот, необходимый для
формирования, например, компактной глобулы.
21
22.
Биологическая роль вторичной структурыВторичная структура необходима для формирования последующих
уровней организации белков.
В глобулярных и фибриллярных белках обнаружены как -спирали,
так и β-структуры.
За открытие вторичной структуры белка с использованием метода
рентгеноструктурного анализа Л. Полинг получил нобелевскую
премию (1954 г.)
Альфа- структурная организация белковой цепи получила название
«модель Л. Полинга – Р. Кори»
22
23.
ТРЕТИЧНАЯ СТРУКТУРА БЕЛКАТретичная структура белка – это трёхмерная пространственная
структура (конформация), образующаяся за счет взаимодействий между
радикалами аминокислотных остатков.
Виды третичной структуры:
глобулярнуая (шарообразная)-гемоглобин, все ферменты, алюбумины;
фибриллярная (вытянутая, волокнистая)-коллагены, кератин, миозин;
При формировании третичной структуры радикалы аминокислотных
остатков сближаются в пространстве так, что между ними возможно
взаимодействие за счет водородных, ионных, гидрофобных связей,
дисульфидных мостиков, которые стабилизируют всю структуру.
Сближение и особая ориентация в пространстве аминокислотных
радикалов формируют функциональные центры, вследствие чего белок
начинает выполнять свою функцию.
23
24.
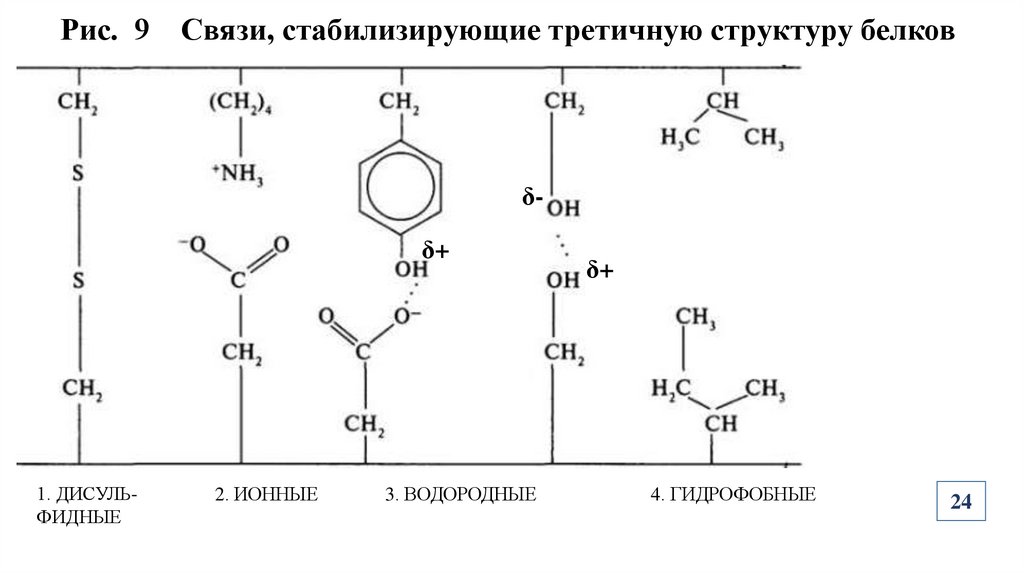
Рис. 9 Связи, стабилизирующие третичную структуру белковδδ+
1. ДИСУЛЬФИДНЫЕ
2. ИОННЫЕ
3. ВОДОРОДНЫЕ
δ+
4. ГИДРОФОБНЫЕ
24
25.
ШАПЕРОНЫРоль шаперонов первого типа -формирование нативной
пространственной структуры белков или фолдинг. Они
обеспечивают завершение формирования третичной
структуры белковой молекулы, белок приобретает
стабильную нативную (природную) конформацию.
Роль шаперонов второго типа – «белков теплового шока» восстановление третичной структуры белка после
конформационных (обратимых) изменений в результате
воздействия температуры, рН, присоединения лигандов
25
26.
Роль третичной структурыБелок приобретает нативную форму и становится функционально
активным за счет образования функциональных центров.
Регуляторная роль конформационных изменений третичной
структуры: изменение t, рН, присоединение лигандов и др.воздействия
приводят к обратимым конформационным изменениям белка, а
следовательно, изменению скорости выполнения его функции, что
лежит в основе регуляции.
Белок реагирует на изменение окружающей среды, следовательно,
конформационные изменения белков лежат в основе адаптации
организма к условиям окружающей среды.
26
27.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКОВЧетвертичная структура белков –это ассоциация одинаковых или
разных белковых глобул (субъединиц, протомеров) в единый
комплекс. Такие белки называются олигомерными и имеют большую
молекулярную массу.
Взаимодействие протомеров осуществляется во многих точках
контактирующих поверхностей с образованием десятков слабых
связей: гидрофобных, водородных, ионных.
Благодаря этому контактные поверхности соединяются с высокой
специфичностью, и ошибки в формировании четвертичной
структуры белков практически исключены.
27
28.
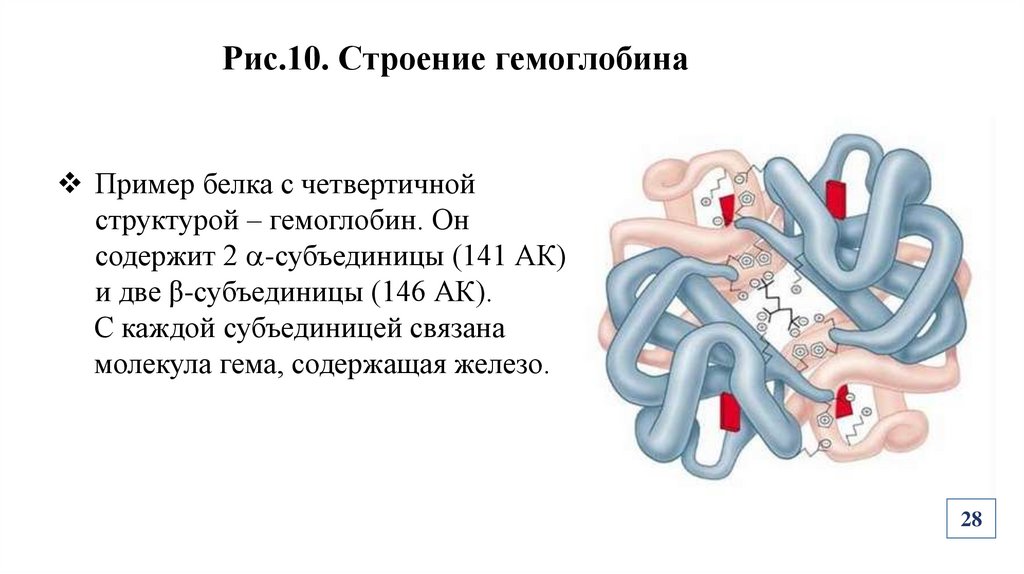
Рис.10. Строение гемоглобинаПример белка с четвертичной
структурой – гемоглобин. Он
содержит 2 -субъединицы (141 АК)
и две β-субъединицы (146 АК).
С каждой субъединицей связана
молекула гема, содержащая железо.
28
29.
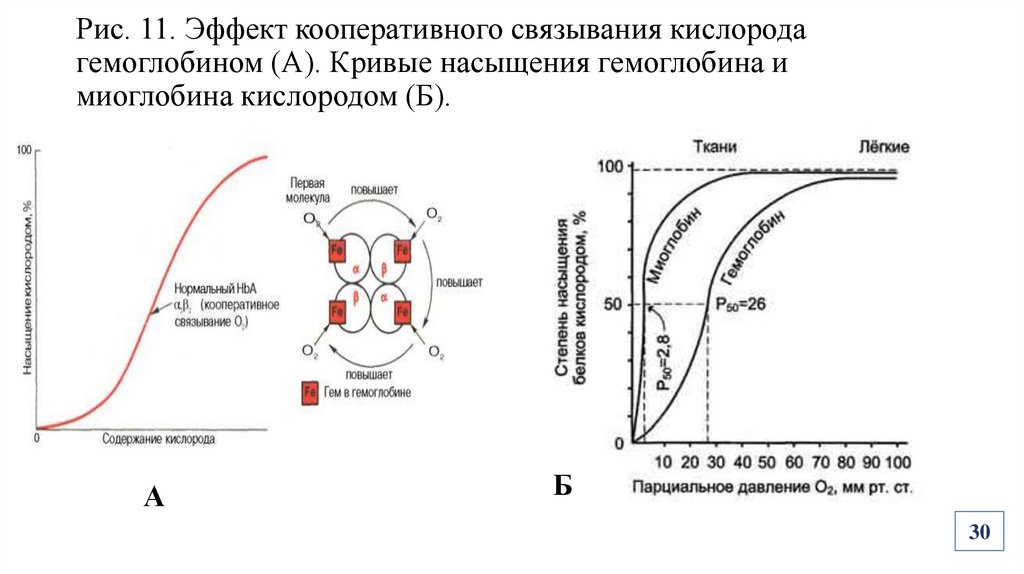
Биологическая роль четвертичной структуры белковПоявление кооперативного эффекта при выполнении функций (Рис.11)
Появление регуляции активности белков за счет наличия дополнительных субъединиц
с регуляторными центрами.
Создание большего разнообразия форм у белков с четвертичной структурой и
разными субъединицами. Например, за счет комбинации различных субъединиц
образуются органоспецифические изоферменты. Комбинация 2-х типов субъединиц Н
и М дает 5 изоферментов лактатдегидрогеназы (ЛДГ): ЛДГ1 -(НННН); ЛДГ2 – (НННМ);
ЛДГ3 – (ММНН); ЛДГ4 – (МММН); ЛДГ5 – (ММММ).
Интеграция нескольких взаимосвязанных функций в единой структуре. Например,
синтез высшей жирной кислоты (ВЖК) на полиферментном комплексе, где каждая
субъдиница, обладающая ферментативной активностью, последовательно выполняет
свою реакцию в едином многоступенчатом метаболическом процессе синтеза ВЖК.
При этом промежуточные продукты синтеза не уходят во внутреннюю среду, а
передаются сразу от одной субъединицы на другую, т.е. происходит
формирование метаболических и транспортных туннелей.
29
30.
Рис. 11. Эффект кооперативного связывания кислородагемоглобином (А). Кривые насыщения гемоглобина и
миоглобина кислородом (Б).
А
Б
30
31.
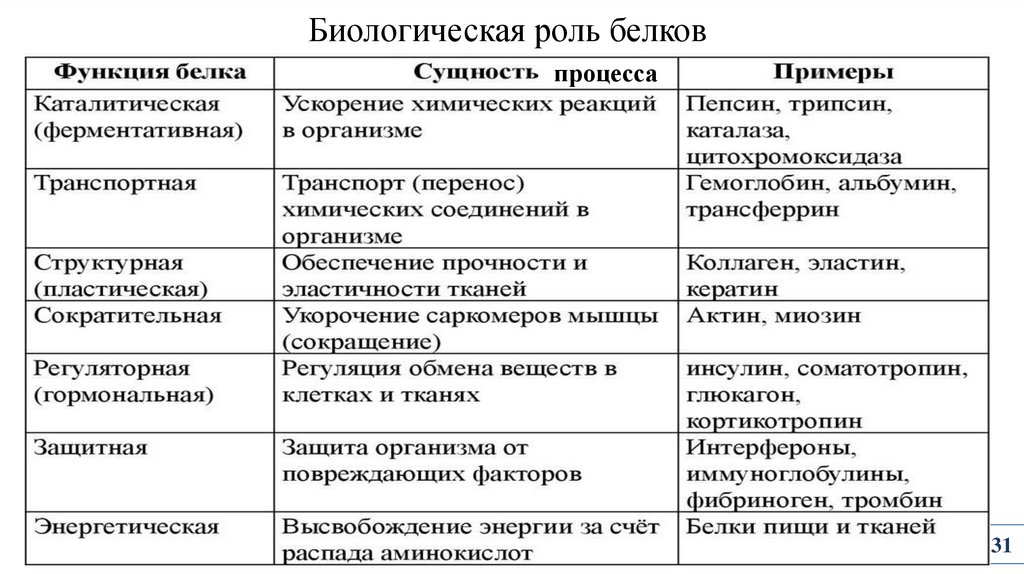
Биологическая роль белковпроцесса
31
32.
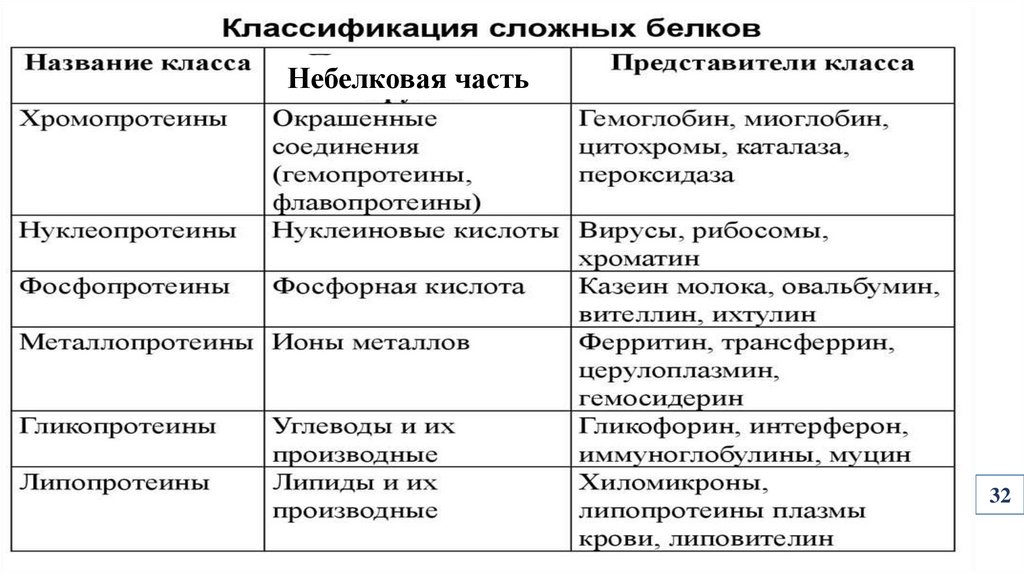
Небелковая часть32
33.
БЛАГОДАРЮ ЗА ВНИМАНИЕ!ПРОЙДИТЕ ТЕСТИРОВАНИЕ.
33




















 Биология
Биология








