Похожие презентации:
Основания. Определение
1. Основания
Презентация по химии для 8класса.Учитель МБОУ ООШ г. Кирсанова:
Е. А. Гвоздева.
2. Определение.
Основания – это сложные вещества, состоящие изионов металлов и связанных с ними гидроксидионов.
Основания – электролиты, при диссоциации
которых образуются катионы металла и анионы
кислотного остатка.
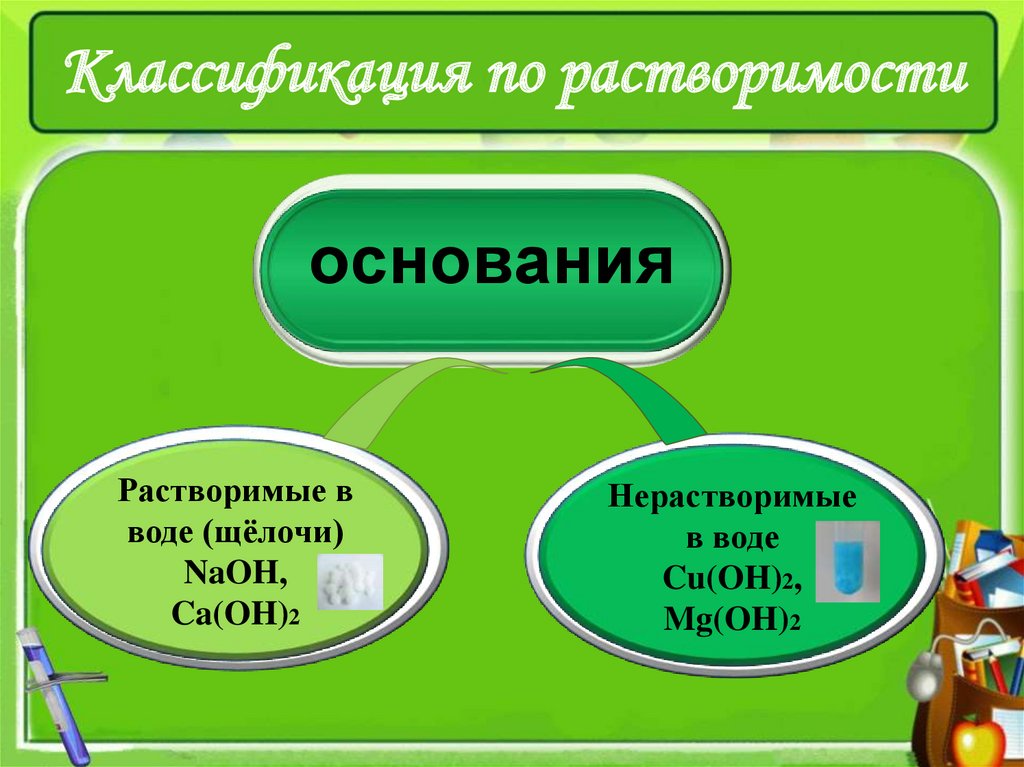
3. Классификация по растворимости
основанияРастворимые в
воде (щёлочи)
NaOH,
Ca(OH)2
Нерастворимые
в воде
Cu(OH)2,
Mg(OH)2
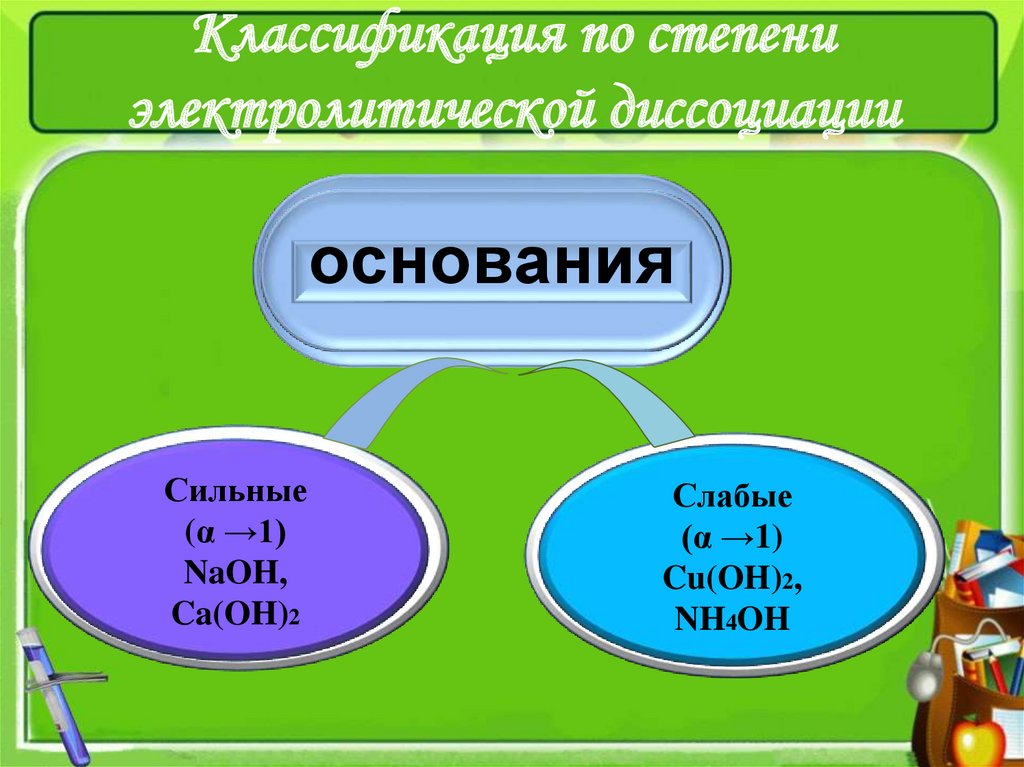
4. Классификация по степени электролитической диссоциации
основанияСильные
(α →1)
NaOH,
Ca(OH)2
Слабые
(α →1)
Cu(OH)2,
NH4OH
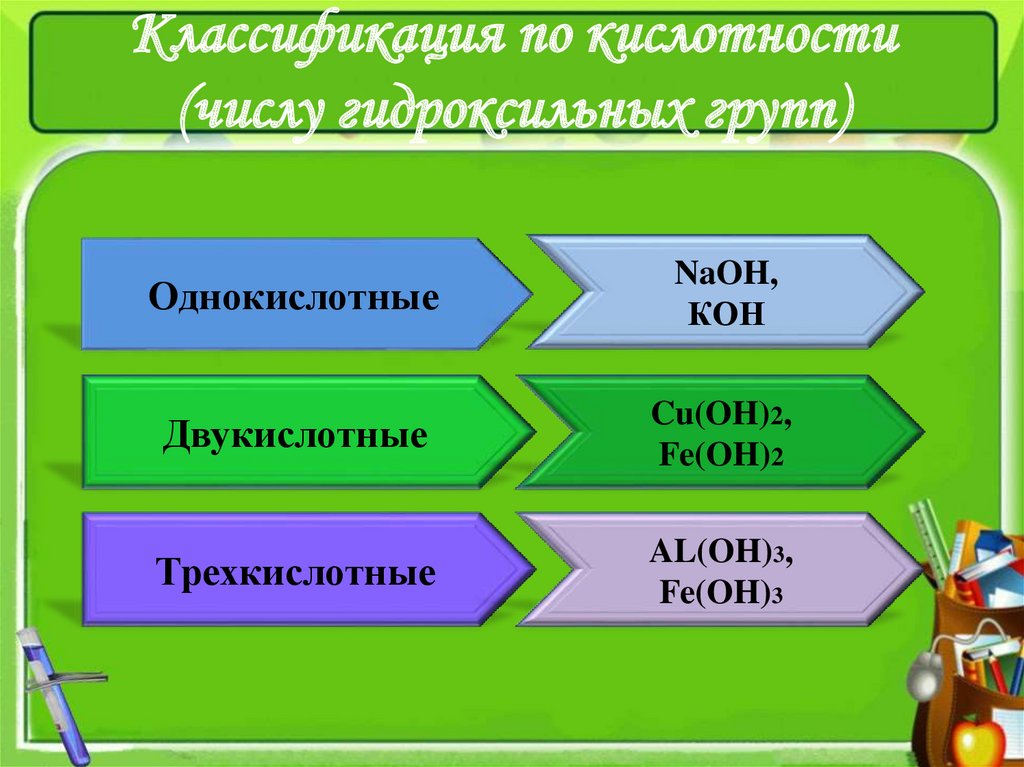
5. Классификация по кислотности (числу гидроксильных групп)
ОднокислотныеNaOH,
КOH
Двукислотные
Cu(OH)2,
Fe(OH)2
Трехкислотные
AL(OH)3,
Fe(OH)3
6. Химические свойства щелочей
Качественные реакции для щелочейИндикатор
Нейтральная среда
Щелочная среда
Лакмус
фиолетовый
синий
Метиловый оранжевый
оранжевый
жёлтый
Фенолфталеин
бесцветный
малиновый
7. Химические свойства щелочей
1. Щелочь + кислота = соль + вода (нейтрализация)NaOH + HCl = NaCl + H2O
2. Щёлочь (изб.) + кислотный оксид = соль + вода
2NaOH + CO2 = Na2CO3 + H2O
3. Щёлочь (нед.) + кислотный оксид = кислая соль
NaOH + CO2 = NaНCO3
4. Щёлочь + соль = гидроксид+ новая соль
2NaOH + CuSO4 = Na2SO4 +Cu(OH)2
8. Химические свойства гидроксидов
1. Гидроксид + кислота = соль + водаCu(OH)2 + 2HCl = CuCl2 + H2O
2. Разложение на оксид и воду
Cu(OH)2 =t СuO + H2O
9. Химические свойства амфотерных гидроксидов
1. Гидроксид + кислота = соль + водаZn (OH)2 + 2HCl = ZnCl2 + 2H2O
2. Гидроксид + щелочь = соль + вода
Zn (OH)2 + 2NaOH Na2ZnO2 + 2H2O







 Химия
Химия








