Похожие презентации:
Галогены. Свойства элементов 7 А группы
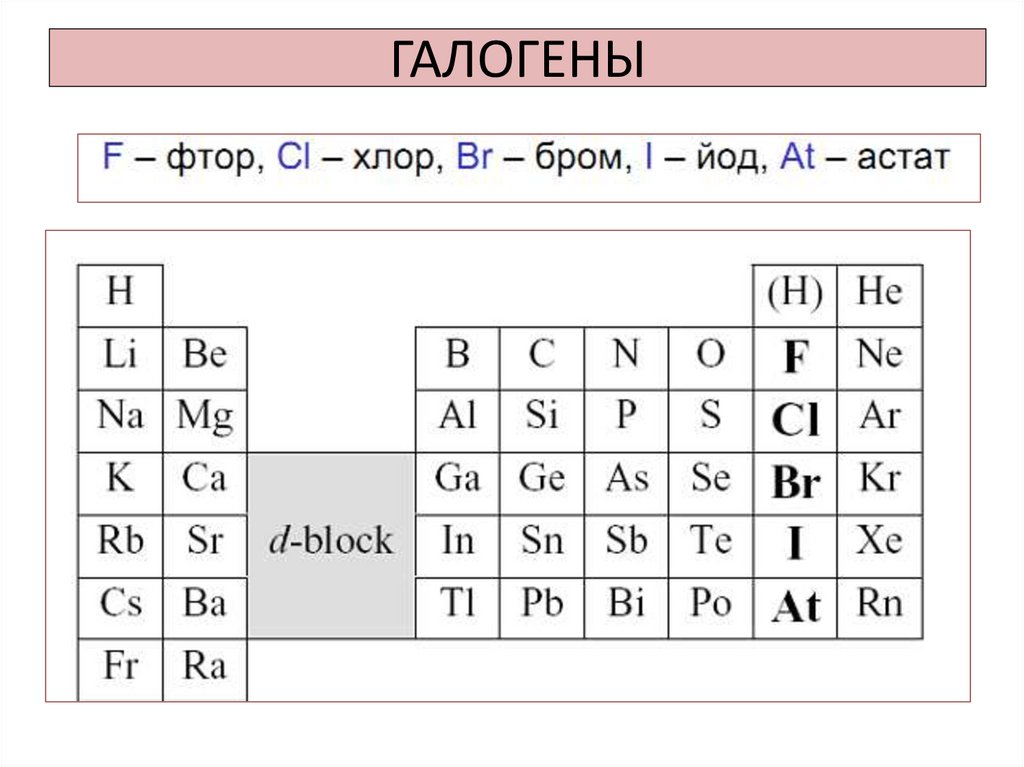
1. ГАЛОГЕНЫ
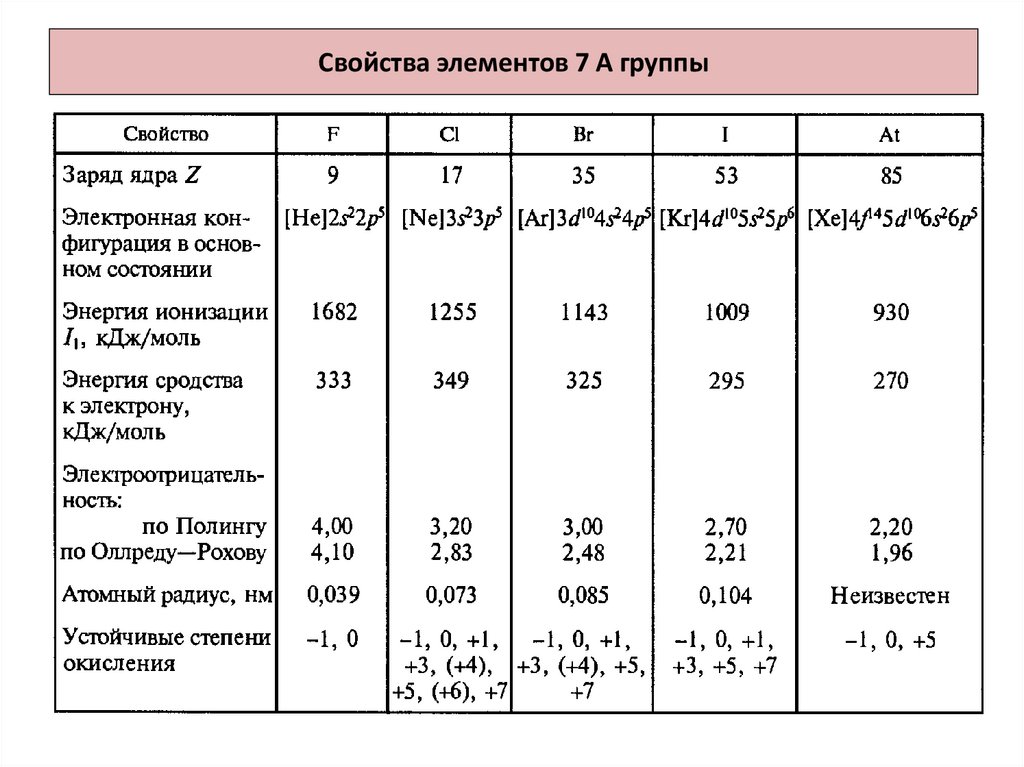
2. Свойства элементов 7 А группы
3. Нахождение в природе
• Фтор:CaF2плавиковый
шпат;
Сa3(PO4)2 Ca2(PO4)F
–
Фторапатит;
Na3AlF6 - криолит.
• Хлор: NaCl – в воде морей и океанов,
пласты в земной коре (каменная соль),
KCl- сильвин, КСl MgCl2 6H2O –
карналлит.
• Бром: бромиды в морской воде, в воде
озер, в подземных буровых водах.
• Йод: в подземных буровых водах;
некоторые водоросли накапливают
йод в своих тканях.
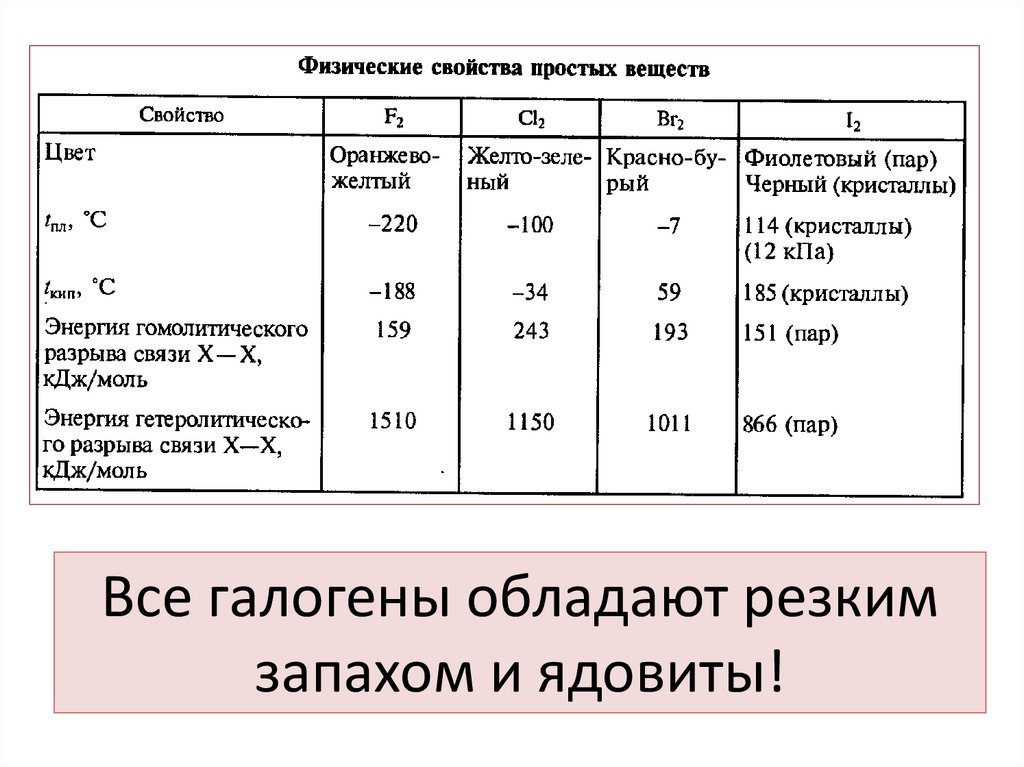
4. Все галогены обладают резким запахом и ядовиты!
5. Получение галогенов
6.
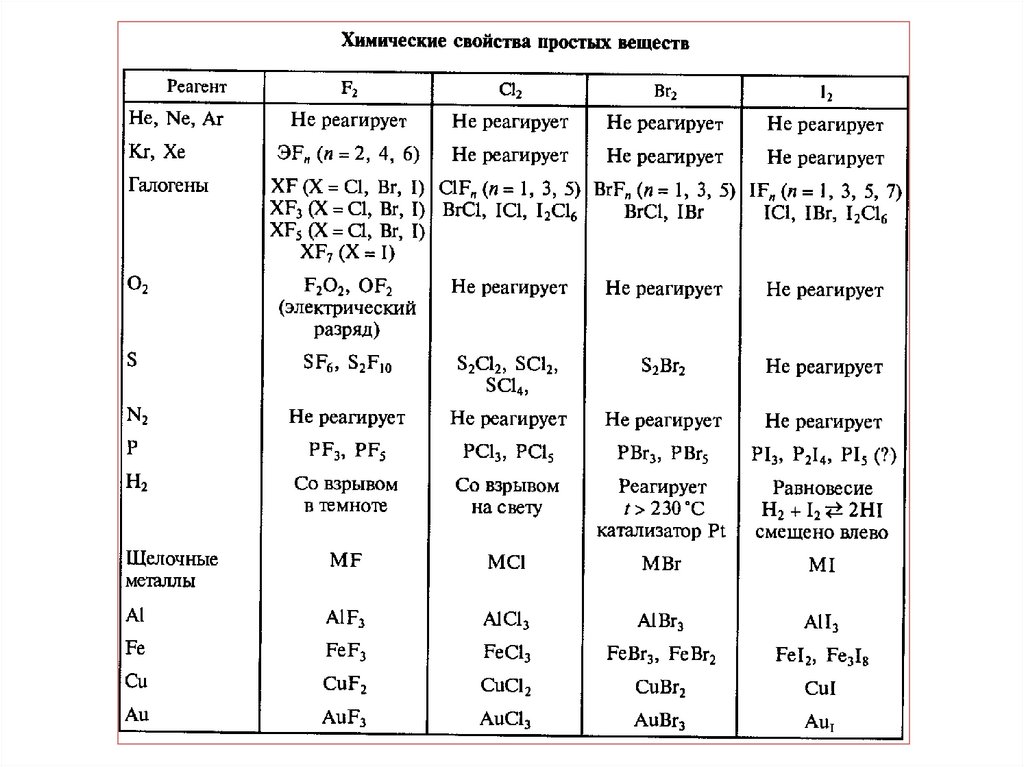
7. Реакции галогенов
Фтор- наиболее активный окислительCa + F2 = CaF2, (кроме Ni, Al, Cu, Zn (н.у)- защитные фторидные пленки)
H2 + F2 = 2 HF,
Cl2 + F2 = 2 ClF,
Xe + F2 = XeF2 (XeF4 ; XeF6)
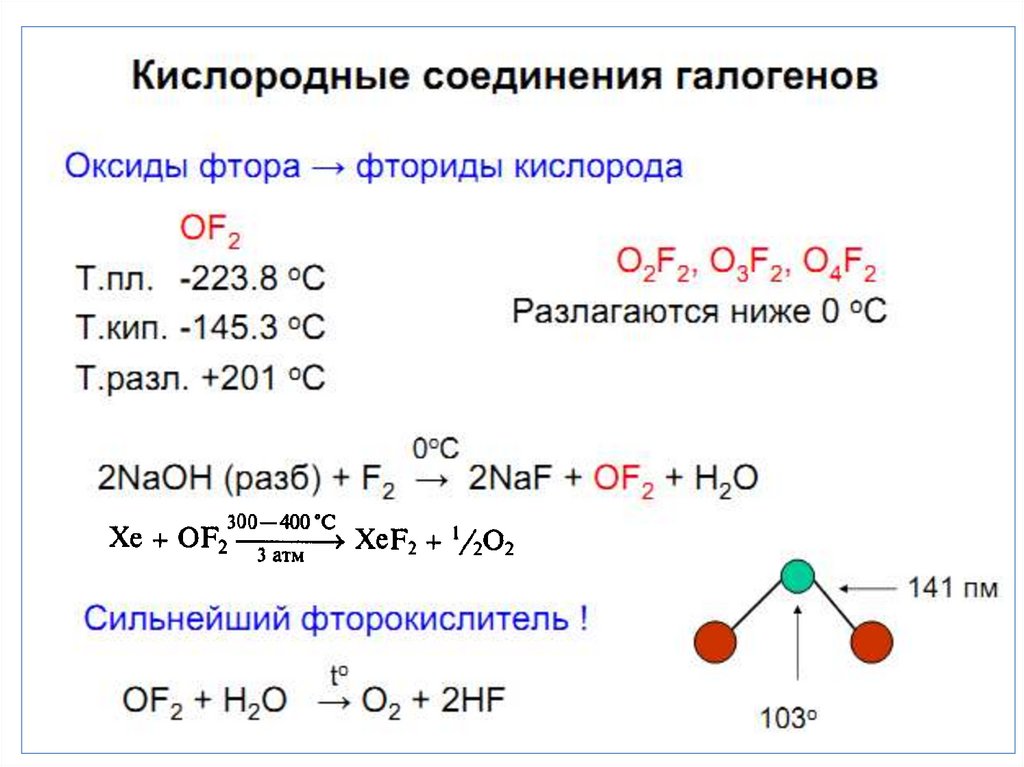
Фтор реагирует с водой и щелочами:
2 F2 + 2 H2O = 4 HF + O2,
2 F2 + 2 NaOH = 2 NaF + H2O + F2O.
SiO2 + 2F2 = SiF4 + O2 (в его атмосфере горит стекло в виде ваты)
• Непосредственно не реагирует только с О2, N2, С (алмаз)
8. Реакции галогенов
Хлор - один из самых активных неметаллов. При
взаимодействии с металлами с переменной валентностью
(Fe, Cr) заставляет их проявлять большую степень
окисления:
2 Fe + 3 Cl2 = 2 FeCl3,
2 Cr + 3 Cl2 = 2 CrCl3,
Mn + 2 Cl2 = MnCl4.
Реагирует с неметаллами:
H2 + Cl2 = 2 HCl, (на свету)
2 P + 3 Cl2 = 2 PCl3 (PCl5) (при низкой температуре с Р, Sb, As)
2 Sb + 3 Cl2 = 2SbCl3 (SbCl5).
9. Реакции галогенов
10. Реакции галогенов
• Йод – окислительные свойства выраженыслабее.
• Характерны восстановительные свойства:
11. Реакции галогенов
• В ряду галогенов сверху вниз окислительная активностьубывает. Каждый вышестоящий Hal вытесняет Hal- из его
соли или окисляет:
• Cl2 + 2KJ 2 KCl + J2
• Cl2 + 2KBr 2 KCl + Br2
• Br2 + 2KJ 2 KBr + J2
• Менее
активный
Hal
способен
вытеснять
(восстанавливать) более активный галоген из его
кислородсодержащего соединения:
• Br2 + 2 KClO3 2KClO3 + Cl2
• J2 + 2KClO4 2 KJO4 + Cl2
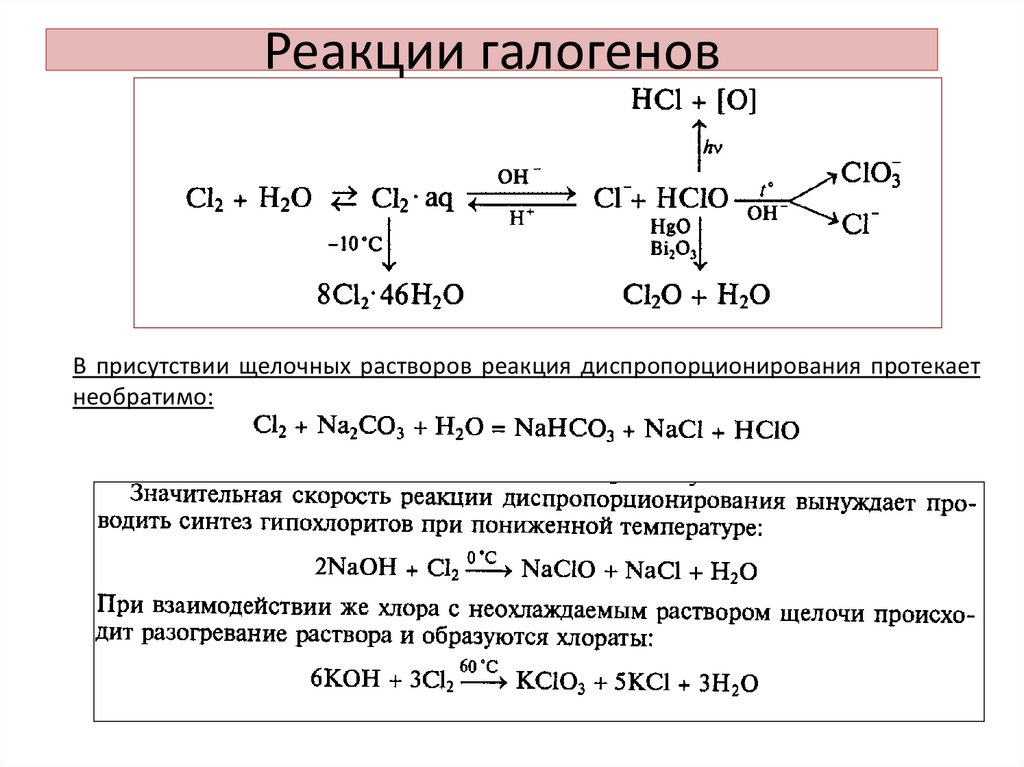
12. Реакции галогенов
• Растворение в воде:1 - (растворение):
2- (диспропорционирование):
13. Реакции галогенов
В присутствии щелочных растворов реакция диспропорционирования протекаетнеобратимо:
14. Реакции галогенов
• Для брома и йода константы равновесия реакциидиспропорционирования меньше, чем в случае хлора ,
поэтому бром и йод присутствую в водном растворе в виде
Br2 и J2. (Бромная и йодная вода при хранении не
разлагаются и имеют нейтральную реакцию)
• В щелочных растворах бром и йод диспропорционируют
подобно хлору:
Скорость диспропорционирования JО- велика при любой температуре,
поэтому в растворах он не существует:
15. Применение галогенов
16.
17.
18.
19.
20.
21.
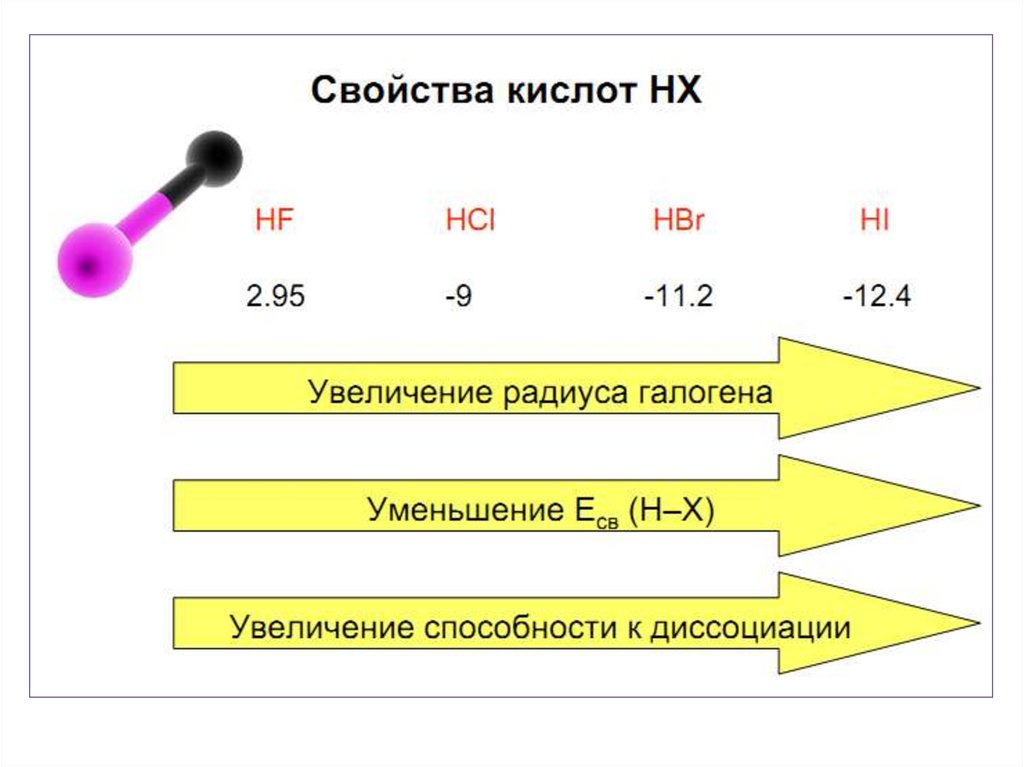
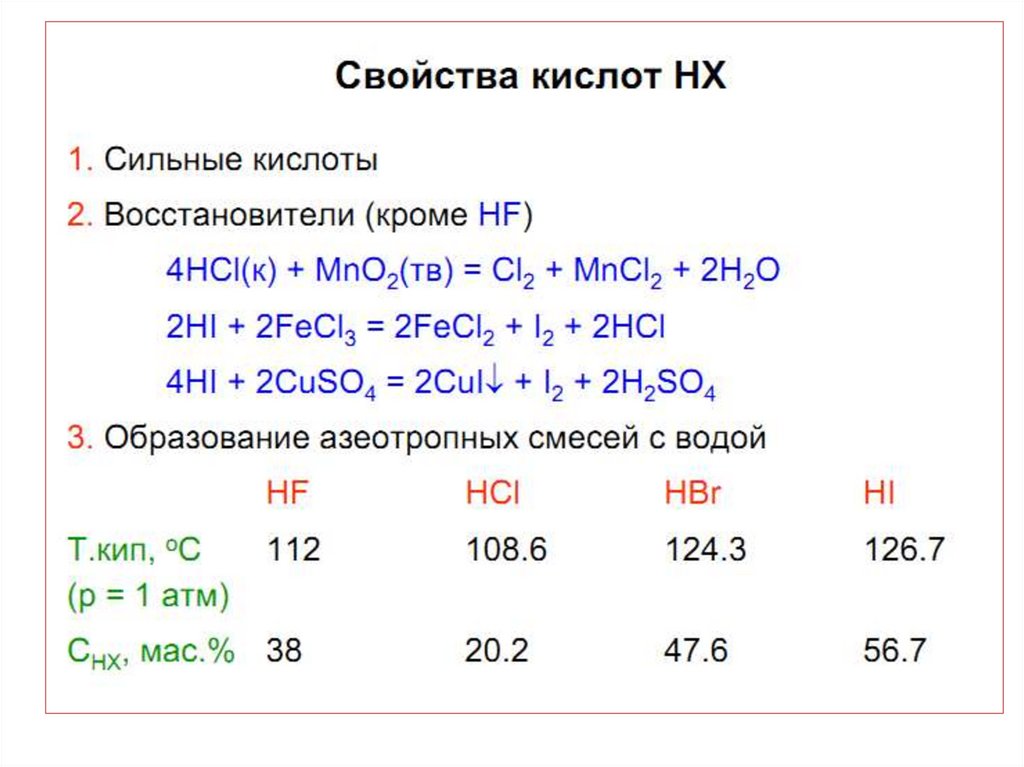
• С увеличением размера и уменьшением Еионатома галогена восстановительная способность
увеличивается.
HBr и HJ окисляются конц. H2SO4:
2HBr + H2SO4(к) Br2 + SO2 + 2H2O
8HJ + H2SO4(к) 4J2 + H2S + 4H2O
HJ окисляется даже на воздухе и буреет за
счет выделения J2:
4НJ + O2 2H2O + J2
22.
23.
24.
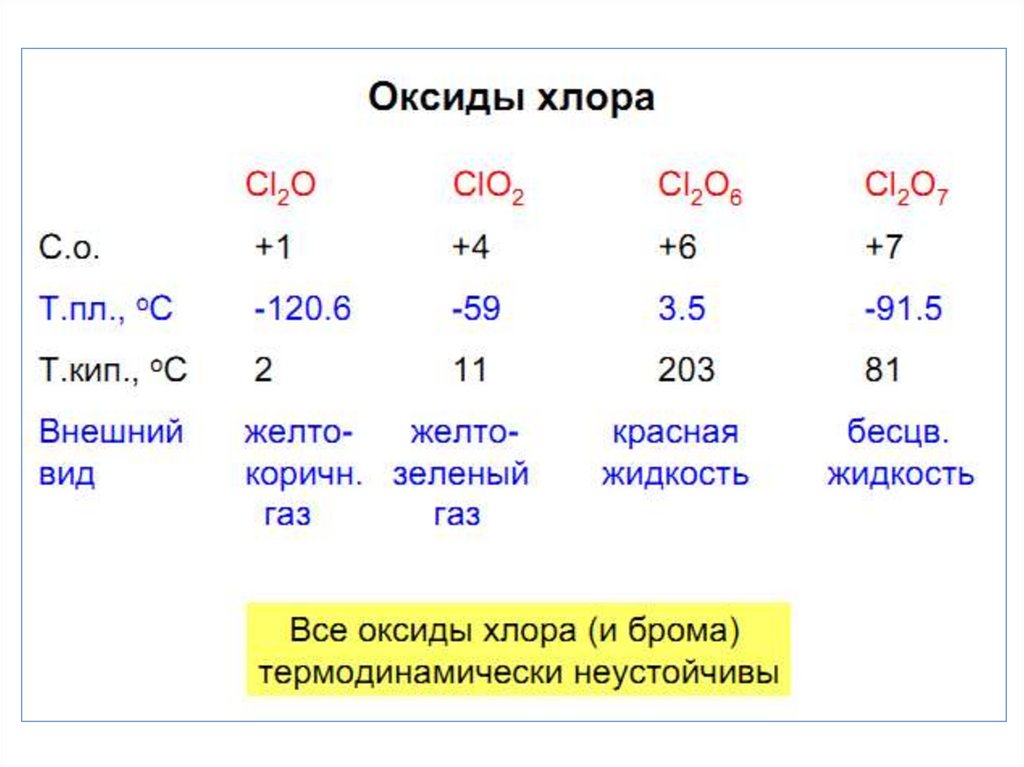
25. Оксид хлора (I) Cl2O – ядовитый желто-коричневый газ
• Получение:2 Cl2 + HgO = HgCl2 + Cl2O (конденсируют при t = -60 C)
• При нагревании он разлагается:
2 Cl2O = 2 Cl2 + O2,
• с водой дает хлорноватистую кислоту:
Cl2O + H2O = 2 HOCl.
26.
27.
• Cl2O6 - оксид хлора(VI).• Кислородосодержащая
кислота
со
степенью
окисления атома хлора +6 неизвестна.
Образуется при озонолизе ClO2:
• 2 ClO2 + 2 O3 = Cl2O6 + 2 O2,
Cl2O6 неустойчив и легко разлагается, образуя оксид с
меньшим содержанием кислорода:
Cl2O6 2 ClO2 + O2
• Ангидрид 2-х кислот, дает реакции
диспропорционирования:
• Cl2O6 + 2 KOH = KClO3 + KClO4 + H2O.
28.
• Оксид хлора(VII) Cl2O7 –маслянистаябесцветная жидкость.
• Получение (дегидратация с P2O5 с перегонкой в вакууме):
2 HClO4 + P2O5 = Cl2O7 + 2 HPO3,
• ангидрид хлорной кислоты HClO4 (это одна из
самых сильных кислот и умеренный окислитель):
Cl2O7 + H2O = 2 HClO4,
• легко взрывается:
2 Cl2O7 = 2 Cl2 + 7 O2 ,
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
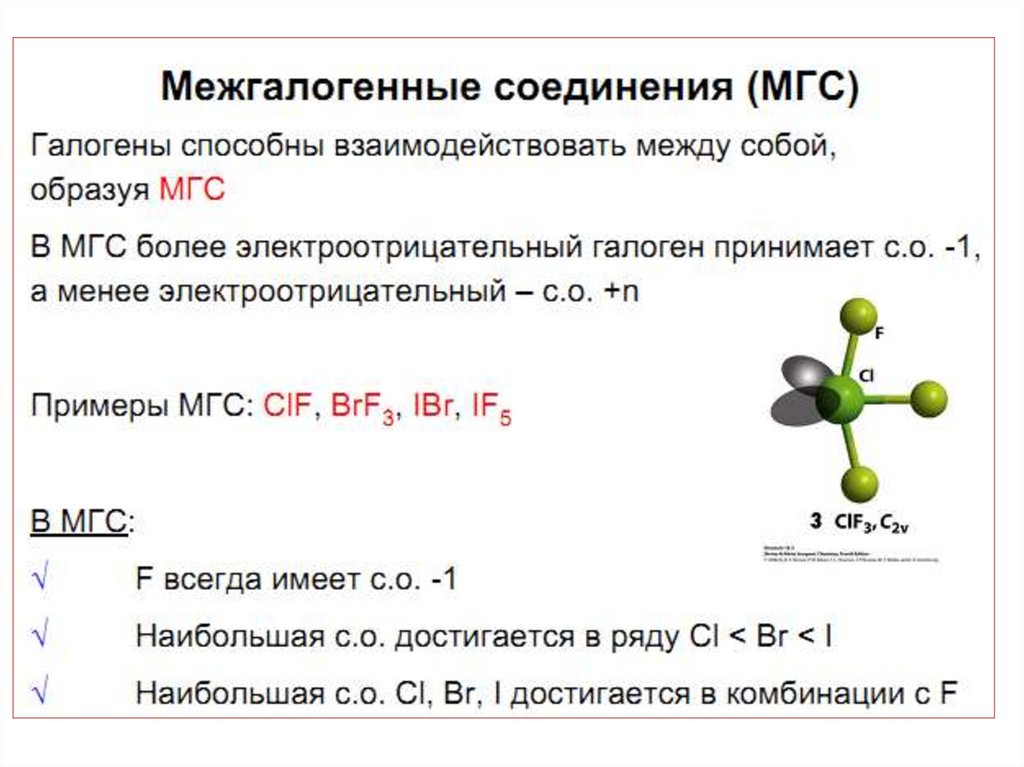
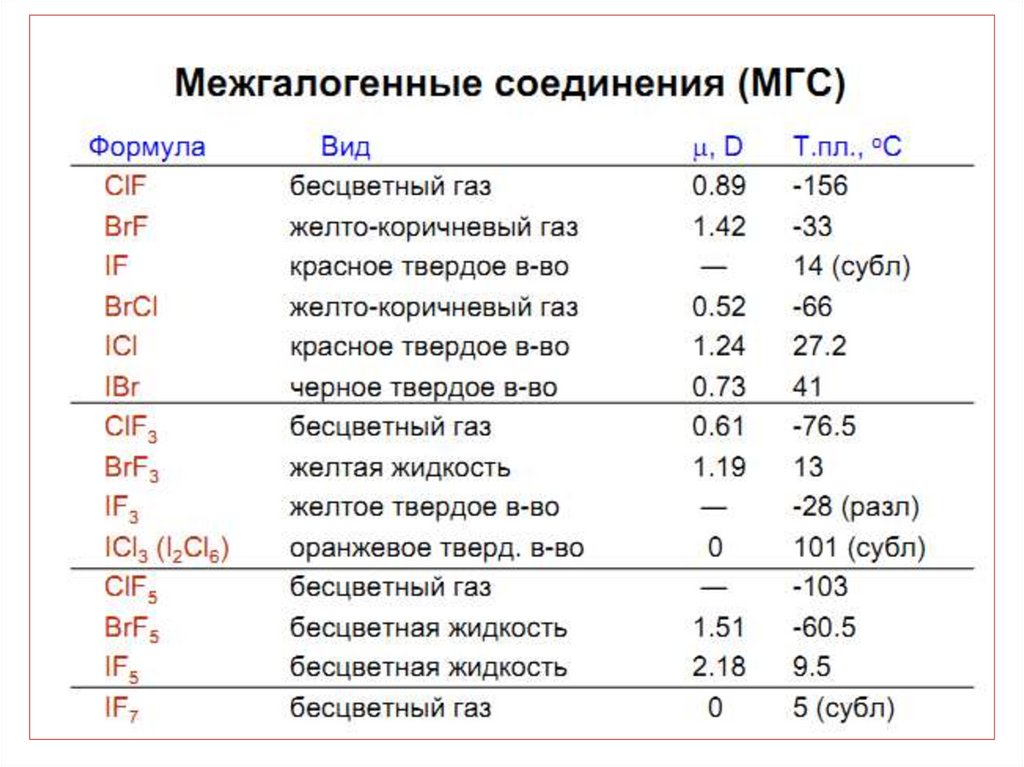
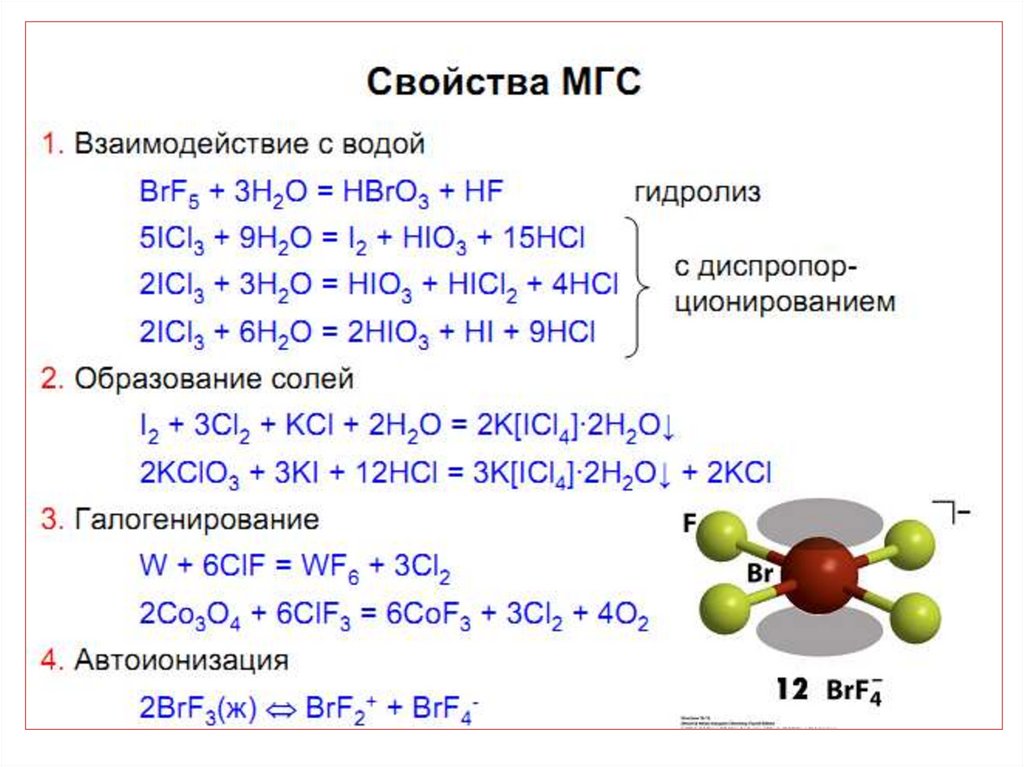
42. МГС синтезируют при непосредственном взаимодействии простых веществ, варьируя соотношения реагентов, температуру и давление:
43.
44.
45. Применение МГС
• в качестве неводных ионизирующихрастворителей;
• для производства UF6 ;
• для разделения продуктов деления ядерного
топлива;
• При обработке смеси продуктов деления ядерного
топлива с помощью ClF3 плутоний и большинство металлов
образуют малолетучие фториды, что позволяет отделить от
них более летучий UF6:
46. Общие закономерности
• Все элементы существуют в виде 2-х атомных молекул , tпл иtпл указывают на ван-дер-ваальсово взаимодействие между
Нal2.
• Проявляют свойства типичных неметаллов. Для F неизвестны
положительные степени окисления.
• Галогены – окислители. Окислительная способность падает
вниз по группе.
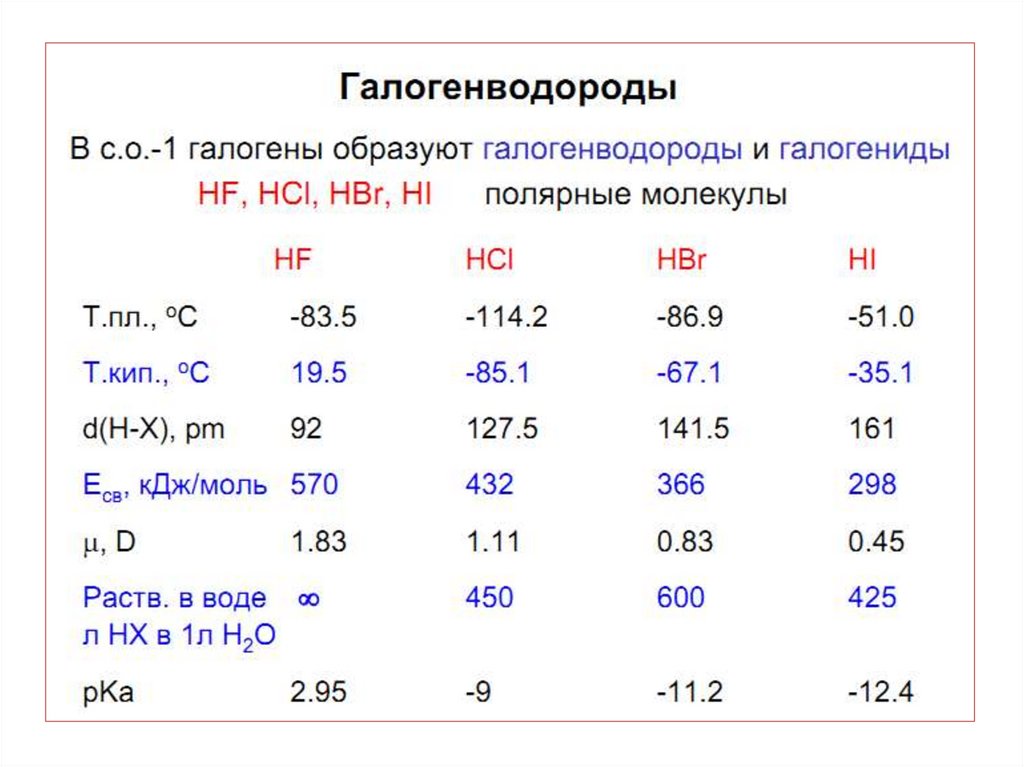
• Стабильность HНal падает вниз по группе . Для HF характерны
наиболее прочные водородны е связи.
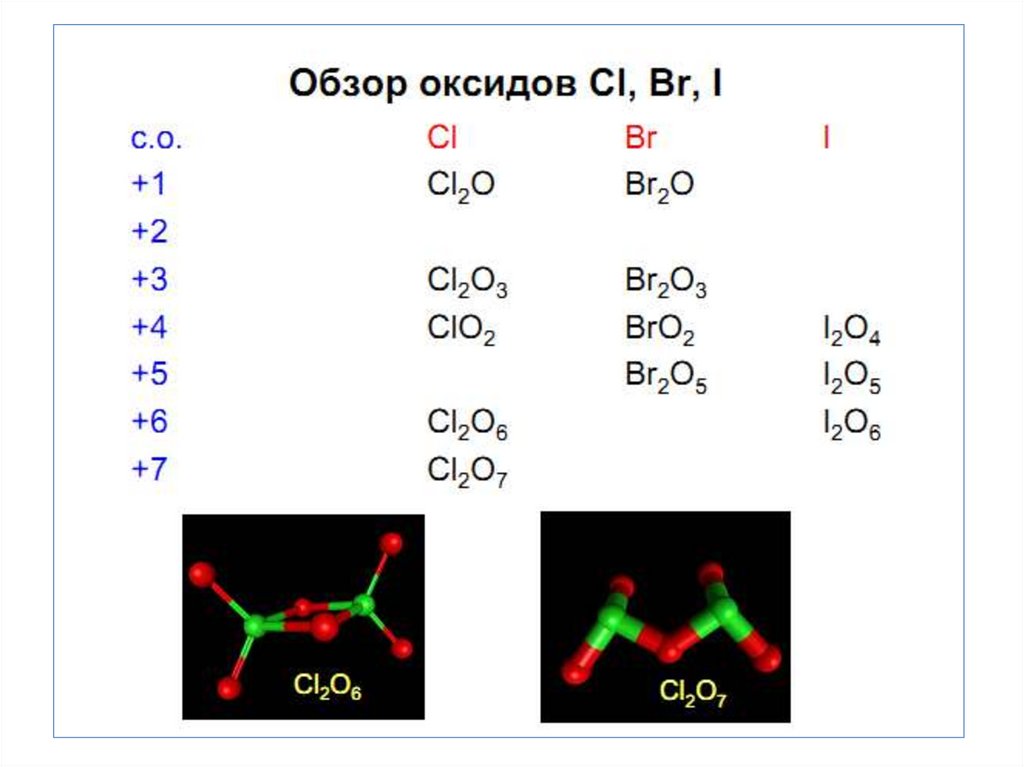
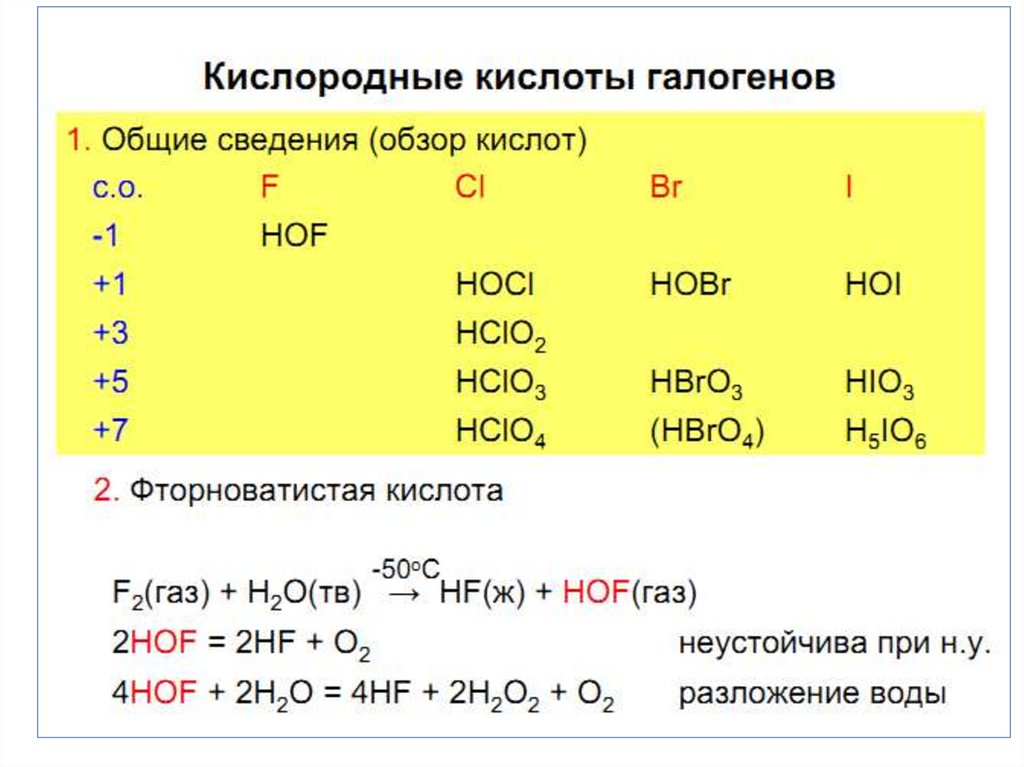
• Кислородные соединения
характерны для Сl, Br, J.
Максимальная С.О. равна +7
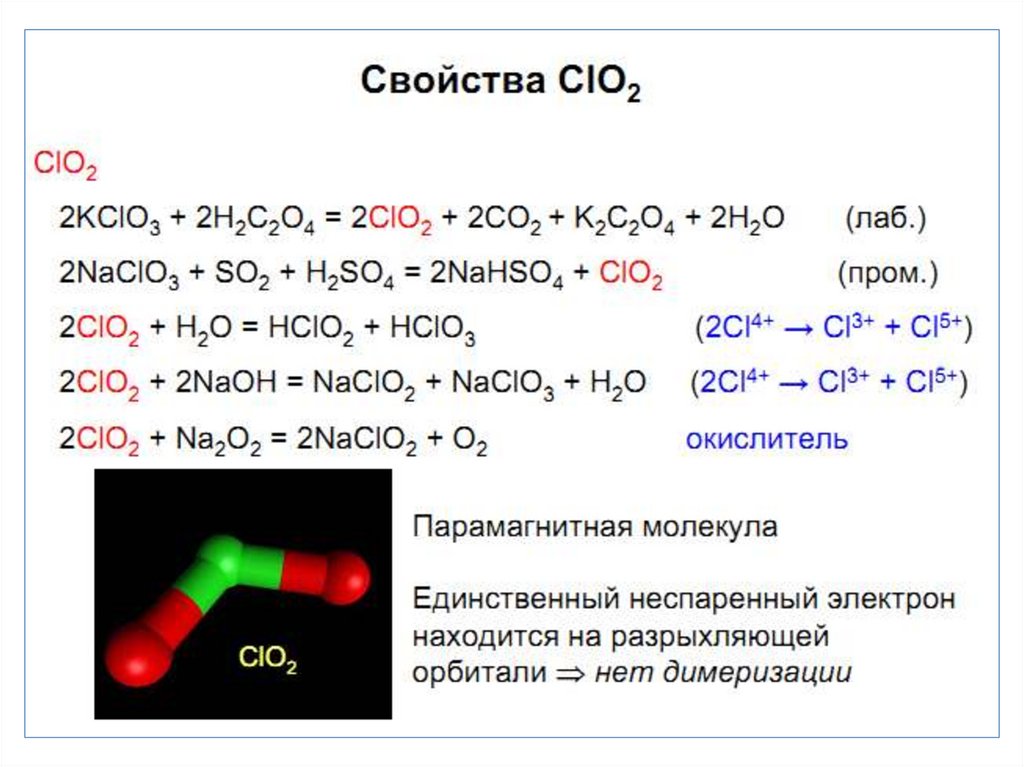
• Наиболее стабильная С.О. +1 и +5. Особенность хлора
образование диоксида ClO2.
• Легко образуются МГС.
















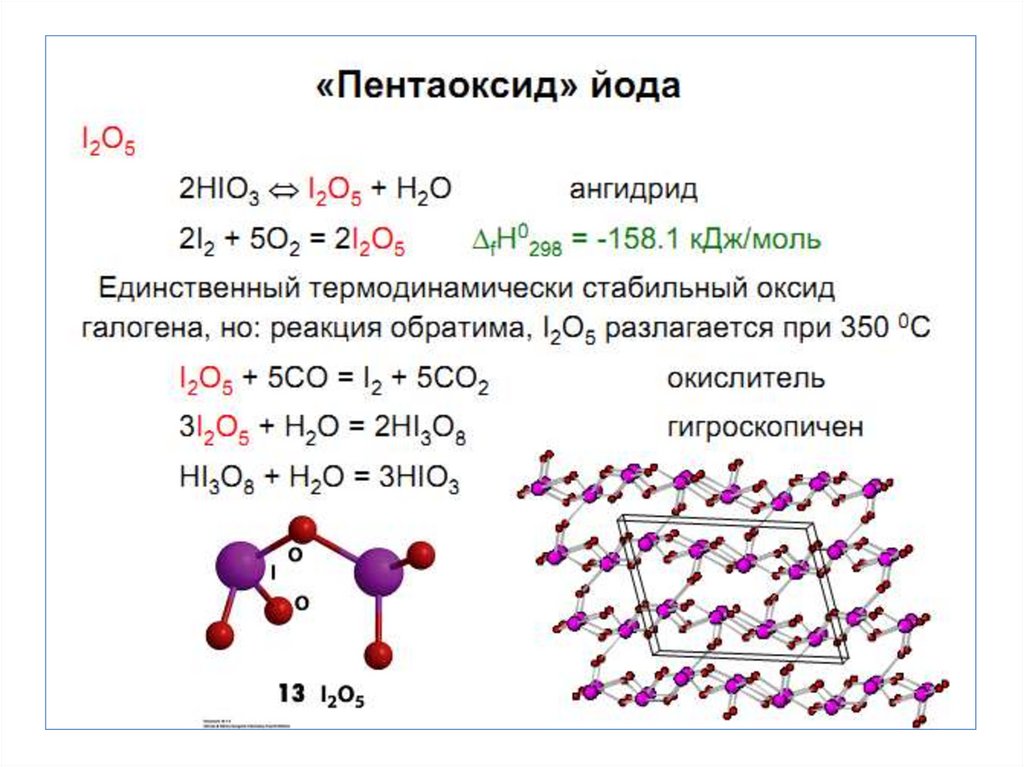



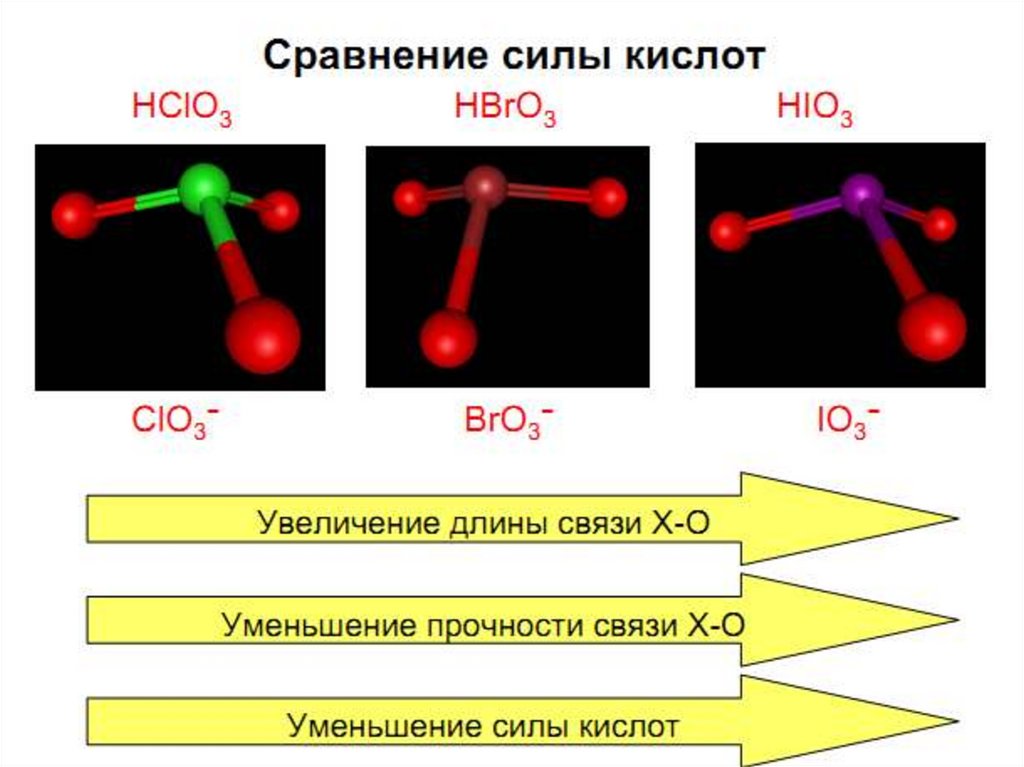
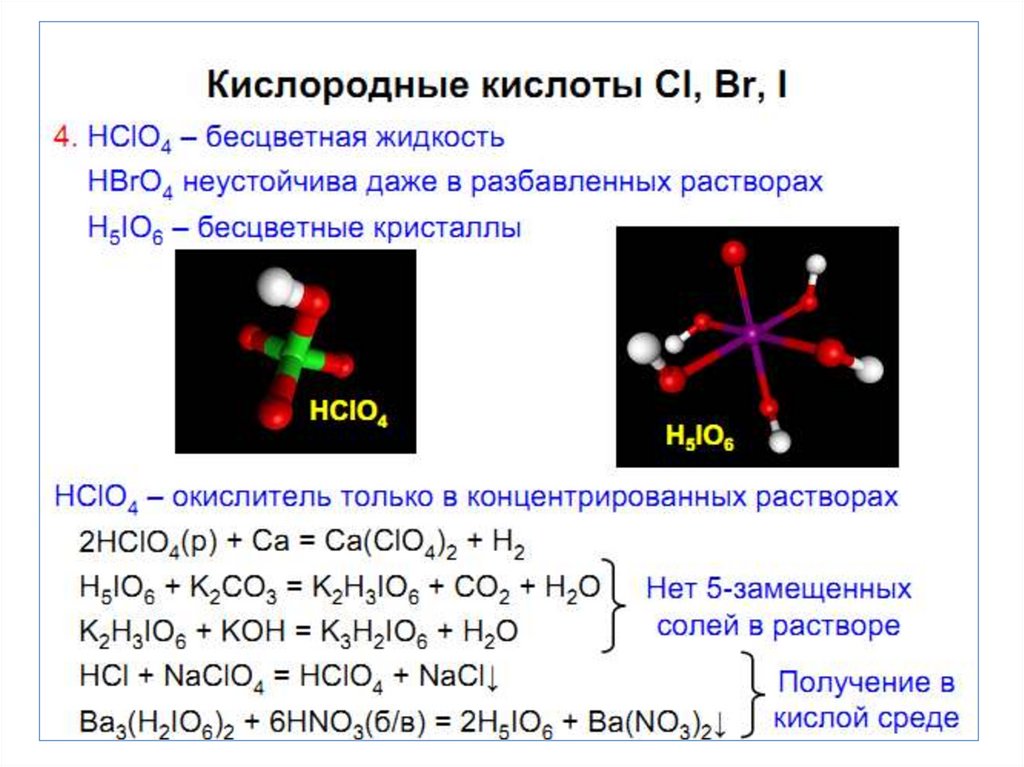






 Химия
Химия








