Похожие презентации:
Ферментные метки в иммуноанализе (лекция 4)
1.
Ферментные метки виммуноанализе
Лекция 4
2.
Основные понятия и термины,используемые в энзимологии
Ключевое
место
в
развитии
современной
биомолекулярной химии и технологии занимают ферменты
(энзимы) – белковые катализаторы различных процессов.
Ферменты представляют собой белки, катализирующие
реакции, протекающие в живых организмах.
3.
Физико-химические и каталитическиесвойства ферментов
Структура ферментов
В
активном
центре
фермента,
образованном
сближенными и определенным образом ориентированными в
пространстве участками полипептидной цепи, происходит
связывание субстрата и его химическое превращение. Иногда
в состав таких центров входят так называемые кофакторы
– низкомолекулярные органические вещества довольно
сложного строения или неорганические ионы.
Кофактор, прочно связанный с белковой глобулой
(апоферментом) и остающийся в неизменном состоянии
после каталитического акта, называют простетической
группой.
4.
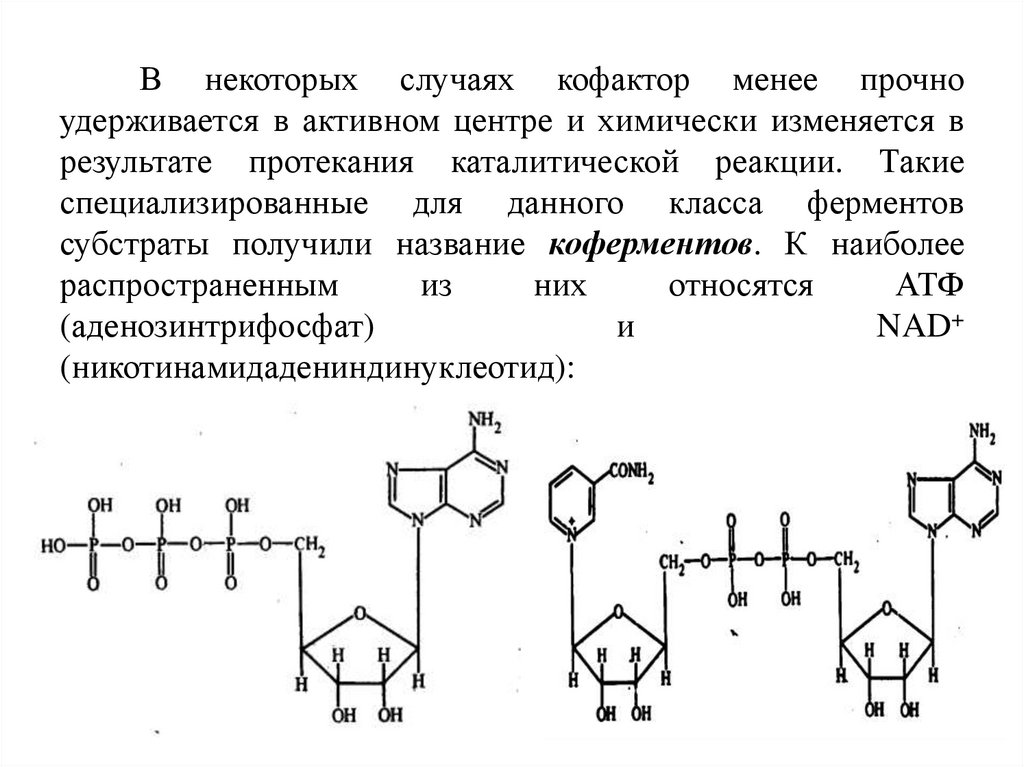
В некоторых случаях кофактор менее прочноудерживается в активном центре и химически изменяется в
результате протекания каталитической реакции. Такие
специализированные для данного класса ферментов
субстраты получили название коферментов. К наиболее
распространенным
из
них
относятся
АТФ
(аденозинтрифосфат)
и
NAD+
(никотинамидадениндинуклеотид):
5.
Если нативная конформация молекулы существенноменяется, при этом способность фермента осуществлять
каталитическое
превращение
субстрата
падает
(денатурация).
Денатуририующие факторы:
повышение температуры,
изменение pH,
введение химических агентов (мочевины, солей гуанидина
и др.),
механическое воздействие.
В более широком плане можно говорить об
инактивации ферментов, т. е. потери ими каталитической
способности, которая может быть обусловлена как
денатурацией, так и химической модификацией отдельных
функциональных групп молекул фермента.
6.
В иммуноферментном анализе введение ферментнойметки осуществляют путем ковалентного связывания
молекулы фермента с молекулой антигена или антитела.
!!! Должно проводиться таким образом, чтобы
модификация фермента не вызывала его инактивации.
В водном растворе молекулы белков обладают
структурой, при которой в поверхностном
слое
располагаются преимущественно гидрофильные боковые
цепи отдельных аминокислотных остатков, часть из которых
находится в ионизированном состоянии. Среди этих
функциональных групп наиболее удобными для связывания
являются ε-аминогруппы лизина, карбоксильные группы
аспарагинового или глутаминового остатков, SH-группа
цистеинового остатка.
!!! Такая модификация не должна затрагивать
функциональных групп активного центра, а также влиять на
каталитически активную конформацию всей ферментной
глобулы.
7.
Каталитические свойства ферментовОбщую схему ферментативной реакции
записывают следующим образом:
обычно
где S1 и S2 – субстраты;
P1 и Р2 – продукты ферментативной реакции;
Е – фермент.
Для многих ферментов в качестве одного из субстратов
выступает вода, поэтому, ввиду того, что ее концентрация
велика и постоянна в ходе ферментативной реакции, часто
такие реакции рассматривают как псевдомоносубстратные.
Для
целых
классов
ферментов,
вторыми
специализированными субстратами являются молекулы
коферментов.
8.
Весьма важной и часто используемой на практикехарактеристикой препаратов является каталитическая
активность фермента.
За единицу каталитической активности (1 каталь)
любого фермента принимают такое его количество, которое
катализирует превращение 1 моль субстрата в 1 с в
реакционной системе при определенных условиях. Наиболее
удобным для практических целей является нанокаталь (10-9
кат).
До сих пор часто употребляется старое обозначение
каталитической активности, известное как «международная
единица» (U), определенное как количество фермента,
катализирующее превращение 1 ммоль субстрата в 1 мин.
Соотношение между этими единицами следующее:
9.
Для сравнительной оценки различных препаратовфермента часто используют удельную каталитическую
активность, т. е. каталитическую активность, отнесенную к
единице массы белка.
Согласно
приведенному
выше
определению
каталитическая активность не тождественна понятию
скорости ферментативной реакции, которая определяется как
количество субстрата, превращаемого ферментом за единицу
времени в единице объема системы, в которой протекает
реакция (размерность – моль·л-1×с-1).
10.
На скорость ферментативнойвлияние различные факторы:
температура,
природа буфера и pH,
субстраты,
коферменты,
ингибиторы и другие эффекторы,
количество белка в системе.
реакции
оказывают
11.
ТемператураВлияние температуры (Т) на скорость (v) обычных
химических реакций описывается зависимостью Аррениуса:
В случае ферментов температурные зависимости
скорости имеют более cложный вид, что обусловлено как
термолабильностью белковых глобул, так и влиянием
температуры на:
константы Михаэлиса,
константы скоростей распада отдельных ферментсубстратных комплексов,
положение pH-оптимума.
12.
В области низких температур, когда структураактивного центра достаточно стабильна, константа скорости
распада фермент-субстратного комплекса описывается
уравнением типа Аррениуса.
Среднее значение эффективной энергии активации для
ферментативных процессов обычно близко к 40 кДж/моль.
Как правило, зависимость скорости ферментативных
реакций имеет температурной оптимум, обусловленный
тепловой денатурацией фермента.
13.
Буфер и pHВсе ферменты характеризуются определенным pHоптимумом активности. Этот диапазон максимальной
активности может иметь весьма узкий интервал.
pH-оптимум активности зависит от:
ионной силы,
вида используемого буфера,
меняется с температурой.
Например, для щелочной фосфатазы рН-оптимум:
при 37°С составляет 9,9
при 30°С – 10,1
при 25°С – 10,3.
14.
СубстратыОпределяемая каталитическая активность фермента
сильно зависит от используемого субстрата. Субстраты
данного фермента могут быть как природными, так и
синтетическими, при этом скорости их превращения также
значительно варьируют.
Например, фермент β-D-галактозидаза гидролизует
синтетические субстраты 2-нитрофенил-β-D-галактозид и 4нитрофенил-β-D-галактозид соответственно в 7 и 17 раз
быстрее, чем естественный субстрат лактозу.
15.
ЭффекторыК эффекторам относят как ингибиторы, так и
активаторы ферментативных реакций, т. е. вещества,
оказывающие замедляющее или ускоряющее действие на
превращение субстрата.
Эффекторы могут вноситься в реакционную среду как с
растворами реагента, так и анализируемого образца. В
некоторых
случаях
для
ферментативных
реакций
наблюдается ингибирование высокими концентрациями
субстрата или одним из продуктов реакции.
Наличие в реакционной среде эффекторов может
приводить к нежелательному отклонению от линейной
зависимости наблюдаемой скорости ферментативной
реакции от количества фермента в системе.
16.
Кинетические закономерностипротекания ферментативных реакций
В иммуноферментных методах анализа в качестве
метки антигенов и антител могут использоваться:
ферменты – способ детекции должен обеспечивать
регистрацию сигнала, пропорционально зависимого от
концентрации (количества) фермента. В этом случае
фермент выполняет роль маркера, он ковалентно связан с
молекулой антигена или антитела.
их субстраты – регистрируем сигнал пропорциональный
концентрации (количества) субстрата, при этом он
выполняет роль детектора (свободный фермент).
17.
Оптимизация условий каталитической реакции (выборpH, оптимальных концентраций фермента и субстратов)
осуществляется
в
соответствии
с
используемой
модификацией ИФА.
После проведения всех иммунохимических стадий
любого метода ИФА необходимо установить концентрацию
(или количество) меченного ферментом компонента
иммунохимической
реакции,
т.
е.
определить
каталитическую активность фермента. Для этого в систему
добавляют соответствующие субстраты фермента и
измеряют
скорость
ферментативной
реакции.
По
наблюдаемой скорости реакции судят о концентрации
фермента-маркера в системе. Для этого необходимо наличие
пропорциональности между концентрацией фермента и
измеряемой скоростью ферментативной реакции:
18.
Следует отметить, что ИФА всегда строится насравнительном определении в идентичных условиях
стандартного и измеряемого образца.
Выполнение
условия
пропорциональности
в
определенном диапазоне концентраций обеспечивает:
большую точность эксперимента,
позволяет построить теоретическую модель и провести
математическое описание метода с целью его
оптимизации.
19.
Экспериментальные методыопределения ферментативной
активности
В
иммуноферментном
анализе
наибольшее
распространение получил фотометрический метод
регистрации активности ферментов.
В качестве субстратов ферментов при этом используют
такие вещества, продукты превращения которых являются
окрашенными
соединениями
или
окраска
самих
субстратов изменяется в процессе реакции.
Окрашенные соединения поглощают видимый свет, т. е.
электромагнитное излучение с длинами волн 400-700 нм.
При прохождении пучка света через кювету раствора
толщиной d (см) интенсивности прошедшего света I по
сравнению с начальной интенсивностью Iо связана законом
Бугера-Ламберта-Бера:
20.
где ε – постоянная для данного вещества вопределенном растворе величина, называемая молярным
коэффициентом поглощения (размерность – моль-1·л·см-1);
С – концентрация вещества, поглощающего свет
(моль/л).
На практике часто измеряют оптическую плотность (А),
которая связана с I и Iо следующим простым соотношением:
Таким образом, если поглощение света подчиняется
закону Бугера-Ламберта-Бера, то оптическая плотность
раствора в определенном диапазоне прямо пропорциональна
концентрации вещества.
21.
В последнее время в иммуноферментном анализеполучили распространение субстраты, которые образуют
продукты, регистрируемые флуориметрическим методом.
Молекула при поглощении фотона переходит из
основного электронного состояния в возбужденное.
Возбужденная молекула может вернуться в основное
состояние, при этом избыток энергии перейдет в теплоту, но
может произойти обратный процесс перехода электрона на
основной уровень, сопровождающийся выделением кванта
света, который носит название флуоресценции.
Как отмечалось выше, оптическая плотность раствора
определяется следующим соотношением:
22.
Интенсивность флуоресценции (F) пропорциональна.количеству света, адсорбированного образцом (Io-I), а так как
Io~I, можно записать, что
φ – доля молекул, перешедших из возбужденного
состояния в основное с испусканием света.
Таким образом, интенсивность флуоресценции прямо
пропорциональна концентрации растворенного вещества С и
абсолютному значению начальной интенсивности света Iо, в
то время как в фотометрии сравниваются относительные
интенсивности I и Iо.
!!!! Этот факт позволяет на 1-2 порядка повысить
чувствительность определения вещества в растворе
флуориметрическим
методом
по
сравнению
с
фотометрическим.
23.
Вкачестве
детектирующих
систем
в
иммуноферментном анализе нашли также применение
ферментативные реакции, энергия которых реализуется в
виде
светового
излучения
–
реакции
биои
хемилюминесценции.
За скоростью таких реакций следят по интенсивности
свечения реакционной системы, регистрируемой с помощью
люминометра. Реакции биолюминесценции катализируются
люциферазами светляков и бактерий, а реакция окисления
циклических гидразидов перекисью водорода (реакция
хемилюминесценции) катализируется пероксидазой хрена.
В последние годы распространение получают
электрохимические способы определения активности
ферментов, используемых в качестве меток в иммуноанализе.
Такие датчики позволяют проводить определение скорости
ферментативных реакций в мутных средах и удобны для
создания проточных иммуноферментных ячеек.
24.
Критерии выбора ферментныхметок
Принципиальная возможность применения ферментов
в качестве меток в ИФА обусловлена чрезвычайно высокой
чувствительностью регистрации ферментов в растворе.
Принципиально осуществимым является значительное
уменьшение пределов обнаружения ферментов как за счет:
увеличения времени ферментативной реакции,
увеличения
чувствительности
регистрации
образующегося продукта.
В
этой
связи
к
перспективным
относятся
люминесцентные
методы
детекции
ферментативных
реакций, а также методы, основанные на ферментативном
усилении детекции продуктов первичной ферментативной
реакции («каскады»).
25.
К выбору ферментных меток в ИФА предъявляется рядобщих требований. Основными являются следующие:
а)
высокая
специфичность
и
удельная
каталитическая
активность
фермента,
позволяющая
обнаруживать
ферментативную
метку
в
низких
концентрациях;
б)
доступность
ферментов;
возможность
получения достаточно чистых ферментных препаратов,
сохраняющих высокую ферментативную активность после
химической модификации при получении конъюгата, с
антителами или антигенами;
в)
стабильность
в
оптимальных
условиях
взаимодействия антигена с антителом;
г)
простота
и
чувствительность
метода
определения концентрации фермента.
26.
д) быть относительно дешевым;е) хорошо растворяться в воде;
ж) сохранять стабильную активность;
з) иметь свободные реакционно-способные группы
(например, –NH2, COOH или –SH) для связывания с
иммунологически активной молекулой.
В гетерогенных методах ферменты – маркер антигенов
или антител. В гомогенных методах фермент – составная
часть иммунохимической реагентной системы, т.е. обладает
рядом весьма специфических свойств.
27.
Характеристика ферментов,используемых в ИФА в качестве
меток
Факторы, влияющие на активность
ферментов при проведении ИФА
28.
Наибольшее распространение в гетерогенном ИФАсреди ферментов получили:
− пероксидаза хрена,
− щелочная фосфатаза,
− β-D-галактозидаза.
пикомолярные концентрации
29.
Пероксидаза хренаПероксидаза хрена представляет собой глобулярный белок
(Мr=40000, диаметр молекулы 5,0 нм, удельная активность 200
Ед/мг, рНоптим5-7). Молекула состоит из апофермента (белковой
части, содержащей около 18% нейтральных и аминоуглеводных
остатков) и простетической группы – гемина.
Ионообменной хроматографией пероксидаза разделяется на
7 изоферментов, обозначаемых как А-1, А-2, А-3, В, С, D и Е,
которые отличаются по аминокислотному и углеводному составу.
В коммерческих препаратах пероксидазы в основном
содержится изофермент С. В состав молекулы изофермента С
входит 308 а.о. и 8 нейтральных углеводных остатков, связанных с
остатками аспарагиновой кислоты, стабилизирующих фермент
относительно воздействия протеолитических ферментов.
30.
Углеводные остатки имеют также существенноезначение при синтезе иммунопероксидазных конъюгатов
методом перйодатного окисления.
Молекула изофермента С имеет шесть остатков лизина,
содержащих свободные аминогруппы, четыре из которых
находятся вблизи поверхности белковой глобулы и легко
доступны для модификации.
В состав активного центра молекулы пероксидазы
входит феррипротопорфирин IX (гемин), образующий с
апобелком очень прочный комплекс.
31.
Фермент катализирует двухсубстратные реакции сучастием
перекиси
водорода
(реже
органических
гидроперекисей). На первой стадии взаимодействие
фермента Е с перекисью приводит к образованию
промежуточной окисленной формы EI. На второй стадии
происходит одноэлектронное восстановление ЕI вторым
субстратом АН2, являющимся донором водорода, с
образованием второй промежуточной формы фермента ЕII,
которая после взаимодействия со второй молекулой донора
переходит в нативный фермент:
32.
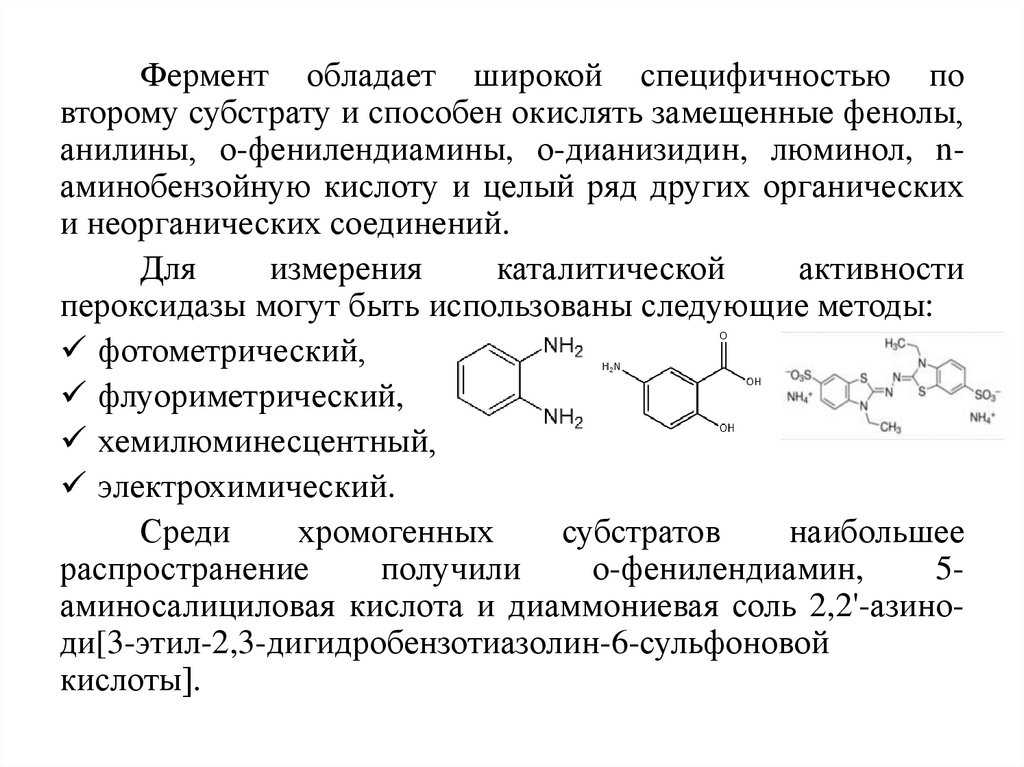
Фермент обладает широкой специфичностью повторому субстрату и способен окислять замещенные фенолы,
анилины, о-фенилендиамины, о-дианизидин, люминол, nаминобензойную кислоту и целый ряд других органических
и неорганических соединений.
Для
измерения
каталитической
активности
пероксидазы могут быть использованы следующие методы:
фотометрический,
флуориметрический,
хемилюминесцентный,
электрохимический.
Среди
хромогенных
субстратов
наибольшее
распространение
получили
о-фенилендиамин,
5аминосалициловая кислота и диаммониевая соль 2,2'-азиноди[3-этил-2,3-дигидробензотиазолин-6-сульфоновой
кислоты].
33.
Во флуориметрическом методе в качестве субстратаиспользуют n-оксифенилпропионовую или гомованилиновую
кислоту.
Флуориметрический метод регистрации активности
пероксидазы обладает некоторыми преимуществами по
сравнению с фотометрическим:
более чувствителен,
низкая фоновая реакция,
интенсивность флуоресценции образующегося продукта
стабильна по крайней мере в течение 4 ч.
34.
Принцип работы электрохимического датчика дляопределения активности пероксидазы основан на известной
реакции окисления йодид-ионов перекисью водорода,
катализируемой пероксидазой. Обычно регистрируют либо
скорость изменения тока, либо предельный ток, проходящий
через электрод за определенный промежуток времени.
35.
ГлюкозооксидазаВ качестве метки в иммуноферментном анализе обычно
используют глюкозооксидазу из Aspergillus niger. Фермент
представляет собой гликопротеин, содержащий 16%
углеводных групп, молекулярная масса 160 000, в состав
входят 2 молекулы связанного флавинадениндинуклеотида. В
нативном состоянии сульфгидрильные группы в молекуле
фермента не обнаруживаются, однако после денатурации в
8М мочевине титруются 1-2 SH-группы на молекулу белка.
Фермент обладает высокой стабильностью и сохраняет
активность при хранении в течение нескольких лет в
замороженном виде в концентрации 10 мг/мл.
Фермент катализирует реакцию окисления β-D-глюкозы
кислородом с образованием перекиси водорода:
36.
2-D-арабиноза, 2-дезокси-D-глюкоза и ионы Ag+, Hg2+,Cu2+ являются ингибиторами, pH-оптимум ферментативной
активности равен 5,5.
Принцип измерения каталитической активности
основан на регистрации продукта реакции – перекиси
водорода с помощью пероксидазы хрена.
37.
Щелочная фосфатазаПродажными препаратами щелочной фосфатазы
являются фермент из кишечника телят и из Е. coli. В качестве
метки в иммуноферментном анализе обычно используют
первый из них, так как он обладает более высокой удельной
каталитической
активностью.
Молекула
щелочной
фосфатазы представляет собой димер с Мr~100 000. В состав
каждой из субъединиц входят два сильно связанных атома
цинка, один из которых существен для поддержания
структурной целостности молекулы, а второй входит в состав
активного центра и принимает участие в каталитическом
акте.
Щелочная фосфатаза катализирует гидролиз различных
ортофосфатных эфиров, в том числе первичных и вторичных
спиртов, сахарных спиртов, циклических спиртов и фенолов:
38.
Ионы Mg2+ являются сильными активаторамифермента. Фосфат-ион и хелаты двухвалентных металлов,
например ЭДТА, ингибируют фермент. На активность
щелочной фосфатазы значительное влияние оказывает
электростатическое окружение (ионная сила, растворитель).
В сухом виде или в суспензии (3,2 М раствора сульфата
аммония), pH 7, содержащего 1 мМ MgCl2, щелочная
фосфатаза стабильна в течение нескольких месяцев при 4°С.
39.
β-D-Галактозидазаβ-D-галактозидаза из Е. coli имеет молекулярную массу
около 540 000, молекула содержит значительное число SHгрупп (количество титруемых SH-групп зависит от качества
препарата и может составлять 20-24).
Фермент катализирует гидролиз β-D-галактозидов,
обладает достаточной стабильностью; в кристаллической
суспензии в 2,2 М растворе сульфата аммония (pH 6)
сохраняет активность при 4°С в течение нескольких месяцев.
Ионы Na+ являются ингибиторами фермента.
40.
Глюкозо-6-фосфатдегидрогеназаФермент широко распространен и может быть выделен
как из тканей млекопитающих, так и из бактерий. Молекула
состоит из двух субъединиц, каждая из которых содержит
вблизи активного центра реакционноспособный остаток
лизина.
В иммуноферментном анализе часто используют
бактериальную
глюкозо-6-фосфатдегидрогеназу
из
Leuconostos mesenteroides. Фермент не содержит SH-групп и
обладает высокой стабильностью (стабилен более года при
4°С).
Фермент катализирует реакцию окисления глюкозо-6фосфата с образованием 6-фосфо-D-глюконата:
41.
В отличие от фермента из млекопитающихбактериальная
глюкозо-6-фосфатдегидрогеназа
(из
Leuconostoc mesenteroides) эффективно использует в качестве
кофермента не только NADP+, но и NAD+.
Большинство двухвалентных ионов металлов являются
ингибиторами фермента. Mg2+ в концентрации до 10 мМ
активирует, но при высоких концентрациях также
ингибирует его. Ингибирующий эффект оказывают фосфатионы.
Принцип измерения каталитической активности
основан на регистрации образующейся в реакции
восстановленной формы кофермента.
42.
МалатдегидрогеназаВ гомогенном иммуноферментном анализе обычно
используют малатдегидрогеназу из сердца свиньи. Молекула
фермента состоит из двух идентичных субъединиц с
молекулярной массой по 35 000. Каждая из субъединиц
имеет центр связывания молекулы кофермента NAD+ и
обладает каталитической активностью при диссоциации
молекулы на субъединицы. Изоэлектрическая точка 6,2.
Молекула содержит 14 SH-групп, две из которых
существенны для связывания субстрата в активном центре.
Фермент достаточно стабилен и сохраняет активность в
течение года при 4°С в виде суспензии под сульфатом
аммония.
Малатдегидрогеназа
катализирует
реакцию
восстановления оксалоацетата до малата под действием
NADH:
43.
Каталитическую активность измеряют по скоростиуменьшения оптической плотности восстановленной формы
NADH при длине волны 340 нм. Активаторами фермента
являются фосфат, Zn2+, малат; ингибиторами —
оксалоацетат, 8-оксихинолин, AMP, ADP, АТР, сульфит,
тироксин, фенолы.









































 Биология
Биология








