Похожие презентации:
Электрический ток в растворах и расплавах электролитов
1. Электрический ток в растворах и расплавах электролитов.
2. Электролиты
вещества, растворы и расплавы которыхобладают ионной проводимостью.
3.
+NaCl
Cl
Na
H2O
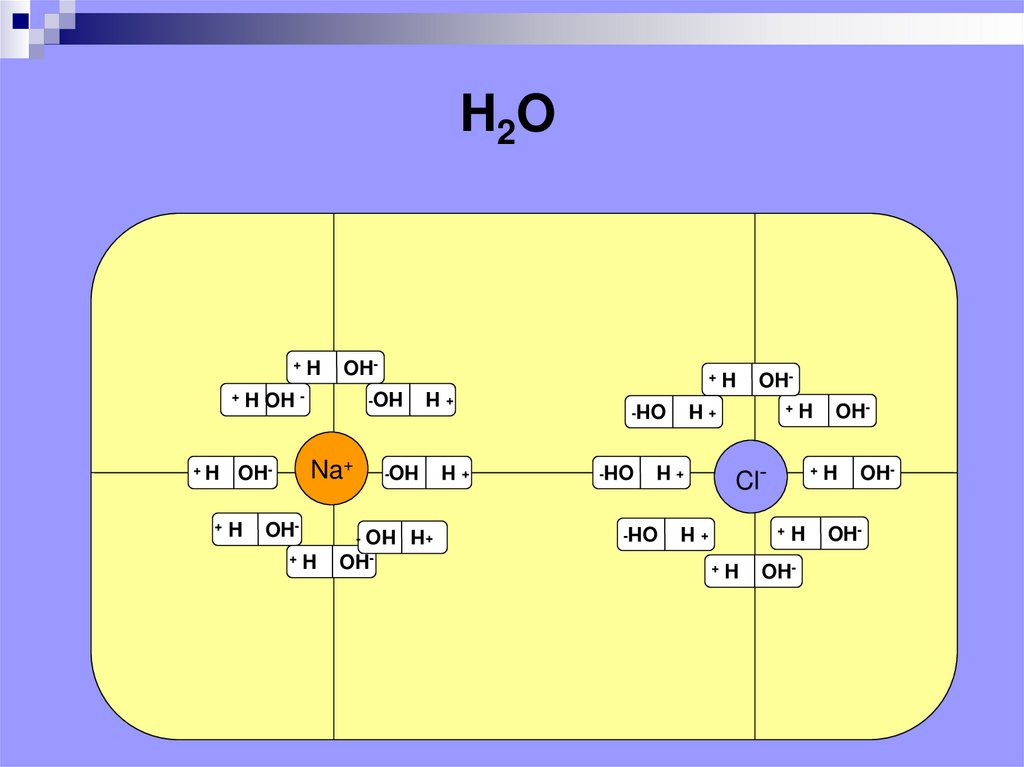
4.
H2OOH-
OH-
+H
HO OH-
OH+ H
Cl-
+ H
HO-
+ H
+ H
OH-
OH-
+ H
+ H
HO-
Na+
OH-
+ H
+H
+ H
OH-
+ H OH -
+ H
+ H
+ H
+ H
+ H
OH-
OH-
OH-
OH-
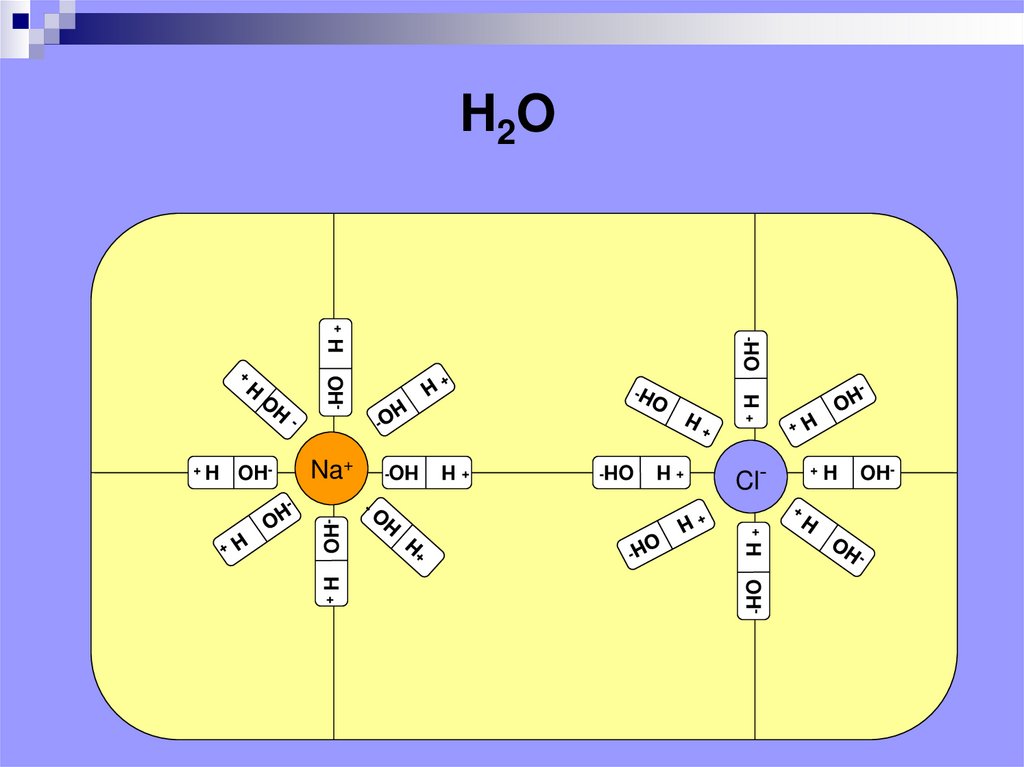
5.
H2OOH-
+ H
+ H
HO-
OH-
Cl+ H
+ H
OH-
Na+
+ H
OH-
+ H
OH-
+H
+ H
OH-
OH-
6. Электролитическая диссоциация
расщепление молекул электролита наположительные и отрицательные ионы
под действием растворителя
(от лат. dissociatio - разъединение).
7. Степень диссоциации
отношениеколичества
молекул,
диссоциировавших на ионы, к общему
количеству молекул данного вещества.
8. Электролиз
выделение на электродах веществ,входящих в состав электролита, при
протекании через его раствор (или
расплав) электрического тока.
9. Закон Фарадея:
m mi N i(1)
Q qi N i
(2)
m mi
k
Q qi
k -электрохимический эквивалент вещества
(3)
10.
Масса вещества, выделившегося на электроде,прямо пропорциональна заряду, прошедшему через
раствор (расплав) электролита:
m=kQ
11.
Учитывая, что Q=It, получим:Масса вещества, выделившегося на
электроде, прямо пропорциональна силе
тока и времени прохождения тока через
раствор (расплав) электролита:
m=kIt
12.
M(4)
mi
NA
qi ne (5)
Согласно (3):
1 M
k
eN A n
(6)
(6) – второй закон Фарадея
F eN A 9,65 10 Kл / моль (7)
4
F- постоянная Фарадея
13. Объединенный закон Фарадея:
1 Mm
Q
F n










 Химия
Химия








