Похожие презентации:
Теория растворов электролитов и неэлектролитов
1. Теория растворов электролитов и неэлектролитов
1.2.
3.
Основные понятия;
Теория электролитической
диссоциации;
Водородный показатель pH.
2.
1.С водой необратимо реагируют …………
2.
Распределите перечисленные оксиды по
их кислотно-основным свойствам:
NO2; Na2O; ZnO; Cr2O3; N2O; Mn2O7; K2O2; CO2; BaO; SiO
3.
Запишите реакцию Al2O3 с щелочью в
растворе и при сплавлении
3. Численное выражение состава раствора:
Процентнаяконцентрация:
Молярная концентрация
– отношение количества
растворенного вещества
к объему раствора:
%
mв
100%
m р ра
C
V
4.
5.
Задача. На нейтрализацию 10 мл раствора гидроксиданатрия израсходовали 6 мл 0,5М раствора соляной
кислоты. Вычислите молярную концентрацию раствора
щелочи (М≡моль/л).
6.
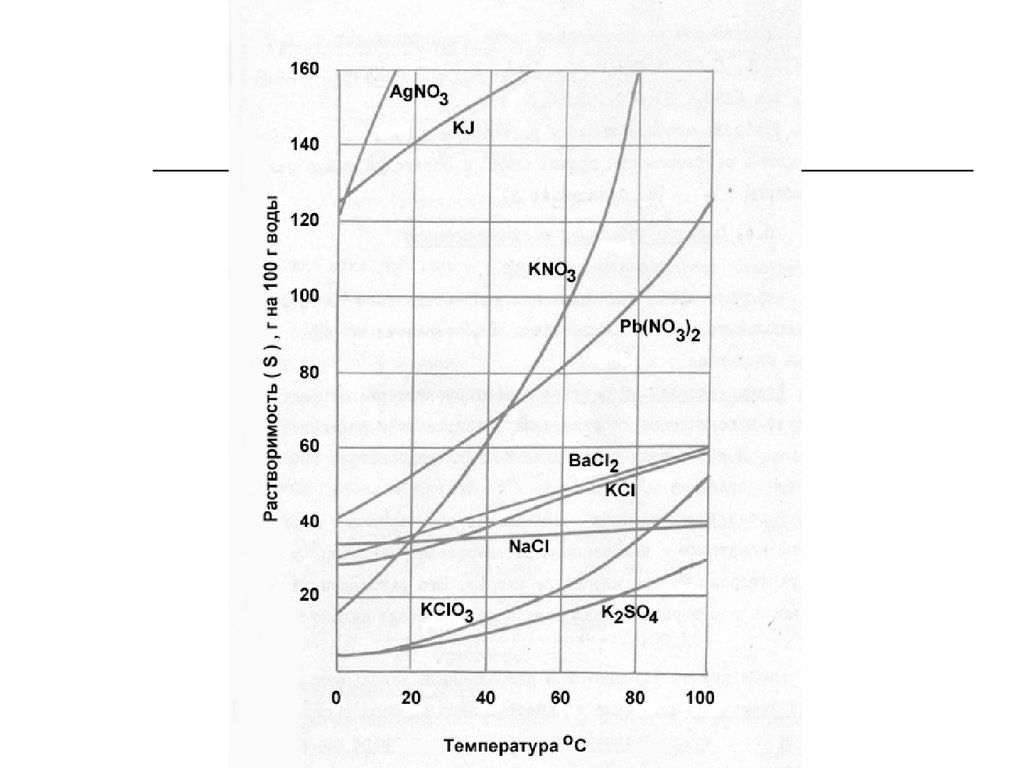
Растворимость – это свойство вещества растворяться вводе или в другом растворителе.
По растворимости в воде растворы бывают
ненасыщенными, насыщенными и перенасыщенными.
Насыщенный раствор – находится в динамическом
равновесии с избытком растворенного вещества.
Ненасыщенный раствор – вещества находится меньше
при данной температуре, чем в насыщенном растворе.
Количественно растворимость выражается
концентрацией насыщенного раствора, т. е.
максимальным числом граммов вещества, которое
можно растворить в 100 г растворителя при данной
температуре.
Перенасыщенный раствор – вещества находится при
данной температуре больше, чем в насыщенном. Эти
растворы нестабильны.
7. Подобное растворяется в подобном
8.
9.
10.
11. В зависимости от того, проводит ли раствор электрический ток или нет, они подразделяются:
Электролиты – вещества, распадающиесяна ионы в растворах или расплавах и
поэтому проводящие электрический ток
(кислоты, основания, соли).
Неэлектролиты – вещества, которые при
тех же условиях на ионы не распадаются
и не проводят электрический ток (бензол,
ацетон, газы, оксиды).
Электролитическая диссоциация – это
распад электролитов на ионы при
растворении их в воде.
KOH
K OH ;
12.
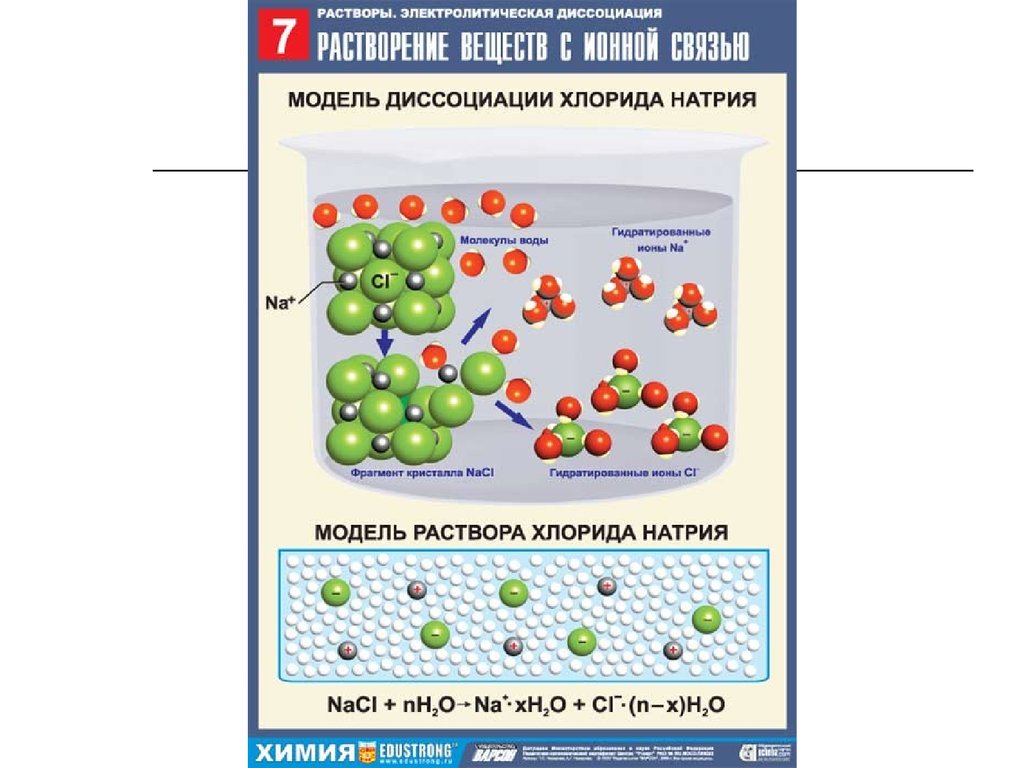
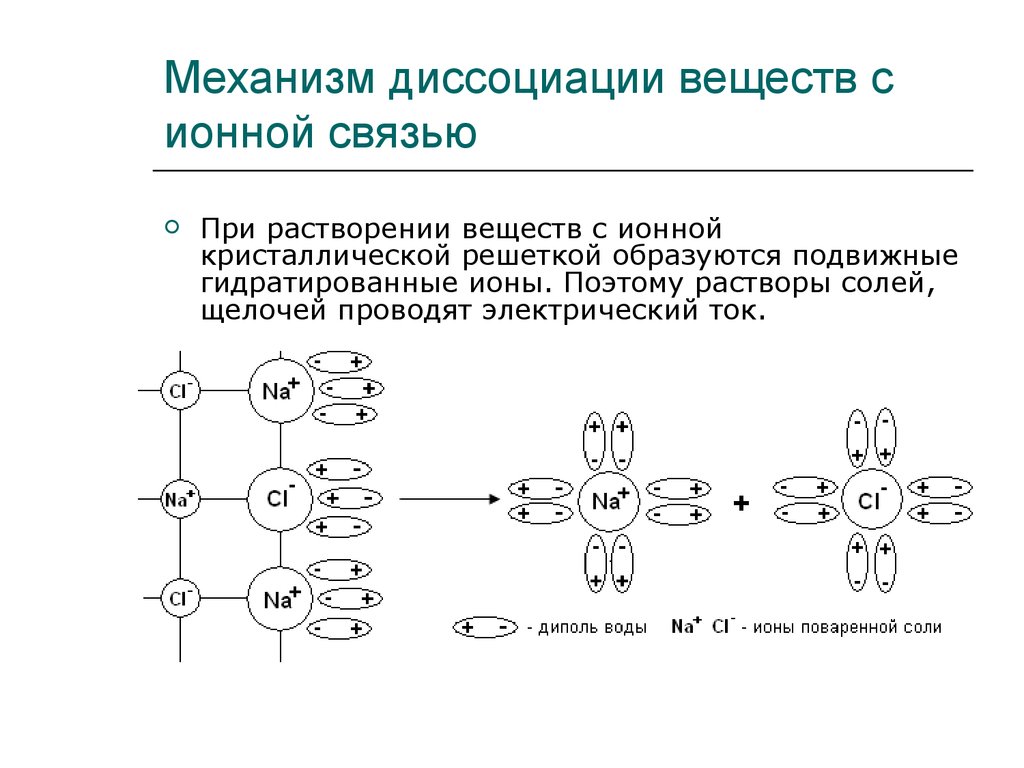
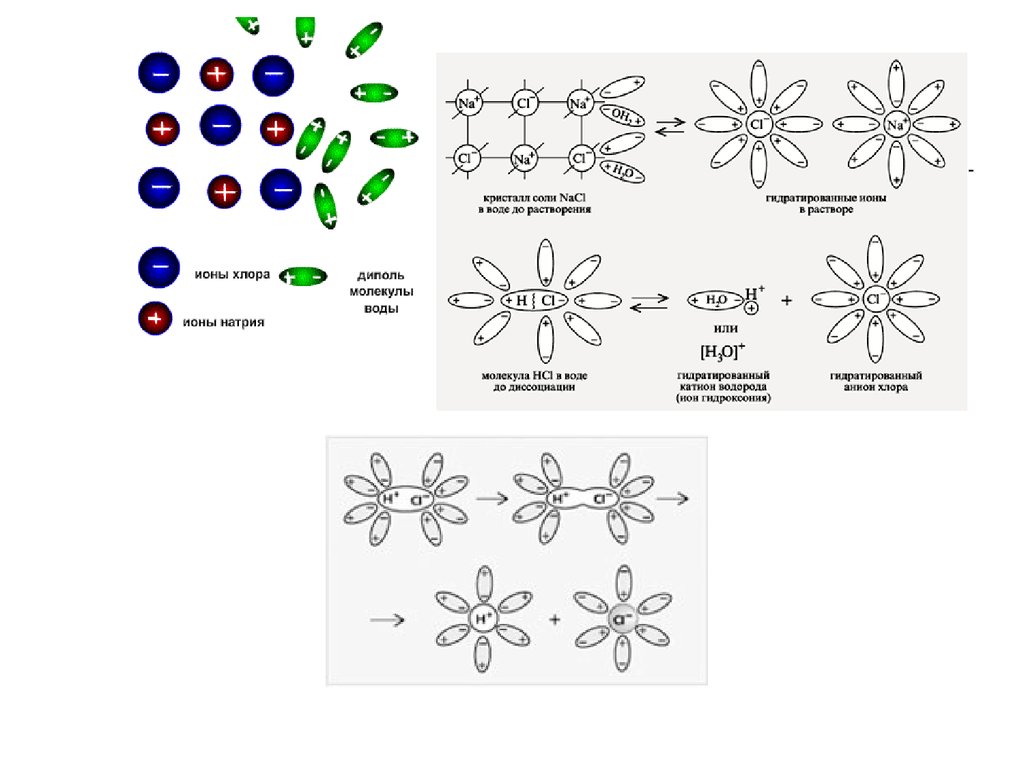
13. Механизм диссоциации веществ с ионной связью
При растворении веществ с ионнойкристаллической решеткой образуются подвижные
гидратированные ионы. Поэтому растворы солей,
щелочей проводят электрический ток.
14.
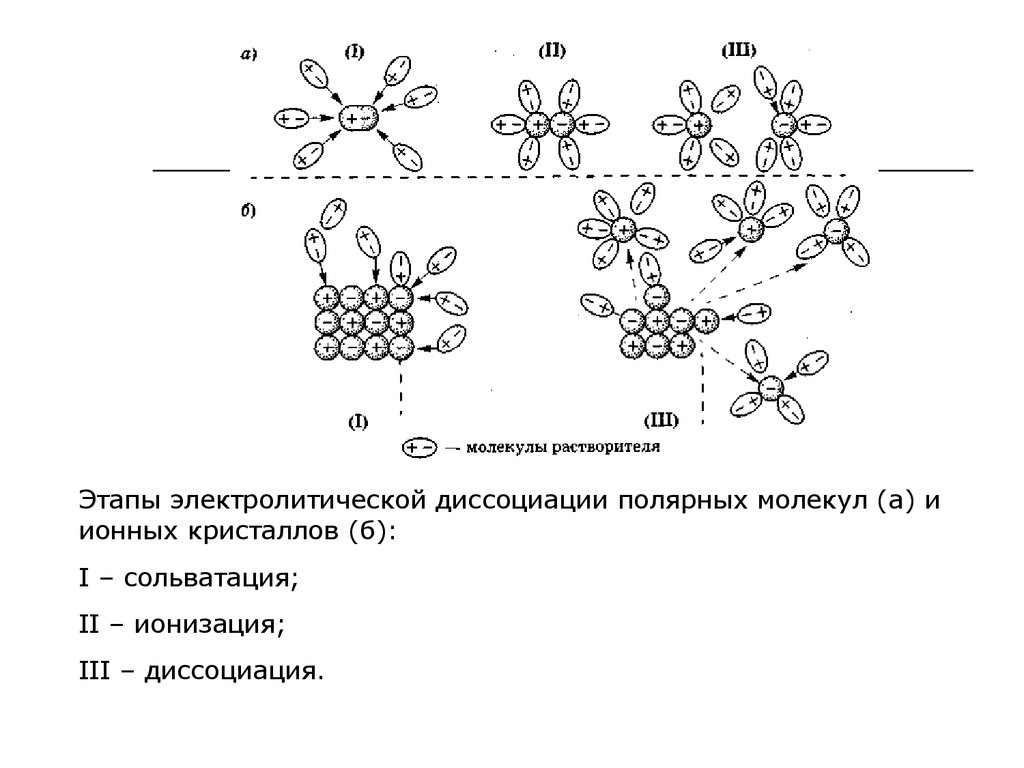
Этапы электролитической диссоциации полярных молекул (а) иионных кристаллов (б):
I – сольватация;
II – ионизация;
III – диссоциация.
15.
16. Теория электролитической диссоциации (ТЭД) (С. А. Аррениус)
1.2.
3.
Электролиты при растворении в воде
распадаются (диссоциируют) на ионы:
положительно заряженные – катионы
(Na+, Mg2+) и отрицательно заряженные –
анионы (NO3-);
Под действием электрического тока ионы
приобретают направленное движение:
катионы движутся к катоду
(отрицательному электроду), а анионы – к
аноду (положительному электроду);
Диссоциация – процесс обратимый:
параллельно с распадом молекул на ионы
(диссоциация) протекает процесс
соединения ионов (ассоциация).
17.
18. Необходимо отметить!
Ионы, в отличие от атомов, имеютзавершенные внешние орбиты и отличаются
своей инертностью, т. е. по этой причине
свойства ионов и атомов различны
NaCl
Na Cl
19.
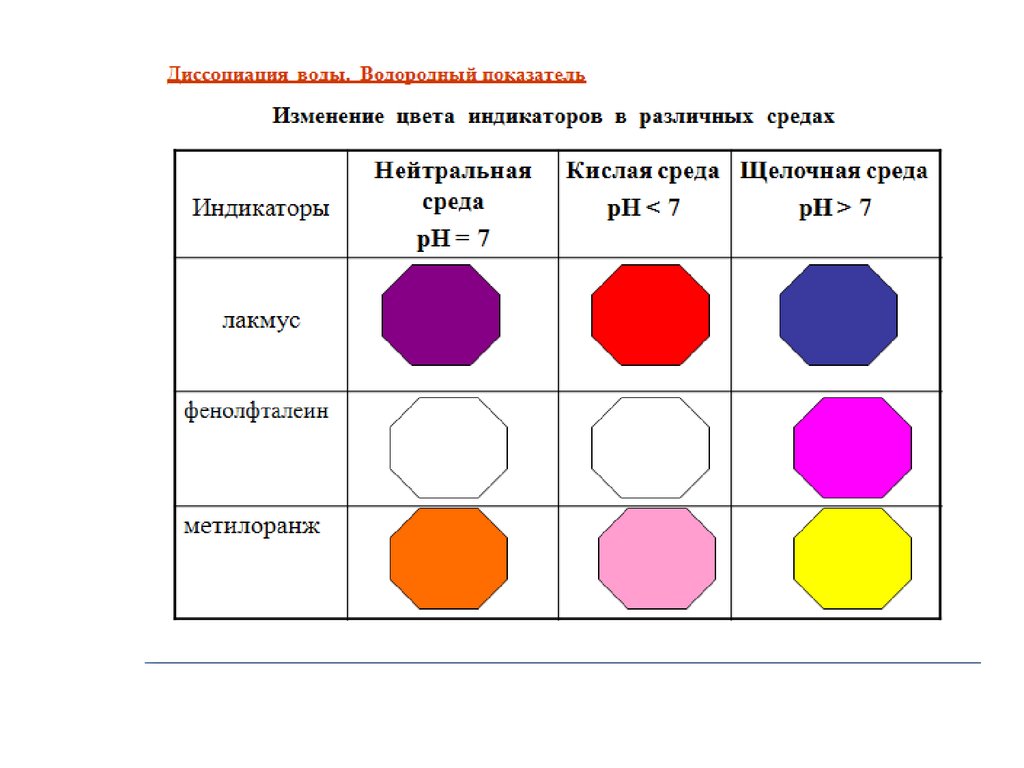
20. Определения с позиции ТЭД
Кислоты – электролиты,которые диссоциируют на
катион водорода и анион
кислотного остатка (Синий
лакмус и метилоранж
краснеют).
Основания – электролиты,
которые диссоциируют на
катион металла и анион
гидроксо-группы
(Фенолфталеин становится
малиновым, а метилоранж –
желтым).
Соли – электролиты, которые
диссоциируют на катион
металла и анион кислотного
остатка.
HCl
H Cl
NaOH
Na OH
KCl
K Cl
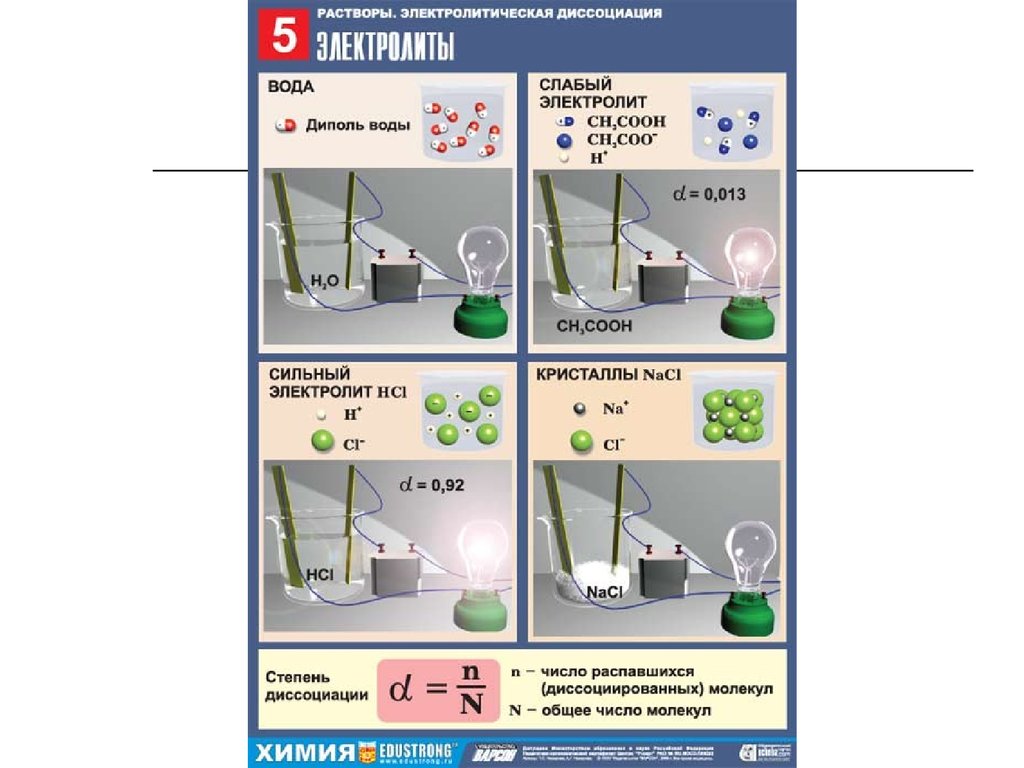
21. Степень диссоциации – отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул.
n;
N
a - степень диссоциации (выражается в
долях единицы или в процентах);
n – число распавшихся на ионы молекул;
N – общее число растворенных молекул.
Степень диссоциации зависит он
концентрации раствора в обратной 1
пропорциональности
С
22.
23. Электролиты по степени диссоциации делятся на сильные, средние и слабые:
1.2.
Сильные электролиты в воде
диссоциируют на ионы почти
полностью (более чем на 50%, т. е. ).
Таковыми являются сильные кислоты
(HCl, HBr, HI, HNO3, H2SO4, HClO4),
все щелочи и почти все растворимые
соли;
Слабые электролиты в воде
диссоциируют на ионы частично
(менее 30%). Таковыми являются
слабые кислоты и основания;
24. Диссоциацию растворов можно зафиксировать количественно, причем это будет постоянная для каждого вещества:
Константа диссоциации – сильные электролитыдиссоциируют полностью, и равновесие
смещается в сторону образовавшихся ионов. В
растворах слабых электролитов равновесие
смещается в сторону образования молекул:
AB
A B
K дисс.
[ A ] [B ]
[ AB]
Константа диссоциации зависит от природы
электролита, температуры, но не зависит от
концентрации раствора.
25. Закон разведения Освальда (для слабых электролитов):
«Степень диссоциации слабыхэлектролитов прямопропорциональна
константе диссоциации и
обратнопропорциональна
концентрации»
26.
Тогда: K дисс.[K ] [ A ]
[ KA]
или
K дисс.
2 С2
1
Для слабых электролитов известно, что a<<1, т.
е.
или, подставив, получим K дисс. 2 С
или, по Закону, получается,
что:
K дисс.
C
1 1
27. Реакции ионного обмена
1.2.
3.
Реакции ионного обмена – это
реакции, протекающие между
ионами электролитов,
образовавшихся при
диссоциации. Ионные реакции
протекают до конца, если:
образуется осадок
образуется легколетучее
соединение (газ)
образуется
малодиссициирующее
вещество (например, вода)
28.
CuSO4 2 KOHCu (OH ) 2 K 2 SO4
Cu 2 SO42 2 K 2OH
Cu (OH ) 2 2 K SO42
Cu 2 2OH
Cu (OH ) 2
29.
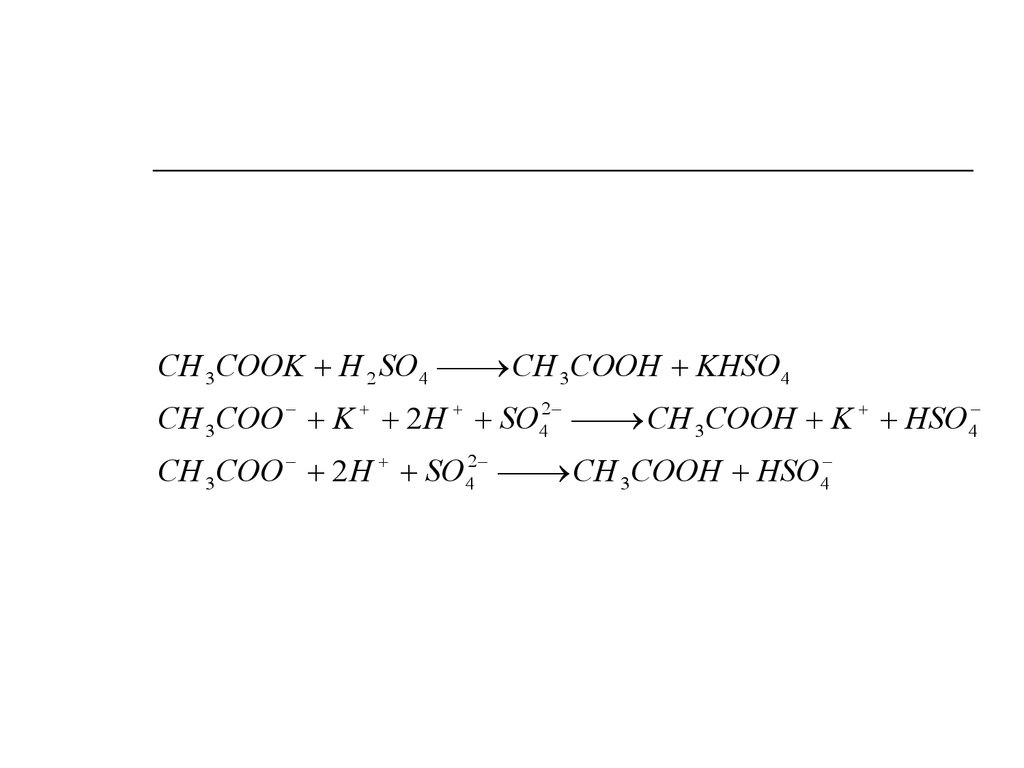
CH 3 COOK H 2 SO4CH 3 COOH KHSO4
CH 3 COO K 2 H SO42
CH 3 COOH K HSO4
CH 3 COO 2 H SO42
CH 3 COOH HSO4
30.
K 2 SO3 2 HNO32 KNO3 SO2 H 2 O
2 K SO32 2 H 2 NO3
2 K 2 NO3 SO2 H 2 O
2 H SO32
SO2 H 2 O
31.
32. Вода – слабый электролит. В чистой воде существует равновесие:
H 2OH OH
H 2O H 2O
H 3 O OH
Образование катиона или определяет
принадлежность воды к классу кислот,
а аниона - оснований. Опытным путем
установлено, что в 1 л воды при t = 22C
диссоциирует воды, образуя
10 моль / л H
7
или
10 7 моль / л OH
[ H ] [OH ] 10 7 моль / л
K воды [ H ] [OH ] 10 14
33.
Водородный показатель pH –отрицательный десятичный логарифм
концентрации ионов водорода.
pH lg[ H ]
или
[ H ] 10 pH
Чем меньше pH, тем больше концентрация
ионов , т. е. выше кислотность среды; и
наоборот, чем больше pH, тем меньше
концентрация ионов , т. е. выше
щелочность среды.





















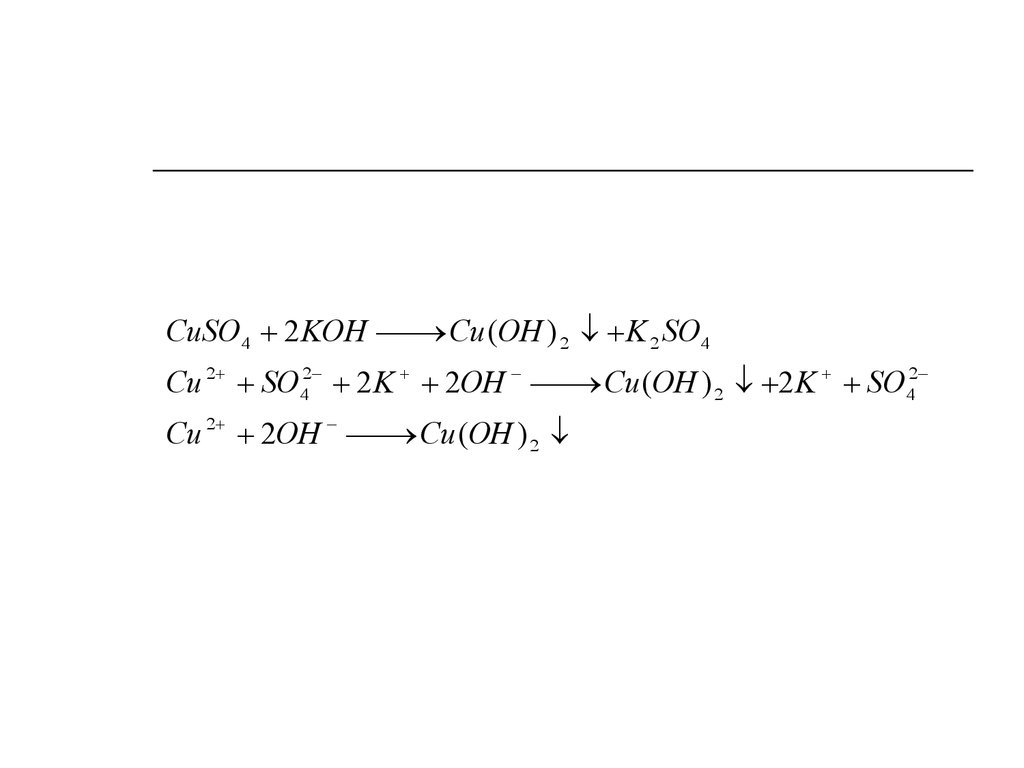
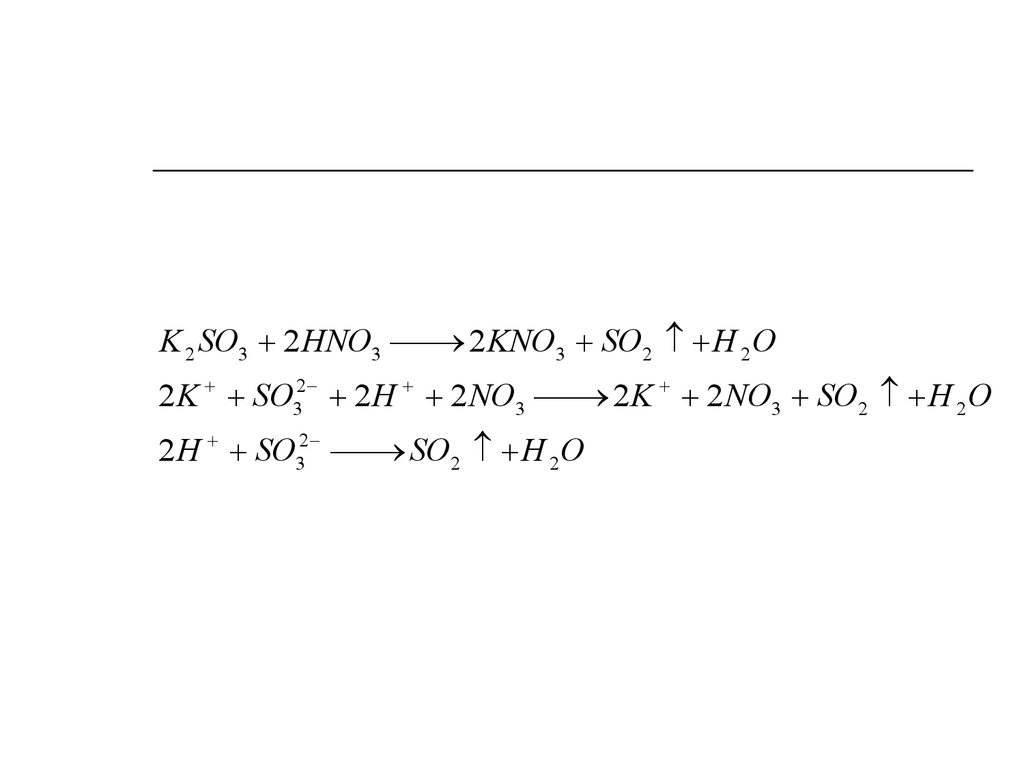




 Химия
Химия








