Похожие презентации:
Атомная и ядерная физика. Спектры излучения
1.
Атомная и ядернаяфизика
Парфентьева Наталия Андреевна
2.
Спектры излучения.Вид
спектра
определяется
излучателем.
Спектры
излучения
могут
быть
линейчатыми, сплошными, полосатыми.
Сплошные спектры излучают нагретые твердые тела, а также жидкости.
Атомы излучают линейчатые спектры, причем каждому атому соответствует свой
спектр излучения.
Молекулы имеют полосатый спектр, он состоит из ярких полос, разделенных
темными промежутками.
3.
Формула Бальмера-Ридберга:1
1 1
R 2 2
n
k
R = 1,097 107 м–1 – постоянная Ридберга.
k = 1 , n = 2,3,… Серия линий Лаймана – ультрафиолетовая часть спектра
R = 1,097 107 м–1 – постоянная Ридберга.
Cерия линий Бальмера – видимая часть спектра
1
1 1
R 2 2
2 n
Спектральные линии серии Бальмера имеются и
в ультрафиолетовой части спектра при n > 6.
k = 3 n = 4,5,… Серия линий Пашена– инфракрасная часть спектра
4.
Начало ХХ века• Известно
• 1) Атом электронейтрален
• 2) спектр атома линейчатый
• 3) в состав атома входят электроны
• 4) атом устойчив
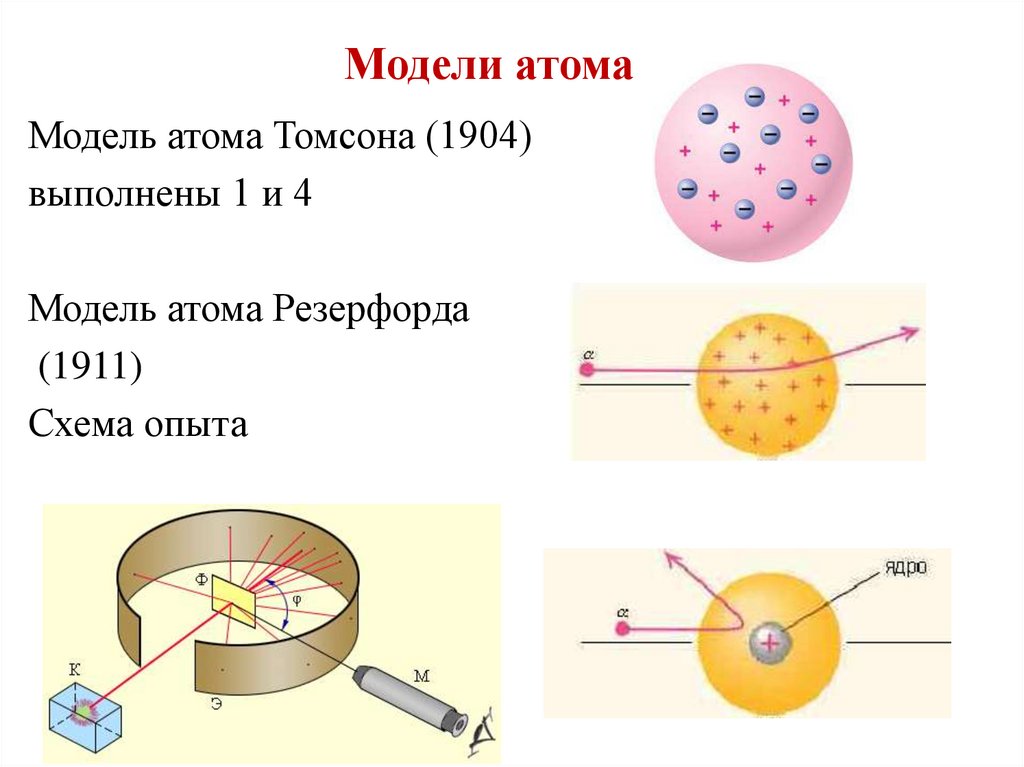
5.
Модели атомаМодель атома Томсона (1904)
выполнены 1 и 4
Модель атома Резерфорда
(1911)
Схема опыта
6.
В центре атома положительноеядро, вокруг – по орбитам
движутся электроны.
• Недостатки:
• атом неустойчив;
• спектр излучения сплошной
7.
Модель атома по Бору (1912 г.)Постулаты Бора.
1. Электроны могут двигаться в атоме только по определенным орбитам,
называемым стационарными, при движении по которым энергия не
теряется. Момент импульса электрона, движущегося по n- орбите:
mvnrn = nh/2π
2. Излучение и поглощение энергии атомом происходит при переходе с
одной стационарной орбиты на другую.
Энергия испускаемого (поглощаемого) фотона равна (это следует из закона
сохранения энергии)
h = E2 – E1,
8.
Расчет радиуса, скорости электрона в атоме водородаУсловие стационарного вращения условие квантования орбит
на n - ой орбите по Бору :
mvn rn = nh / 2π,
n – главное квантовое число.
mvn2
1 Zqe2
1 Zqe2
Fk
2
4 0 rn
rn
4 0 rn2
0 h 2 n 2
rn
mZqe2
r1 0,529 10 –10 м,rn r1 n 2 .
9.
Zqe2mvn2
En Eпот n Eкин n
4 0 rn
2
mvn2
Zqe2
Zqe2
En –
2
4 0 2rn
4 0 2rn
Энергетические уровни в водородоподобном атоме :
Z 2 qe4 m 1
En – 2 2 2 , где n 1, 2, 3,
8 0 h n
Z 1
E1 – 2,17 10 –18 Дж – 13, 6 эВ.
На разрешенных стационарных орбитах энергия электрона в
водородоподобном атоме имеет строго определенные значения (квантованные
значения) и определяется главным квантовым числом n, которое может
принимать только целые положительные значения.
10.
В атомной физике энергия электрона в определенномстационарном состоянии называется энергетическим уровнем.
Z 2 qe4 m 1 1
h Ek – En 2 2 2 2
n
8 0 h k
1 Z 2 qe4 m 1 1
2 3 2 2
c 8 0 h c n k
1,6 10 9 ,1 10 31
qm
R
2
3
12
102
8
8 h c 8 8,85 10 6 ,63 10 3 10
4
e
2 3
0
19 4
1,0974 107 м –1 ,
На разрешенных стационарных орбитах энергия электрона в
водородоподобном атоме имеет строго определенные значения
(квантованные значения) и определяется главным квантовым
числом n, которое может принимать только целые положительные
значения.
11.
Если электрон в атоме водорода движетсяпо первой боровской орбите, то энергия
атома
минимальна,
невозбужденном,
атом
или
находится
в
в
основном
состоянии. Если электрон в атоме под
действием
внешнего
излучения
или
столкновения атома c частицей переходит на
следующие разрешенные орбиты, то сам
атом из основного состояния переходит в
возбужденное состояние, в котором он
существует ~10–8 с, а затем, испуская
фотоны,
состояние.
переходит
опять
в
основное
12.
Достоинства теории Бора1) были получены правильные значения постоянной Ридберга,
2) энергии ионизации атома водорода, 3) объяснения поглощения и
излучения атома.
Недостатки
Не могла объяснить спектра следующего по сложности атома – атома
гелия, невозможность определения интенсивности спектральных
линий, невозможность объяснить тонкую структуру спектров и т. д.
Изучение микромира требует совершенно новых подходов, где
представления о движении частиц по определенным траекториям и с
определенными скоростями уже не могут быть использованы. Теория,
потребовавшая
введения
новых
понятий, названная квантовой
механикой, позволила объяснить строение многоэлектронных атомов,
их спектры и многие другие процессы, происходящие в микромире.
13.
Волны де БройляСогласно гипотезе де Бройля все частицы обладают волновыми
свойствами.
Таким образом, дуализм волна-частица,
присущий свету, свойственен всем частицам.
Импульс частицы связан с длиной волны соотношением
h
p
где λ – длина волны де Бройля.
Принцип неопределенности Гайзенберга
Согласно принципу неопределенности невозможно одновременно абсолютно
точно измерить проекцию импульса (рх,у,z) и соотвествующую координату (x, y, z)
частицы. Математически этот принцип записывается (например, для х-й
координаты) так:
x px h / 2
14.
Волновая функция(x,y,z,t)
Квантовые числа
Название
Обозначение Разрешенны
е значения
Главное
квантовое
число
n
1,2,3…
Орбитальное l
квантовое
число
0, 1, …n-1
Магнитное
квантовое
число
l,l-1…0…-l
Спиновое
квантовое
число
ml
1/2
ms
15.
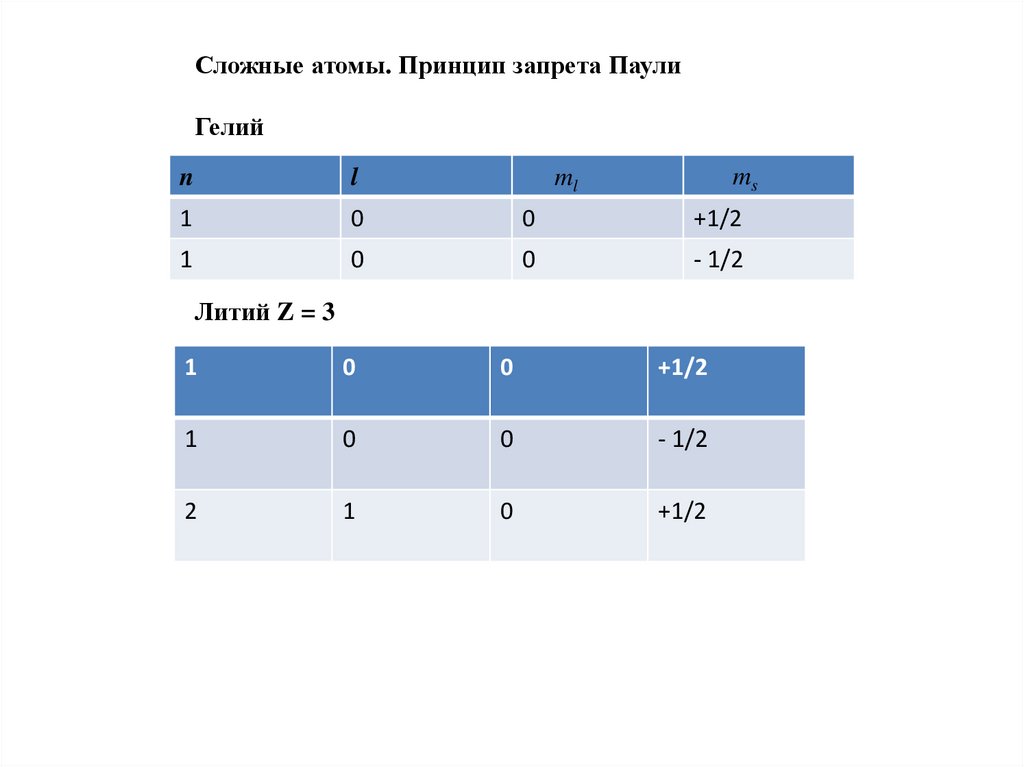
Сложные атомы. Принцип запрета ПаулиГелий
ms
n
l
1
0
0
+1/2
1
0
0
- 1/2
ml
Литий Z = 3
1
0
0
+1/2
1
0
0
- 1/2
2
1
0
+1/2
16.
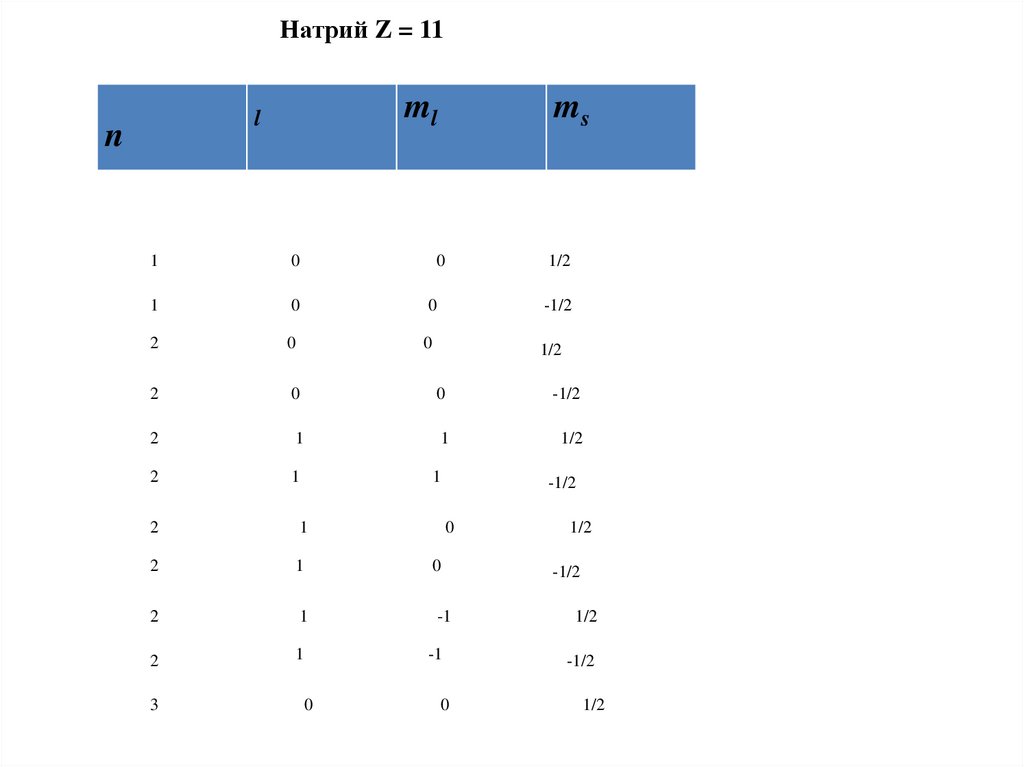
Натрий Z = 11ml
l
n
ms
1
0
0
1/2
1
0
0
-1/2
2
0
0
1/2
2
0
0
-1/2
2
1
1
1/2
2
1
1
-1/2
2
1
2
1
0
2
1
-1
1/2
2
1
-1
-1/2
3
0
0
1/2
0
1/2
-1/2
17.
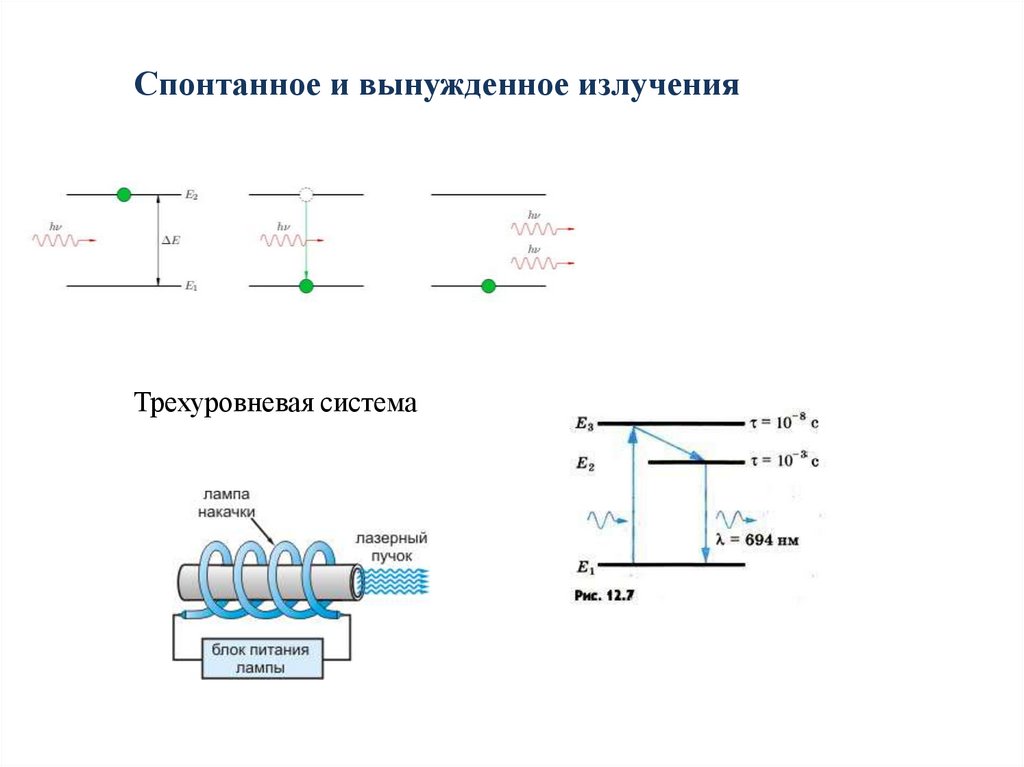
Спонтанное и вынужденное излученияТрехуровневая система
18.
Ядерная физикаСостав ядра
Ядро атома состоит из протонов и нейтронов. Масса протона mp = 1,673 10–27 кг,
заряд протона положителен и равен по величине заряду электрона qp = +1,6 10-19
Кл.
Масса нейтрона mn = 1,675 10– 27 кг. Нейтрон – электрически нейтральная
частица.
Массы ядер принято измерять в атомных единицах массы. 1 атомная
единица массы равна 1/12 массы атома углерода и равна 1 а.е.м. = 1,6606 10–27
кг. В этих единицах масса нейтрона равна
mn = 1,008665 а.е.м., а масса протона mp = 1,007276 а.е.м.
Используя связь массы и энергии (см. шаг 24), имеем 1 а.е.м. = 931,5 МэВ/с2,
где с – скорость света
19.
Нейтроны и протоны, составляющие ядро, называются нуклонами. Междунуклонами в ядре действуют силы, удерживающие их на малом расстоянии друг
от друга – ядерные силы.
Ядерные силы – короткодействующие, это значит, что они действуют только
на малых расстояниях порядка размеров ядра, т. е. 10–15 – 10–14 м.
Общее число нуклонов в ядре равно числу целых единиц атомной массы
элемента и называется массовым числом А.
rя = 1,3 10–15 А1/3 м.
Число протонов в ядре обозначается буквой Z и называется зарядовым числом.
Очевидно, что число нейтронов в ядре равно
N = A – Z. Элемент принято обозначать AZ X
X –. символ химического элемента.
Ядра одного и того же химического элемента, содержащие одинаковое число протонов,
но разное число нейтронов, называются изотопами.
Например, водород имеет три изотопа:
1
1
H, 21 H, 31 H
20.
Дефект масс и энергия связиm = Zmp + (A – Z)mn – mя
Есв = mc2 = [Zmp + (A – Z)mn – mя]c2.
Есв = c2{[ZmН + (A – Z)mn – mа]}=931,5 МэВ {[ZmН + (A – Z)mn – mа]}
.
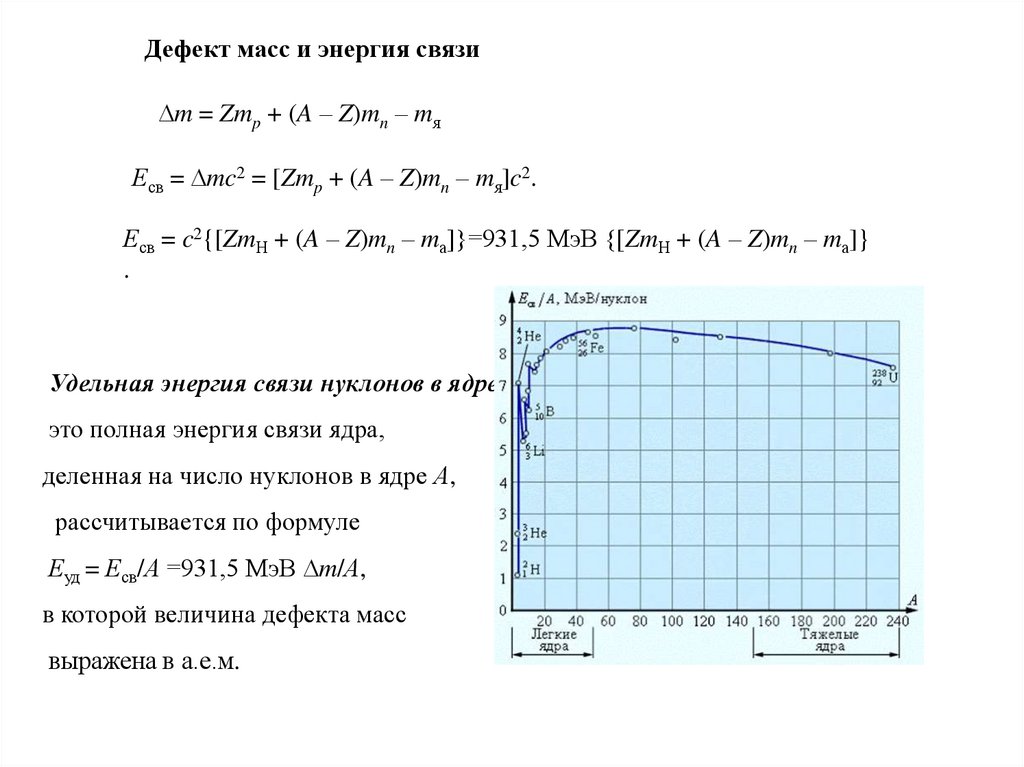
Удельная энергия связи нуклонов в ядре –
это полная энергия связи ядра,
деленная на число нуклонов в ядре А,
рассчитывается по формуле
Еуд = Есв/А =931,5 МэВ m/А,
в которой величина дефекта масс
выражена в а.е.м.
21.
Явление радиоактивностиЕстественная радиоактивность. Явление радиоактивности было открыто в 1896 г.
А. Беккерелем.
Мария и Пьер Кюри – полоний и радий.
В природе существуют нестабильные ядра, которые превращаются
в ядра других элементов;
при этом происходит излучение.
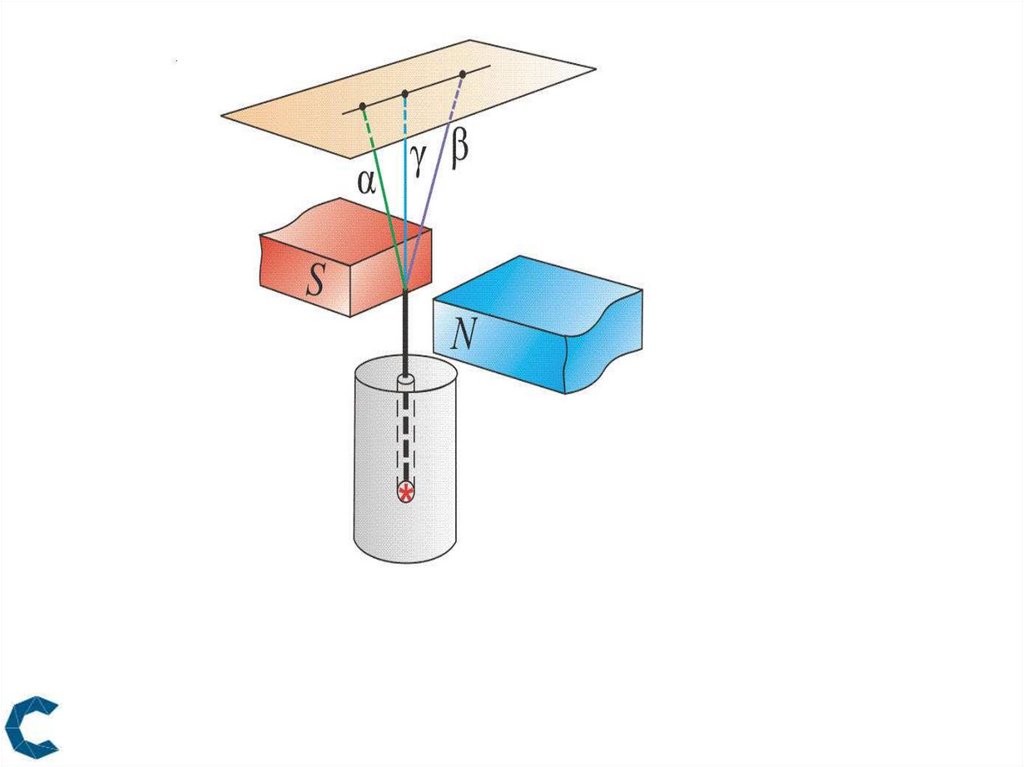
Три основных вида радиоактивного излучения
(радиоактивного распада ядер):
-, - и -излучения;
-излучение – это поток ядер гелия
(их называют также -частицами, они заряжены положительно);
-излучение – поток быстрых электронов,
-излучение – электромагнитные волны очень высокой частоты.
При всех ядерных превращениях выполняются все известные законы сохранения:
энергии, импульса, момента импульса, заряда (зарядового числа), к которым
добавляется закон сохранения числа нуклонов (массового числа).
22.
Пример -распада - превращение радия в радон:.
226
88
222
Ra 86
Rn + 24 He
При -распаде происходит излучение электронов высоких энергий. Пример
-распада – распад ядра углерода:
C N+ e
14
14
0
6
7
1
Некоторые изотопы распадаются с испусканием позитрона – частицы, имеющей
ту же массу, что и электрон, но положительный заряд. Позитрон – античастица
электрона. Такой тип распада называют позитронным -распадом, или +распадом.
19
10
0
Ne 19
F
+
9
1 e e
К-захват
7
4
Be + 0 1 e 37 Li .
Гамма – излучение ( -лучи) – это очень короткие электромагнитные
волны, длины которых попадают в следующий за УФ-излучением интервал
от 10–13 до 10–10 м.
23.
24.
Искусственная радиоактивность. При поглощении частиц стабильнымиатомными ядрами они могут стать радиоактивными. Такая радиоактивность
называется искусственной. Это явление было обнаружено в 1932 г. Ирен и
Фредериком Жолио-Кюри.
27
13
1
Al + 24 He 30
P
+
15
0n
30
15
30
P 14
Si 10 e
Закон радиоактивного распада
У радона период полураспада T 3,8 суток, у радия – 1600 лет, у одного из
изотопов урана – 5730 лет.
dN – Ndt
dN
– dt
N
N N 0e
T
ln2
T
25.
Активность – число распадов в сN расп N 0 1 e t
N расп 0 N 0 e t N 0 e t N
Ядерные реакции
1. Реакции деления.
235
92
141
92
1
U 01n 236
U
Ba
Kr
3
92
56
36
0n
2. Реакция термоядерного синтеза
2
1
H + 31 H 24 He +10 n



















 Физика
Физика








