Похожие презентации:
Недостаточность первого закона термодинамики. Качественная неэквивалентность теплоты и работы. Типы процессов
1.
Недостаточность первого законатермодинамики. Качественная
неэквивалентность теплоты и работы.
Типы процессов. Обратимые и
необратимые процессы.
1
2.
23.
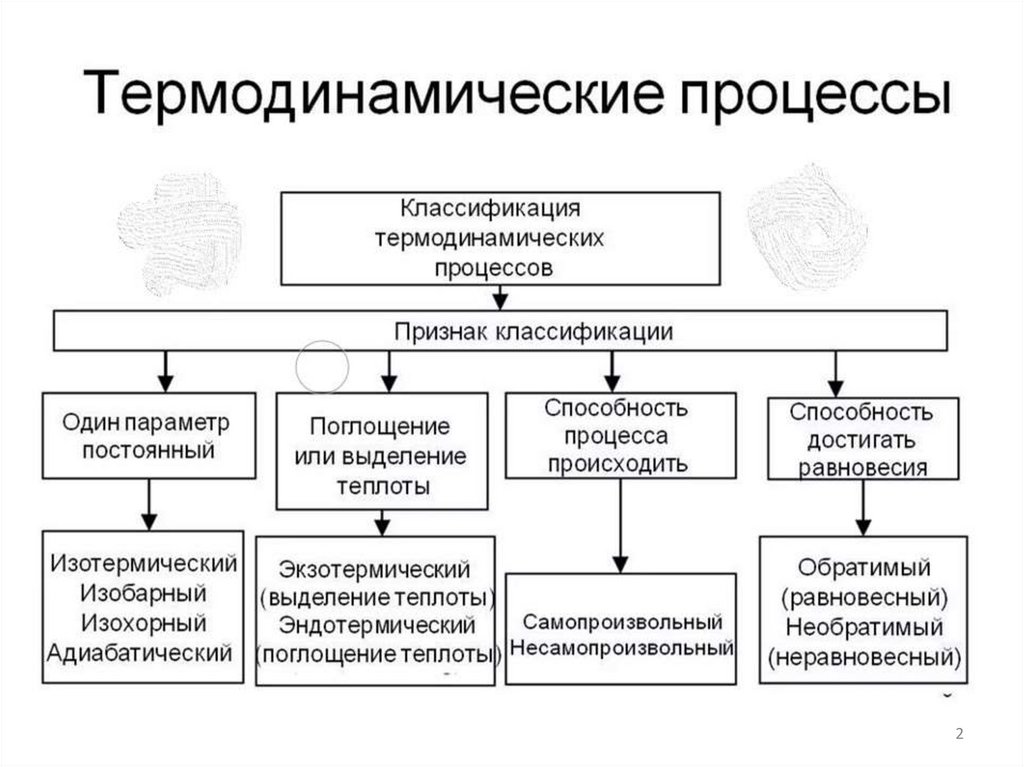
Если в системе изменяется хотя бы один из термодинамических параметров, тоэто означает, что протекает термодинамический процесс
изотермический (Т = const.);
изобарический (Р = const.);
изохорический (V = const.);
адиабатный (А = const.);
неравновесный (ΔР ≠ ΔТ ≠ ΔV ≠ 0);
равновесный (ΔР = ΔТ = ΔV = 0).
По направлению термодинамического процесса
обратимый процесс (допускающий возможность возвращения системы в
исходное состояние без того, чтобы в окружающей среде остались какиелибо изменения.);
необратимый процесс (идет только в одном направлении).
3
4.
Внутренняяэнергия
(U)
–
запас
энергии
системы.
Включает в себя все виды энергии, связанные со строением
системы,
и
не
включает
кинетическую
и
потенциальную
энергии системы как целого. Так как абсолютных знаний о
строении
вещества
не
существует,
внутренней энергии найти нельзя.
абсолютное
значение
5.
Теплота (Q) – это количественная характеристика энергии, которую система входе данного процесса получает (отдает) от окружающей среды. Теплота
является формой передачи энергии, реализуемой путем изменения
кинетической энергии теплового (хаотического) движения частиц (атомов,
молекул). Если процесс сопровождается переходом энергии от окружающей
среды к системе, он называется эндотермическим, в противном случае –
экзотермическим. Любая экзотермическая реакция в прямом направлении
становится эндотермической, если она идет в обратном направлении, и
наоборот.
Работа (А), совершаемая системой, обусловлена взаимодействием системы с
внешней средой, в результате чего преодолеваются внешние силы, т.е. работа
является одной из форм обмена энергией с окружающей средой и служит
количественной характеристикой переданной энергии, причем передача
энергии реализуется путем упорядоченного (организованного) движения
молекул под действием определенной силы.
5
6.
Схема опыта ДжоуляВ теплоизолированный медный сосуд 1, заполненный водой, погружена мешалка
2, снабженная лопатками. К стенкам сосуда также прикреплены лопатки 3,
затрудняющие движение воды при вращении мешалки. Мешалка приводится во
вращение посредством опускания связанного с ней тросом через блок 5 груза 4
весом G. При опускании на высоту Δz работа, производимая грузом (и,
следовательно, мешалкой), равняется убыли потенциальной энергии груза GΔz.
Теплота, выделившаяся в сосуде с водой, вычисляется по повышению температуры
воды, измеряемой термометром.
6
7.
В результате серии тщательно поставленных опытов Джоуль установил, чтомежду затраченной работой A и количеством полученной теплоты Q существует
прямая пропорциональность:K
Q = AK
Коэффициент пропорциональности К всегда сохраняет одно и то же
значение независимо от способа получения теплоты, вида работы,
температуры тела и т.д.
Для закрытой системы этот закон термодинамики устанавливает связь
между теплотой, полученной или выделенной системой в некотором процессе,
изменением внутренней энергии системы и произведенной при этом работой.
Для описания этих изменений вводят функцию состояния - внутреннюю
энергию U и две функции перехода - теплоту Q и работу A.
7
8.
Проще всего рассчитывать работу, совершаемую идеальным газом, длякоторого известно уравнение состояния p = nRT / V (табл. 1).
Таблица 1. Работа идеального газа в некоторых процессах расширения
Процесс
A
Расширение в вакуум
0
Расширение
против
внешнего давления p
постоянного p (V2-V1)
Изотермическое обратимое расширение
nRT ln(V2/V1)
Адиабатическое обратимое расширение
nCV(T1-T2)
При обратимом процессе совершаемая работа максимальна
8
9.
Энергия не исчезает и не возникает из ничего, а только превращается изодного вида в другой в строго эквивалентных соотношениях.
Определение 1.
Изменение ΔU внутренней энергии неизолированной
термодинамической системы равно разности между количеством теплоты Q,
переданной системе, и работой A, совершенной системой над внешними
телами.
Определение 2.
Количество теплоты, полученное системой, идет на
изменение ее внутренней энергии и совершение работы над внешними
телами.
Определение 3. В изохорном процессе, то есть в условиях неизменного объема
(V=const) , газ не совершает работы, A=0.
Определение 4. Невозможно построить вечный двигатель первого рода, то
есть двигатель, который совершает работу, не потребляя энергии
Математическая формулировка первого закона:
dU = δQ - δA (дифференциальная форма)
U = Q - A (интегральная форма)
9








 Химия
Химия








