Похожие презентации:
Константа равновесия. Способы выражения констант равновесия. Принцип Ле-Шателье, его практическое применение
1.
Константа равновесия. Способы выраженияконстант равновесия. Принцип Ле-Шателье,
его практическое применение
1
2.
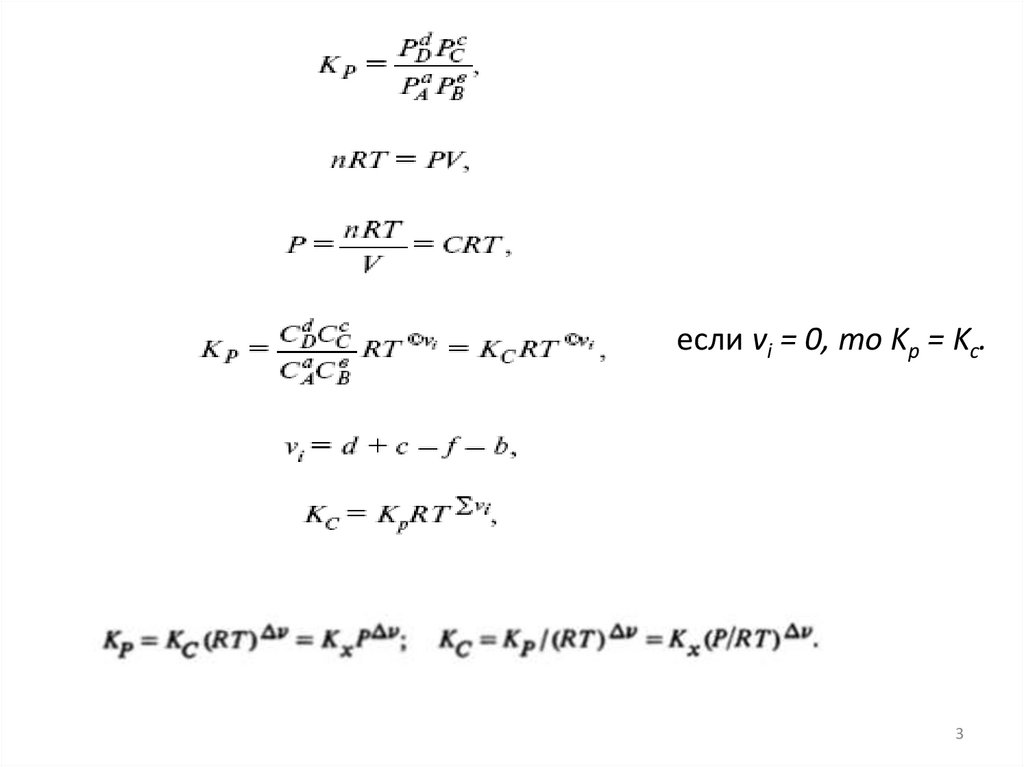
f – фугитивность – парциальное давлениедля реальных газов.
2
3.
если vi = 0, то Kp = Kc.3
4.
45.
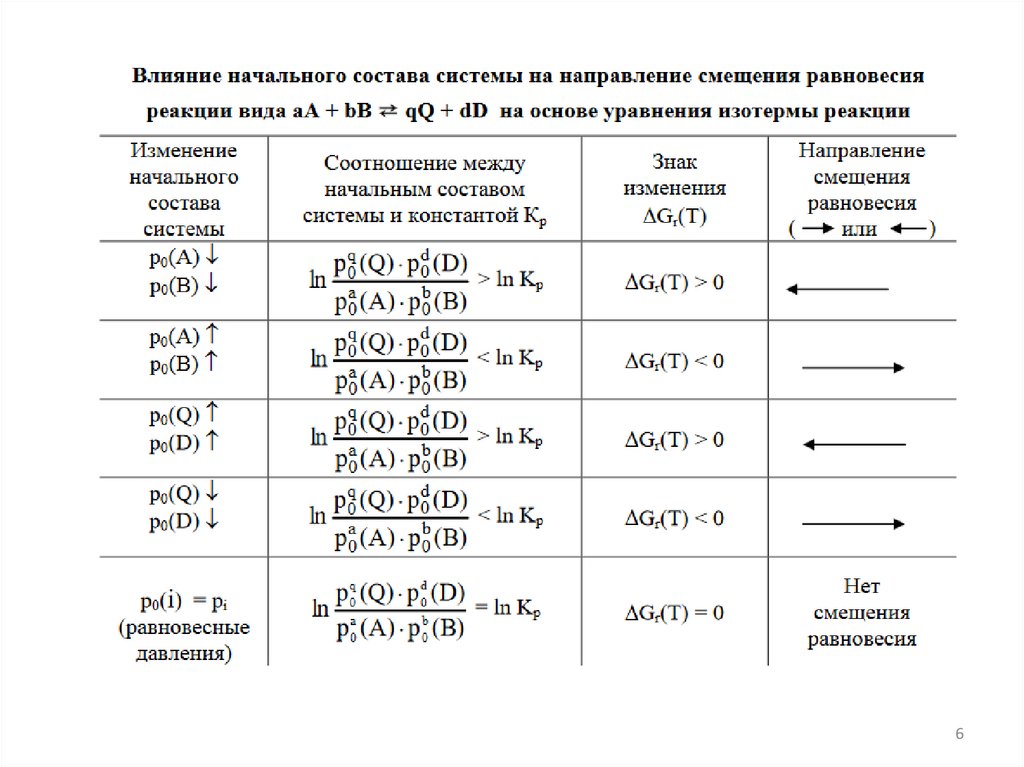
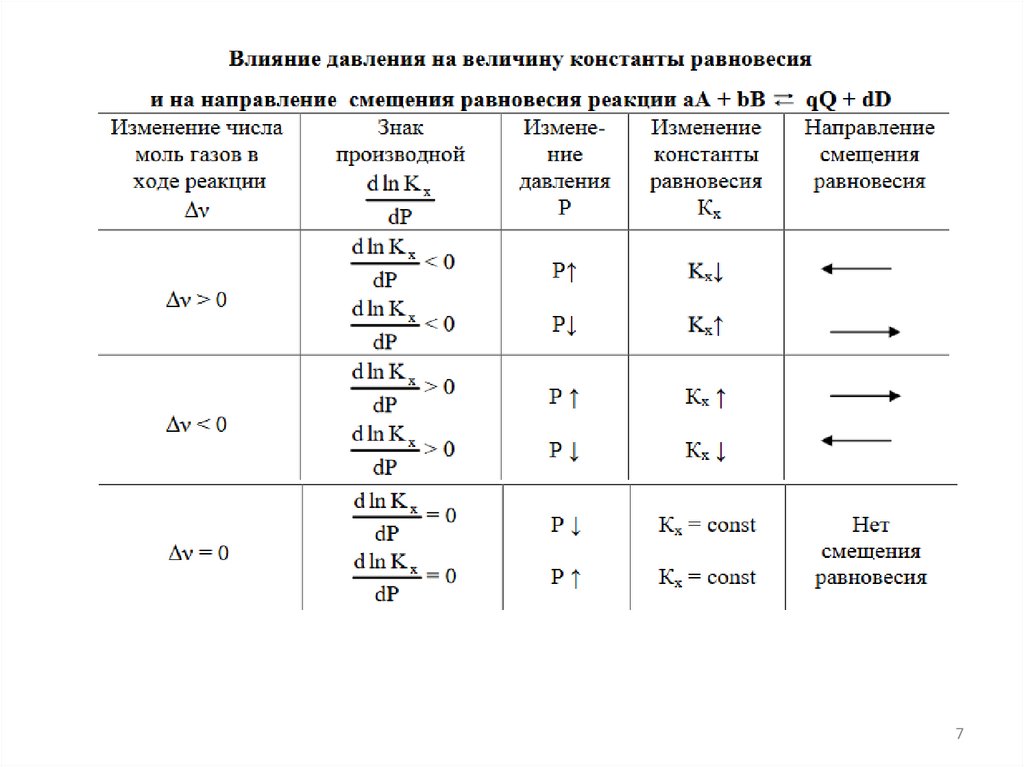
Принцип Ле-ШательеЕсли на систему, находящуюся в равновесии, оказать внешнее
воздействие, то равновесие реакции смещается в том
направлении, которое ослабляет эффект внешнего
воздействия.
На смещение химического равновесия влияют следующие
факторы:
-
изменение
концентрации
участвующих в реакции;
-
изменение температуры;
-
изменение давления.
какого-либо
из
веществ,
5
6.
67.
78.
89.
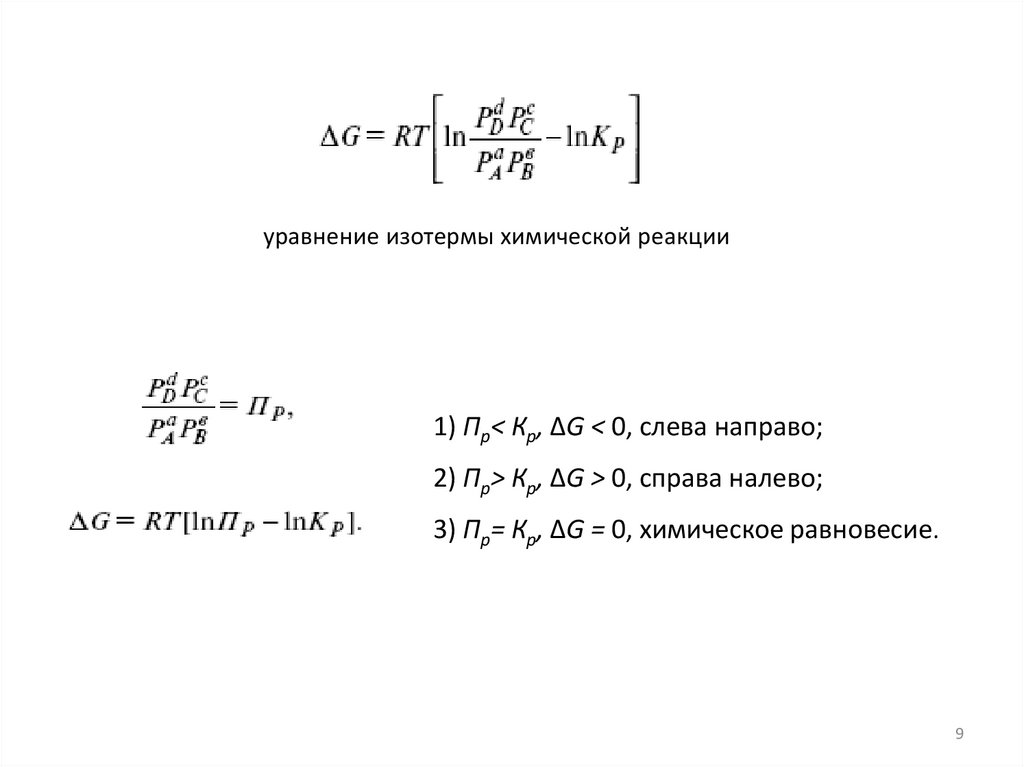
уравнение изотермы химической реакции1) Пp< Кp, ΔG < 0, слева направо;
2) Пp> Кp, ΔG > 0, справа налево;
3) Пp= Кp, ΔG = 0, химическое равновесие.
9
10.
Уравнения изохоры, изобары химической реакцииЗависимость К от температуры
10
11.
Уравнение изобары:Уравнение изохоры:
По ним судят о направлении протекания реакции:
11
12.
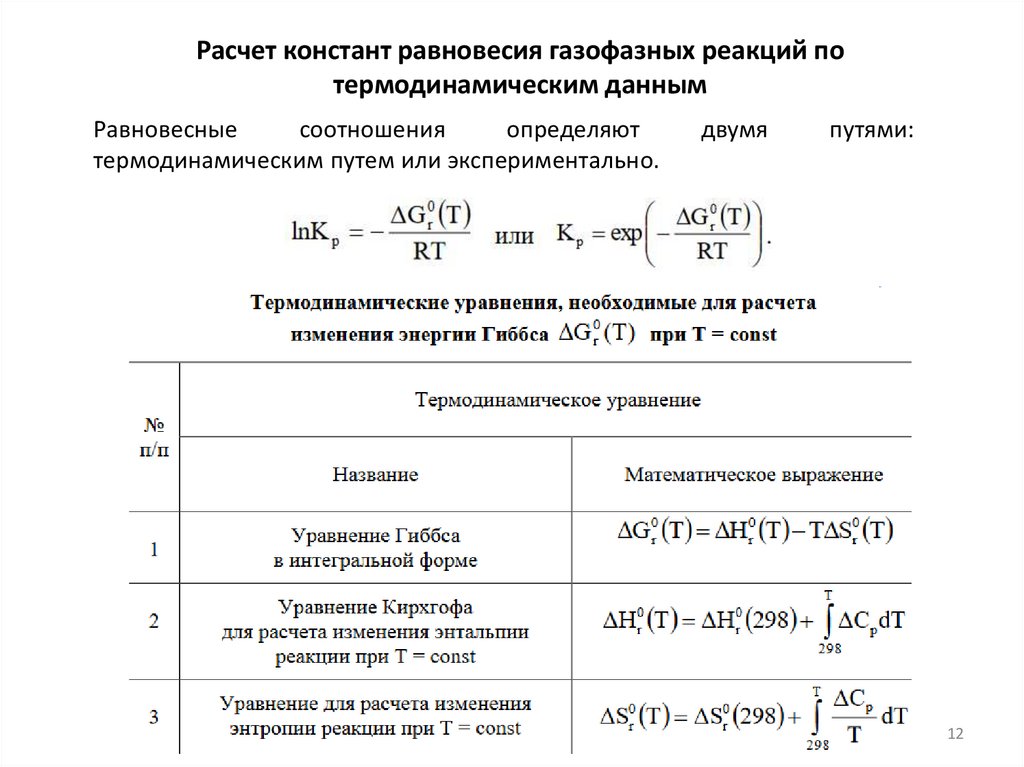
Расчет констант равновесия газофазных реакций потермодинамическим данным
Равновесные
соотношения
определяют
термодинамическим путем или экспериментально.
двумя
путями:
12







 Химия
Химия








