Похожие презентации:
Электродные процессы. Уравнение Нернста. Классификация электродов
1.
Электродные процессы. Уравнение Нернста.Классификация электродов.
1
2.
Электродные процессы – процессы, связанные с переносомзарядов через границу между электродом и раствором. Катодные
процессы связаны с восстановлением молекул или ионов
реагирующего вещества, анодные – с окислением реагирующего
вещества и с растворением металла электрода.
Электрохимическими реакциями являются процессы с участием
заряженных частиц, в которых захват и высвобождение
электронов химическими частицами (ионами или молекулами)
разделены в пространстве и происходят на поверхности отдельных
проводников — электродов.
Электролитическая ячейка — электрохимическое устройство,
служащее для проведения электрохимических реакций и
представляющее собой сосуд с электролитом, в который
погружены два электрода.
2
3.
Механизм возникновения электродного потенциалаПри
погружении
металлической
пластинки
в
раствор
собственной
соли
имеют
место
два
основных
процесса.
Первый процесс – это ионизация металла пластинки, где в узлах
кристаллической решетки находятся ионы – атомы:
Ме ⇄ Меn+ + ne-
На границе металл-раствор возникает равновесный двойной
электрический
слой
(ДЭС):
на
поверхности
пластинки
–
отрицательный заряд, вблизи – положительные ионы Меn+.
Между ними возникает скачок потенциала, который называется
электродным потенциалом.
Потенциал, возникающий в условиях равновесия электродной реакции,
называется равновесным электродным потенциалом.
3
4.
Уравнение Нернста позволяет предсказать максимальный рабочийпотенциал,
который
может
быть
получен
в
результате
электрохимического взаимодействия, когда известны давление и
температура.
— электродный потенциал,
— число молей электронов, участвующих в процессе;
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
· постоянная Фарадея, равная 96485,35 Кл·моль−1;
—
·
— стандартный электродный потенциал, измеряется в вольтах;
·
— абсолютная
температура;
·
— активности
соответственно окисленной и восстановленной
форм вещества, участвующего в полуреакции.
4
5.
Если в формулу Нернста подставить числовые значения константF = 96 485,332 12... Кл·моль⁻¹
R = 8,314 462 618... Дж·К⁻¹·моль⁻¹
и перейти от натуральных логарифмов к десятичным, то при
получим
5
6.
67.
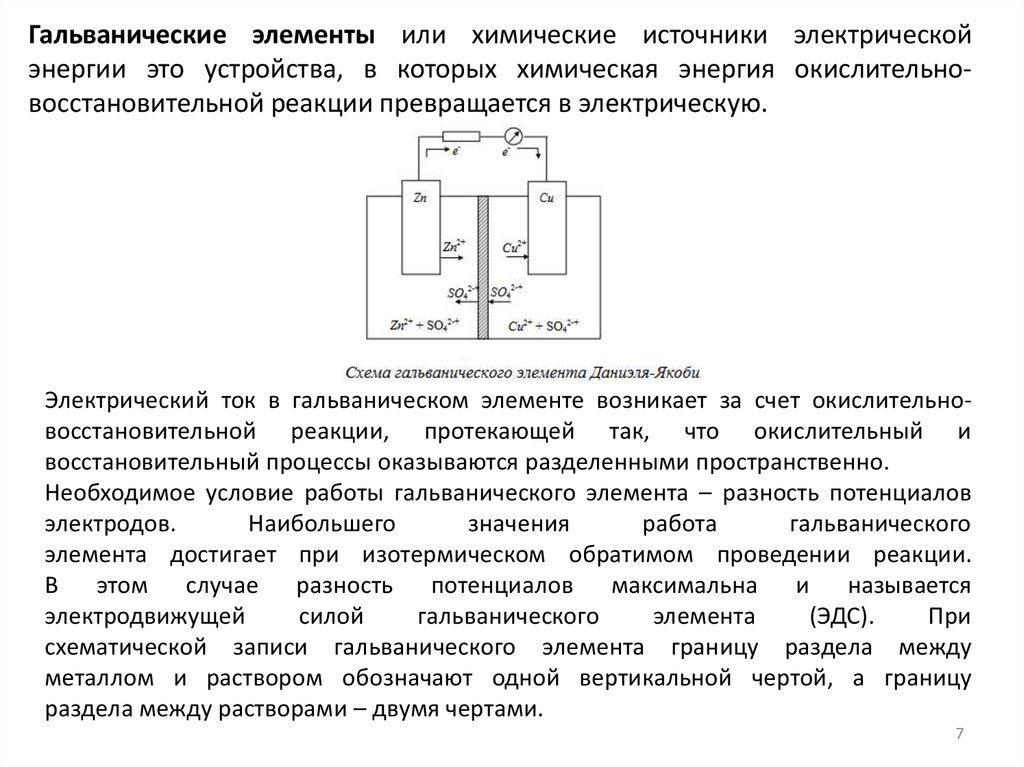
Гальванические элементы или химические источники электрическойэнергии это устройства, в которых химическая энергия окислительновосстановительной реакции превращается в электрическую.
Электрический ток в гальваническом элементе возникает за счет окислительновосстановительной реакции, протекающей так, что окислительный и
восстановительный процессы оказываются разделенными пространственно.
Необходимое условие работы гальванического элемента – разность потенциалов
электродов.
Наибольшего
значения
работа
гальванического
элемента достигает при изотермическом обратимом проведении реакции.
В этом случае разность потенциалов максимальна и называется
электродвижущей
силой
гальванического
элемента
(ЭДС).
При
схематической записи гальванического элемента границу раздела между
металлом и раствором обозначают одной вертикальной чертой, а границу
раздела между растворами – двумя чертами.
7
8.
Электроды I родаЭлектродом 1-го рода называют систему, в которой восстановленной формой
Red является металл, а окисленной ОХ - соль данного металла, содержащая
простые ионы Меn+. Пример такого электрода – система Сu/Сu2+, где
полуреакция восстановления следующая:
Сu2++ 2е ↔ Сu0
Сu – Red
Сu2+- Ох
Потенциал такого электрода 1-го рода записывается в соответствии с
уравнением Нернста:
ЕI=Е0Me/ Mе2++Rtlna Mеn+ /nF
ЕI=Е0Cu/ Сu2++Rtlna Cu2+/2F
8
9.
Электроды 1-го рода, обратимые по аниону.Например, полуреакция восстановления теллура
2 Те + 2е ↔ Те22ЕI =Е02Тe/ Те22-- RTlna Те22-/2F
Еще к электродам I рода относятся амальгамные электроды, например:
амальгама ртути на таллии.
Полуреакция восстановления Tℓ (таллия)
Тℓ++е(Hg) ↔ Тℓ(Hg)
ЕI=ЕI0+RTln(aTl)/1F
9
10.
Электродом II рода называют систему, в которой металл покрыт слоем еготруднорастворимой соли или оксидом, а раствор содержит анионы этой соли или
группы ОН-.
Полуреакция восстановления для хлор - серебряного электрода имеет вид:
AgCl + e ↔ Ag0 + ClПотенциал такого электрода согласно этому уравнению:
ЕII =Е0Ag/Ag+ - RTln(aCl-)/F
Как видно из этого уравнения электроды II рода обратимы по аниону.
Полуреакция восстановления для ртутно-окисного электрода имеет вид:
Hg2O + H2O +2e ↔ 2Hg + 2ОНЕII =Е0Нg/Нg+ - RTln(aОН-)/2F
Каломельный электрод – это соль Нg2Cl2 (серого цвета).
Нg2Cl2 + 2e ↔ 2Hg + 2ClЕII =Е02Нg/Нg+2 - RTln(aCl-)/2F
10
11.
Электроды III рода – это электроды, в которых металлы находятся вконтакте с двумя труднорастворимыми солями, а в растворе присутствуют
ионы соли с большим произведением растворимости.
Пример:
Pb+| PbCl2, AgCl, Ag
ПР – произведение растворимости ПРPbCl2 >> ПРAgCl
Полуреакция восстановления:
AgCl + 2e + Pb2+ ↔ 2Ag + PbCl2
ЕIII =Е0 - RTln(aPb2+)/2F
11
12.
Газовый электрод: кислородный, хлорный, водородный электроды.Представляют собой инертную металлическую пластину, к которой подводится
электрохимически активный газ. Молекулы газа адсорбируются на поверхности
металла, распадаясь на атомы, а затем участвуя в окислительном процессе с
раствором содержащем одноименные ионы, например, стандартный
водородный электрод сравнения. Он представляет собой платиновую пластину,
покрытую слоем платиновой черни для увеличения истинной поверхности. Эта
пластина опущена в 1М раствора H2SO4, налитый в емкость, внутрь которой
пропускают чистый водород под давлением Р = 1 атм.
Полуреакция восстановления: Н+ + ē↔1/2Н2
Потенциал водородного электрода – ЭДС следующей электрохимической цепи:
Pt, H2 | H2SO4 || H2SO4 | H2, Pt
P=1 атм
аН+ = 1
∆Е = RTln(аН+)/F – RTln(PН2)/P = Е0H+/ (1/2)H2 + RTln(аН+/ PН2)/F
Е0H+/ (1/2)H2 = 0
12
13.
Простые окислительно-восстановительные электроды отличаются тем, чтоне сопровождающееся образованием металла или газообразных веществ изменение
степени окисления элемента на поверхности инертного материала происходит без
участия ионов или молекул других веществ.
Простые редокс-электроды характеризуются электродной реакцией, которую можно
представить в общей форме:
Mz+ + ye = M(z−y)+,
условной записью
Mz+, M(z−y)+ / Pt
и выражением для электродного потенциала
В качестве примера простого редокс-электрода можно привести электрод, на
котором происходит восстановление ионов Fe3+ до Fe2+:
Fe3+ + e = Fe2+,
Fe3+, Fe2+/ Pt,
13
14.
Сложные окислительно-восстановительные электроды. Отличительнойособенностью этих электродов является то, что в реакции окисления или
восстановления принимают участие другие ионы и молекулы.
Приведем в качестве примера сложного редокс-электрода кислотный
перманганатный электрод:
MnO4- + 8H+ + 5e = Mn2+ + 4H2O,
MnO4-, Mn2+, H+/ Pt,
14
15.
Хингидронный электрод представляет собой платиновую проволоку,погружаемую в исследуемую среду, в которую добавлено небольшое
количество кристаллов хингидрона- эквимолекулярной смеси хинона
С6Н4О2 и гидрохинона С6Н4(ОН)2.Хингидрон трудно растворяется в воде.
Поэтому активность кристаллов хингидрона можно считать равной 1. На
этом электроде происходит восстановление хинона до гидрохинона:
С6Н4О2 + 2Н+ +2е = С6Н4(ОН)2.
Условно электрод можно записать следующим образом:
Н+/ С6Н4О2,С6Н4(ОН)2, Pt.
Электродный потенциал хингидронного электрода зависит от рН
среды:
Хингидронный электрод работает только в кислых и нейтральных средах,
так как в щелочных средах происходит образование солей гидрохинона,
которые хорошо растворимы в воде.
15














 Химия
Химия








