Похожие презентации:
Репликация и транскрипция НК. Синтез и распад пурин-пиримидиновых оснований
1.
Репликация и транскрипция НКСинтез и распад пурин-пиримидиновых оснований
2.
Репликация и транскрипция НК1. Каков способ репликации ДНК у прокариот и эукариот.. Примеры.
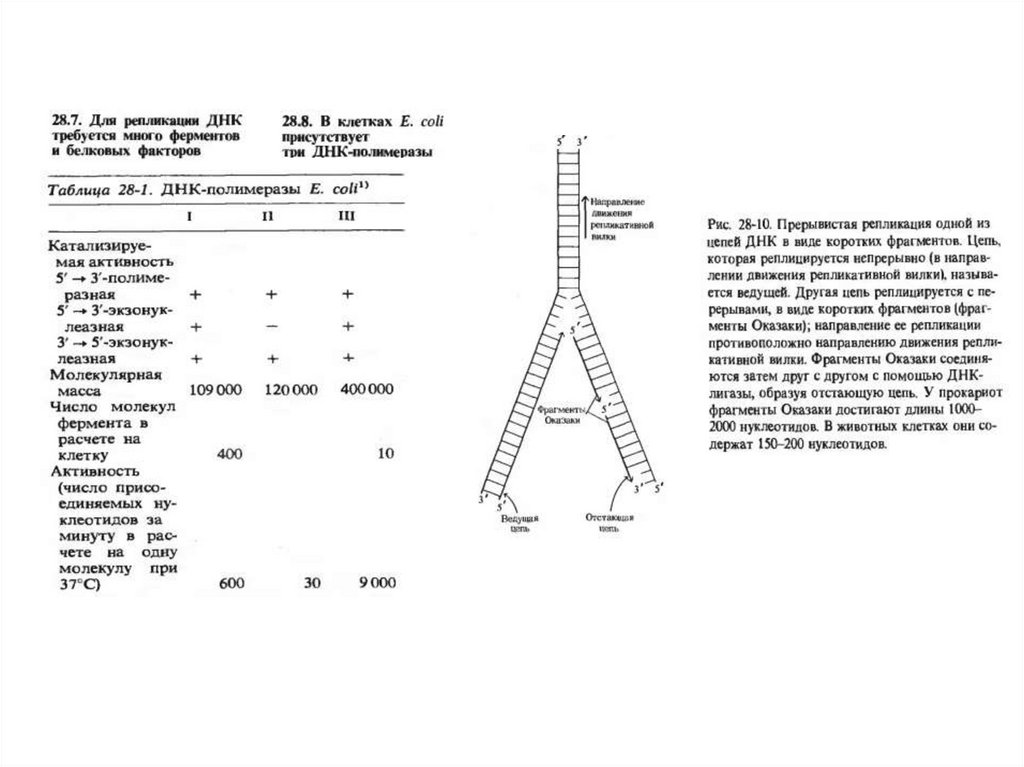
2. Обозначьте схематично элементы репликативой вилки
3. Что такое ведущая и отстающая нить ДНК и как идет репликация на
ведущей нити ДНК
4. Как идет синтез на отстающей ДНК и что такое фрагмент Оказаки?
5. Дайте анализ роли ключевых ферментов в репликации ДНК (ДНК
полимераза I, II, III, ДНК гираза, Хеликаза, Примаза)
6. Дайте характеристику ДНК ферментов: полимераз, эндо- и экзонуклеаз, метилаз, рестриктаз
7. Дайте характеристику ДНК зависимых топоизомераз, ДНК зависимых
РНК полимераз, РНК зависимых ДНК полимераз, ДНК зависимая
ДНК полимеразная
3.
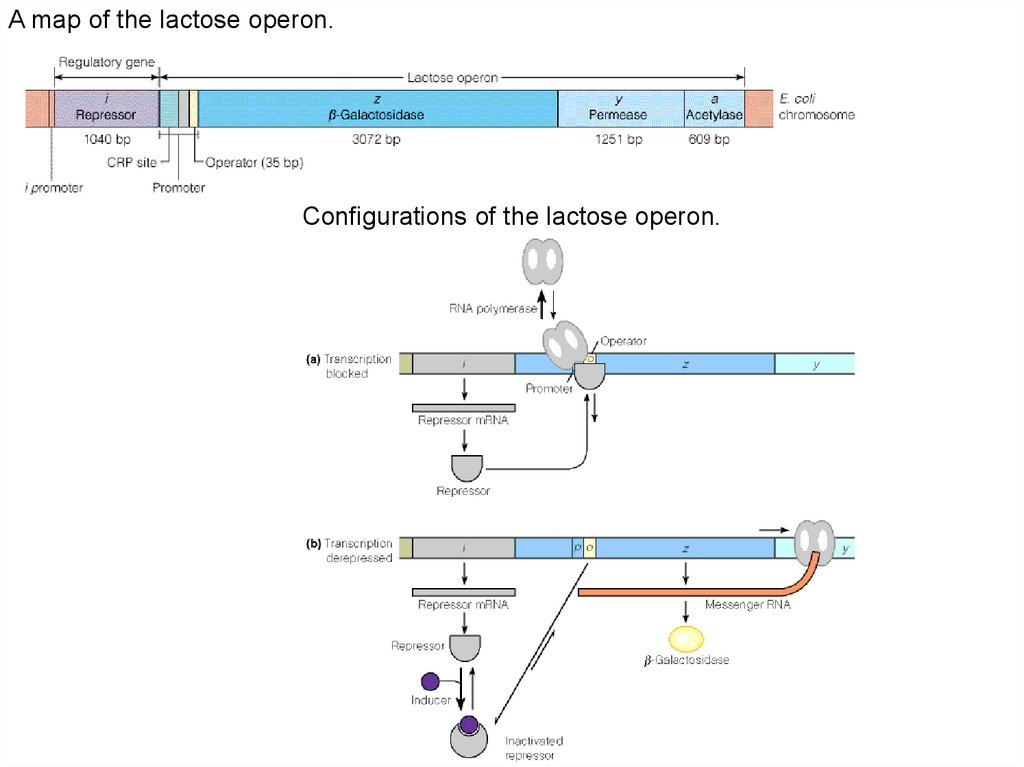
1.Транскрипция ДНК у прокариот. Структура оперона, предложенная в1961 году Франсу ЖакобОМ и ЖакОМ Моно
2. Структура отдельных областей оперона:
зона регуляторного гена, зона промотора, зона оператора, лидерная
зона, зона инициации транскрипции, зона транскрипции или
элонгации, зона терминации.
3. Регуляторные участки lac-оперона и их работа (сл.35)
4.Как идет регуляция экспрессии конститутабельных генов у
простого оперона
5. Как идет регуляция экспрессии lac-оперона у E.coli
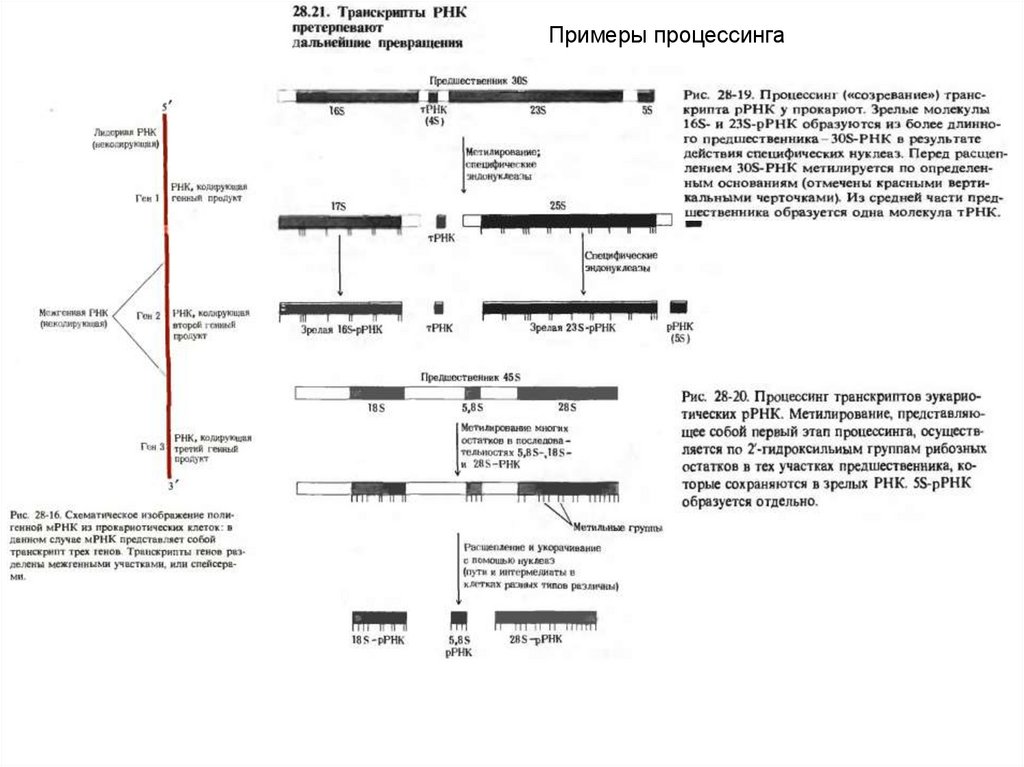
6.Примеры процессинга транскриптов рРНК и тРНК
7. Примеры процессинга транскриптов мРНК
8. Регуляция синтеза белка в клетке. Конститутивные ферменты и
индуцируемыеные. Позитивный и негативный контроль на примере lacоперона у E.coli
9. Чем отличается транскриптон у эукариот от оперона прокариот
4.
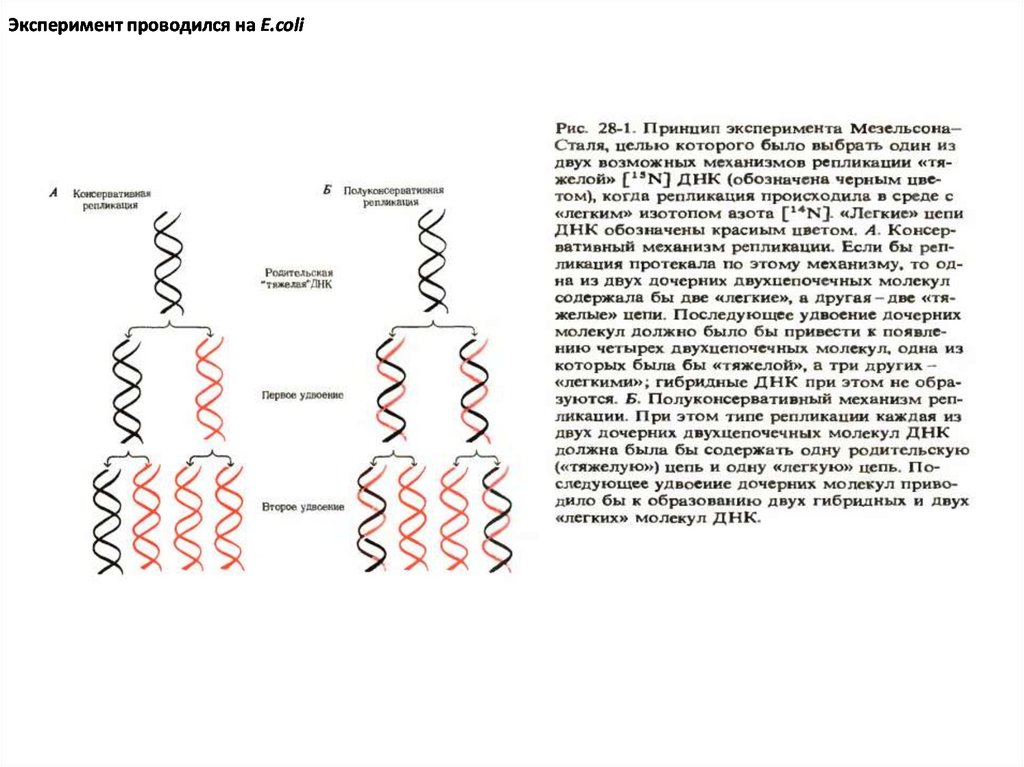
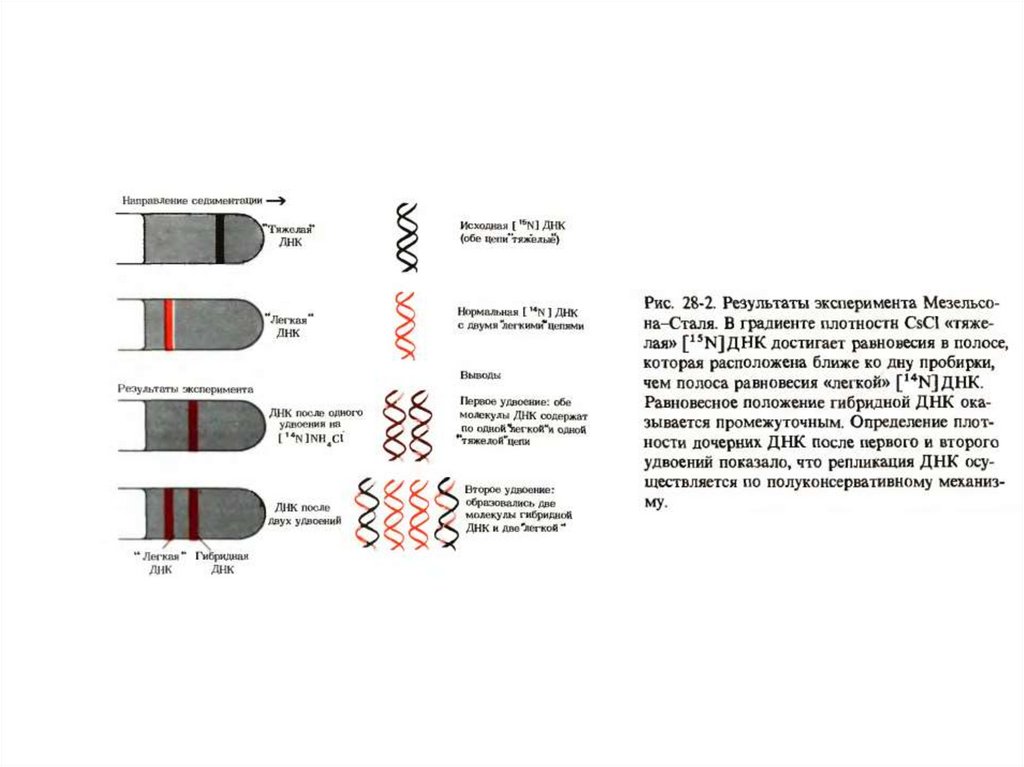
Эксперимент проводился на E.coli5.
6.
7.
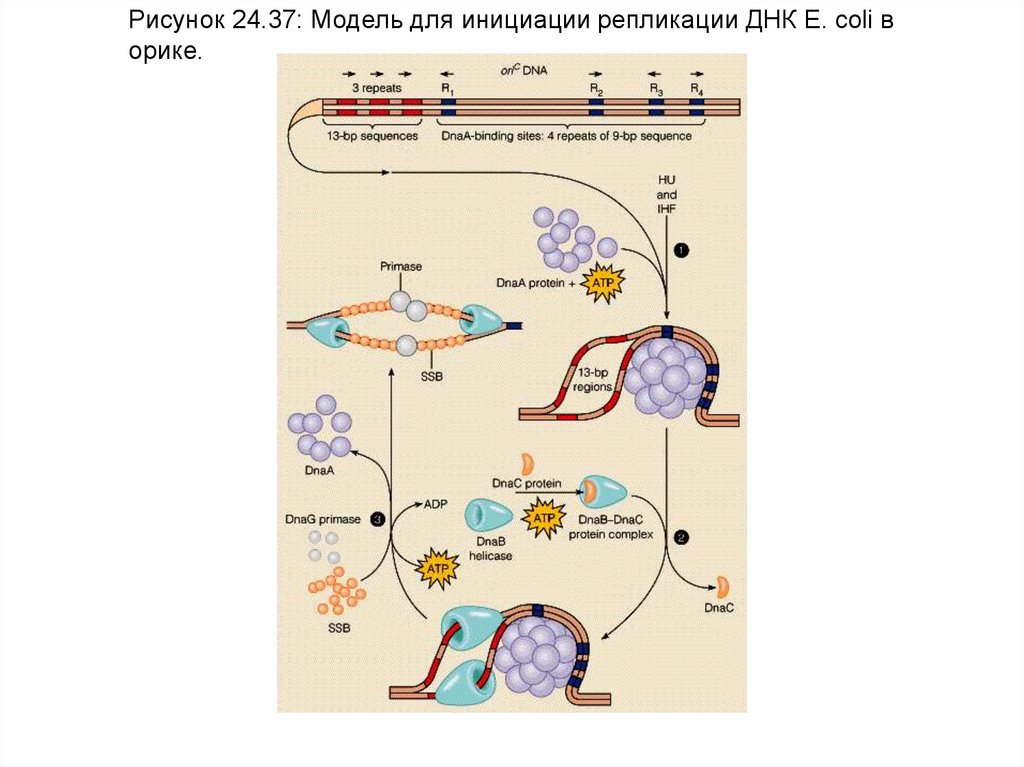
Рисунок 24.37: Модель для инициации репликации ДНК E. coli ворике.
8.
9.
10.
11.
12.
Гираза – прекращение вращенияХеликаза – разделение цепей
13.
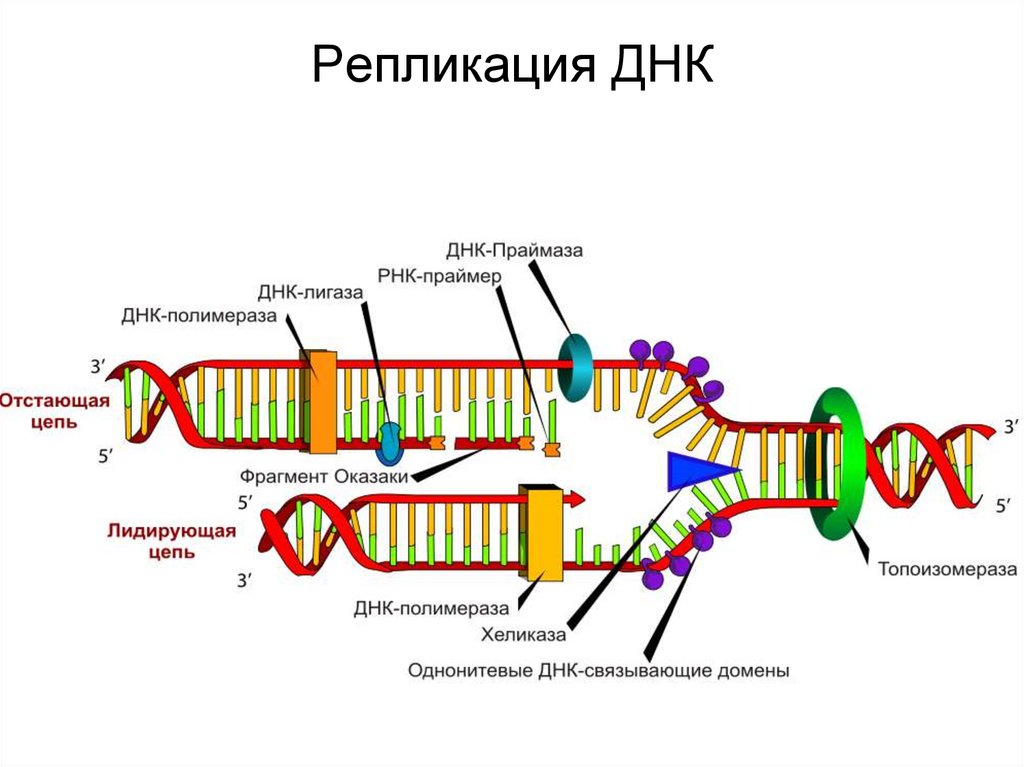
14. Репликация ДНК
15.
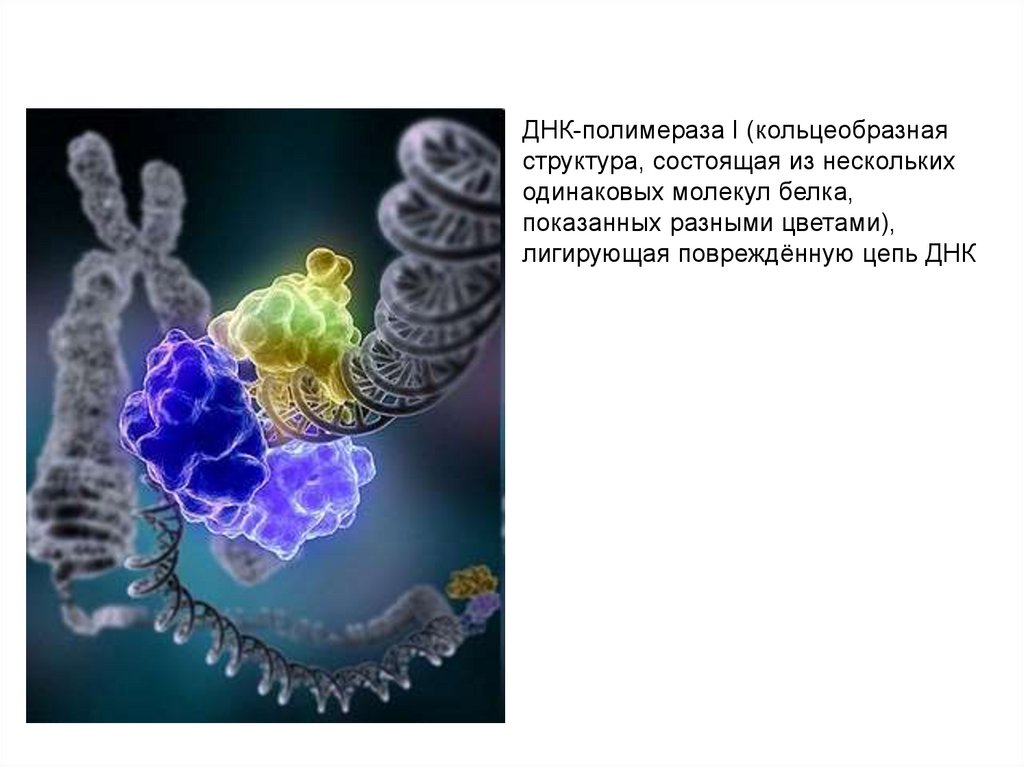
ДНК-полимераза I (кольцеобразнаяструктура, состоящая из нескольких
одинаковых молекул белка,
показанных разными цветами),
лигирующая повреждённую цепь ДНК
16.
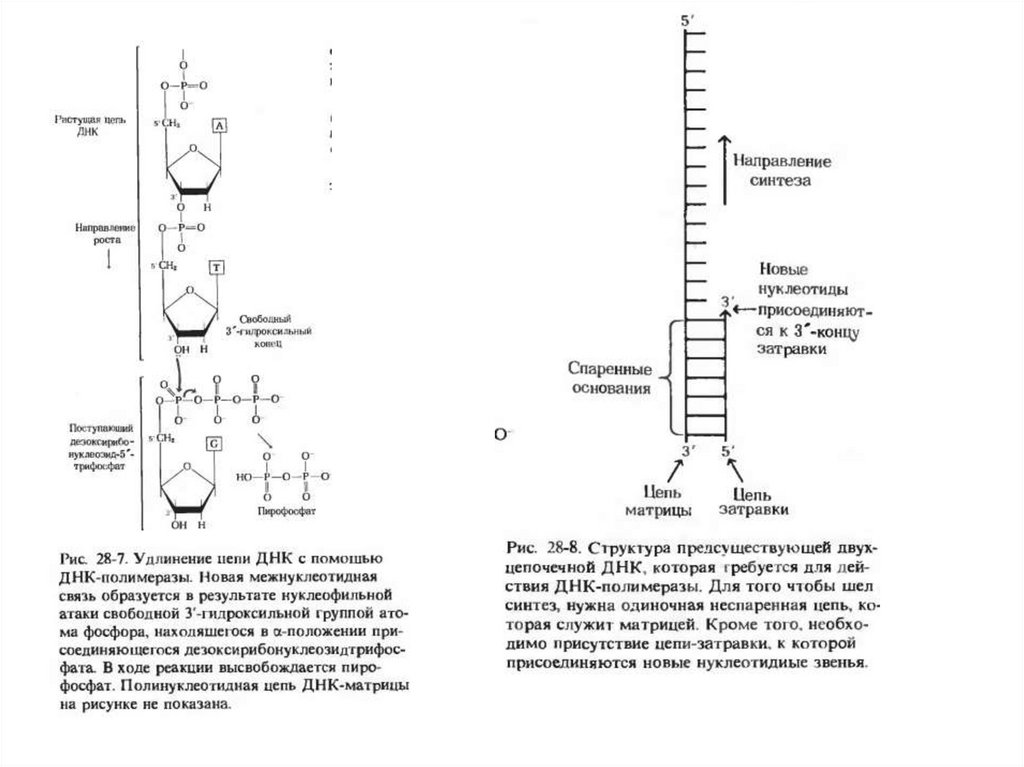
Ферменты синтеза и превращений нуклеиновых кислот•Три ДНК полимеразы –
ДНК п-з I (400 шт) открыта в 1956г Корнбергом, ведет
полимеризацию на 2х цепочечных ДНК. Для синтеза
необходима ДНК затравка (праймер). Присоединение
нуклеотидов идет к 3' ОН группе ДНК затравки.
Ее
роль вспомогательна, она застраивает бреши после
удаления
отщепляет
РНК
затравки
неправильно
(фр.Оказаки),
включенные
а
также
нуклеотиды
проявляя при этом экзонуклеазную 3' → 5' активность.
Играет важную роль в репарации ДНК и может вести
синтез ДНК на матрице имеющей несколько разрывов.
Катализирует одновременное включение нуклеотидов с
3' конца и отщепление с 5', ДНКп-за 1
вызывает
продвижение однонитевого разрыва вдоль ДНК.
17.
Ферменты синтеза и превращений нуклеиновых кислотДНК п-за II, (100шт) восстанавливает повреждение в участках молекулы ДНК до 100
нуклеотидов. Этот фермент может достраивать ДНК если нет ДНК п-зы 1.
ДНК п-за III (10 штук) истинная репликаза, открыта в 1972 Корнбергом. Полимеризацию
ведет 5' → 3'. Матрицей in vitro служит 2х цепочечная ДНК имеющая большое число
коротких пробелов и в связи с этим много свободных
3' ОН концов. Рабогтает в
присутствии 2х специфических белков и кополимеразы 3 на длинной матрице ДНК. Ее
активность в 15 раз выше чем у ДНК п-зы 1 и в 300 раз выше чем у ДНК п-зы 2.
Эукариоты тоже имеют несколько ДНК п-з, но они не обладают экзонуклеазной
активностью. Митохондрии имеют свой аппарат для матричного синтеза.
ДНК метилазы. Модифицируют азотистые основания в цепи ДНК после их синтеза.
Метилирование защищает ДНК от расщепляющего действия ДНК рестриктаз ферментов.
Нуклеазы: расщепляют фосфодиэфирные связи в молекулах НК.
Эндонуклеазы –рвут внутренние связи. Экзо – наружные связи.
Есть нуклеазы –РНКазы и ДНКазы.
Рестриктазы – щепят ДНК в строго определенных местах. Защищают бактериальные
клетки от чужеродной ДНК.
ДНК топоизомеразы – изменяют число супервитков в кольцевой ДНК.
18.
ДНК зависимая РНК п-за . Все типы РНК тРНК, рРНК, мРНК синтезируются этимиполимеразами. Информация транскрибируется с ДНК языка на РНК ковый. Цепь растет
в направлении 5' → 3'. Для синтеза нужны 4 типа РНТФ +Mg. Хотя обычно матрицей
служит 2х цепочечная ДНК, траскрибируется только одна ее цепочка несущая
антикодоновые последовательности, так что образующаяся мРНК содержит кодоны.
Обычно копируется только определенный участок ДНК несущий информацию о
ферменте или группе ферментов.
1. E.coli РНК п-за мм 480000. 5 субъединиц : 2α (39000), β (155000)
β(165000) δ (95000).
2.РНКп-за затравочная для синтеза ДНК
У прокариот РНК п-за фагов.
У всех эукариот есть система множественных РНК п-з
РНК п-за 1 –синтез рРНК в ядрышке
РНК п-за 2 –синтез в нуклеоплазме транскрибирует все гены эукариот кодирующие белки
мРНК
РНК п-за 3 – в нуклеоплазме отвечает за синтез 5S РНК и тРНК.
19.
Обратная транскриптаза –или ревертаза или РНК-зависимая ДНК полимераза . Ферментобладает 3 активностями.
1.РНК зависимая ДНК полимеразная
2.ДНК зависимая ДНК полимеразная
3.Гидролизующая активность в составе РНК-ДНК гибрида.
Образовавшаяся 2х цепочечная ДНК встраивается в геном хозяина.
Ген кодирующий синтез ревертазы находится в геноме онковируса.
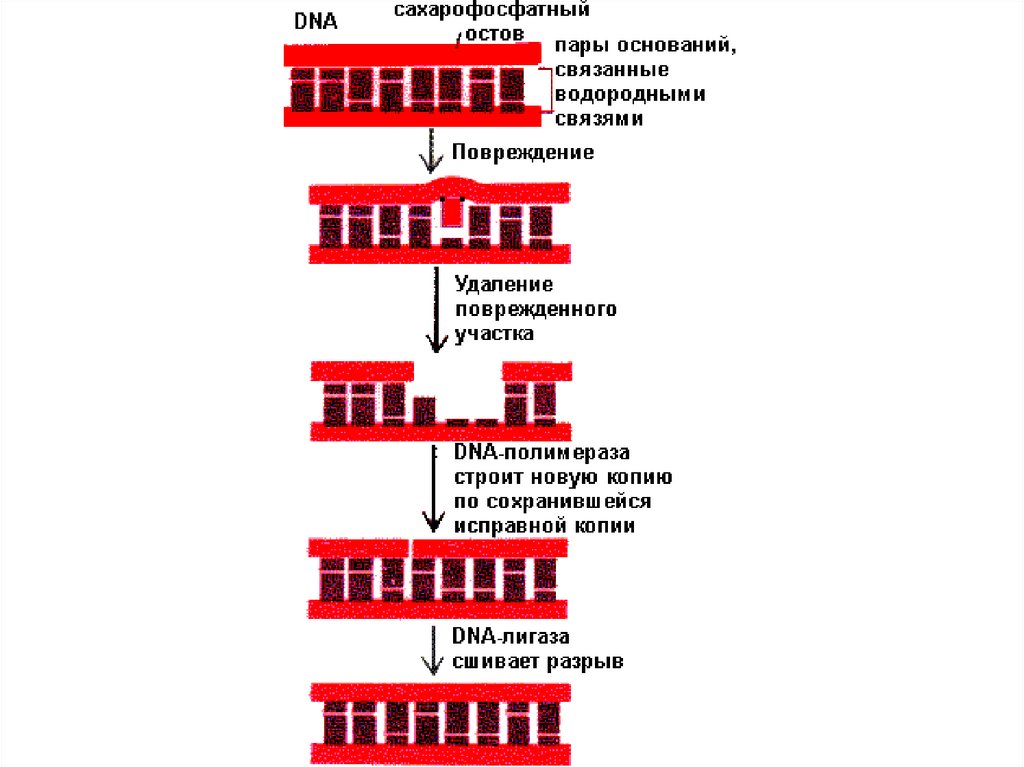
ДНК лигазы. Устраняют единичный разрыв в цепи ДНК при участии АТФ.
РНК репликазы, собственность самого вируса .
Полинуклеотид фосфорилазы. Синтез РНК из РНДФ.
20.
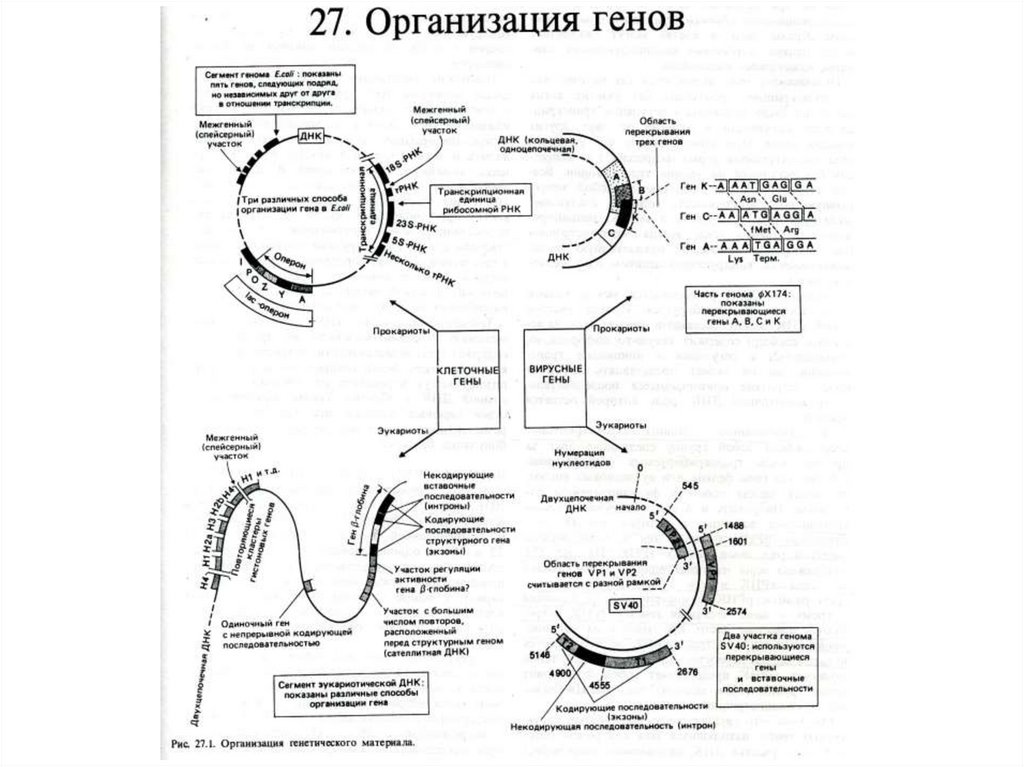
Синтез РНК.Транскрипция ДНК у прокариот. Структура оперона.
Франсу Жакоб и Жак Моно из Пастеровского института в Париже
сформулировали гипотезу о структуре оперона и молекулярногенетических механизмах регуляции синтеза белка и его контроле на
уровне транскрипции т.е. на стадии образования мРНК..
21.
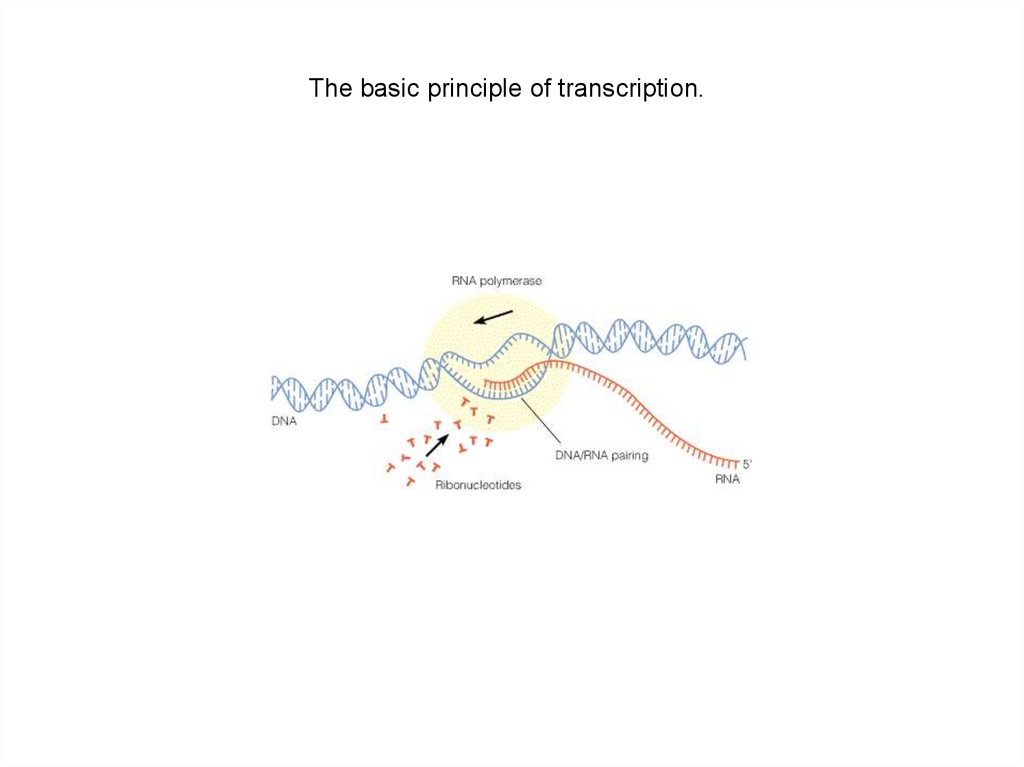
The basic principle of transcription.22.
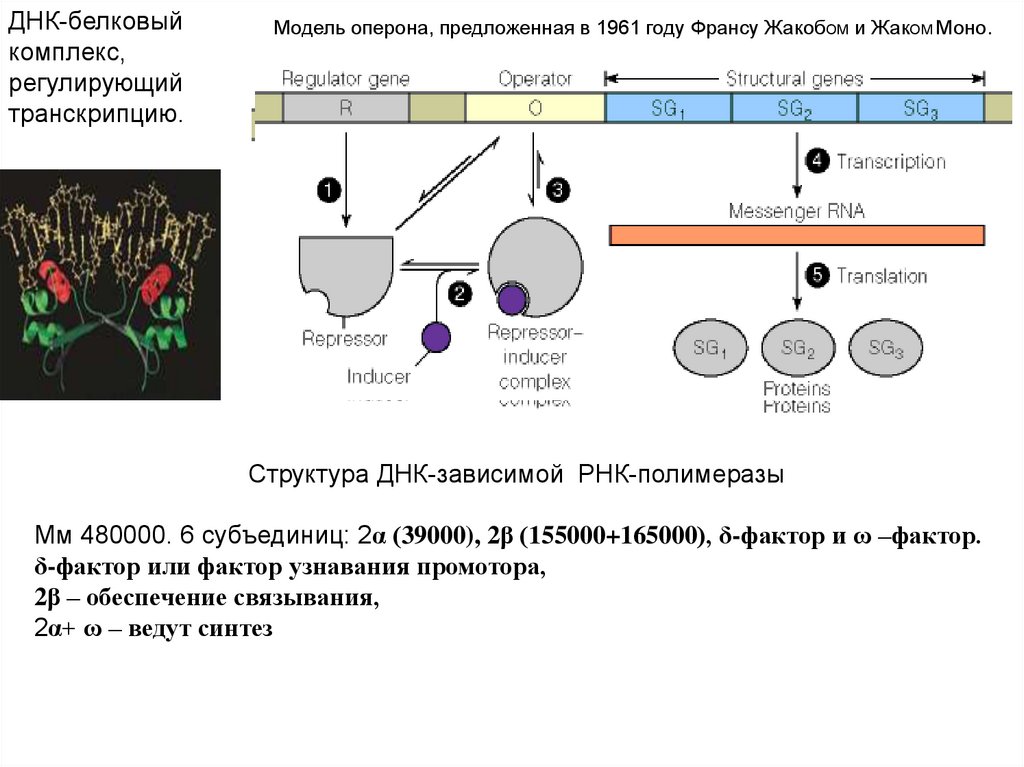
ДНК-белковыйкомплекс,
регулирующий
транскрипцию.
Модель оперона, предложенная в 1961 году Франсу ЖакобОМ и ЖакОМ Моно.
Структура ДНК-зависимой РНК-полимеразы
Мм 480000. 6 субъединиц: 2α (39000), 2β (155000+165000), δ-фактор и ω –фактор.
δ-фактор или фактор узнавания промотора,
2β – обеспечение связывания,
2α+ ω – ведут синтез
23.
24.
25.
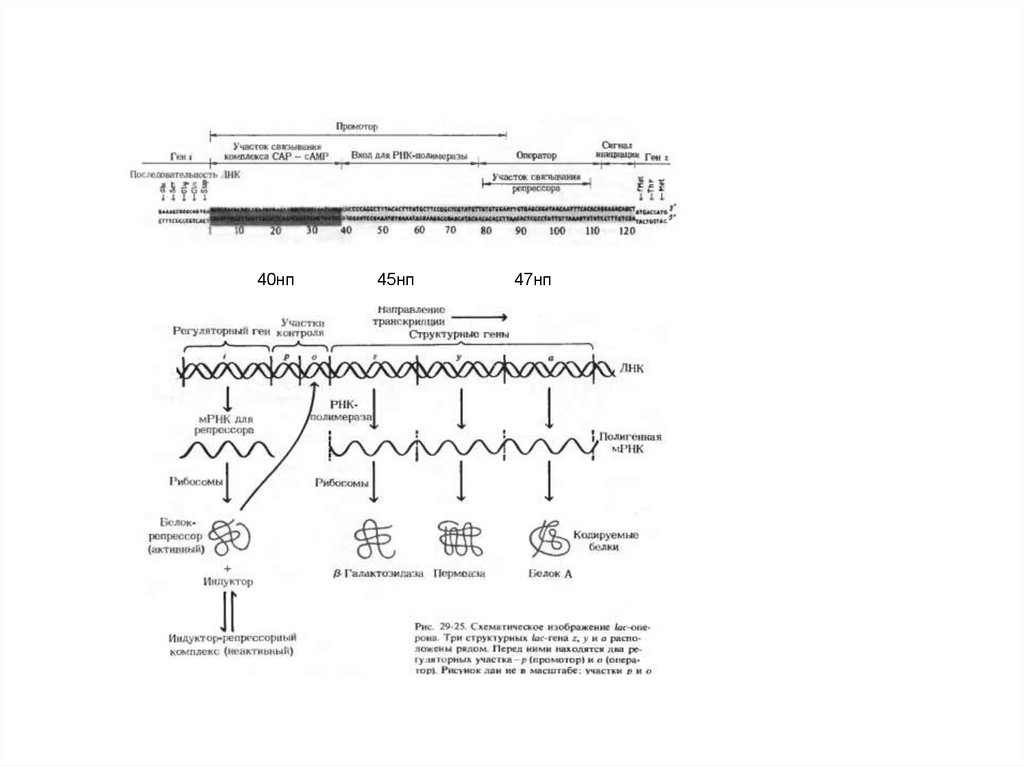
40нп45нп
47нп
26.
27.
A map of the lactose operon.Configurations of the lactose operon.
28.
Гираза – прекращение вращенияХеликаза – разделение цепей
галактозидаза – щепит лактозу а глюкозу и
галактозу
Пермеаза – транспортирует лактозу в клетку
Галактозилтрансацетилаза
–
превращает
галактозу в глюкозу, предотвращая накопление в
клетке токсических соединений
29.
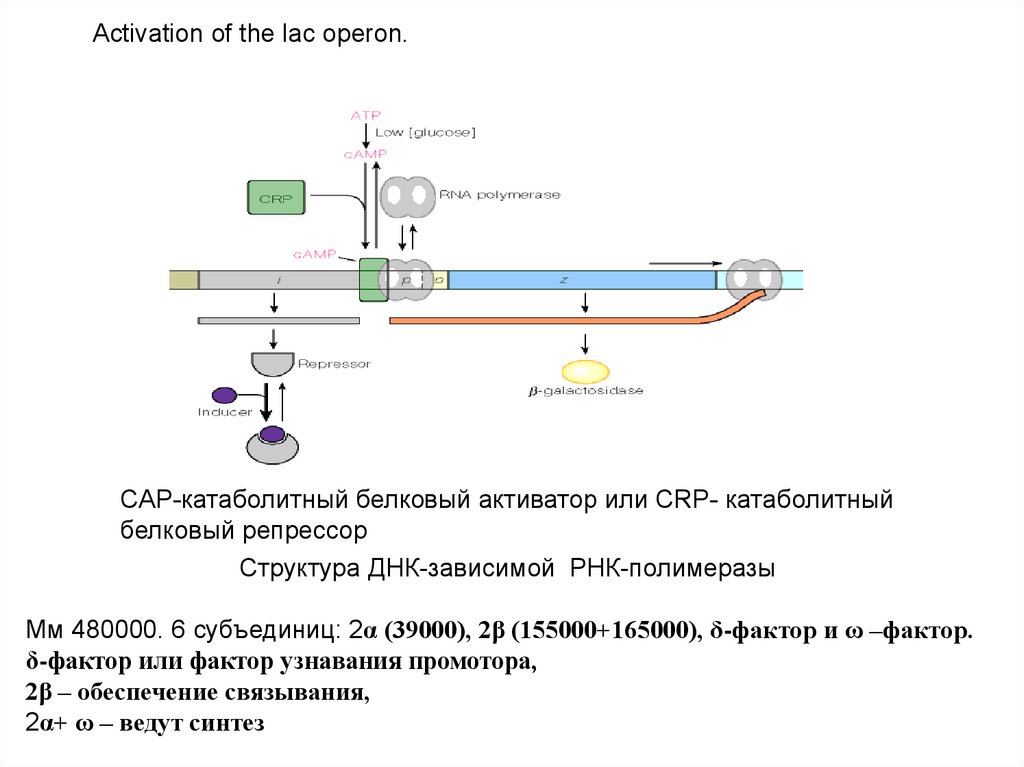
Activation of the lac operon.CAP-катаболитный белковый активатор или СRP- катаболитный
белковый репрессор
Структура ДНК-зависимой РНК-полимеразы
Мм 480000. 6 субъединиц: 2α (39000), 2β (155000+165000), δ-фактор и ω –фактор.
δ-фактор или фактор узнавания промотора,
2β – обеспечение связывания,
2α+ ω – ведут синтез
30.
31.
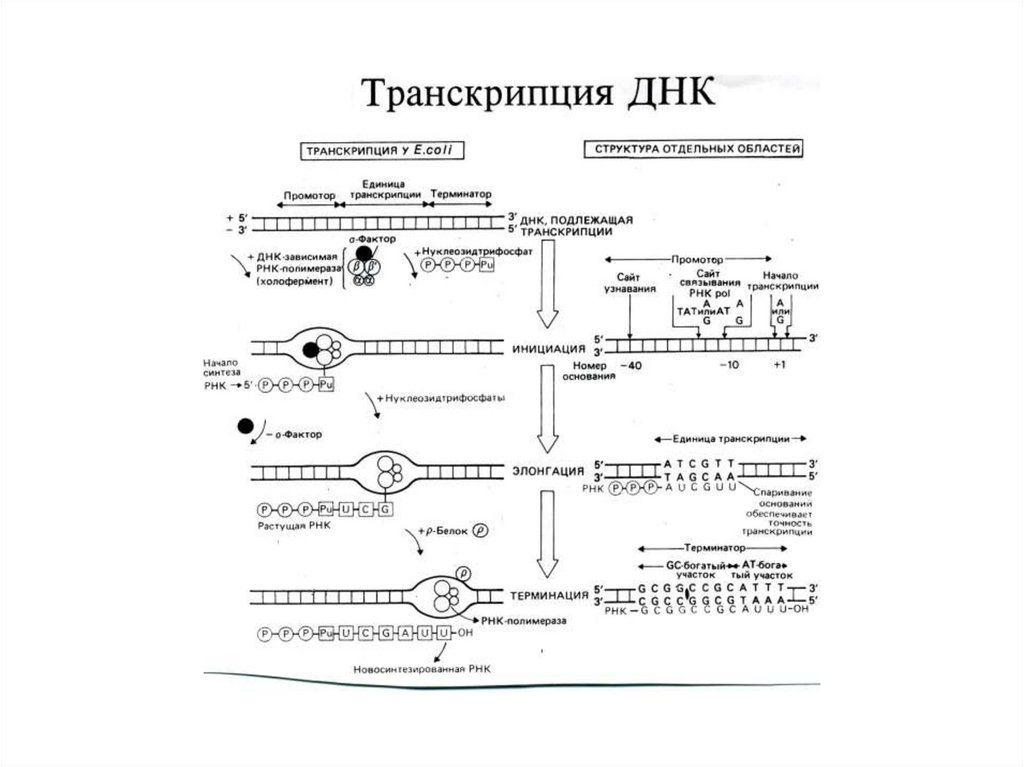
Последовательность транскрипции на Lac-опероне1эт. Присоединение РНК п-зы после снятия регуляторного белкового фактора и
появления на промоторе САР+цАМФ. Только после этого начинается процесс
трансляции. В промоторе в зоне богатой А=Т парами расходятся цепи ДНК .
РНК п-зы 480000.E.coli. С помощью δ-фактора РНК-п-за узнает Р,
2β – обеспечивают связывание с Р, 2α+ ω – ведут синтез. У эукариот 3 типа РНКполимераз: рРНК, мРНК, тРНК.
2эт.Инициация синтеза: много АТФ и δ-фактор узнающий Р. Далее δ-фактор
уходит до нового синтеза. Лидерная зона и иногда частично оператор
транскрибируются.
3эт.Элонгация 5' → 3‘ синтез по правилу комплементарности с одной значащей нити.
Отдельные участки ДНК могут считываться независимо.
4эт. Терминация длинные блоки ТТТ и терминирующие кодоны.
5эт. Процессинг транскриптов РНК (см.22-23 файл)
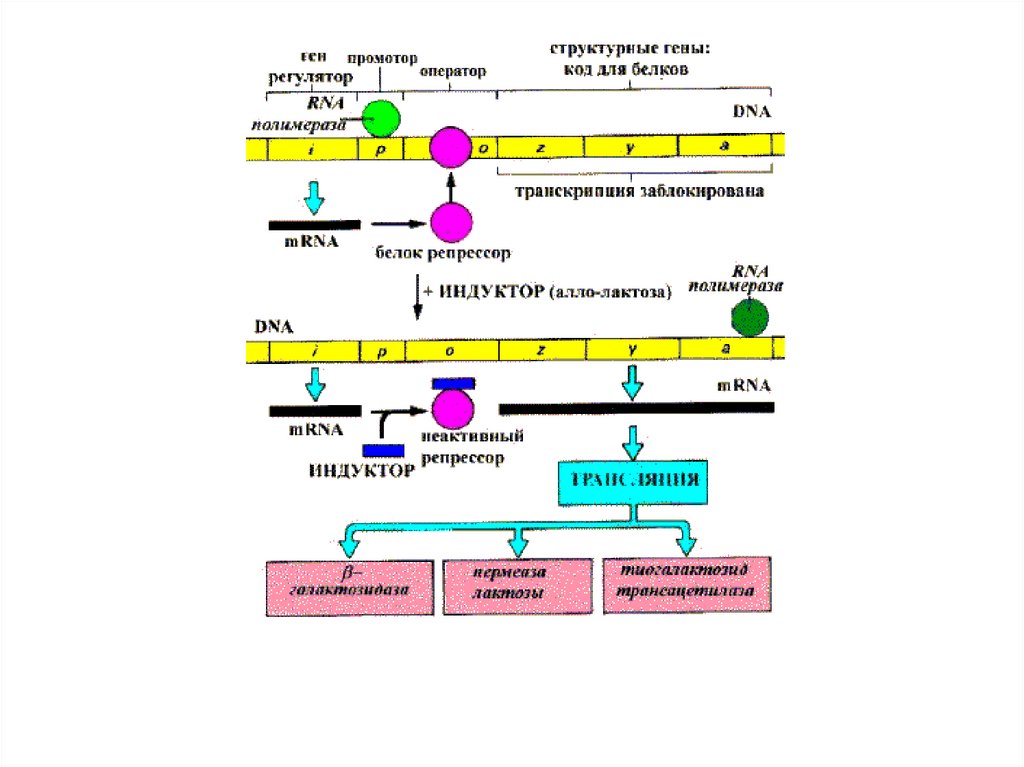
Lac- оперон находится, как под позитивным контролем (Р участок) через механизм
катоболитной репрессии (Gl нет,есть цАМФ+CAP, Gl есть нет комплекса), так и под
негативным контролем (О участок) через индуктивный или репрессивный механизм
(Lac+РБ) уходит с оператора, Lac нет – РБ садится на оператор.
32.
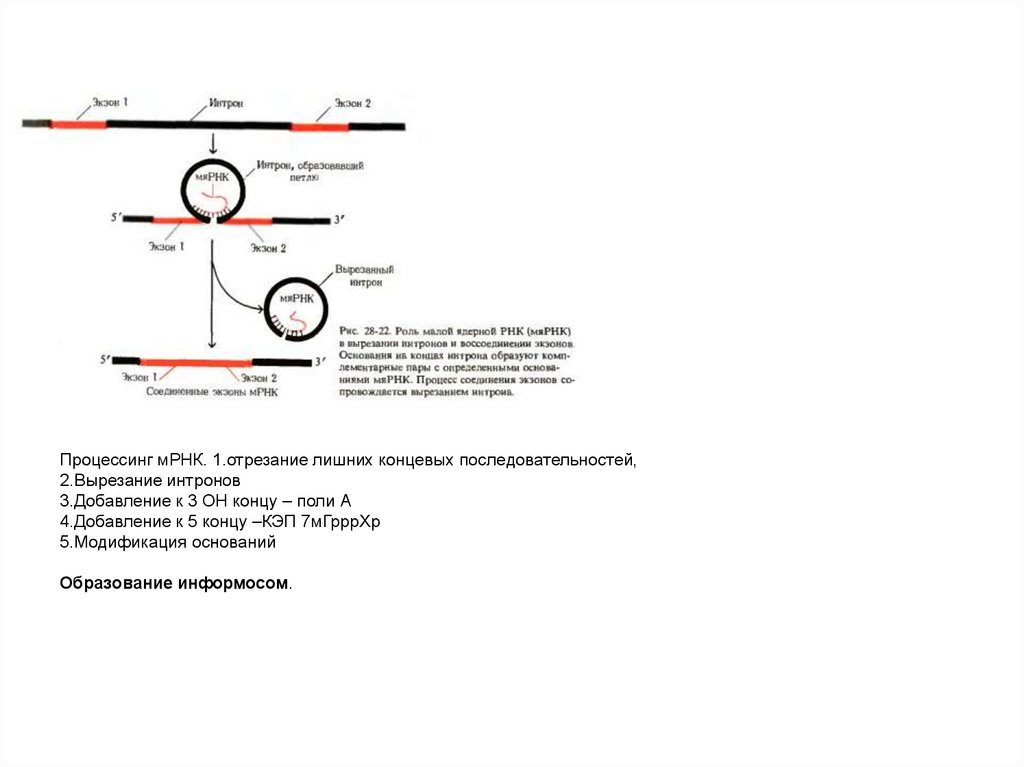
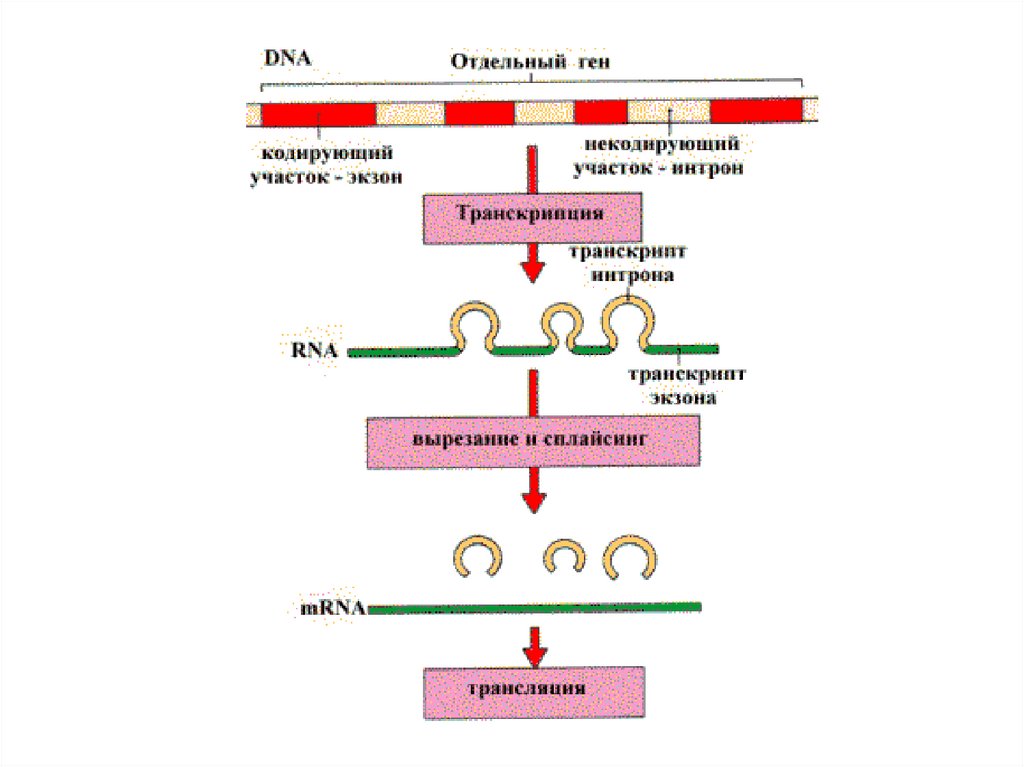
Примеры процессинга33.
Процессинг мРНК. 1.отрезание лишних концевых последовательностей,2.Вырезание интронов
3.Добавление к 3 ОН концу – поли А
4.Добавление к 5 концу –КЭП 7мГрррХр
5.Модификация оснований
Образование информосом.
34.
35.
36.
Синтез белка в клетке регулируется. В E.coli 15000 Rb в каждой по 55 белков в виде 15000 копий. Число копий гликолитических
ферментов тоже const. Галактозидаз 5 мол. Однако их количество резко увеличивается при
отсутствии глюкозы. Определенный набор ферментов в клетке поддерживается путем
регуляции.
Конститутивные E постоянно независимо от метаболического состояния организма. E
гликолиза.
Индуцируемые E обычно в следах, однако при наличии своего субстрата их концентрация
может возрасти в 1000 раз. В этих условиях индуцируемые E могут потребоватся для
транспортировки субстрата внутрь клетки и его превращения. Т.е. срабатывает lac. Оперон и
появляются в больших количествах ферменты для превращения субстрата. Пермиаза
обеспечивает проникновение Lac.в клетку, глюкозидаза - расщепление лактозы., белок А
превращение галактозы в глюкозу. Есть Глюкоза нет ц-АМФ и нет расщепления Лактозы.
Индуцируемые E появляются только тогда когда в них есть потребность. Индуктор- вещество
способное вызвать синтез. Белок репрессор может связываться то с индуктором (Лактоза) то
с оператором. И может определять как индукцию так и репрессию синтеза галактозидазы.
Таким образом 1.Лактозный оперон находится как под позитивным контролем (Р-участок)
через механизм катаборлитной репрессии(глюкозы нет, есть ц-АМФ+CAP белок, Глюкоза
есть – нет комплекса. 2.так и под негативным контролем (О-участок) через индуктивный или
репрессивный механизм Лактоза+ регуляторный белок уходит с оператора. Лактозы нет- РБ
садится на оператор –репрессивный механизм.
Транскрипция может регулироваться и другими путями: метилир.ДНК, Спирализация ДНК,
аттенюатором, недостатком АК и др. а также на уровне трансляции, но слабее.
37.
Транскриптон , но не оперон, у эукариот.1значительно больше 80% регуляторная часть и 20% информативная.
2 Участок структурных цистронов кодирует как правило 1 белок, но в то
же время он может быть многократно повторен.
3. гены ведющие синтезом совместно функционирующих ферментов,
часто расположены на большом удалении друг от друга и даже на
разных хромосомах.
4.транскрипция и трансляция у них разнесена во времени и
пространстве.
5. Основная масса ДНК неинформативна и избыточна ( 1-5% против
95%).
38.
Синтез белковили этап трасляции
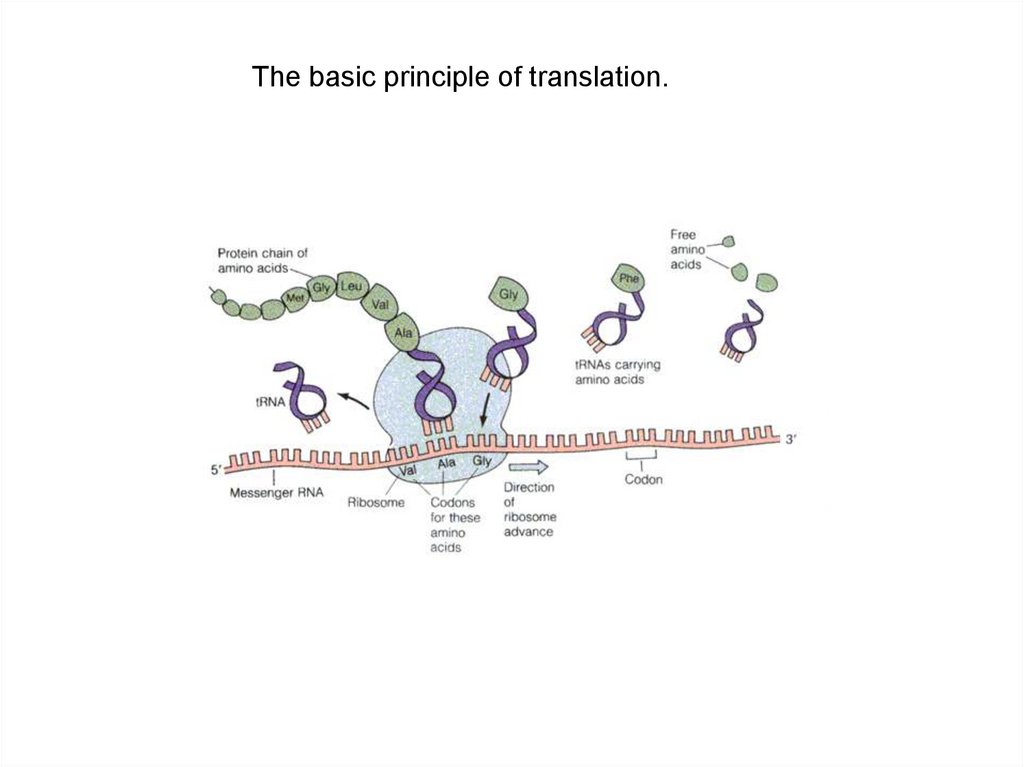
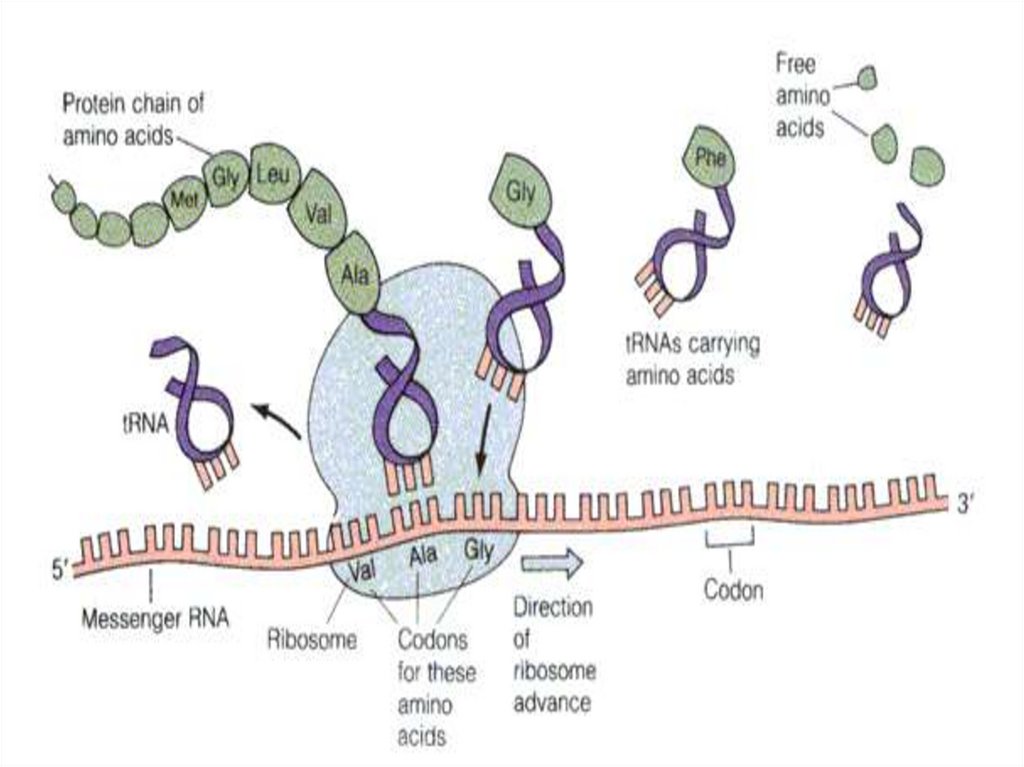
39. The basic principle of translation.
Figure 4.22: The basic principle of translation.40.
41.
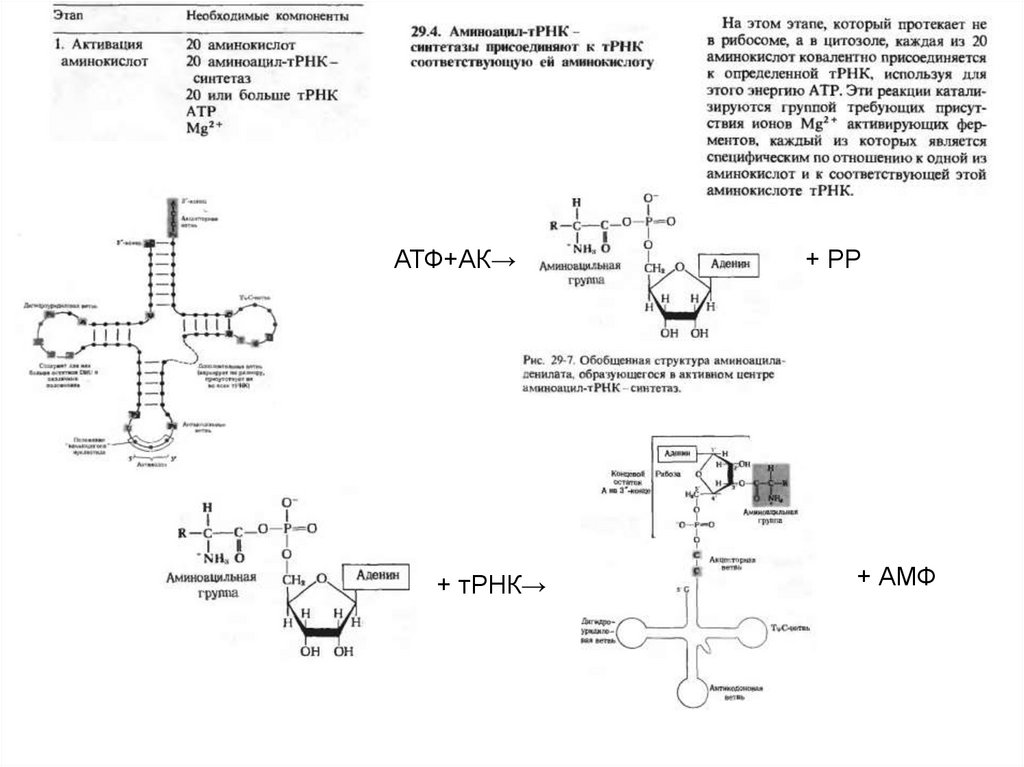
АТФ+АК→+ тРНК→
+ РР
+ АМФ
42.
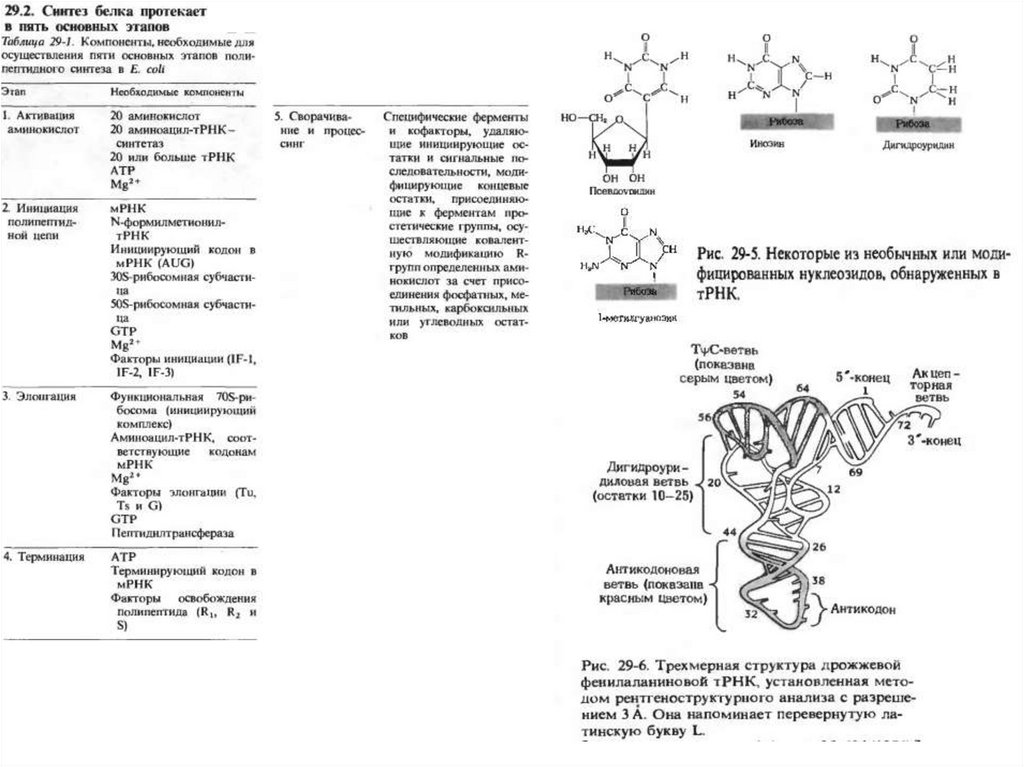
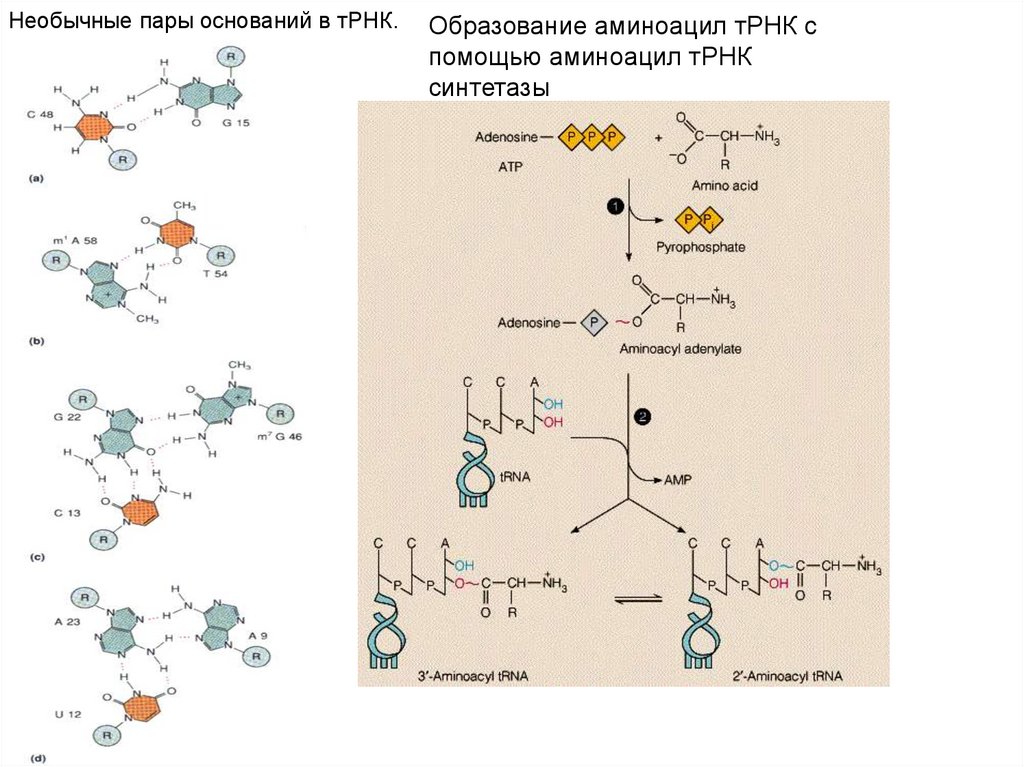
Необычные пары оснований в тРНК.Образование аминоацил тРНК с
помощью аминоацил тРНК
синтетазы
43.
44.
45.
Модели низкого разрешения малых и больших рибосомныхсубъединиц и их комплекса 70S, как это было выведено из ранних
исследований электронной микроскопии.
46.
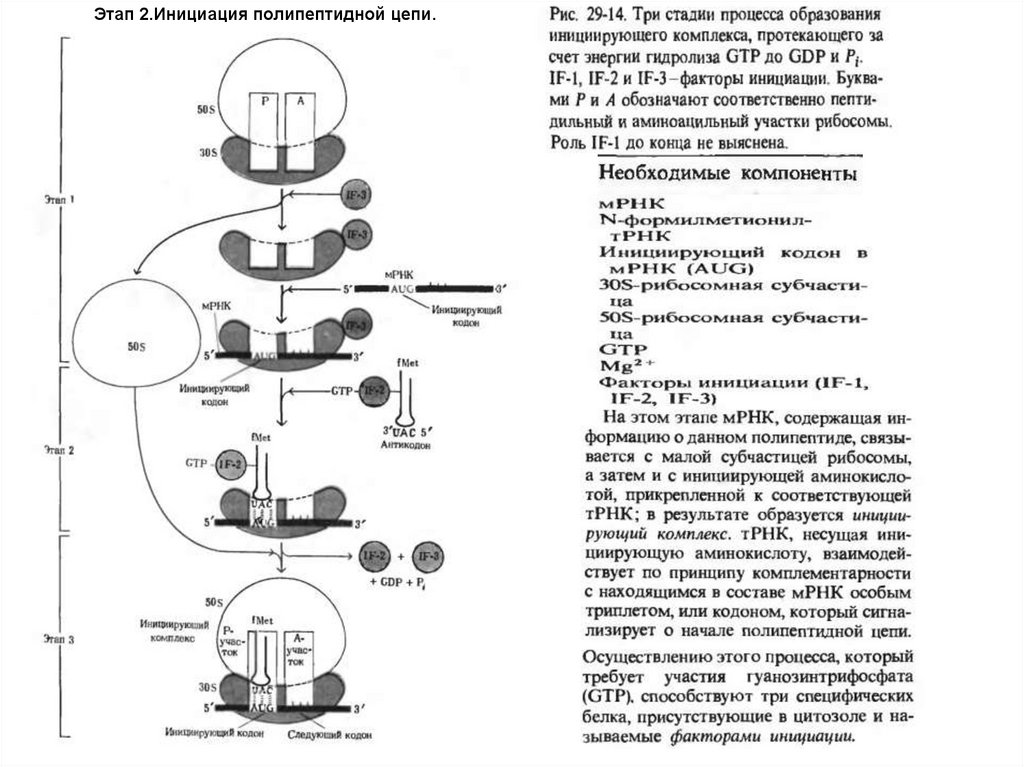
Этап 2.Инициация полипептидной цепи.47.
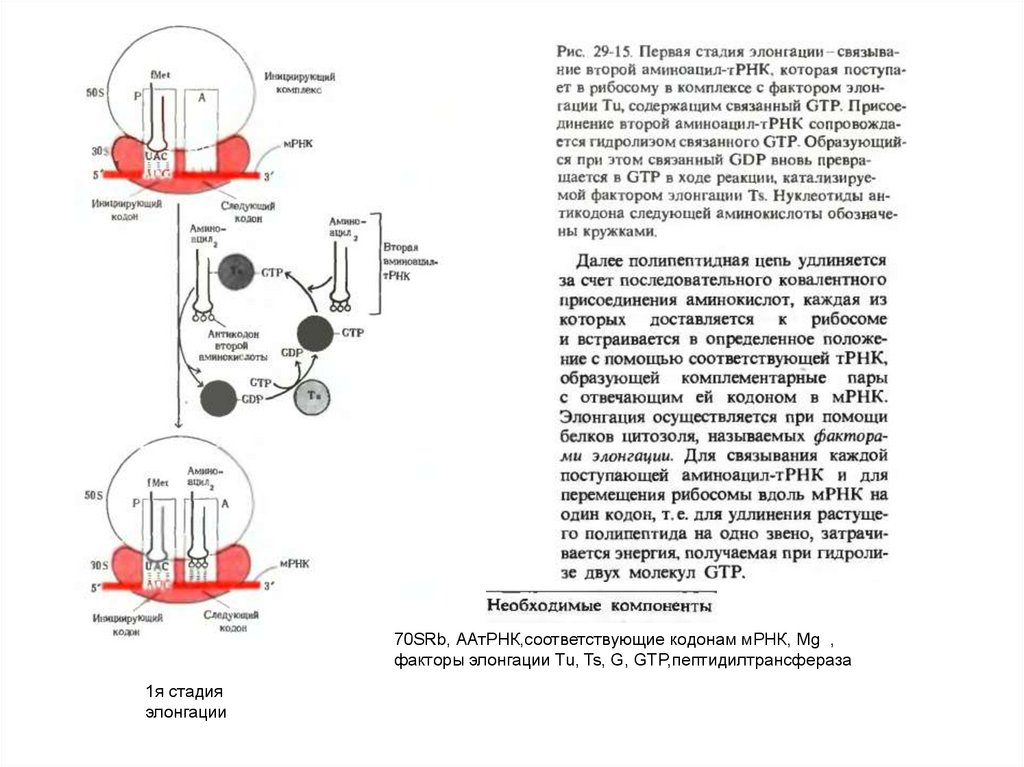
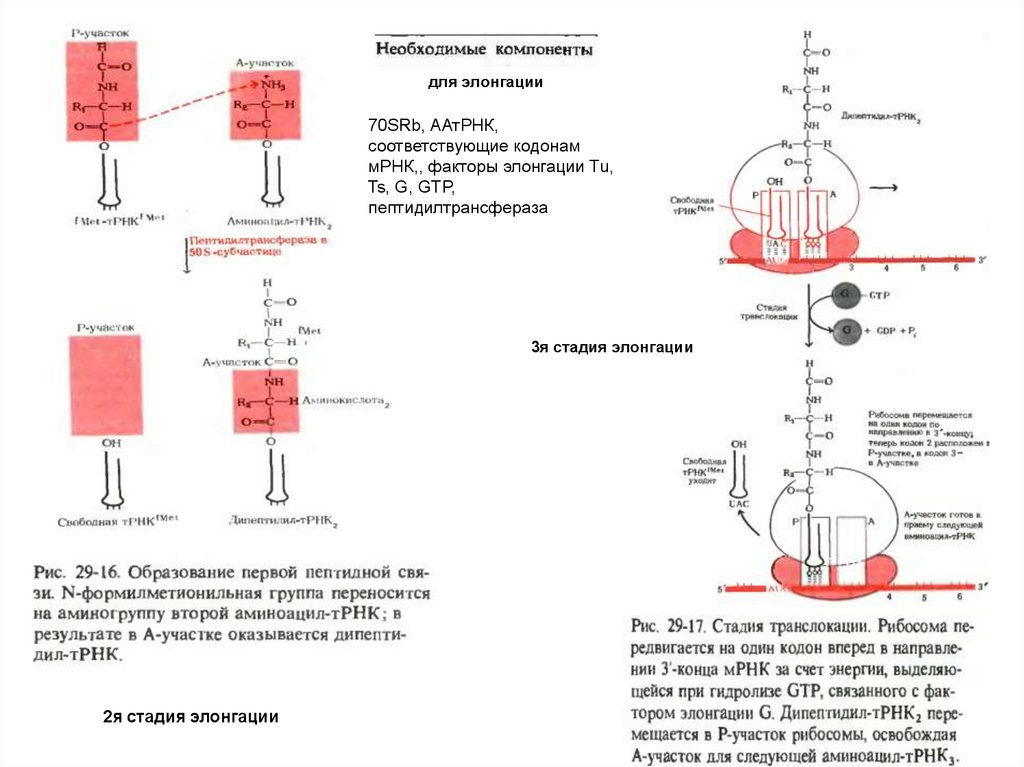
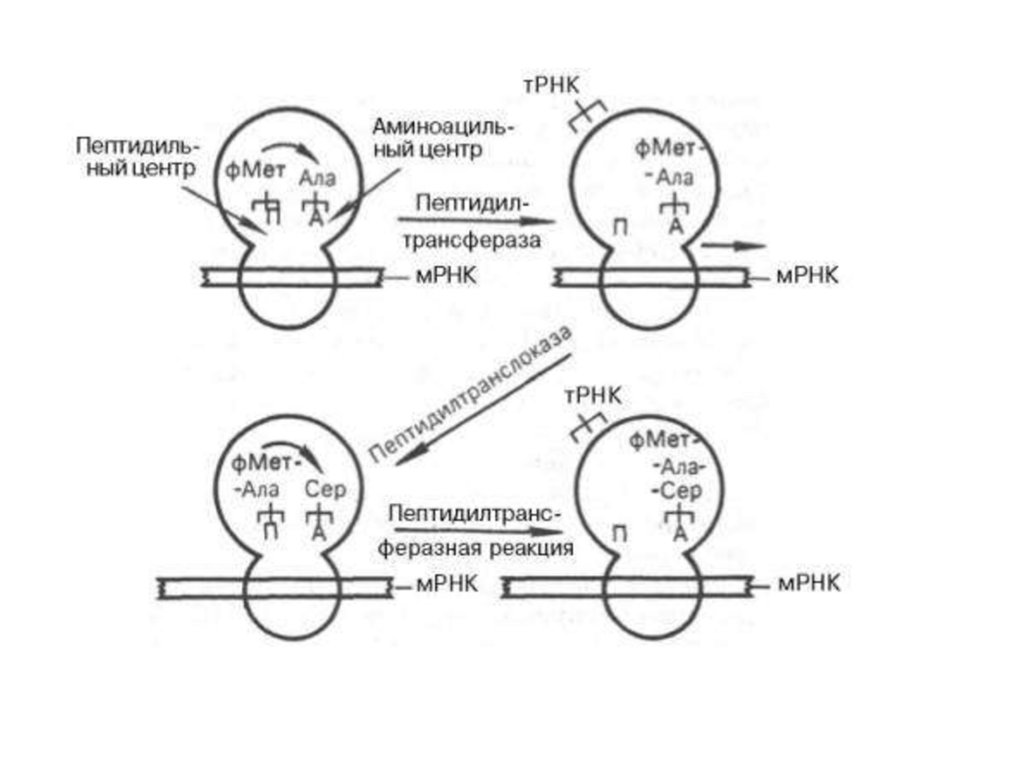
70SRb, ААтРНК,соответствующие кодонам мРНК, Mg ,факторы элонгации Tu, Ts, G, GTP,пептидилтрансфераза
1я стадия
элонгации
48.
для элонгации70SRb, ААтРНК,
соответствующие кодонам
мРНК,, факторы элонгации Tu,
Ts, G, GTP,
пептидилтрансфераза
3я стадия элонгации
2я стадия элонгации
49.
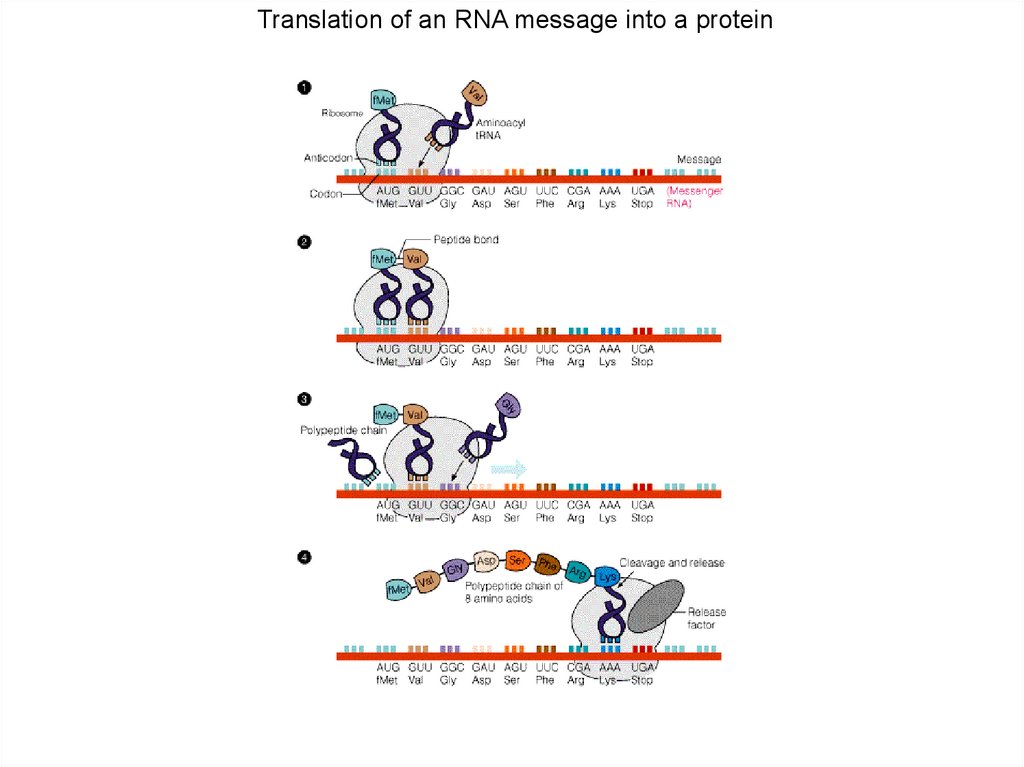
Translation of an RNA message into aprotein.
50.
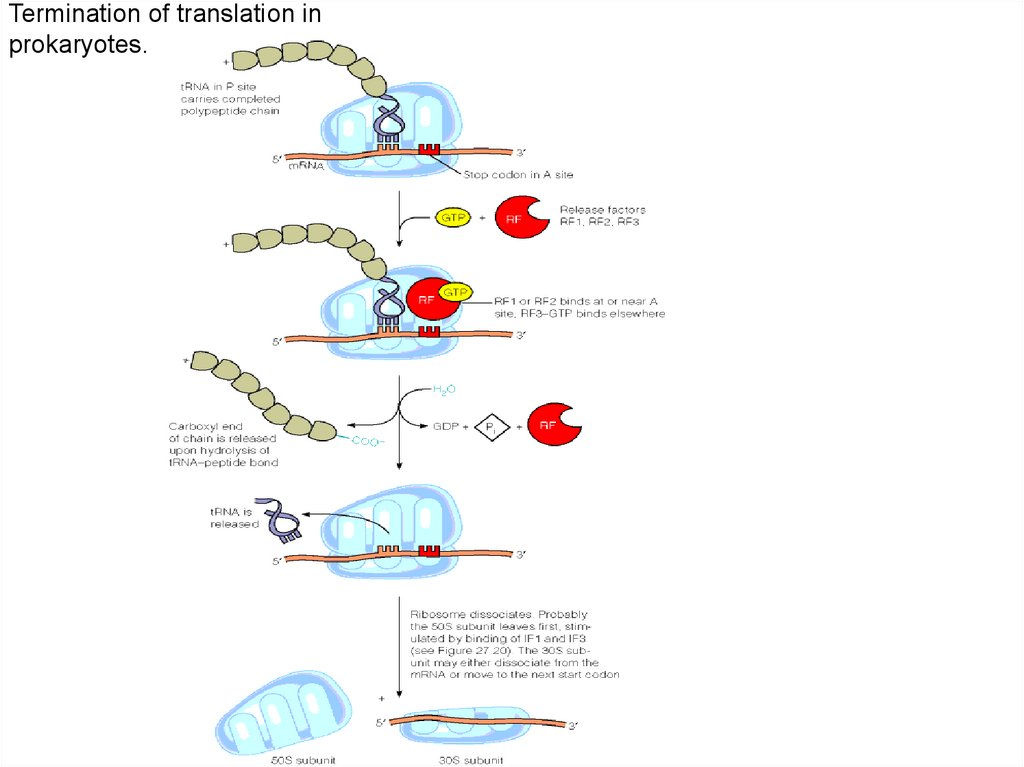
Для терминации синтеза полипептида необходим специальный сигналЭто терминирующие (бессмысленные ) триплеты и факторы RF1, RF2, RF3. При
участии этих факторов происходит:
1.гидролитическое отщепление полипептида от тРНК,
2.отделение от Р сайта пустой тРНК
3. диссоциация Rb70S на 30S и 50S субчастицы.
51.
52.
53.
54.
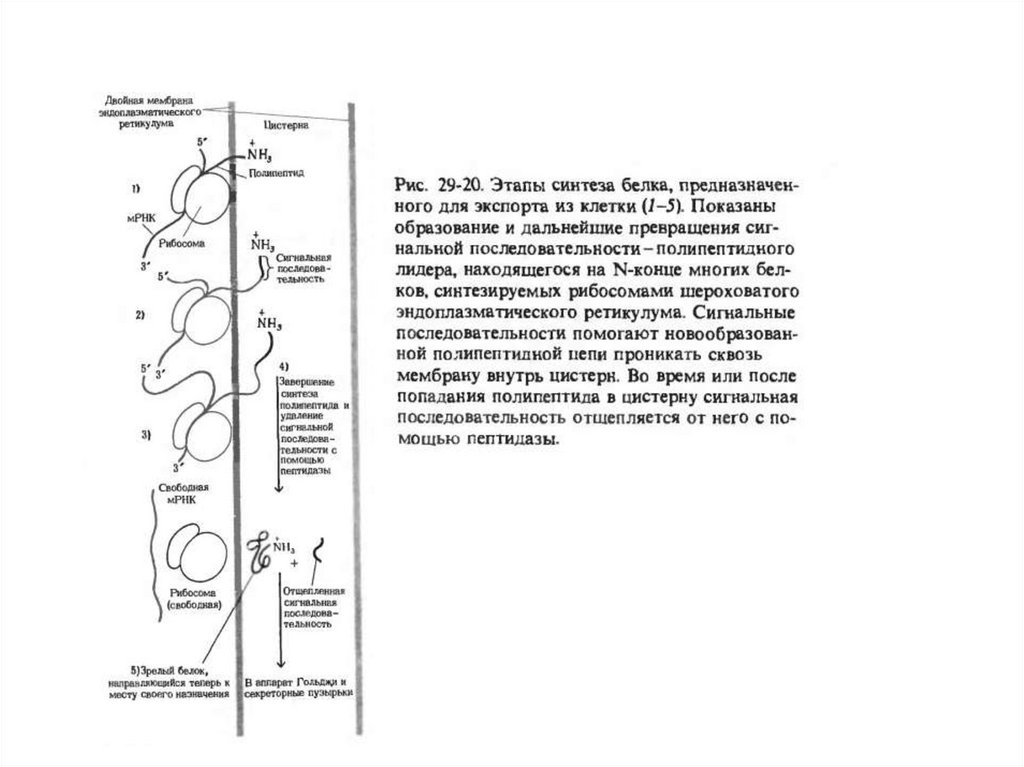
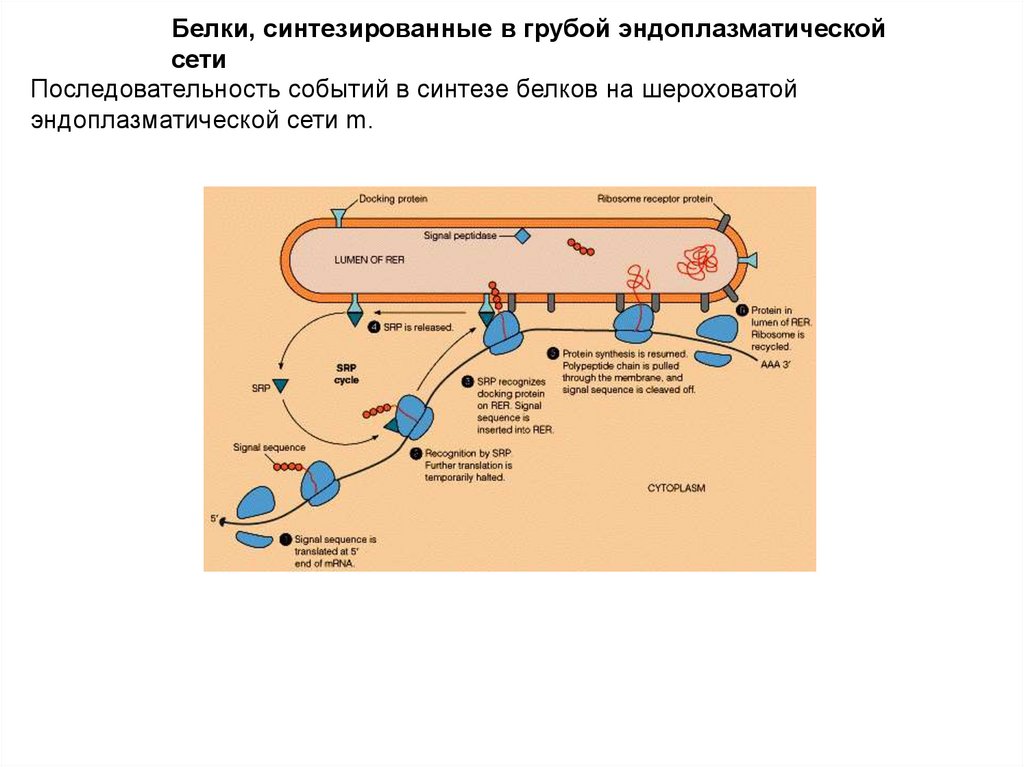
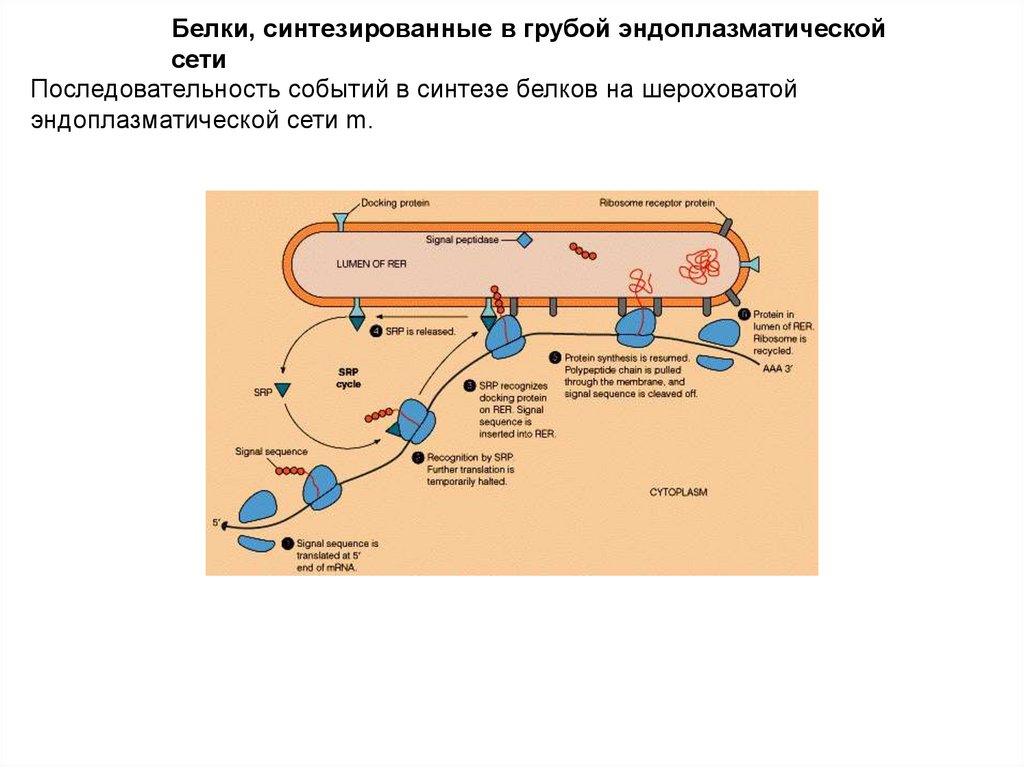
Белки, синтезированные в грубой эндоплазматическойсети
Последовательность событий в синтезе белков на шероховатой
эндоплазматической сети m.
55.
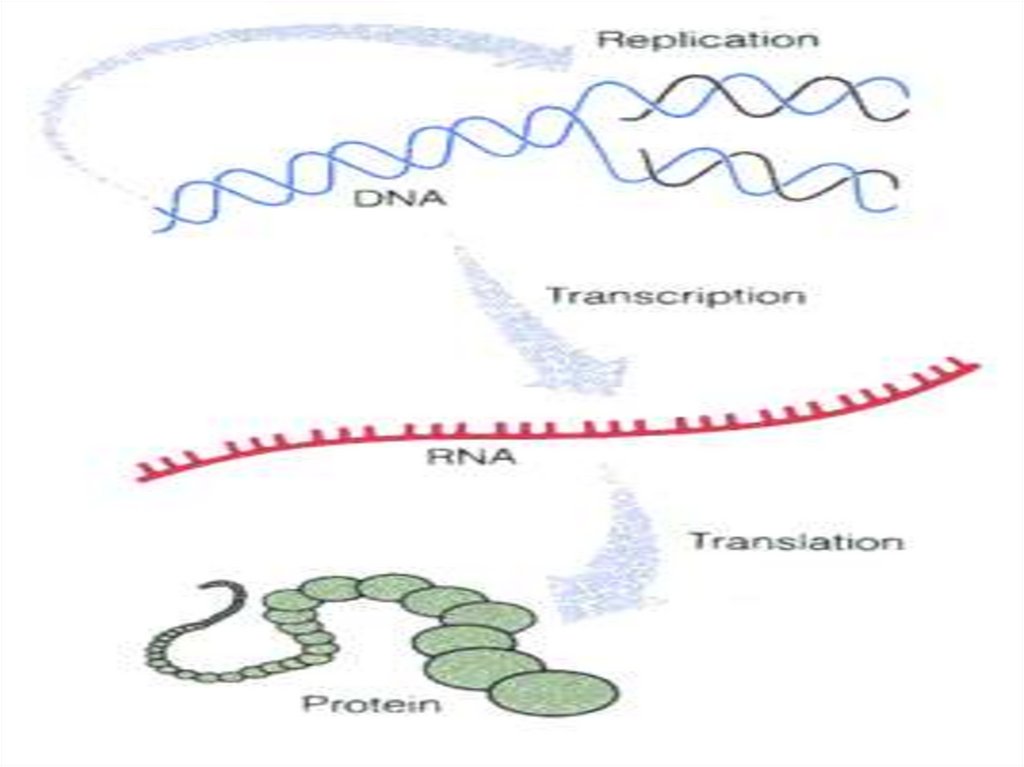
Генетический кодИтак, мы разобрали каков механизм транскрипции и трансляции у про- и эукариот.
Структура всех белков закодированная в ДНК передается на мРНК, которая далее идет к
рибосомам, связывается с ними и становится матрицей для считывания информации.
Каким же образом происходит переход с языка нуклеиновых кислот на язык
аминокислот, т.е. как осуществляется переход с 4х буквенного алфавита НК на 20
буквенный белка. В 1954 году Георг Гамов предложил кодовые слова в таком словаре
составить из 3х букв оснований. Триплетный код из 4х оснований позволяет составить
64 слова. Нужно было определить какие нуклеотиды и вкаком порядке в молекуле мРНК
соответствуют различным АК. Впервые заглянуть в природу кода экспериментально
удалось Ниренбергу и его сотр. В 1961г. Ключ оказался простым. Был получен
синтетический РНК полимер полиуридиловой кислоты. Ее добавляли к системе из E.coli
+ГТФ+20АК(одна меченая) где идет синтез белка. Оказалось, что идет синтез
полифенилаланина, а 19 остальных АК не включаются. Следовательно 3 урацильных
остатка кодируют образование полифенилаланина. Код остальных АК был
расшифрован аналогичным образом.
Другой тип опытов , проведенный в лаборатории Хар Гобинд Корана в 1965 г состоял в
химическом синтезе олигодезоксирибонуклеотидов определенного строения, синтезе на
их матрице олигорибонуклеотидов и в дальнейшем в испытании на связывание с тРНК.
В результате этих опытов Ниренбергу и Коране удалось с большой точностью
установить последовательность нуклеотидов в кодонах для большинства АК. Результаты
исследований показали:
56.
Генетический кодWobble
гипотеза
57.
1. Код триплетный; считывание информации идет с 5' → 3'.2. Код не перекрывающийся. Считывание информации идет от одной
определенной точки непрерывно. Считывание информации начинается с N
коневой АК. Исключение фаг ΨХ 174 ген в гене-сдвиг рамки.
3. Код однозначный – каждый кодон кодирует одну АК.
4. Код «вырожденный» т.е. одна АК может кодироваться разными триплетами. Из 64
триплетов 61 кодирует АК, 3 бессмысленных-УАГ, УАА, УГА.
Специфичность каждого кодона определяется главным
образом 2 первыми буквами, третья менее
специфична.Вырожденность кода позволяет организмам
противостоять мутациям. Замена одного из двух первых
нуклеотидов ведет к замене АК, но синтез продолжается.
Одна и та же ААтРНК способна связываться с разным
числом кодонов, которые определяют одну и ту же АК
при различии в третьем кодоне.
5.Код не безразличен к температуре. У термофильных
бактерий код работает нормально при 50-60 С.
6.Код универсален для всех живых систем. Правда одни
организмы пользуются своими триплетами избегая
других. Это свидетельство общего происхождения кода.
Последовательность нуклеотидов в мРНК будет
определять структуру белка.
58.
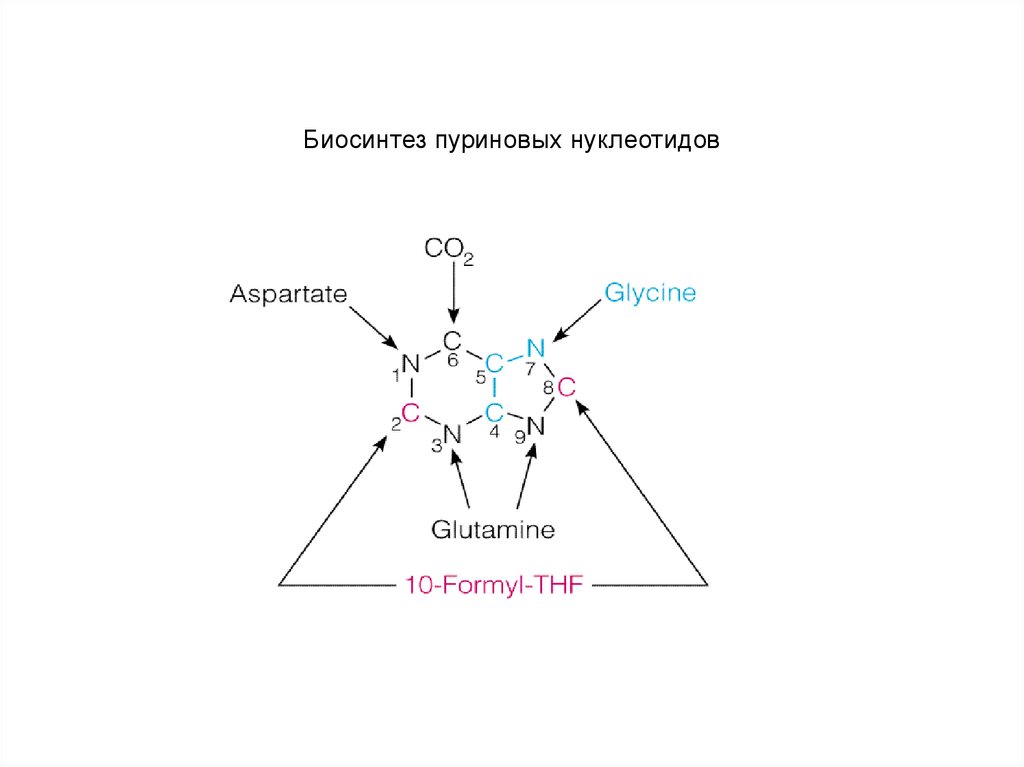
Биосинтез пуриновых нуклеотидов59.
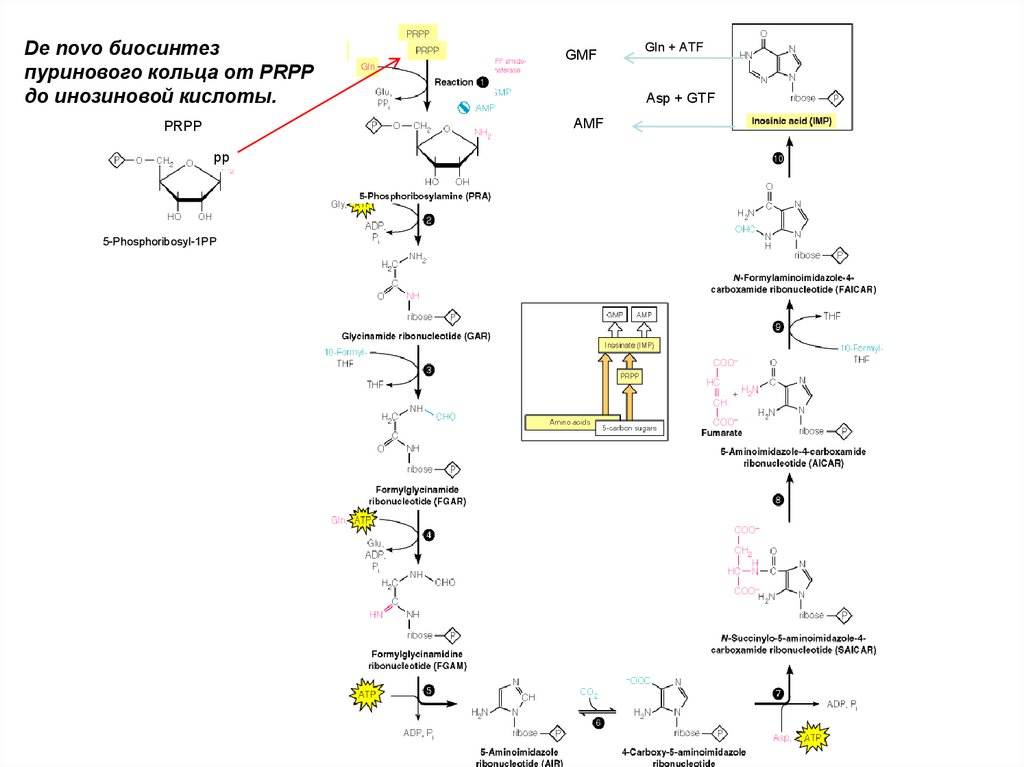
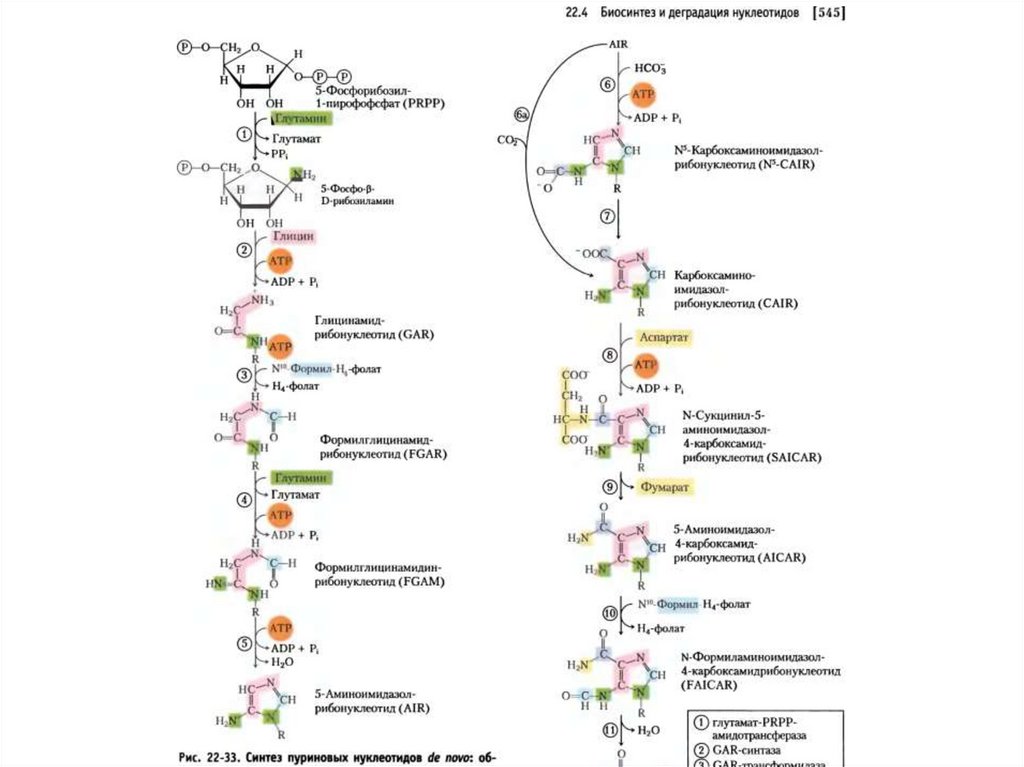
De novo биосинтезпуринового кольца от PRPP
до инозиновой кислоты.
GMF
Asp + GTF
AMF
PRPP
pp
5-Phosphoribosyl-1PP
Gln + ATF
60.
61.
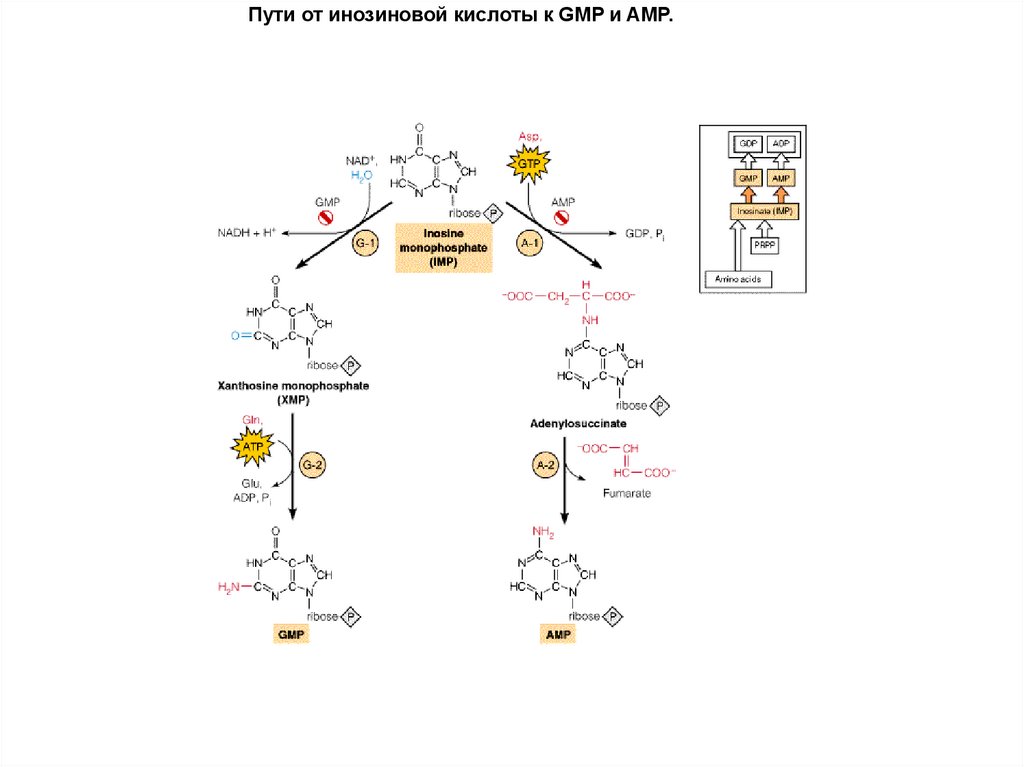
Пути от инозиновой кислоты к GMP и AMP.62.
63.
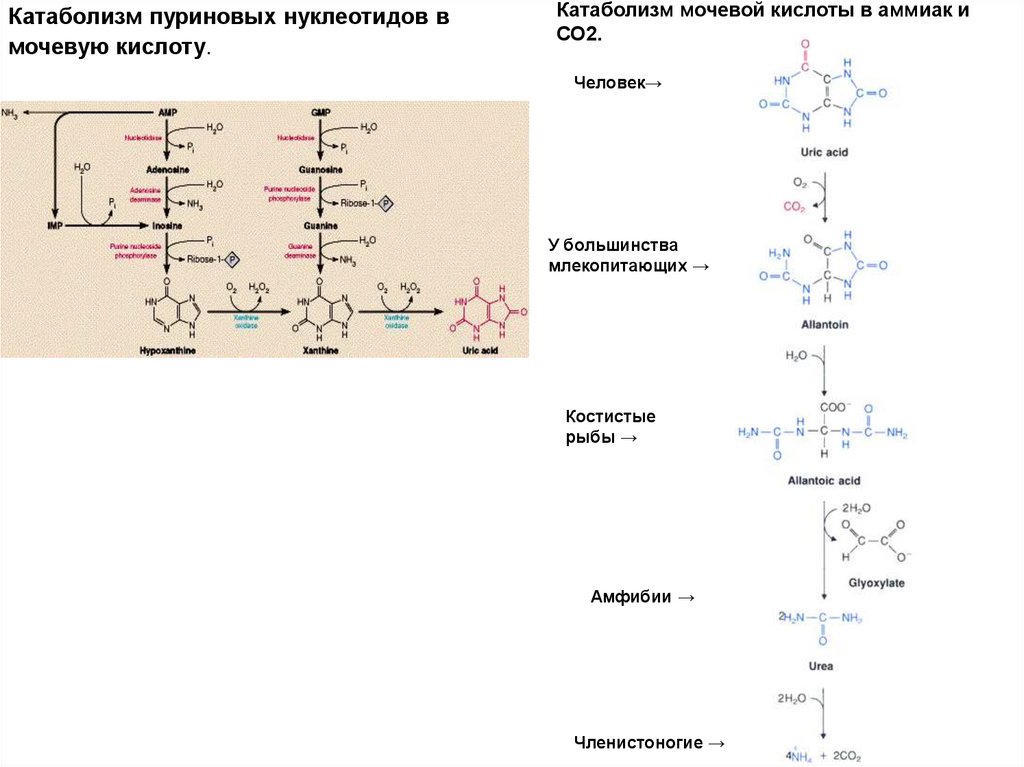
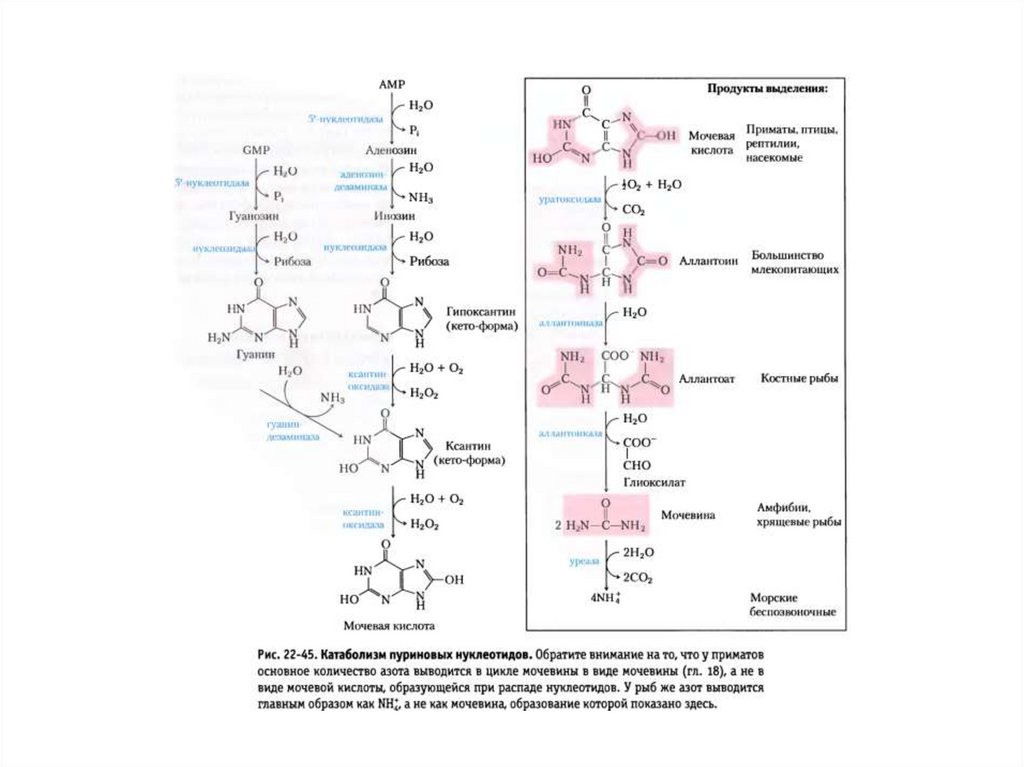
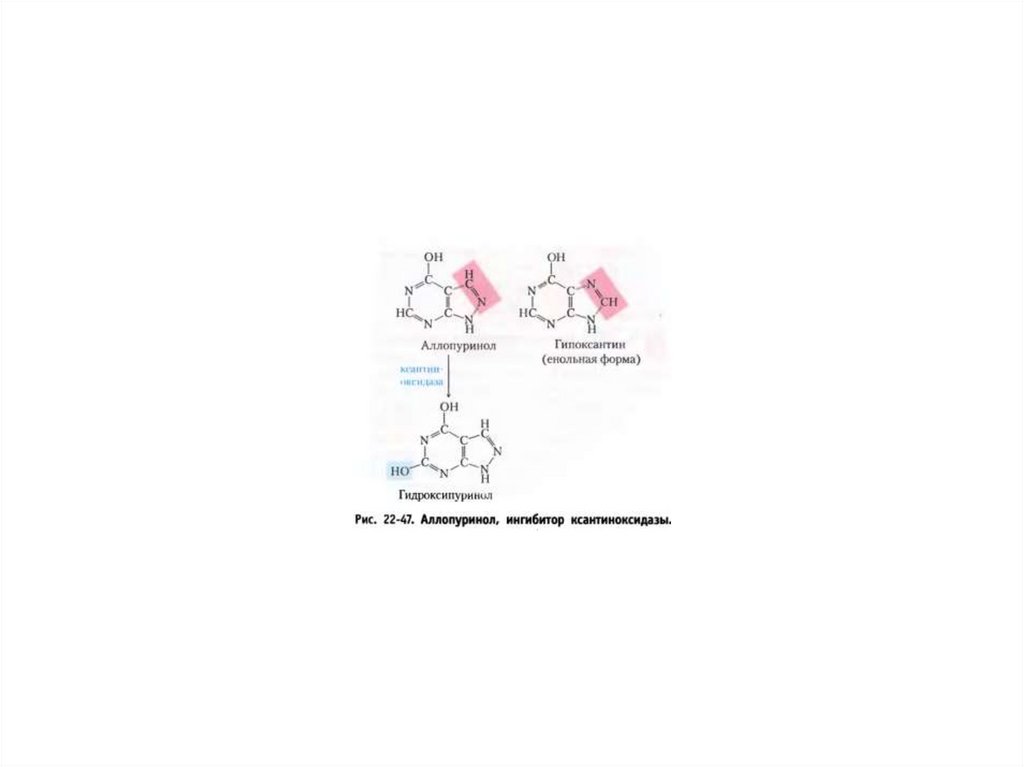
Катаболизм пуриновых нуклеотидов вмочевую кислоту.
Катаболизм мочевой кислоты в аммиак и
СО2.
Человек→
У большинства
млекопитающих →
Костистые
рыбы →
Амфибии →
Членистоногие →
64.
65.
Реутилизация пуриновых и пиримидиновыхоснований.
66.
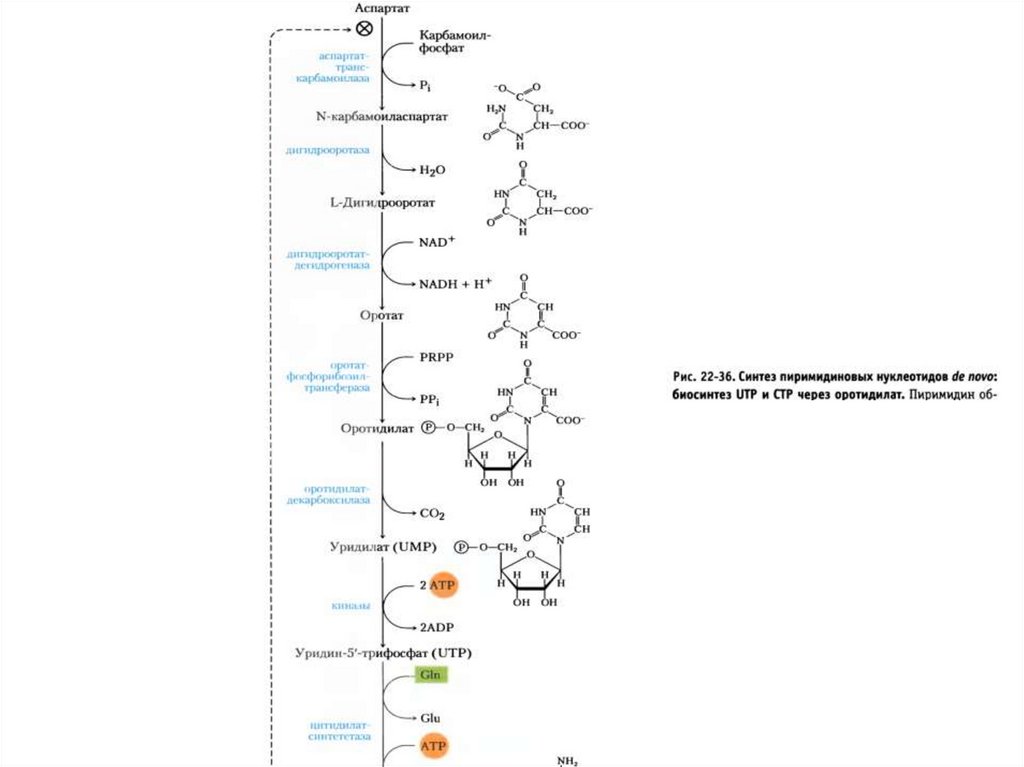
De novo synthesis of pyrimidine nucleotides.67.
68.
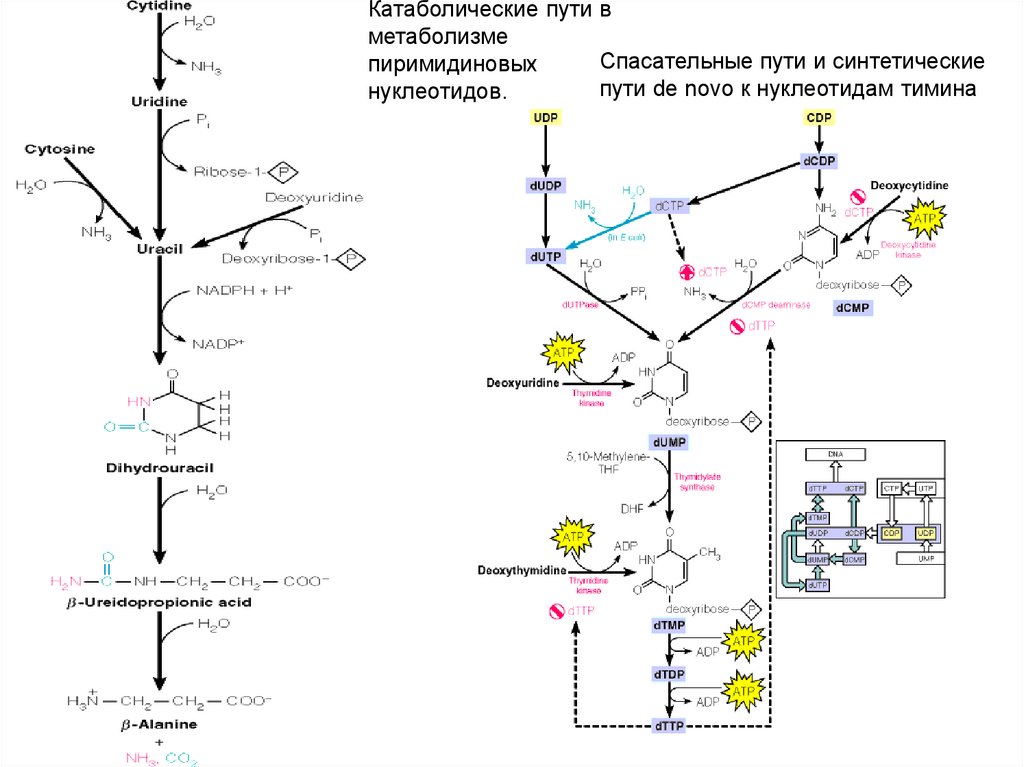
Катаболические пути вметаболизме
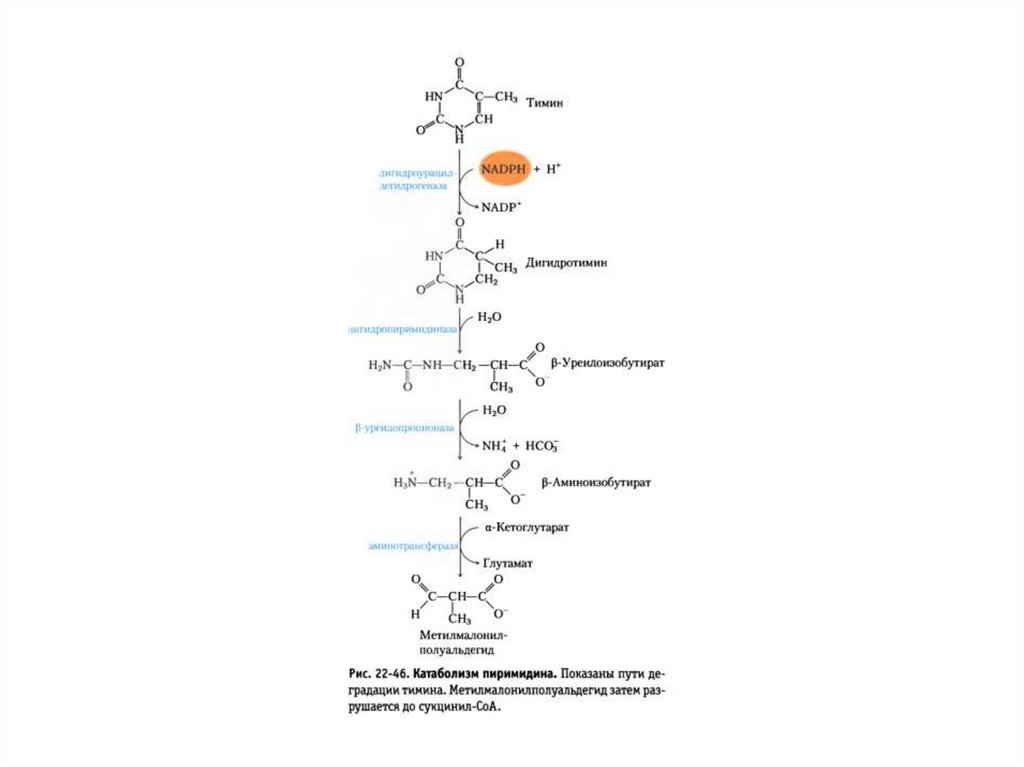
Спасательные пути и синтетические
пиримидиновых
пути de novo к нуклеотидам тимина
нуклеотидов.
69.
70.
71.
Далее ненужная информация72.
73.
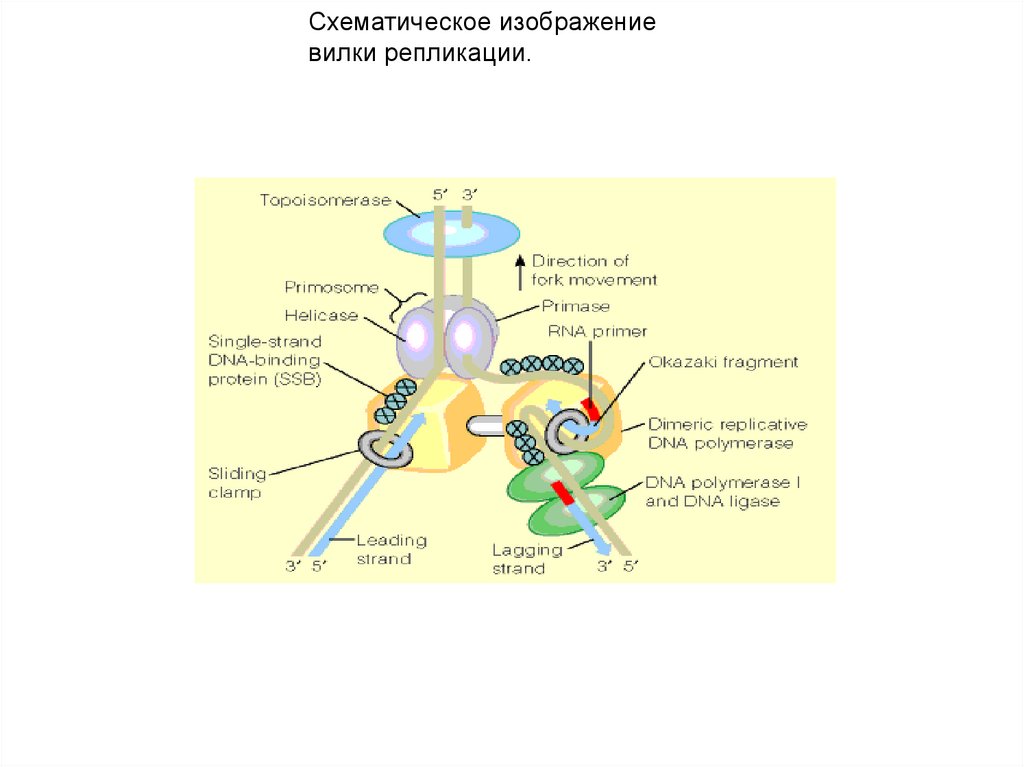
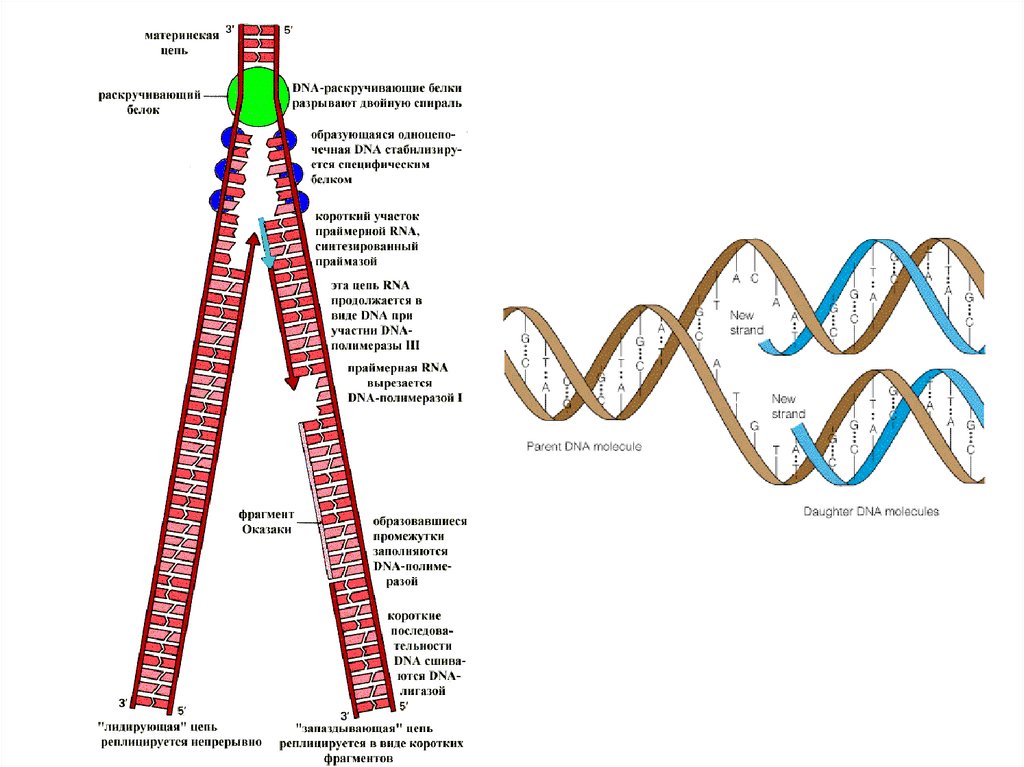
Схематическое изображениевилки репликации.
74.
75.
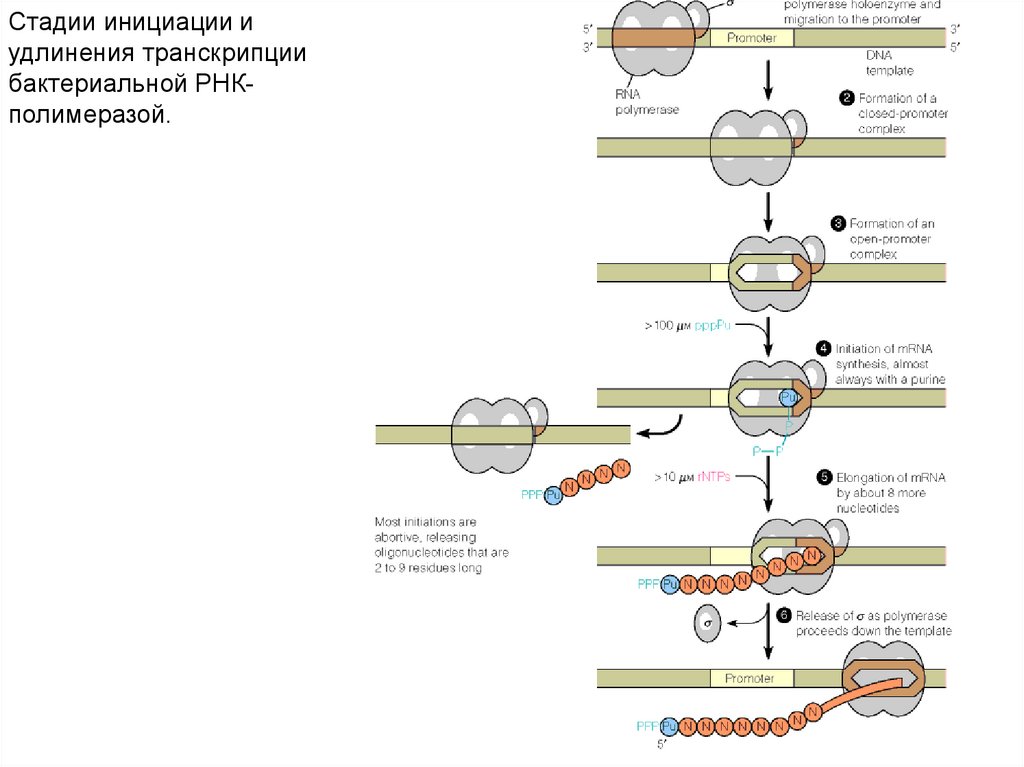
Стадии инициации иудлинения транскрипции
бактериальной РНКполимеразой.
76.
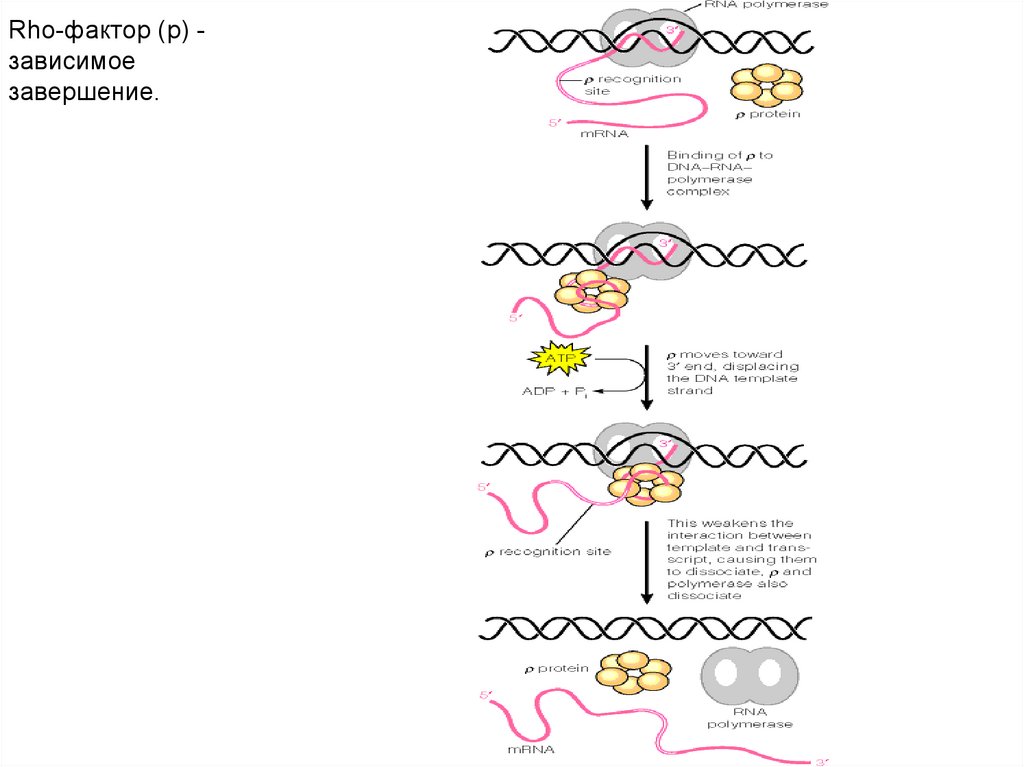
Rho-фактор (p) зависимоезавершение.
77.
78.
79.
Components of a 70S prokaryotic ribosome80.
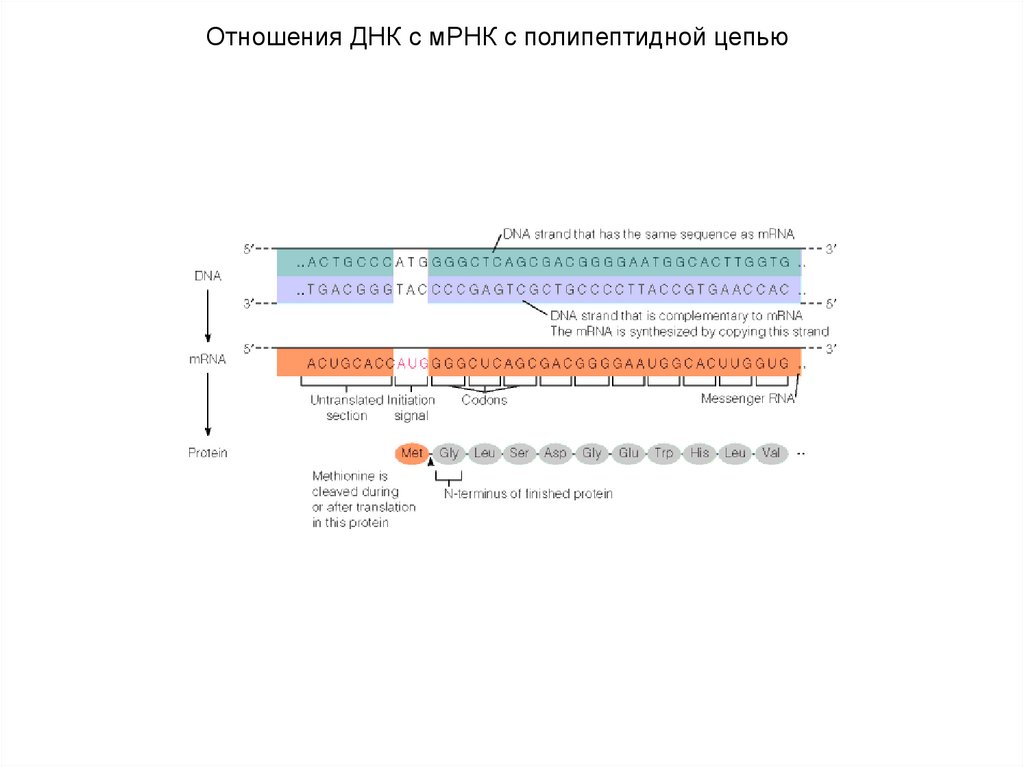
Отношения ДНК с мРНК с полипептидной цепью81.
Activation of amino acids for incorporation into proteins.82.
83.
84.
Translation of an RNA message into aprotein.
Post
Translational
Modification of
Proteins
85.
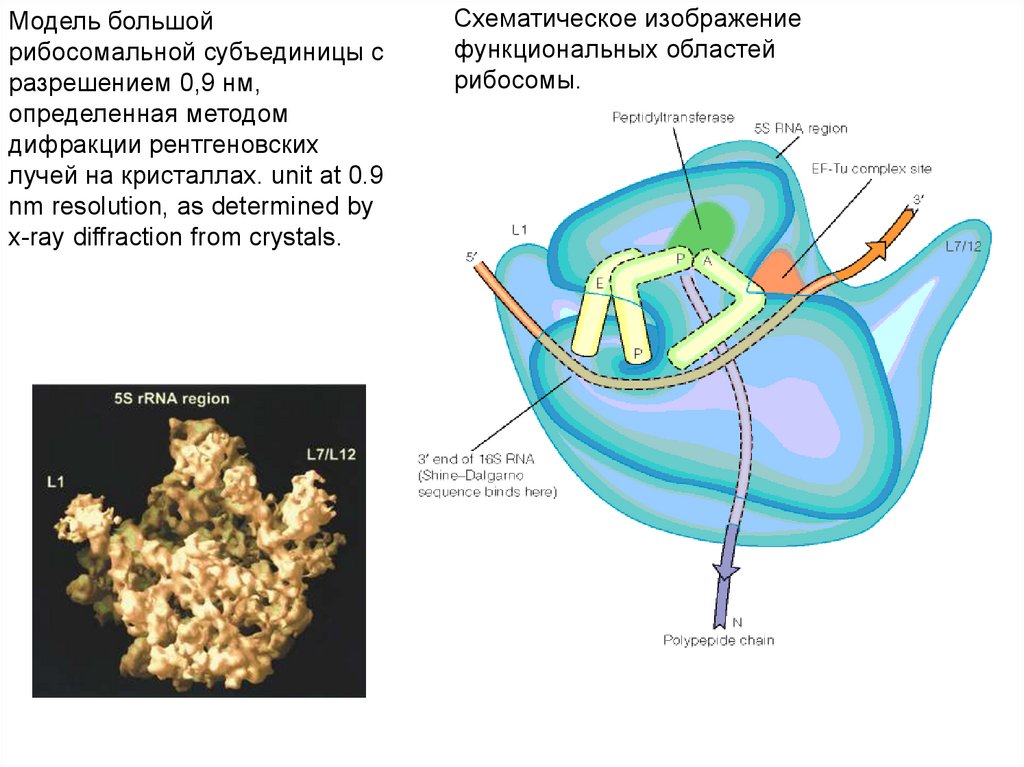
Модель большойрибосомальной субъединицы с
разрешением 0,9 нм,
определенная методом
дифракции рентгеновских
лучей на кристаллах. unit at 0.9
nm resolution, as determined by
x-ray diffraction from crystals.
Схематическое изображение
функциональных областей
рибосомы.
86.
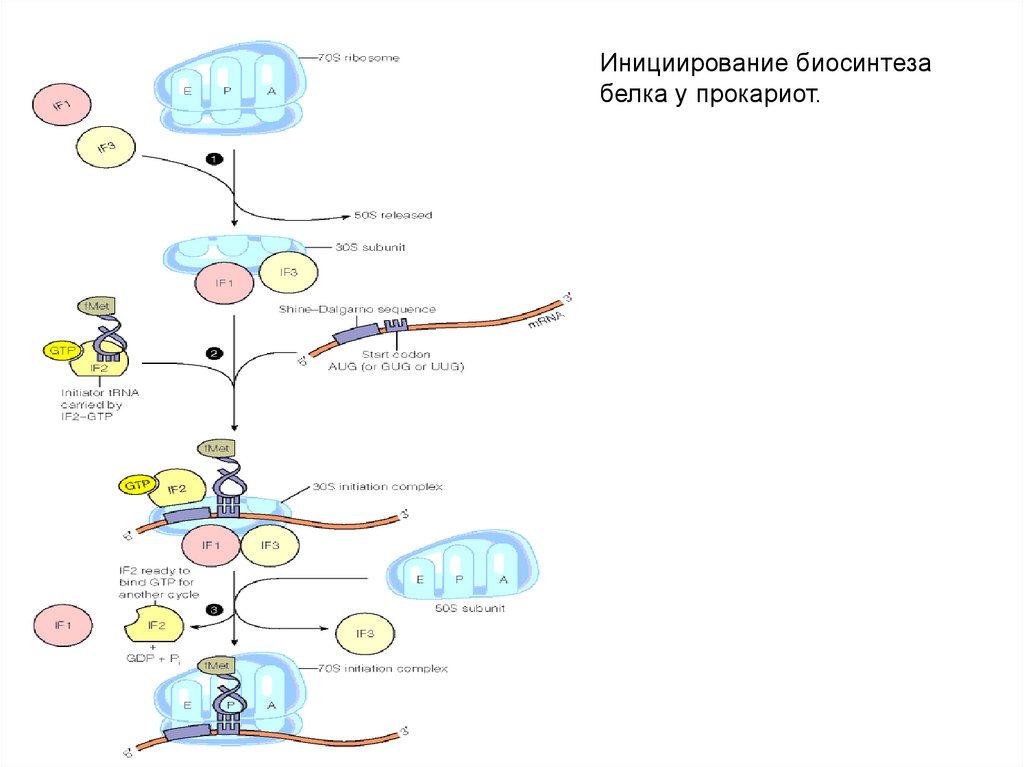
Инициирование биосинтезабелка у прокариот.
87.
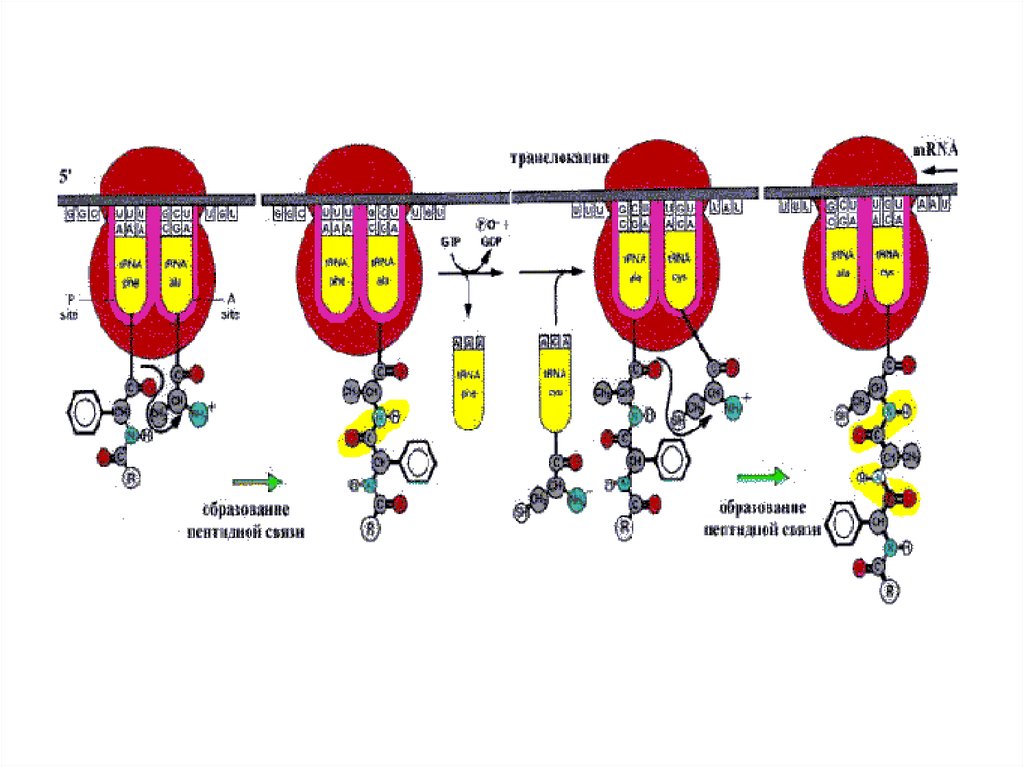
Chain elongation inprokaryotic translation.
Регенерация EF-Tu-GTP
путем обмена Ту-Ц
88.
Termination of translation inprokaryotes.
89.
90.
91.
92.
93.
Translation of an RNA message into a protein94.
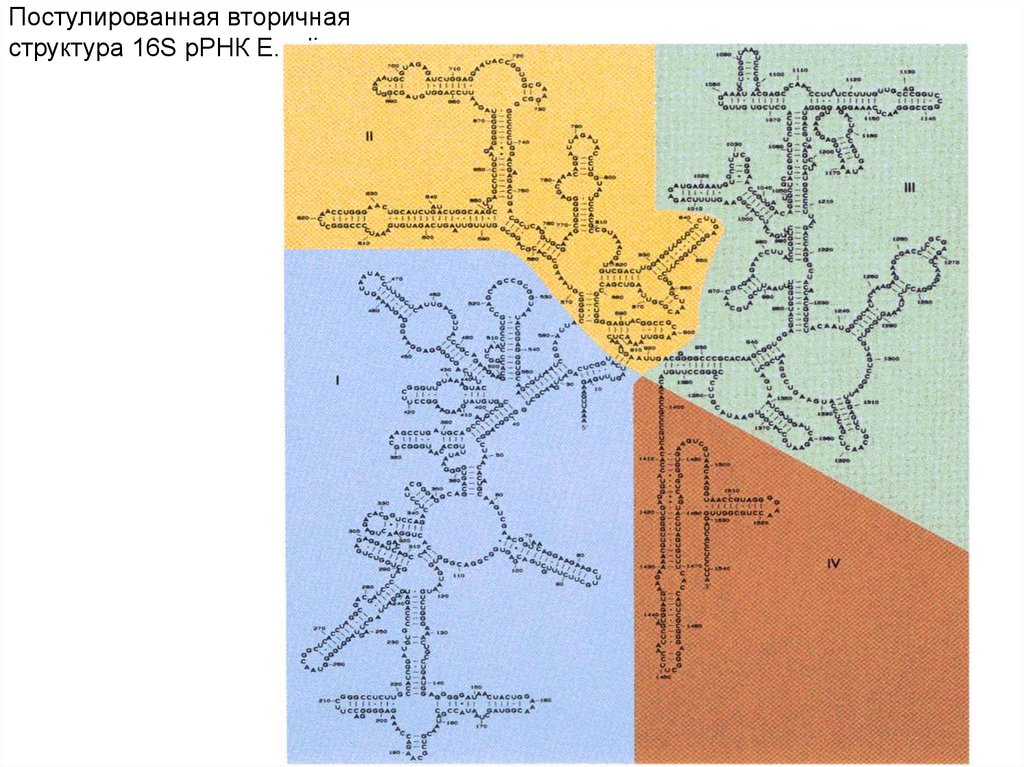
Постулированная вторичнаяструктура 16S рРНК E.coli.
95.
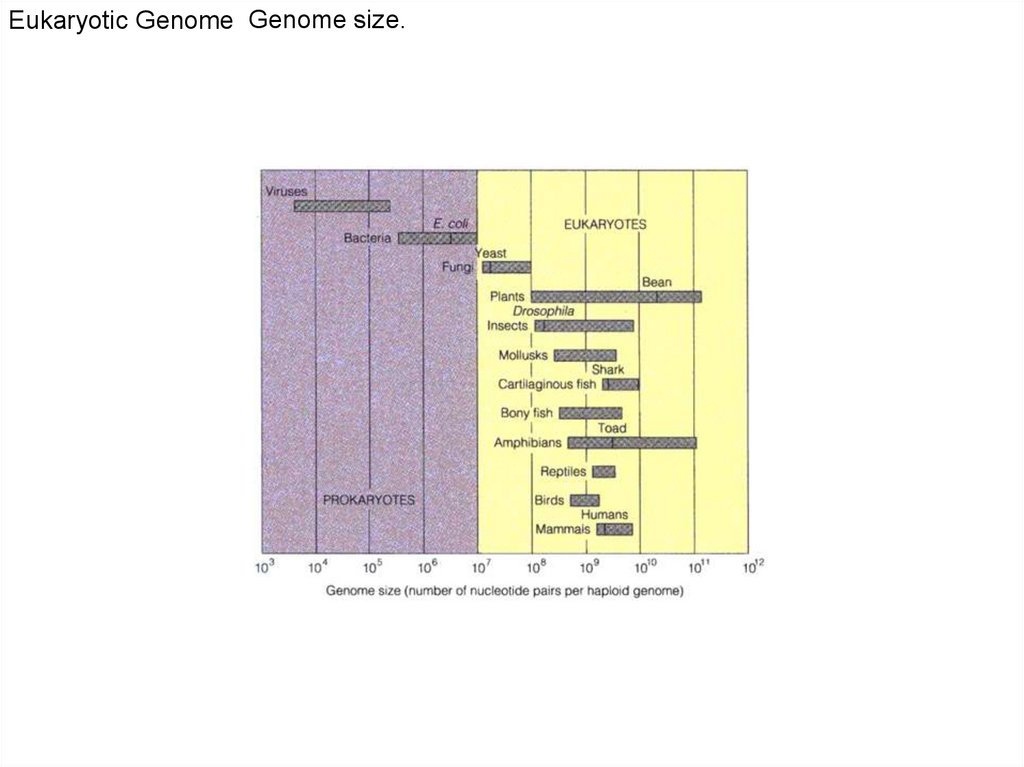
Eukaryotic Genome Genome size.96.
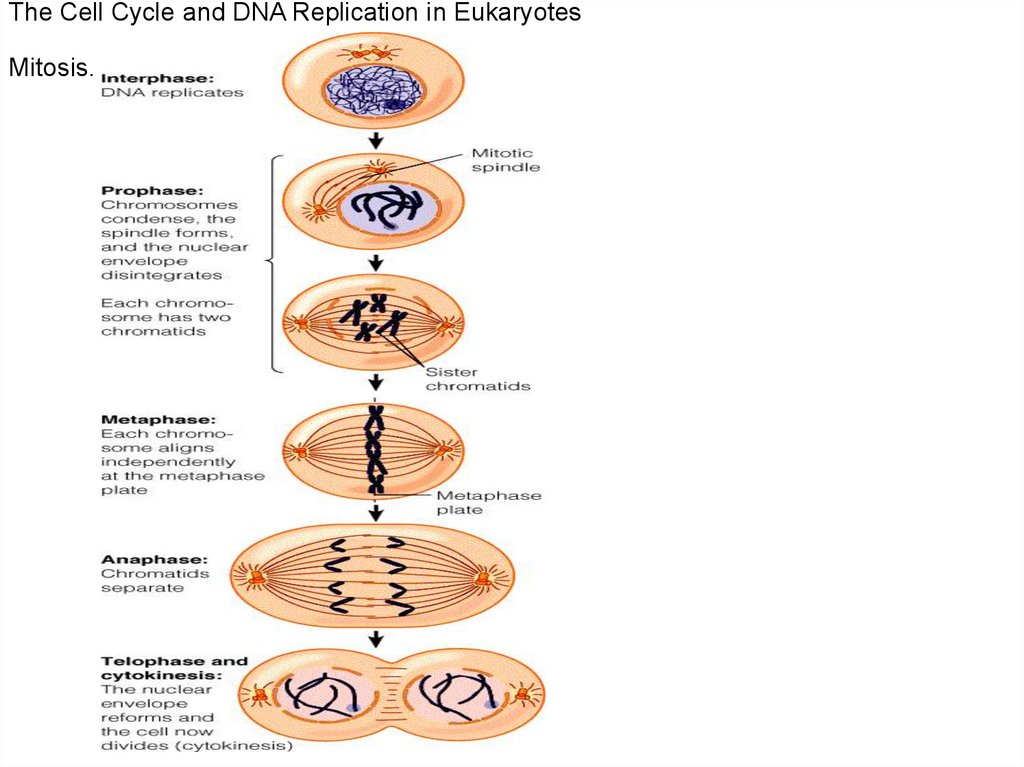
The Cell Cycle and DNA Replication in EukaryotesMitosis.
97.
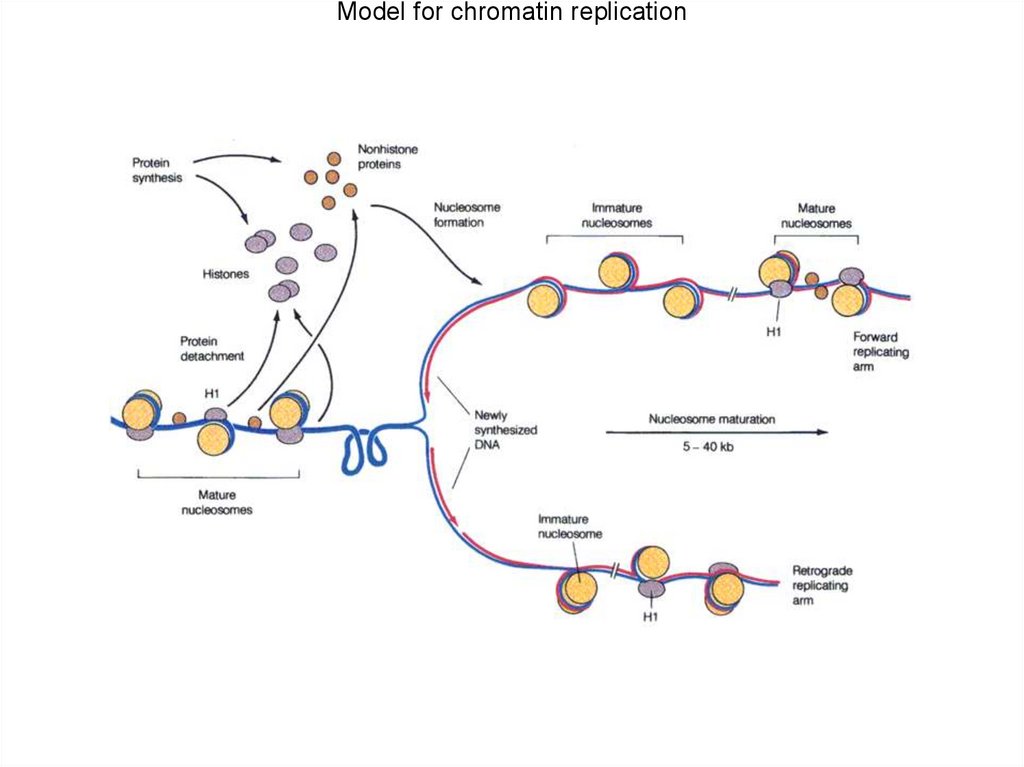
Model for chromatin replication98.
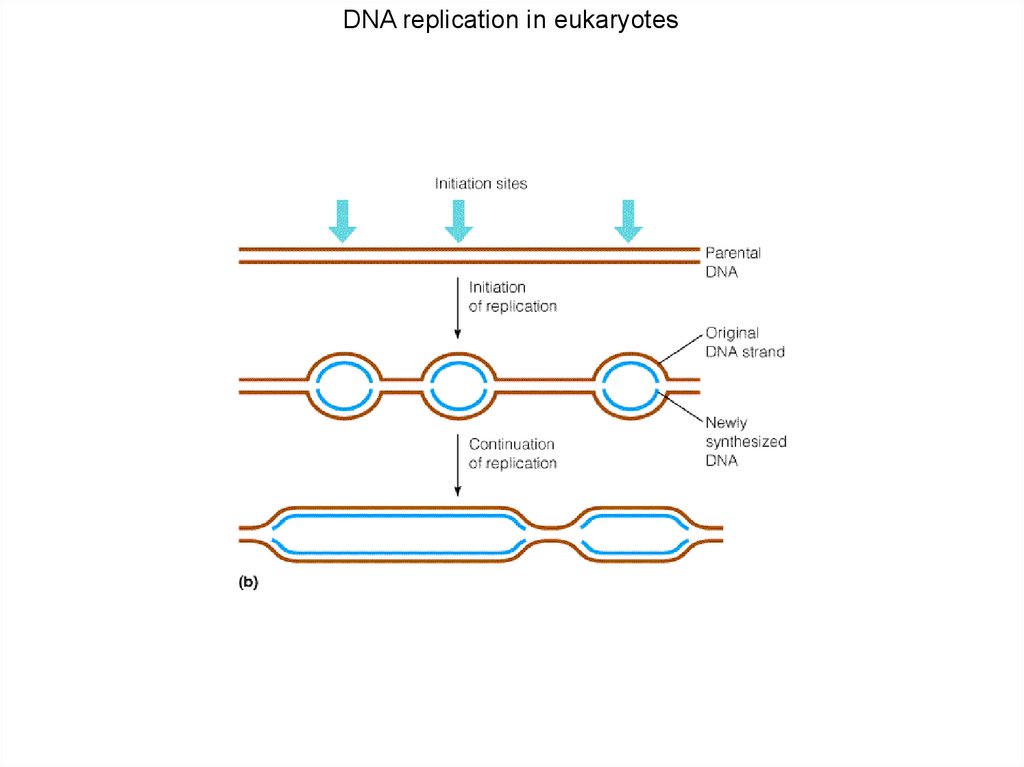
DNA replication in eukaryotes99.
Транскрипция и процессинг основных рибосомальных РНК уэукариот.
100.
Структура малой ядерной РНК (snRNA).Схематическое изображение
предложенного механизма сплайсинга
мРНК.
101.
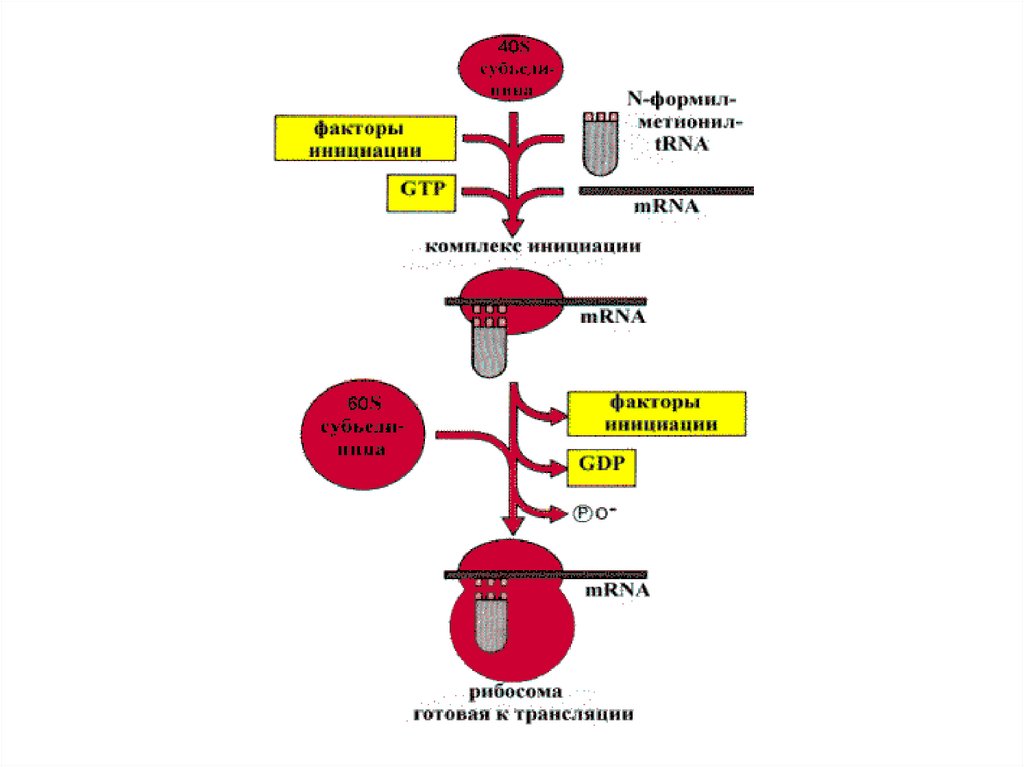
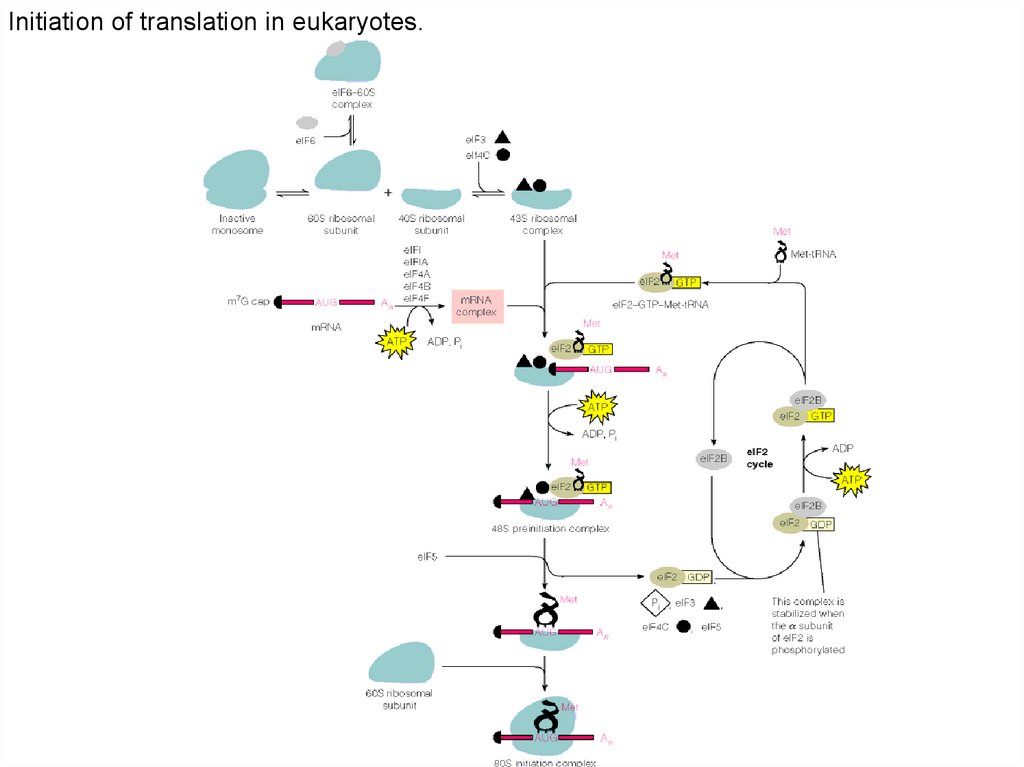
Initiation of translation in eukaryotes.102.
Белки, синтезированные в грубой эндоплазматическойсети
Последовательность событий в синтезе белков на шероховатой
эндоплазматической сети m.
103.
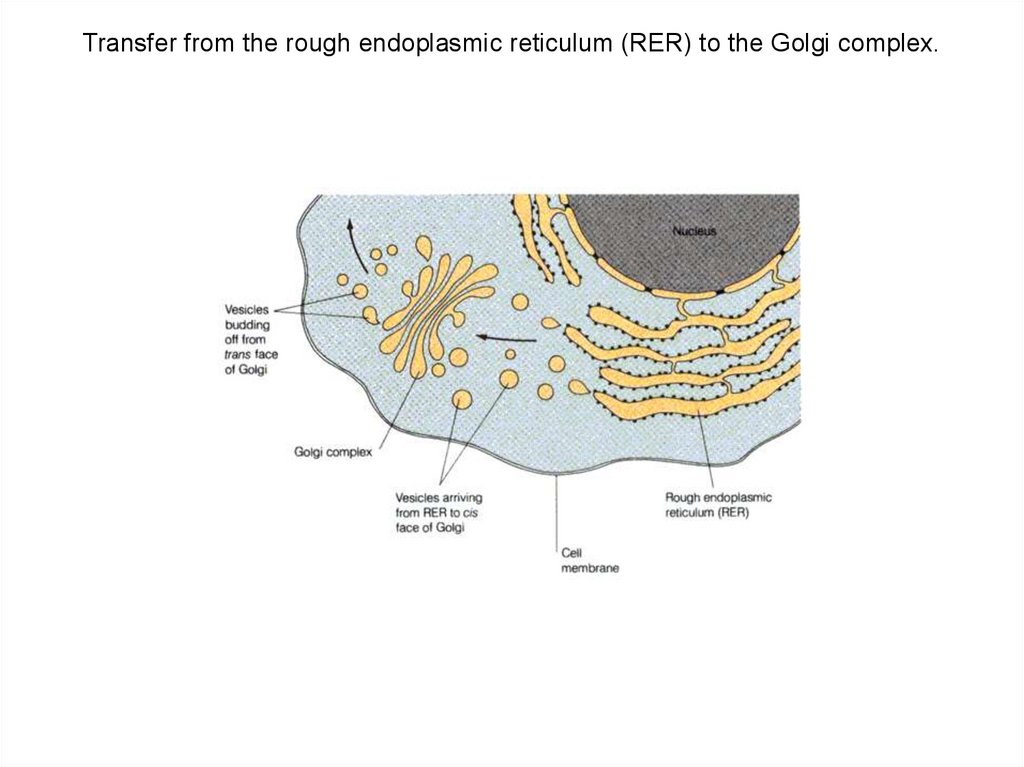
Transfer from the rough endoplasmic reticulum (RER) to the Golgi complex.104.
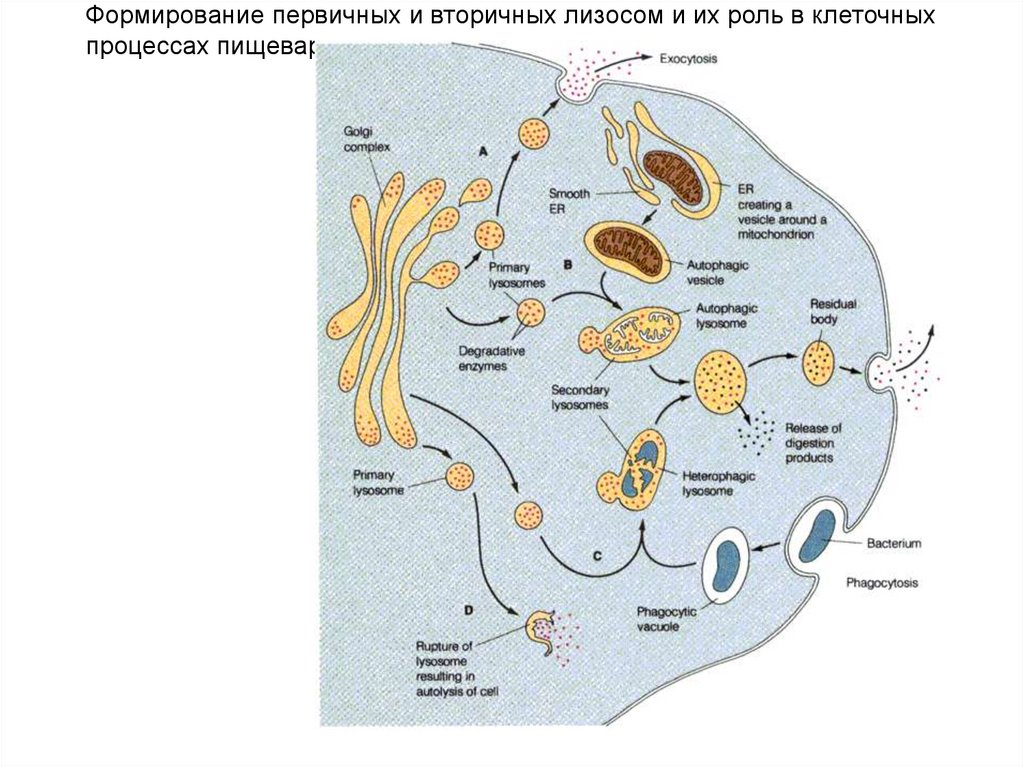
Формирование первичных и вторичных лизосом и их роль в клеточныхпроцессах пищеварения.










































 Биология
Биология








