Похожие презентации:
Готовимся к ЕГЭ, ОГЭ! Теоретические разделы химии. Реакции ионного обмена
1.
Готовимся к ЕГЭ, ОГЭ! Теоретические разделы химии.Реакции ионного обмена
2.
Реакции обмена.Реакции между двумя сложными веществами, в результате
которых они обмениваются своими составными частями,
называются реакциями обмена.
Химические реакции в растворах электролитов протекают при
участии ионов. Если такие реакции не сопровождаются
изменением степеней окисления, они называются
реакциями ионного обмена.
3.
В соответствии с правилом Бертолле ионные реакциипротекают практически необратимо:
I случай
III случай
II случай
В остальных случаях реакции обратимы!
4.
Условия протекания реакцийионного обмена.
Конечный результат реакции зависит от:
степени растворимости исходных продуктов реакции
Р + Р = ; М + Р =; Р + Н =
5.
Реакции ионного обмена.Реакции с образованием малорастворимых веществ,
выпадающих в осадок ( ).
Такие реакции необратимы, т.к. один из продуктов
уходит из сферы реакции в виде нерастворимого
вещества.
6.
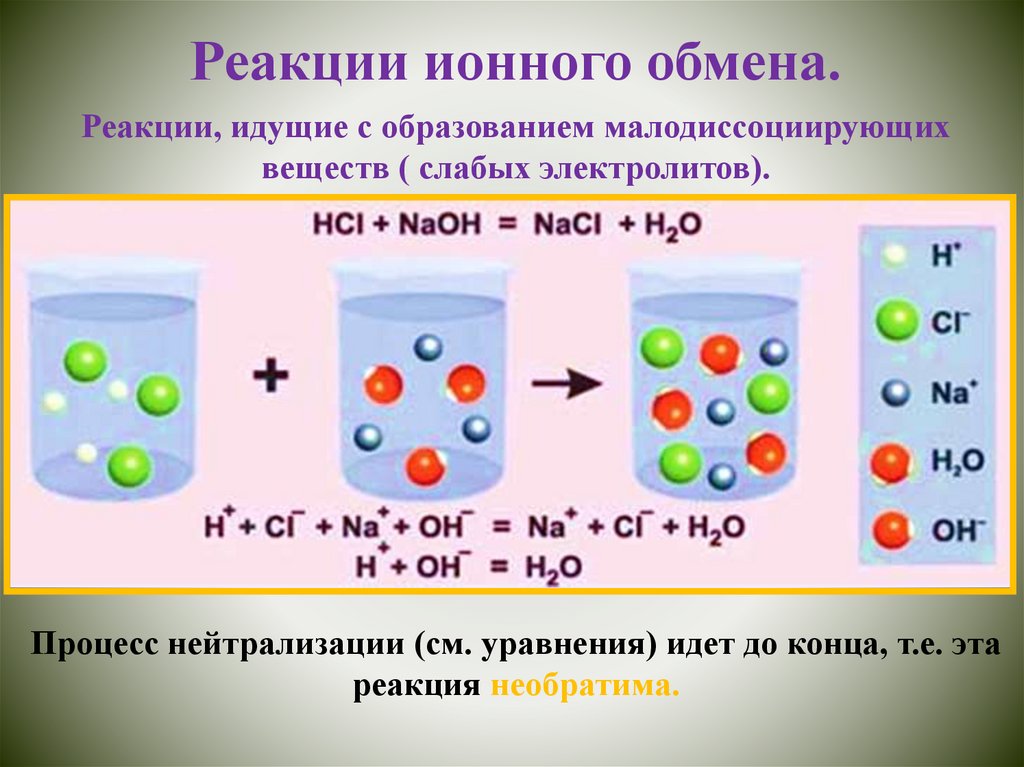
Реакции ионного обмена.Реакции, идущие с образованием малодиссоциирующих
веществ ( слабых электролитов).
Процесс нейтрализации (см. уравнения) идет до конца, т.е. эта
реакция необратима.
7.
Реакции ионного обмена.Реакции, протекающие с образованием газообразных
веществ ( ).
Такие реакции ионного обмена практически необратимы.
8.
Запомни ! Если среди исходных веществ имеются слабыеэлектролиты или малорастворимые вещества, то такие
реакции являются обратимыми, т.е. до конца не идут:
Cu(OH)2 + 2HCl
CuCl2 + 2H2O
нерастворимое основание
слабый электролит
Cu(OH)2 + 2H+
Cu²+ + 2H2O (сокращенное
ионное уравнение)
9.
Запомни! Если исходными веществами реакций обменаявляются сильные электролиты, которые при взаимодействии
не образуют малорастворимых или малодиссоциирующих
веществ, то такие реакции не протекают. При смешивании их
растворов образуется смесь ионов, которые не соединяются друг
с другом:
2NaCl + Ca(NO3)2 = 2NaNO3 + CaCl2
2Na+ + 2Cl¯ + Ca²+ + 2NO¯3 = 2Na+ + 2NO¯3 + Ca²+ + 2Cl¯
Запомни! Уравнения таких реакций обмена не
пишут.
10.
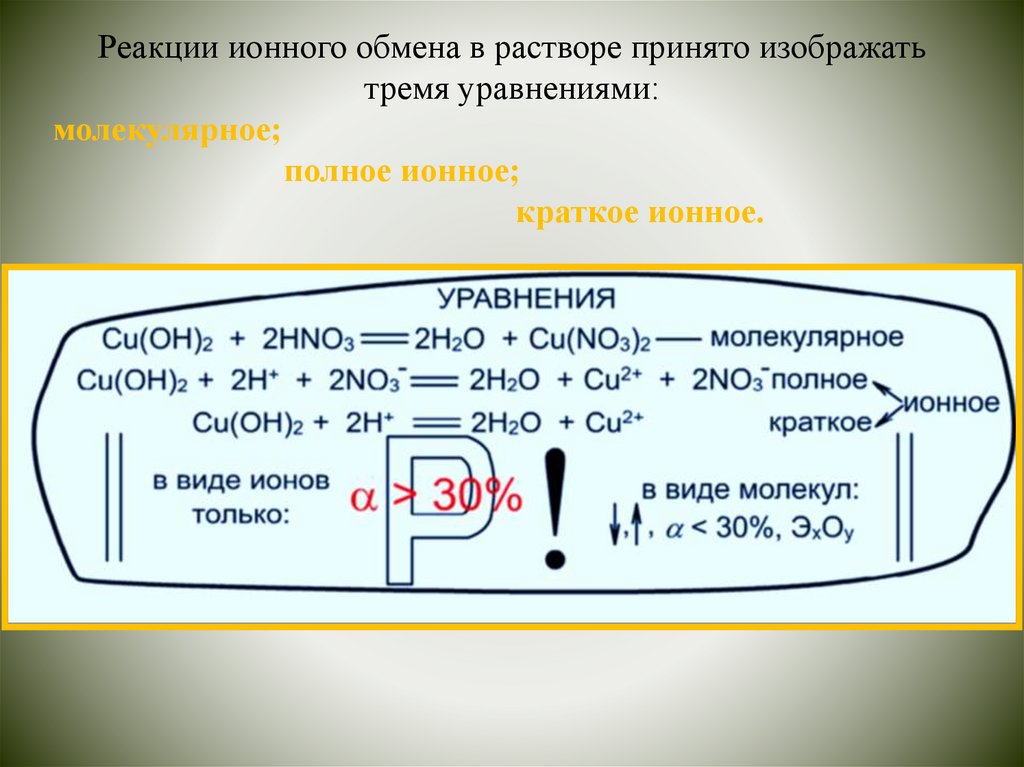
Реакции ионного обмена в растворе принято изображатьтремя уравнениями:
молекулярное;
полное ионное;
краткое ионное.
11.
В ионных уравнениях формулы веществ записываются ввиде ионов или в виде молекул:
В виде ионов
Сильные кислоты
( HClO4, H2SO4, HNO3 и др.)
Сильные основания
(NaOH, KOH, CsOH,
Ca(OH)2, Ba(OH)2 и др.)
Растворимые в воде соли
(NaBr, KNO3, BaCl2,
Al2(SO4)3 и др.)
В виде молекул
H2O
Слабые кислоты
(HNO2, HCN, H2CO3, H2SO3,
CH3COOH и др.)
Слабые основания
(NH3OH, Cu(OH)2 и др.)
Малорастворимые соли
(AgCl, FeS, BaSO4, CaCO3 и др.)
Амфотерные гидроксиды
(Cr(OH)3, Al(OH)3, Zn(OH)2)
Газообразные вещества и
оксиды
(CO2, SO3, H2, Na2O, P2O5)
12.
Растворимость солей в воде.п/ Анионы и
№ катионы
Растворимость солей
1 NO3¯
Растворимы все соли.
2 Cl¯
Растворимы все соли, кроме AgCl. CuCl, PbCl2,
HgCl2.
3 SO4²¯
Растворимы все соли, кроме BaSO4, SrSO4,
PbSO4, малорастворима CaSO4.
4 CO3²¯
Из средних солей растворимы только натрия,
калия, аммония.
5 РО4³¯
Из средних солей растворимы только натрия,
калия, аммония.
6 Na+, K+,
NH4+
Растворимы почти все соли.
13.
Задания для самостоятельной работы.1. Составьте молекулярные и ионные уравнения реакций ионного
обмена в растворе:
а)FeSO4 + KOH =; б)Ba(NO3)2 + Na2SO4 =; в)KNO3 + NaCl =;
2. Составьте возможные молекулярные уравнения реакций по
указанным ионным уравнениям:
а) Ca²+ + CO3²¯ = CaCO3 ; б) S²¯ + 2H+ = H2S
3. Определите, возможно ли (да, нет)совместное существование в
водном растворе следующих веществ:
а) нитрат бария и сульфат калия; б) сульфат кальция и ацетат натрия
Составьте возможные уравнения реакций ионного обмена.
14.
Проверочный тест (время выполнения 10 мин).1. Краткое ионное уравнение OH¯ + H+ = H2O отвечает
взаимодействию:
1. Fe(OH)2 + HCl =; 2. NaOH + HNO2 =; 3. NaOH + HNO3 =;
4. Ba(OH)2 + KHSO4 =
2. Сумма коэффициентов в молекулярном уравнении
Ca(HS)2 + Ca(OH)2 = CaS + …
1. 9 ;
3. 7 ;
2. 8 ;
4. 6 .
3. В водном растворе не могут существовать совместно два
вещества:
1. SrBr2 и (NH4)2SO4
2. CaCl2 и Cr(NO3)3
3. MnSO4 и NaI
4. Ba(NO3)2 и KOH
Ответы: 1. 3.; 2.4.; 3.1.
15.
http://himege.ru/wpcontent/uploads/2014/03/%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B8-%D0%B8%D0%BE%D0%BD%D0%BD%D0%BE%D0%B3%D0%BE%D0%BE%D0%B1%D0%BC%D0%B5%D0%BD%D0%B0.jpg
http://olovorona.ru/wp-content/uploads/2015/09/olovo3.jpg
https://encryptedtbn3.gstatic.com/images?q=tbn:ANd9GcTwqR1pDKGTWanhbqxxFjwCYonI78ZlqW1NcSBtBf45-3l7GyB













 Химия
Химия








