Похожие презентации:
Введение в дисциплину «Методы исследования молекулярных механизмов биорегуляции» (тема 1)
1.
Тема 1. Введение вдисциплину «Методы
исследования молекулярных
механизмов биорегуляции»
Лекции – 16 часов;
Лабораторные занятия – 32 часа.
2.
Предмет курса: знакомство с методами исследованиямолекулярных механизмов биорегуляции.
3.
Задачи курсаОзнакомиться с методами, использующимися в геномике,
транскриптомике, протеомике, метаболомике для исследования
молекулярных механизмов биорегуляции.
4.
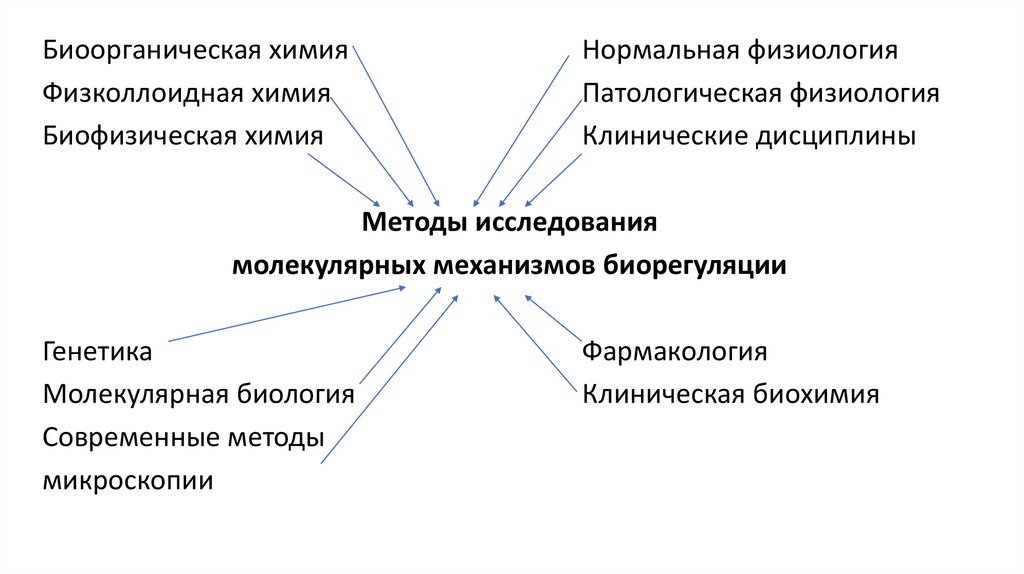
Биоорганическая химияФизколлоидная химия
Биофизическая химия
Нормальная физиология
Патологическая физиология
Клинические дисциплины
Методы исследования
молекулярных механизмов биорегуляции
Генетика
Молекулярная биология
Современные методы
микроскопии
Фармакология
Клиническая биохимия
5.
Живая клетка – это открытая система, постоянно обменивающаясявеществом и энергией с окружающей средой.
Оставаясь термодинамически открытой системой, клетка
стремится сохранить неизменным свой внутренний состав.
В многоклеточном организме происходит специализация функций.
При этом клетка приобретает способность реагировать
изменением функциональной активности и метаболизма не только
на факторы окружающей среды, но и на изменения, происходящие
в других клетках организма.
6.
В клетке происходит множество химических реакций, согласованных повремени, скорости, месту протекания.
Согласованность, упорядоченность всех процессов (химических,
физических) достигается благодаря существованию многообразных
внутриклеточных и межклеточных механизмов биорегуляции.
Практически все процессы в биологических системах протекают при
участии катализаторов белковой природы.
7.
• Наряду с белками, основными объектами, на которые направленорегуляторное воздействие, являются мембраны и нуклеиновые кислоты.
• Те из них, которые секретируются в межклеточное пространство,
проникают в кровь или лимфу, а затем попадают на клетки-мишени
(гормоны). Те, которые секретируются из пресинаптической мембраны в
синаптическую щель и вызывают биологический эффект, связываясь с
рецепторами постсинаптической мембраны - нейромедиаторы.
• Т.е. нейромедиатор, диффундируя из синаптической щели в
межклеточное пространство, а оттуда в кровь и лимфу, становится
гормоном. При этом, переходя из синапса в кровь, вещество может
утрачивать одни и приобретать другие регуляторные функции.
8.
Процессы, протекающие в клетке, подвергающиеся биорегуляции:• Контроль метаболического баланса;
• Контроль роста и деления клеток;
• Гемопоэз;
• Регуляция дифференцировки и клеточный иммунитет;
• Воспалительные реакции;
• Регенерация тканей;
• Мышечное сокращение.
9.
Современные высокопроизводительные технологии физикохимического анализа веществ позволяют измерять параметрыбиологических систем на всех четырех основных уровнях
функциональной организации живых систем (молекулярном,
клеточном, тканевом и организменном) и передачи информации в
них (трансляции генома в РНК, транскрипции белка и участии
белков в передаче сигналов и синтезе метаболитов в клетках).
Каждый из них дает комплиментарную информацию о фенотипе.
Под фенотипом понимают совокупность биологических свойств и
признаков организма, сложившуюся в процессе его
индивидуального развития.
10.
Изучение генома – полной совокупности информации,представленной нуклеотидными последовательностями ДНК
клетки - дает информацию об изменениях, которые могут
произойти в организме (то есть о различных
предрасположенностях и потенциальных функциональных
нарушениях работы организма).
По сравнению с транскриптомом, протеомом и метаболомом,
геном относительно статичен и не подвержен изменениям в
процессе жизнедеятельности клетки (за исключением деления), не
считая эпигенетических модификаций (метилирование ДНК),
влияющих на экспрессию генов или “включающих” и
“выключающих” их транскрипцию.
11.
Изучение транскриптома - полной совокупности молекулинформационной РНК (транскриптов), транскрибированных из
включенной в процесс транскрипции части генома
и протеома - полной совокупности белков, транслированных из
информационной РНК (транскриптома) - позволяет получить
информацию об изменениях, непосредственно происходящих в
организме и о причинах, их вызвавших.
Состав транскриптома и протеома относительно динамичен и
изменяется в результате пост-транскрипционных и посттрансляционных модификаций, соответственно.
12.
Состав метаболома, как финальной, завершающей части этойцепочки, наиболее подвержен изменениям и позволяет получить
информацию об изменениях в организме, которые уже
произошли.
13.
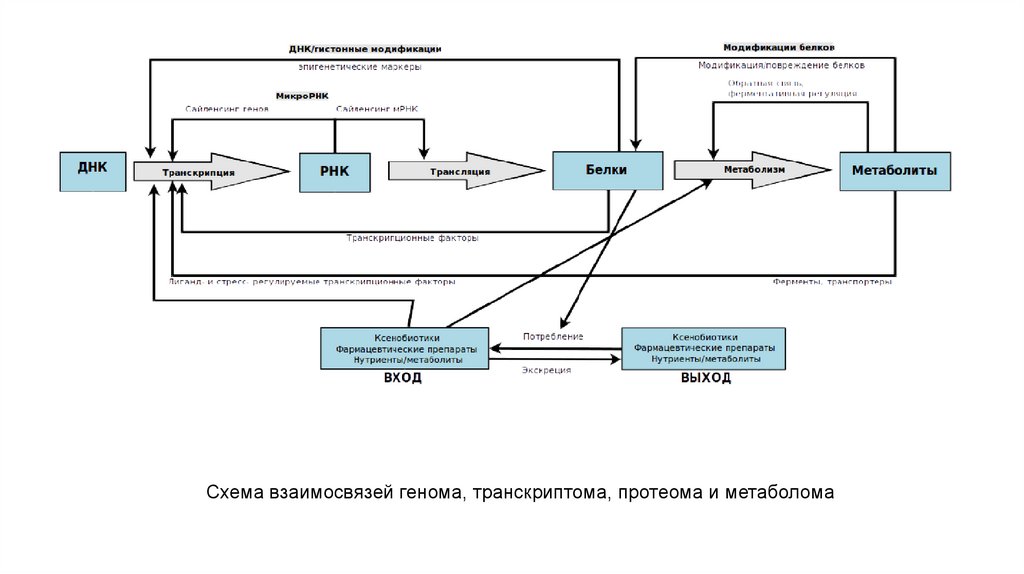
Схема взаимосвязей генома, транскриптома, протеома и метаболома14.
В то время как генетическая информация наследуется и геномописывает потенциал живой системы, метаболом описывает
конкретное функциональное и физиологическое состояние живой
системы в конкретный момент времени.
15.
Метаболом является конечным продуктом геномной, транскриптомнойи протеомной активности. Его качественный и количественный состав
представляют собой сигнатуру (“отпечаток пальца”, отражение)
клеточной активности. Поэтому состав метаболома тесно взаимосвязан
с фенотипом.
Помимо участия в биохимических процессах в качестве субстратов и
продуктов реакций или в качестве сигнальных молекул (как вторичные
мессенджеры) метаболиты оказывают и более “дальнодействующее”
влияние – участвуют в регуляции эпигенетических модификаций и в
регуляции активности белков, обеспечивая таким образом обратную
связь для процессов биохимической регуляции жизнедеятельности
клетки
16.
Более важный практический аспект изучения метаболома заключается втом, что состав метаболома является отражением влияния не только
генома, но и окружающей среды.
Изучение совместного влияния генома и факторов окружающей среды
на метаболом может стать инструментом для выявления и измерения
экспосома (от exposure – воздействие), совокупности факторов
окружающей среды, влияющей на регуляцию генов и индивидуальное
развитие организма.
17.
Концентрации метаболитов в значительной степени отражаютсинергетический эффект воздействия на организм множества риск-факторов
окружающей среды, в том числе, влияние внутреннего микробиома
(совокупности бактерий, находящихся внутри и на внешних поверхностях
организма), оксидативного стресса и воспалительных процессов, внешнего
климата, поллютантов, патогенов, питания, фармацевтических препаратов и
социальных взаимодействий между индивидами.
Совокупность этих воздействий в течение жизни организма также формирует
и фенотип.
18.
Прогресс в технологии и рост мощности компьютеров совместно сиспользованием методов биоинформатики, вычислительной
статистики и прикладной математики сделали возможным не
только быстрое измерение большого числа метаболитов в малых
количествах биологического материала (биологических жидкостях,
клетках, тканях), но и переход от изучения изменения
концентраций индивидуальных метаболитов к функциональному
анализу активности метаболических путей и обратной связи этой
активности с фенотипом с использованием других биологических
данных (уровня экспрессии генов, ферментативной активности и
т.п.) из смежных областей молекулярной биологии и биохимии
(эпигеномики, транскриптомики, протеомики).
19.
Как мощная технология измерения и анализа измененияпараметров фенотипа, метаболомика играет ключевую роль в
дальнейшем развитии персонализированной медицины.
20.
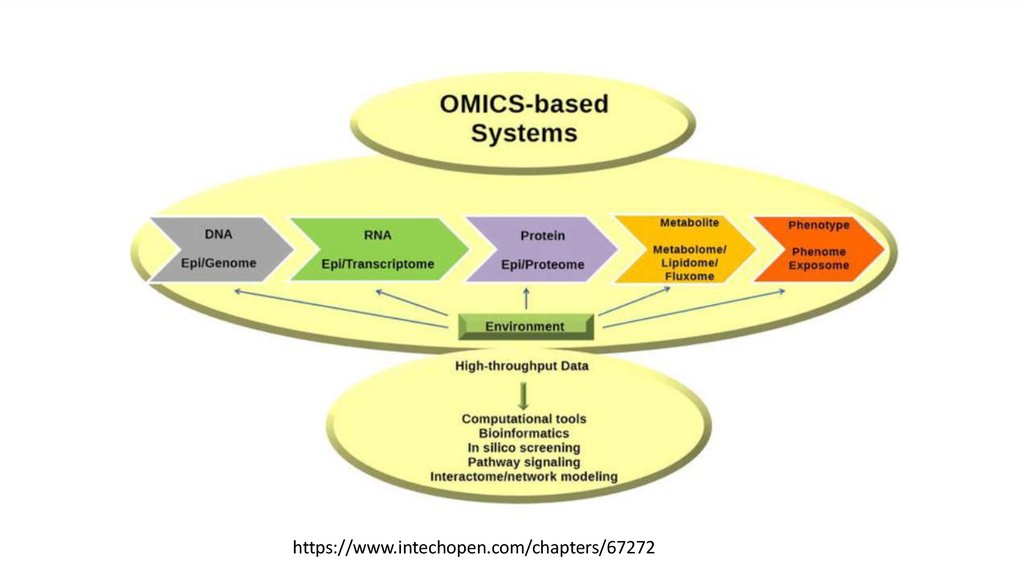
https://www.intechopen.com/chapters/6727221.
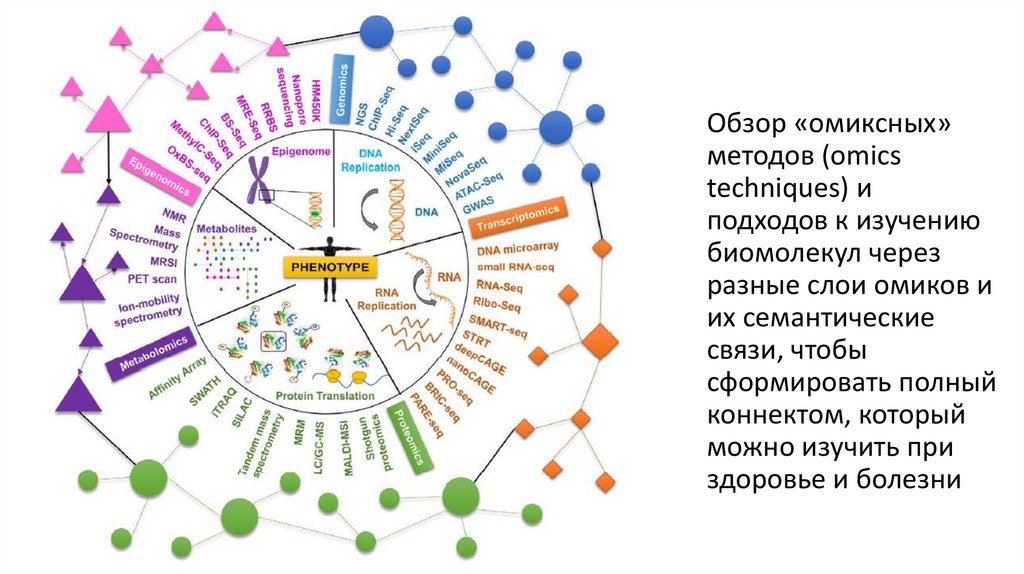
Обзор «омиксных»методов (omics
techniques) и
подходов к изучению
биомолекул через
разные слои омиков и
их семантические
связи, чтобы
сформировать полный
коннектом, который
можно изучить при
здоровье и болезни
22.
«Омиксные» технологии (‘Omic’ technologies) представляютсовокупность эффективных экспериментальных дисциплин
(геномика, протеомика, транскриптомика, метаболомика…),
позволяющих сформировать целостный взгляд на молекулы, из
которых состоит клетка, ткань или организм.
Они нацелены в первую очередь на универсальное обнаружение
генов (геномика), мРНК (транскриптомика), белки (протеомика) и
метаболиты (метаболомика) в конкретном биологическом
образце.
23.
Интеграция этих методов называетсясистемной биологией (биологические
исследования с упором на
систематическое изучение сложных
взаимодействий в биологических
системах с использованием моделей
интеграции. Конечная цель – понимание
функционирования целостной системы,
например, сложные клеточные пути,
изучение влияния измененных внешних
факторов на геном, транскриптом,
протеом и метаболом одновременно).
24.
Геномика – это изучение полного набора генов организма, в ходекоторого основное внимание уделяется структуре, функциям и
эволюции геномов.
Новые экспериментальные технологии привели к постоянному
потоку объемных и сложных наборов геномных данных,
поступающих в общедоступные базы данных, что
революционизирует изучение практически всех жизненных
процессов.
25.
Методы, доступные для геномики и регистрации генетическихвариаций, включают секвенирование по Сэнгеру, ДНК-микрочипы
и секвенирование следующего поколения (NGS). В настоящее
время секвенирование в основном выполняется на платформах
NGS, которые используют массовое параллельное секвенирование
для секвенирования миллионов фрагментов ДНК из одного
образца за раз.
Существует несколько платформ NGS, которые обеспечивают
недорогое высокопроизводительное секвенирование, которое
включает подготовку образца / библиотеки, секвенирование /
визуализацию и анализ данных. Оно включает в себя различные
методы с аналогичной базовой методологией, но с разными
целями, например: NextSeq, NovaSeq, iSeq, MiSeq, MiniSeq, Hi-Seq,
ChIP-Seq, RNA-Seq, MeDIP-Seq и др.
26.
Эпигеномика - изучение наследственных изменений, отличных отзакодированных в последовательности ДНК. Включает в себя любой
процесс, изменяющий генетическую активность без изменений в
ДНК, но приводит к наследственным модификациям.
Эпигенетика охватывает модификации ДНК или хроматина,
например, метилирование ДНК, модификация цитозина и
посттрансляционная модификация гистонов, которые играют важную
роль в регуляции активности транскрипции.
Метилирование ДНК контролирует важные клеточные процессы,
такие как эмбриогенез и канцерогенез.
27.
Для изучения эпигенетических изменений доступно несколько методов,таких как
иммунопреципитация метилированной ДНК с последующим
секвенированием (MeDIP-seq),
полногеномное бисульфитное секвенирование (WGBS) (включая MethylCseq и BS-seq),
бисульфитное секвенирование с пониженной репрезентативностью
(RRBS), и др., чтобы изучить закономерности метилирования генома.
Метод иммунопреципитации хроматина с последующим секвенирование
(ChIP-Seq) используется для построения графиков участков связывания
модификации хроматина и фактора транскрипции (TF) в геноме.
28.
Транскриптомика - включает изучение экспрессии РНК вопределенных тканях, на определенных стадиях развития или при
развитии заболевания. Позволяет получить информацию о клетках
и тканях, о специфической экспрессии гена, прогнозировать
изоформы белка с использованием альтернативного сплайсинга и
выполнять оценку генотипа по экспрессии генов локусов
количественных признаков экспрессии (eQTL).
29.
Различные методы включают секвенирование по Сэнгеру EST(экспрессируемые теги последовательностей) или библиотеки
кДНК, например серийных и Cap-анализ экспрессии генов (SAGE /
CAGE), ДНК-микрочипы и т.д.
Футпринтинг рибосом (химическое зондирование) (ribosome
footprinting), также известное как профилирование рибосом, или
Ribo-Seq, bkb ART-Seq (active mRNA translation sequencing) protected
by ribosome. Количественно измеряет фрагмент, занимаемый
рибосомой, и трансляцию, путем секвенирования фрагментов
мРНК защищенных рибосомой.
30.
Протеомика и интерактомикаПротеомика - это качественное и количественное исследование
протеома (полное набор всех экспрессируемых белков в клетке, ткани
или организме в данном контексте).
В дополнение к профилированию всех белков, протеомика также
включает изучение изоформы, модификации, их взаимодействия и
белковые комплексы
31.
Протеомные подходы включают разделение на гелевой основе:одномерный и двухмерный полиакриламид гель-электрофорез и
безгелевые высокопроизводительные технологии, включая
технологию многомерной идентификации белков и разделения с
использованием жидкостной хроматографии-масс-спектрометрии
(LC-MS).
Скорострельная (shotgun) протеомика включает в себя анализ
образцов путем экстракции, переваривания, жидкой
хроматографии с последующей тандемной масс-спектрометрией.
32.
Интерактомика занимается измерением взаимодействий междубелками, используя аффинную очистку-масс-спектрометрию (APMS), и как эти взаимодействия топологически организованы в сети.
Такие исследования были выполнены с использованием
дрожжевых двугибридных скринингов (Y2H screens) и родственных
анализов комплементации, AP-MS, подходов с близким
маркированием как BioID и APEX, cross-linking mass spectrometry
(XL-MS) и protein co-fractionation coupled to mass spectrometry
(CoFrac-MS).
33.
Протеогеномика объединяет геномные знания с новымибелковыми продуктами (альтернативные начальные / конечные
сайты, модификации, пептиды сплайс-соединений и варианты
аминокислот) для более глубокого понимания функционирования.
Отражение этих омических состояний наблюдается в метаболоме и
липидоме, которые управляются различными протеоформами для
регулирования клеточного метаболизма в здоровом состоянии и
болезни.
34.
Метаболомика (от англ. metabolomics, греч. metabolism + -omics «полный, целый, весь») - научная область, изучающаясовокупность всех исходных, промежуточных и конечных
продуктов метаболизма и их количественное содержание в
организме.
Из промежуточных и конечных продуктов метаболизма строятся
все клеточные субструктуры.
Метаболом - совокупность всех метаболитов (метаболический
профиль), являющихся продуктами обмена веществ в клетках,
тканях, органах и организме в целом. Термин введен по аналогии с
транскриптомикой и протеомикой.
35.
Транскриптомика (данные об экспрессии мРНК генов) ипротеомика (данные протеомного анализа) не раскрывают
полностью процессы, происходящие в клетке.
Протеомика связывает гены с их функционально разнообразными
белковыми продуктами.
36.
Метаболические профили метаболомики дают мгновенныйснимок составов, лежащих в основе физиологических процессов в
организме.
Соответственно, метаболомику можно рассматривать как раздел
молекулярной физиологии.
37.
В метаболомике для определения концентраций интермедиатовметаболизма применяют различные методы разделения и
идентификации химических веществ.
Цель определения концентраций интермедиатов - воссоздание
общей картины распределения потоков компонентов исходных
субстратов в продукты жизнедеятельности клеток.
38.
• Одна из проблем метаболомики обусловлена тем, что с химическойточки зрения многие интермедиаты метаболизма сходны по
строению, поэтому их сложно отделить друг от друга стандартными
физико-химическими методами. В организме в ходе метаболизма
эти сходные соединения, как правило, опознаются ферментами и
могут иметь различное значение для жизнедеятельности клетки.
• Еще одна принципиальная проблема метаболомики связана с тем,
что время жизни многих интермедиатов в клетке очень мало (эти
вещества химически нестабильны в клеточных экстрактах), а их
содержание в клетке очень сильно зависит от условий, в которых
протекает жизнедеятельность организма.
39.
Вместе с другими хорошо разработанными «-омик»-технологиями(геномикой, протеомикой и др.) метаболомика вносит существенный
вклад в детальное понимание функций экспрессии гена in vivo,
результатов биохимического анализа, регуляторных сетей и более
строгое математическое описание и моделирование функционирования
биологических клеток в системной биологии. В результате становится
возможным создавать модели состояний организма на основе данных
биотрансформации и ферментативных методик.
Кроме того, возможность связать данные геномики и протеомики и
определить время исследования различных физиологических
состояний.
40.
Сетевая биология нормального и аномального фенотипапозволяет проводить прогнозирующую, профилактическую,
персонализированную и совместную медицину (P4) (концепция
«медицина P4» (Predictive, Preventative (based on predictive risk),
Personalised and Participatory).
Важно интегрировать данные мультиомики (геномики,
транскриптомики, протеомики, метаболомики, липидомики и т. д.)
для того, чтобы достичь цели медицины P4
Подходы или методы (integration of multi-omics datasets) можно в
значительной степени разделить на: сетевые, байесовские,
слияния, на основе подобия, корреляционные и другие
многомерные методы
DOI: 10.1016/bs.apcsb.2021.03.006
41.
Генетические регуляторные сетиКлетки постоянно регулируют уровень экспрессии генов.
Один из центральных механизмов в этом регуляторном процессе
включает контроль транскрипции, который осуществляется белками,
известными как факторы транскрипции (TFs), которые локализуют и
связывают короткие последовательности ДНК в промоторных или
энхансерных участках регулируемых генов.
Один фактор транскрипции может регулировать экспрессию либо
нескольких, либо множества генов в геноме,
экспрессия одного гена может регулироваться более чем одним
фактором транскрипции; различные факторы транскрипции также могут
регулировать активность друг друга.
42.
Современные методы исследования, например, использованиемикрочипов (microarrays) и связанных с ними инструментов
анализа данных, таких как кластеризация, позволили
исследователям найти наборы генов или модулей, которые
коэкспрессируются (в том числе, стимуляция и угнетение), когда
организм подвергается воздействию различных внешних условий,
и, таким образом, вероятно, регулируются одним и тем же
набором факторов транскрипции.
43.
• Анализы иммунопреципитации хроматина (Chromatinimmunoprecipitation assays, ChIP) сделали возможным прямой
скрининг на короткие сегменты ДНК, которые связывают
известные TF; затем с помощью технологии микрочипов можно
найти межгенные области, к которым принадлежат эти сегменты,
и, следовательно, найти регулируемые гены.
44.
Эти высокопроизводительные экспериментальные подходы всочетании с традиционной молекулярной биологией дополняются
анализом последовательностей и соответствующими
математическими инструментами.
45.
Генная регуляция - это динамический процесс, состоящий из рядаэтапов, например связывания ТФ с ДНК, привлечения
транскрипционного аппарата и производства информационной РНК,
посттранскрипционной регуляции, сплайсинга и транспорта мРНК,
трансляции, созревания и возможной локализации белков.
46.
Сети белок-белкового взаимодействияПосле синтеза белки часто собираются в комплексы посредством
прямых контактных взаимодействий, и эти комплексы являются
функционально активными единицами, участвующими в передаче
сигналов и других реакциях.
47.
Высокопроизводительные методы, такие как дрожжевойдвугибриный скрининг или масс-спектрометрия, позволяют
получить данные все более высокого качества о межбелковых
взаимодействиях или «интерактоме».
48.
Метаболические сетиПостроение и анализ метаболических сетей организует информацию
об анаболических и катаболических реакциях между ферментами, их
субстратами и кофакторами (такими как АТФ).
49.
Сигнальные сетиСигнальные сети состоят из рецепторов и сигнальных белков, которые
интегрируют, передают и направляют информацию посредством химических
преобразований компонентов сети.
Одним из классов таких трансформаций, например, являются
посттрансляционные модификации, в которых мишени фосфорилируются,
метилируются, ацетилируются, по определенным остаткам, что приводит к
изменению их ферментативной (и, следовательно, сигнальной) активности.
С другой стороны, белки могут образовывать стабильные комплексы или
диссоциировать.
Способность клеток модифицировать или маркировать белки (возможно, по
нескольким остаткам) может значительно увеличить способность клетки
кодировать свое состояние и передавать информацию, при условии, что
сигнальные белки высокоспецифичны не только по идентичности, но и по
состоянию модификации своих мишеней.
50.
Сигнальные сети часто учитываются в путях, которые имеютопределенные входы, такие как лиганды рецепторов, связанных с Gбелком на поверхности клетки, и специфические выходы, как пути,
которые связаны с аппаратом регуляции транскрипции или с
изменениями внутриклеточной концентрации мессенджеров, такие
как кальций или циклические нуклеотиды.
Узлы в сигнальных сетях могут участвовать в нескольких путях
одновременно, тем самым обеспечивая интеграцию сигналов или
потенциально вызывая повреждающие «перекрестные помехи»
между путями; как соединения и узлы обрабатывают сигналы –
является областью активных исследований.
51.
Ab-чипы (Ab-chips) локализуют различные сигнальные белки на чипах,напоминающих микрочипы ДНК, и окрашивают их соответствующими
флуоресцентными антителами. Многоцветная проточная цитометрия
выполняется на клетках, иммуноокрашенных на предмет
модификаций сигнального белка, и собираются сотни одновременных
измерений состояния модификации узлов пути на одной клетке.
Косвенный вывод о сигнальных путях также возможен из геномных
или протеомных данных.
Одной из хорошо изученных систем передачи сигналов является каскад митоген-активируемой протеинкиназы
(MAPK), который контролирует, помимо других функций, пролиферацию и дифференцировку клеток. Поскольку
эта система присутствует во всех эукариотах, а ее структурные компоненты используются множеством путей, она
была выбрана в качестве парадигмы для изучения специфичности и перекрестных помех.
Chang L, Karin M (2001) Mammalian map kinase signalling cascades. Nature 410(6824):37–40
52.
Система TOR, первоначально идентифицированная у дрожжей, отвечает за интеграцию информации о доступностипитательных веществ, факторах роста и энергетическом статусе клетки и, соответственно, регулирует рост клеток.
Martin DE, Hall MN (2005) The expanding tor signaling network. Curr Opin Cell Biol 17(2):158–66
53.
Другой интересный пример интеграции сигналов, также внутри- и межклеточной коммуникации наблюдается в цепивосприятия кворума бактерии Vibrio harveyi, где различные виды специфичных для вида и рода сигнальных молекул
обнаруживаются их родственными рецепторами на поверхности клетки, и информация подается в общий путь фосфореле
Lux, который в конечном итоге регулирует гены восприятия кворума.
Waters CM, Bassler BL (2005) Quorum sensing: cell-to-cell communication in bacteria. Annu Rev Cell Dev Biol 21: 319–46

















































 Биология
Биология








