Похожие презентации:
Введение в протеомику. Методы протеомики. Занятие 10
1.
Занятие №10. Введение впротеомику. Методы протеомики
2.
Ограничения геномикиГеномика – предоставляет очень большой объём информации
о живых существах, однако есть задачи, для которых одной
информации о последовательности нуклеотидов в геноме
недостаточно:
1.
Определение
особенностей
посттранскрипционной
регуляции и посттрансляционных модификаций белковых
молекул;
2.
Определение
функциональной
активности
клетки/ткани/органа (уровни транскрипции и экспрессии
генов);
3.
Определение
характера
межмолекулярных
взаимодействий;
4. Выявление различий в спектрах экспрессии для клеток
разных тканей (геном один, а фенотипы разные).
3.
Почему белки клетки/ткани нельзя получить“транслируя” результаты ДНК-секвенирования
потери информации могут привести к частичной или полной потере
белка
явление альтернативного сплайсинга
белковые гены могут перекрываться
не учитываются посттрансляционные модификации, существенные для
укладки и функционирования белка
всякий “белок”, полученный исходя из последовательности ДНК,
является
гипотетическим
объектом,
пока
не
доказано
его
существование
В то же время, результаты ДНК-секвенирования служат существенным
дополнением,
т.к.
трудоёмкий процесс.
секвенирование
белков
значительно
более
4.
Примеры посттрансляционных модификацийФосфорилирование – присоединение -PO4.
– механизм активации белков
– проведение клеточного сигнала
Ацетилирование – присоединения CH3CO-.
Фарнезилирование (частный случай липидирования) –
присоединение
гидрофобной
молекулы
липидной
природы – фарнезила.
– заякоривание в клеточной мембране
Гликозилирование
остатка.
–
присоединение
углеводного
5.
Омиксные технологии (Omics) – cовременныевысокопроизводительные методы изучения
биомолекул
I. ДНК – Геномика (Genomics)
II. мРНК – Транскриптомика (Transcriptomics)
III. Протеины – Протеомика (Proteomics)
и сравнительно недавно:
IV. Липиды – Липидомика (Lipidomics)
V. Метаболиты – Метаболомика (Metabolomics)
6.
Протеомика и её задачиПротеомика (функциональная геномика) изучает
продукты экспрессии генов:
структура и свойства белковых молекул (включая
посттрансляционные модификации);
белковый спектр клеток в различных состояниях
(качественный и количественный состав);
белок-белковые взаимодействия
лиганд-белковые взаимодействия
7.
Разделы протеомики1. Структурная протеомика (экспрессионная протеомика)
первичная
структура
белков
(последовательность
аминокислот);
пространственная укладка в белковой молекуле
положение и характер посттрансляционных модификаций в
белковых молекулах
2.
Функциональная
протеомика
(протеомика
взаимодействий)
наличие и состав активных центров белка
взаимодействие
белковых
молекулами лигандов
молекул
между
собой
и
с
8.
Применение протеомики1. Фармакопротеомика – изучение активных центров
некоторых ферментов для разработки ЛС, специфически их
ингибирующих.
2. Сравнительное определение протеомов здоровых клеток
и при патологии – выявление молекулярных маркеров (или
паттернов) заболеваний.
3. Анализ посттрансляционных модификаций белков для
изучения внутриклеточных процессов в норме и патологии.
4. Количественный анализ протеома в разных тканях или
разные периоды времения – изучение биологических
процессов.
5. Идентификация некультивируемых видов прокариотов по
их протеомам.
6. Скрининг инфекционных заболеваний.
7. Анализ пищевых продуктов – оценка качества.
9.
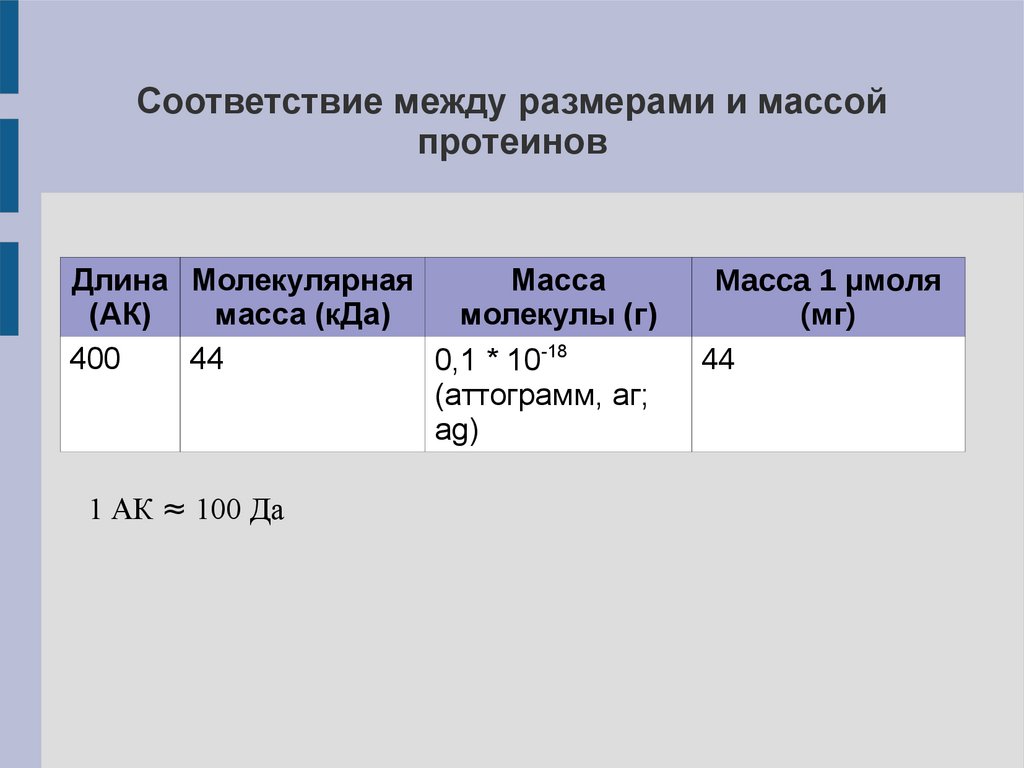
Соответствие между размерами и массойпротеинов
Длина Молекулярная
Масса
(АК)
масса (кДа)
молекулы (г)
400
44
0,1 * 10-18
(аттограмм, аг;
ag)
1 АК ≈ 100 Да
Масса 1 μмоля
(мг)
44
10.
Этапы протеомного (структурного) исследования1. Выделение белков (экстракция)
2. Разделение/очистка (фракционирование) белков
3а.
Исследование
3D-структуры
белка
спектроскопическими методами
и/или
3б. Фрагментация исследуемого белка, определение
первичной структуры белковых фрагментов
5. Анализ данных
11.
Методы выделения белков1. Гомогенизация образца
механическое растирание (с жидким азотом; с абразивом;
в гомогенизаторе)
2. Лизис клеток
химическое растворение (SDS, толуол, меркаптоэтанол)
ферменты (лизоцим)
вибрационный способ (шаровая мельница, ультразвуковая
дезинтерграция)
3. Удаление примесей
центрифугирование
ДНКазы, РНКазы
поливинилпирролидон (сорбирует клеточные фенолы)
4. Экстракция буфером (TE)
12.
Определение концентрации белкаОсуществляется спектрофотометрически:
1). Поглощение УФ (λ=280нм).
2). Поглощение света комплексом белок-краситель (напр.,
для красителя кумасси бриллиантового синего – λ=595нм,
оранжевый цвет).
13.
Методы разделения/очистки пептидовРазделение белков и пептидов (фракционирование):
1. Хроматография (высокоэффективная жидкостная)
2. ПААГ-электрофорез (полиакриламидный гель; PAGE)
Очистка белков:
3. Диализ
14.
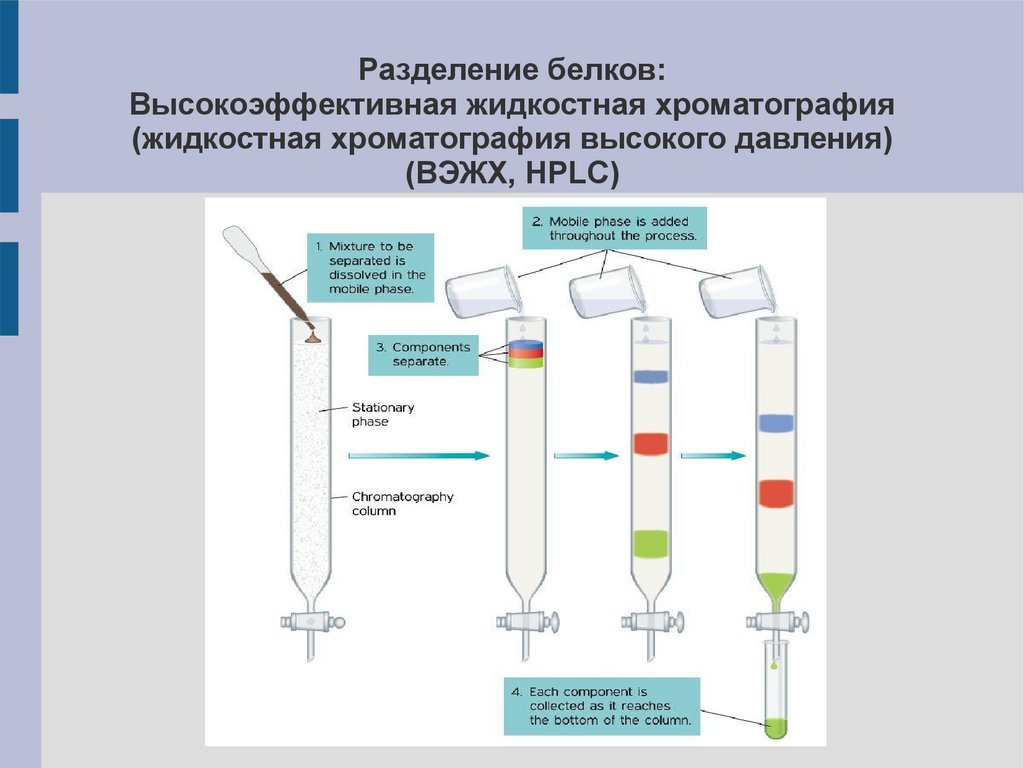
Разделение белков:Высокоэффективная жидкостная хроматография
(жидкостная хроматография высокого давления)
(ВЭЖХ, HPLC)
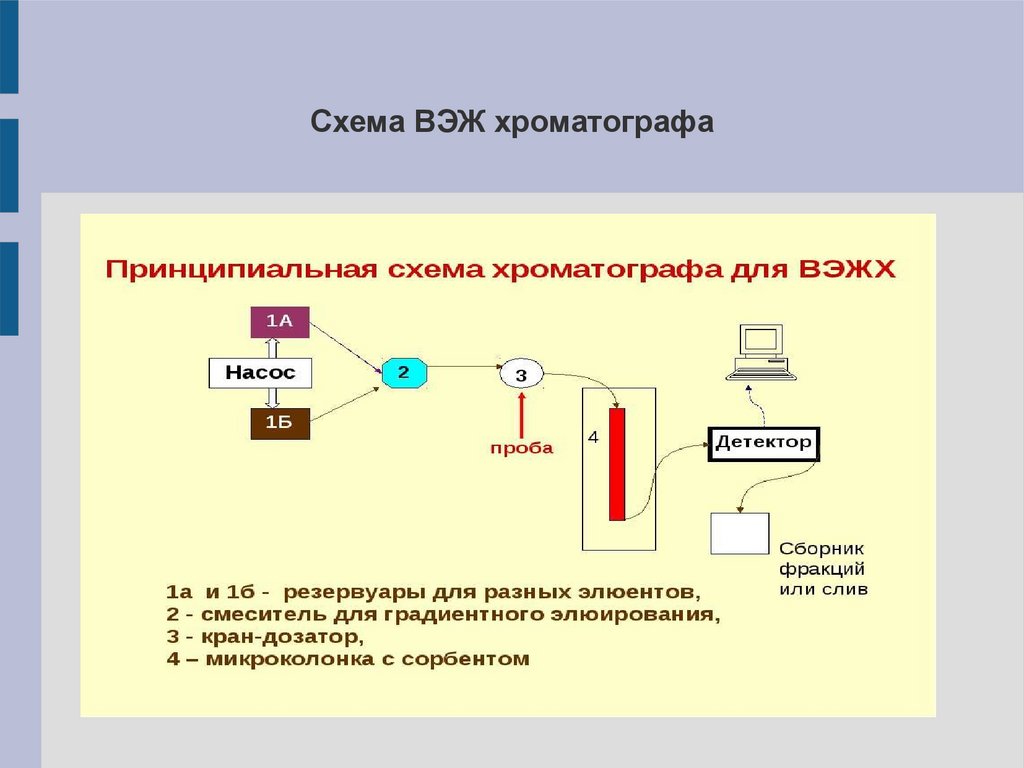
15.
Схема ВЭЖ хроматографа16.
Хроматограф17.
Электрофорез в ПААГБывает двух видов:
1). Электрофорез нативных молекул
не затрагивается функциональность молекул
фракционирование
неполное:
разные
по
молекулы могут не разделяться
2). Электрофорез в денатурирующих условиях
разделение более полное: строго по массам
а). Одномерный (1D-PAGE)
б). Двумерный (2D-PAGE)
массам
18.
Одномерный гель-электрофорез (денатурирующийSDS-PAGE)
19.
Результаты 1D-SDS-PAGE20.
Двумерный гель-электрофорез: этапы1. Первое разделение молекул – по электрическому заряду.
Градиентный
гель-электрофорез
в
пластинках
с
иммобилизованным градиентом pH (IPG) – изоэлектрическое
фокусирование (ИЭФ, IEF).
2. Последующее разделение молекул – по массе.
Денатурирующий
SDS-PAGE
перпендикулярном первому разделению.
в
направлении,
21.
Двумерный гель-электрофорез (2D-PAGE)22.
Результаты 2D PAGE23.
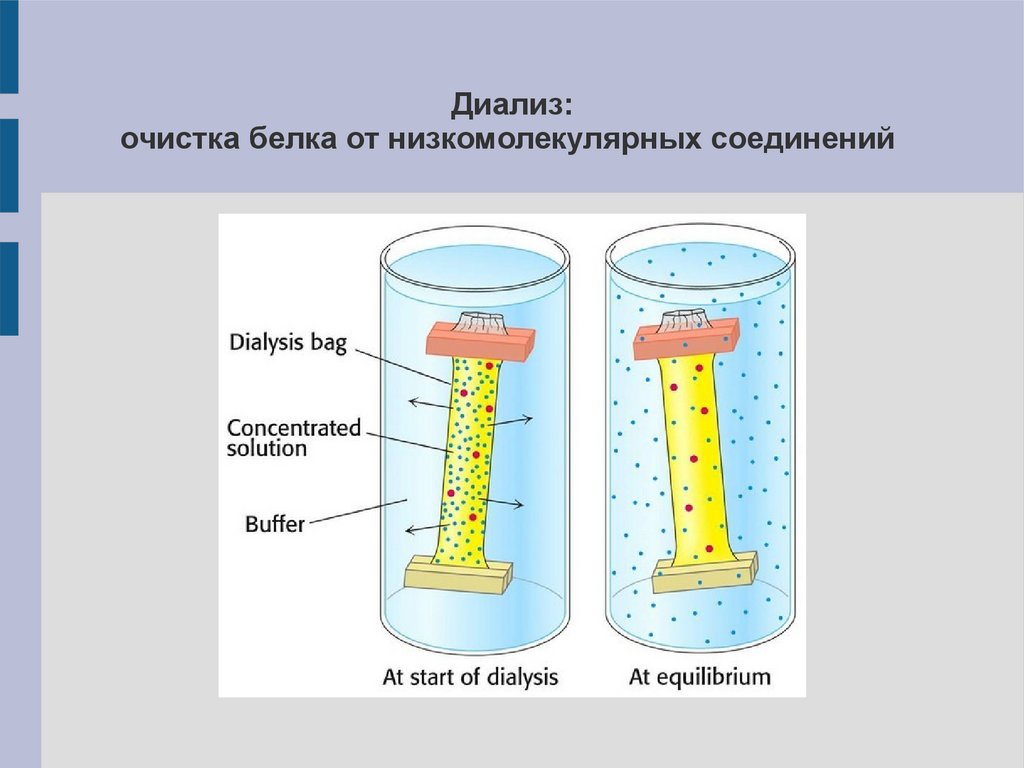
Диализ:очистка белка от низкомолекулярных соединений
24.
Методы изучения структуры белков1.
Изучение
укладки
дифракционный анализ):
рентгеноструктурный анализ
спектроскопические
методы
спектроскопия)
белков
(спектроскопия,
(ИК-спектроскопия,
ЯМР-
2. Изучение первичной структуры белков (секвенирование):
химические методы (метод Эдмана, пептидазный метод)
масс-спектрометрия, хромато-масс-спектрометрия
3.
Изучение
белок-белковых
взаимодействий (интерактомика):
двугибридные клеточные системы
белковые биочипы
аффинная хроматография
и
белок-лигандный
25.
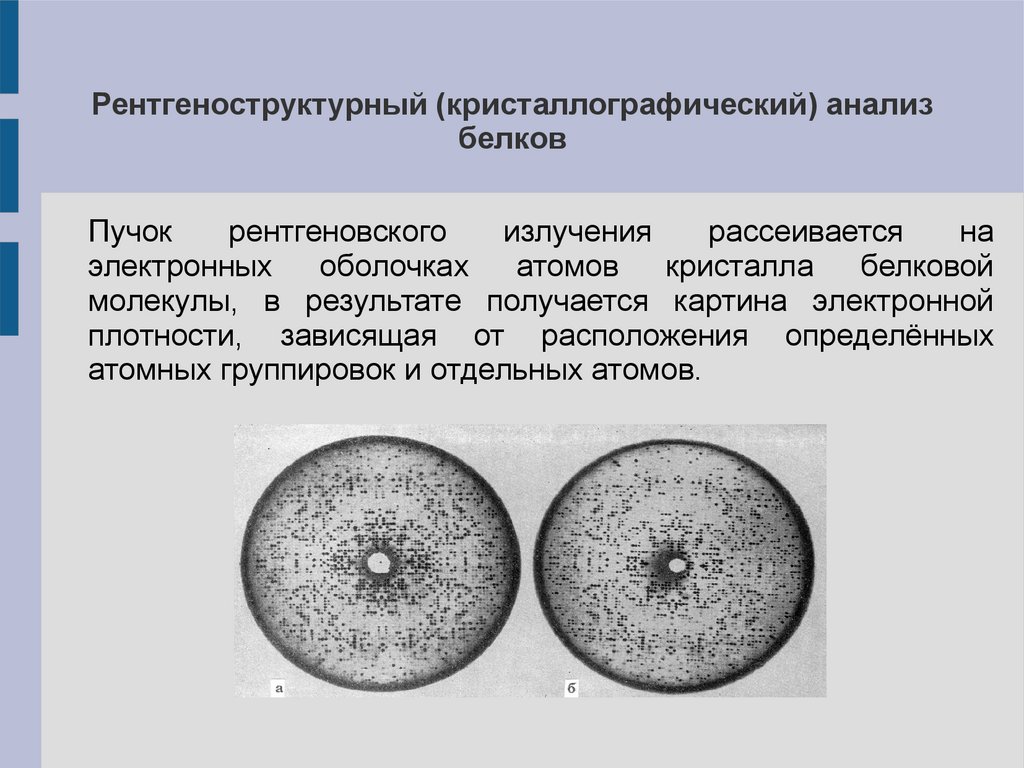
Рентгеноструктурный (кристаллографический) анализбелков
Пучок
рентгеновского
излучения
рассеивается
на
электронных
оболочках
атомов
кристалла
белковой
молекулы, в результате получается картина электронной
плотности, зависящая от расположения определённых
атомных группировок и отдельных атомов.
26.
Спектроскопические методыЧерез вещество (белок) пропускают ЭМИ определённой
области спектра, при которой составные части молекул
этого
вещества
(атомы,
атомные
группировки,
химические связи между ними) входят в резонанс
(возбуждённое
состояние)
и
поглощают
ЭМИ.
Поглощение происходит по определённым частотам,
спектр
которых
внутримолекулярную
уникально
отражает
структуру
вещества
(“фингерпринт”, “отпечатки пальцев”). В ряде случаев
измеряют спектр испускаемого веществом ЭМИ.
27.
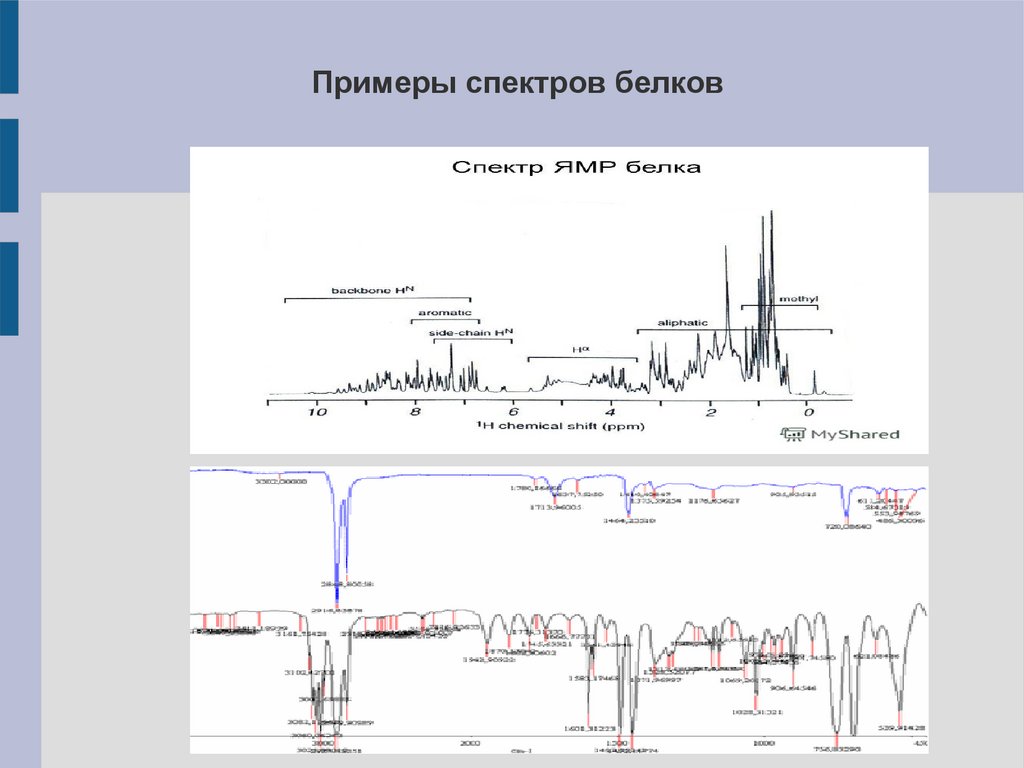
Примеры спектров белков28.
Инфракрасная (колебательная) спектроскопия белковИсточник резонанса: колебания атомов и их групп
около химических связей (изменения длин связей и/или
углов между связями)
Область поглощения: ИК-излучение (λ: 2 мкм – 3мм)
29.
ЯМР-спектроскопия для определения структуры белковИсточник резонанса: атомы, содержащие нечётное
число протонов (в т.ч. ядро атома водорода) в магнитном
поле меняют свой магнитный момент
Область поглощения: радиоволны (λ: 1-10 м)
Преимущества: по сравнению с ИК-спектроскопией
позволяет изучать динамические изменения в белках























 Биология
Биология








