Похожие презентации:
Биологическое окисление -2 (лекция № 5)
1. ЛЕКЦИЯ № 5
ФГБОУ ВО УГМУ Минздрава РоссииКафедра биохимии
Дисциплина: Биохимия
ЛЕКЦИЯ № 5
Биологическое окисление-2:
Оксигеназные, пероксидазные
и радикальные пути
использования кислорода
Лектор: Гаврилов И.В.
Факультет: лечебно-профилактический,
Курс: 2
Екатеринбург, 2017г
2. план
1. Оксигеназные реакции• Монооксигеназные реакции
• Диоксигеназные реакции.
2. Радикальные и пероксидазные
реакции
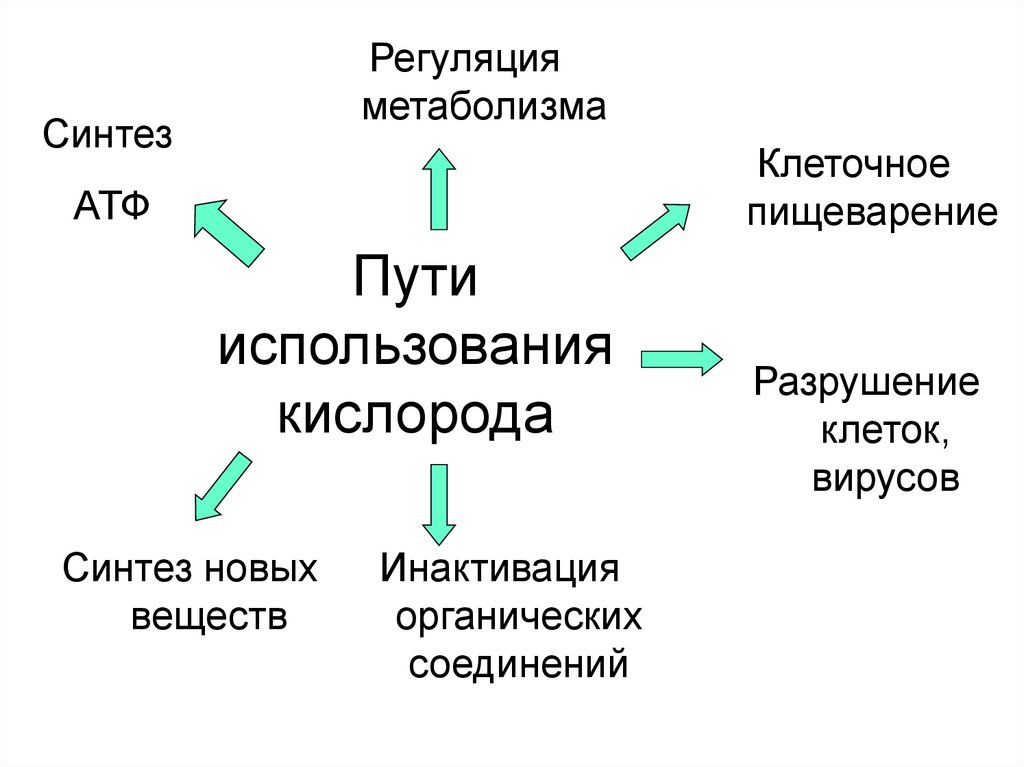
3. Пути использования кислорода
Регуляцияметаболизма
Синтез
Клеточное
пищеварение
АТФ
Пути
использования
кислорода
Синтез новых
веществ
Инактивация
органических
соединений
Разрушение
клеток,
вирусов
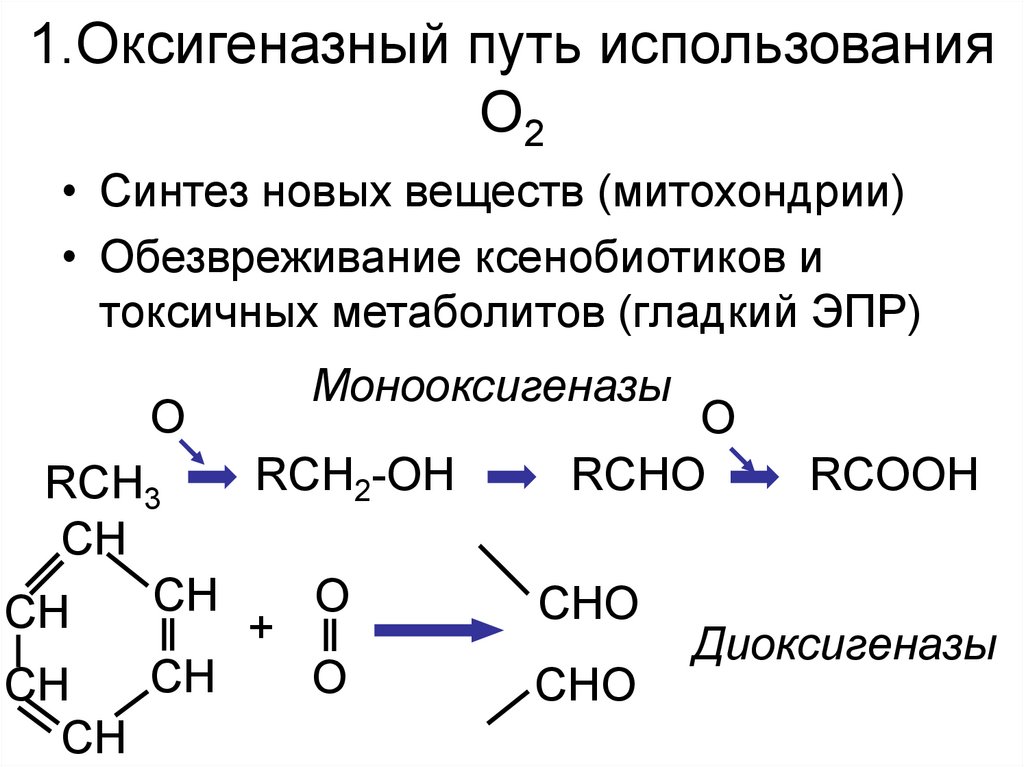
4. 1.Оксигеназный путь использования О2
• Синтез новых веществ (митохондрии)• Обезвреживание ксенобиотиков и
токсичных метаболитов (гладкий ЭПР)
O
Монооксигеназы
RCH2-OH
RCH3
CH
CH
O
CH
+
CH
O
CH
CH
O
RCHO
CHO
CHO
RCOOH
Диоксигеназы
5. Ксенобиотики – чужеродные для организма вещества, которые он не может использовать для собственных нужд.
Токсичные метаболиты – вещества, участвующие вметаболизме и токсичные в высоких концентрациях.
• Некоторые карбоновые кислоты (фенилаланин,
тирозин, гомогентизиновая кислота, 5-АЛК)
• Альдегиды (муравьиный, уксусный и т.д)
• Кетоны (кетоновые тела)
• Билирубин
• и т.д.
Ксенобиотики – чужеродные для организма вещества,
которые он не может использовать для собственных нужд.
1. Полезные – лекарства-антибиотики;
2. Безвредные – некоторые газы (азот, гелий и т.д);
3. Вредные – неорганические и органические вещества
6.
Классификация загрязнителей продовольственногосырья и продуктов питания:
1. химические элементы (ртуть, свинец, кадмий, др.);
2. радионуклиды;
3. Пестициды;
4. нитраты, нитриты и нитрозосоединения;
5. вещества, применяемые в животноводстве;
6. полициклические ароматические и хлорсодержащие
углеводороды;
7. диоксины и диоксинподобные вещества;
8. метаболиты микроорганизмов.
7. Биотрансформация
Биотрансформация (Bios - жизнь, transformatio превращение, видоизменение) - совокупностьхимических превращений ксенобиотиков (xenos чужой, bios - жизнь), и токсичных метаболитов в
организме, подготавливающих их выведение.
Значение биотрансформации:
перевод ксенобиотиков в полярные водорастворимые
соединения, которые выводятся из организма. Как
правило, происходит снижение токсичности.
8. Локализация биотрансформации
90-95% всех чужеродныхлипофильных веществ подвергается
биотрансформации в гладком
эндоплазматическом ретикулуме
клеток печени.
5-10% инактивируется в кишечнике,
почках, легких, коже, плазме.
9. Виды биотрансформации
Метаболическаятрансформация
Конъюгация
Реакции присоединения к
Реакции - окисления
ксенобиотикам
химических
- восстановления
групп:
- гидролиза
- метилирование
образуются функциональные - ацетилирование
группы -ОН, -СООН, -NH2, - сульфатирование
SH и др.
- глюкуронирование и др.
Окисление идет с участием
Образуются гидрофильные
монооксигеназной системы
малотоксичные конъюгаты,
ЭПР.
которые легко выводятся.
Увеличивается
растворимость в воде и как
правило снижается
токсичность
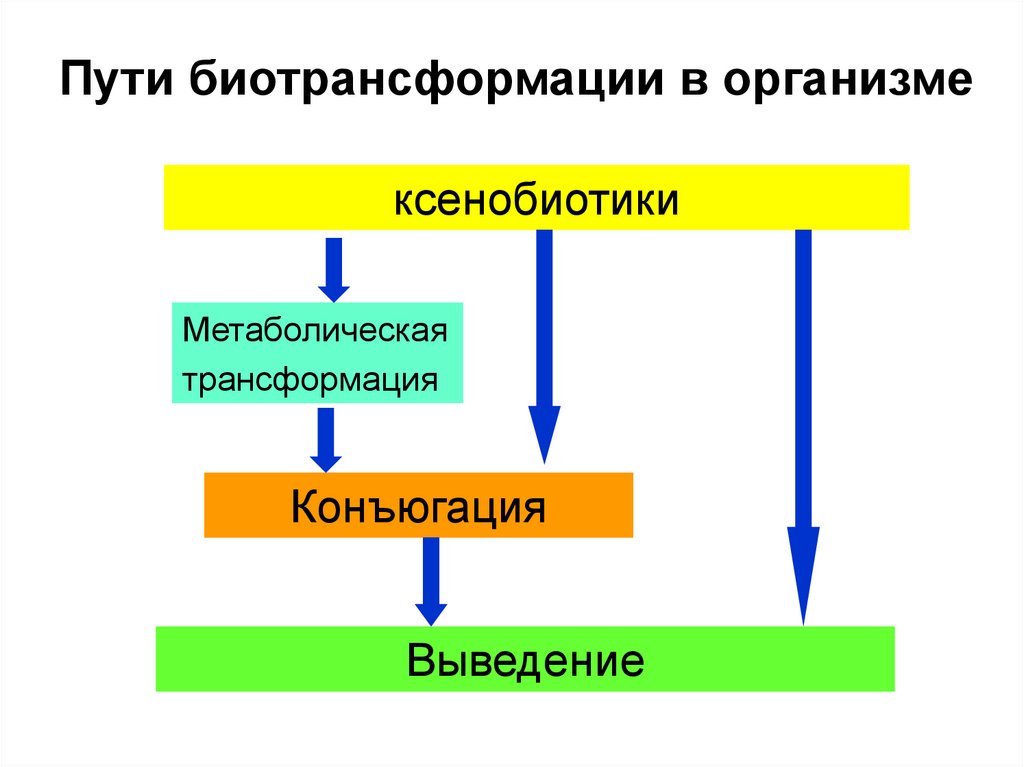
10. Пути биотрансформации в организме
ксенобиотикиМетаболическая
трансформация
Конъюгация
Выведение
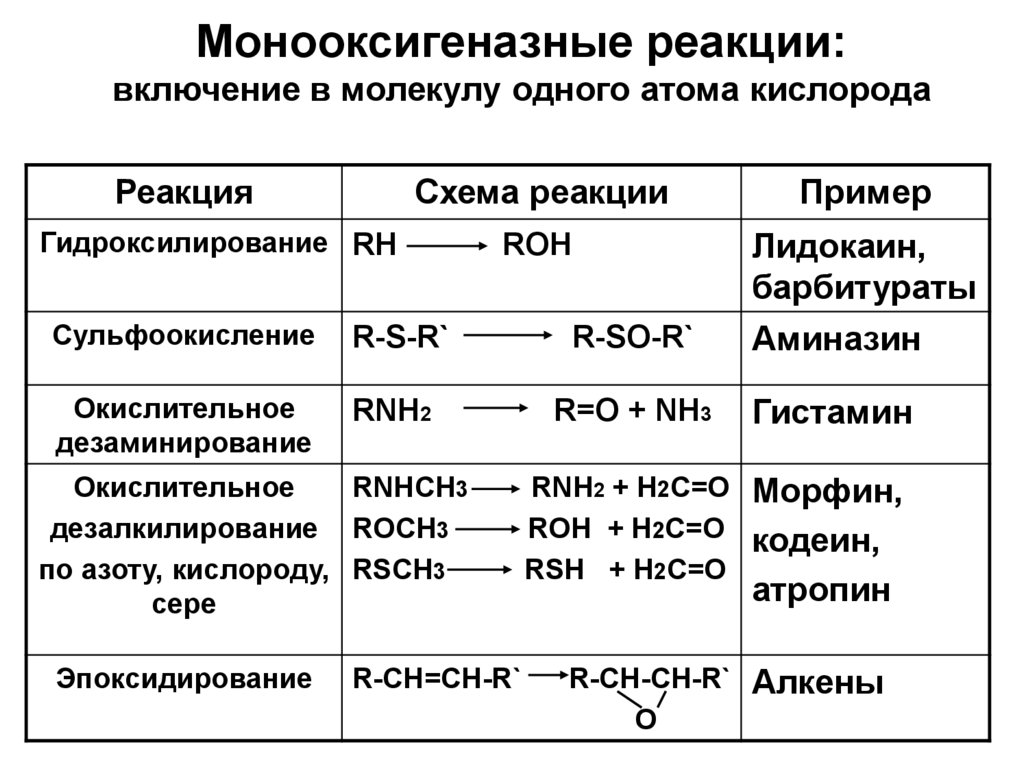
11. Монооксигеназные реакции: включение в молекулу одного атома кислорода
РеакцияСхема реакции
Пример
ROH
Гидроксилирование RH
Сульфоокисление
R-S-R`
R-SO-R`
Лидокаин,
барбитураты
Аминазин
Окислительное
дезаминирование
RNH2
R=O + NH3
Гистамин
Окислительное
RNHCH3
дезалкилирование ROCH3
по азоту, кислороду, RSCH3
сере
Эпоксидирование
R-CH=CH-R`
RNH2 + H2C=O Морфин,
ROH + H2C=O кодеин,
RSH + H2C=O
атропин
R-CH-CH-R` Алкены
O
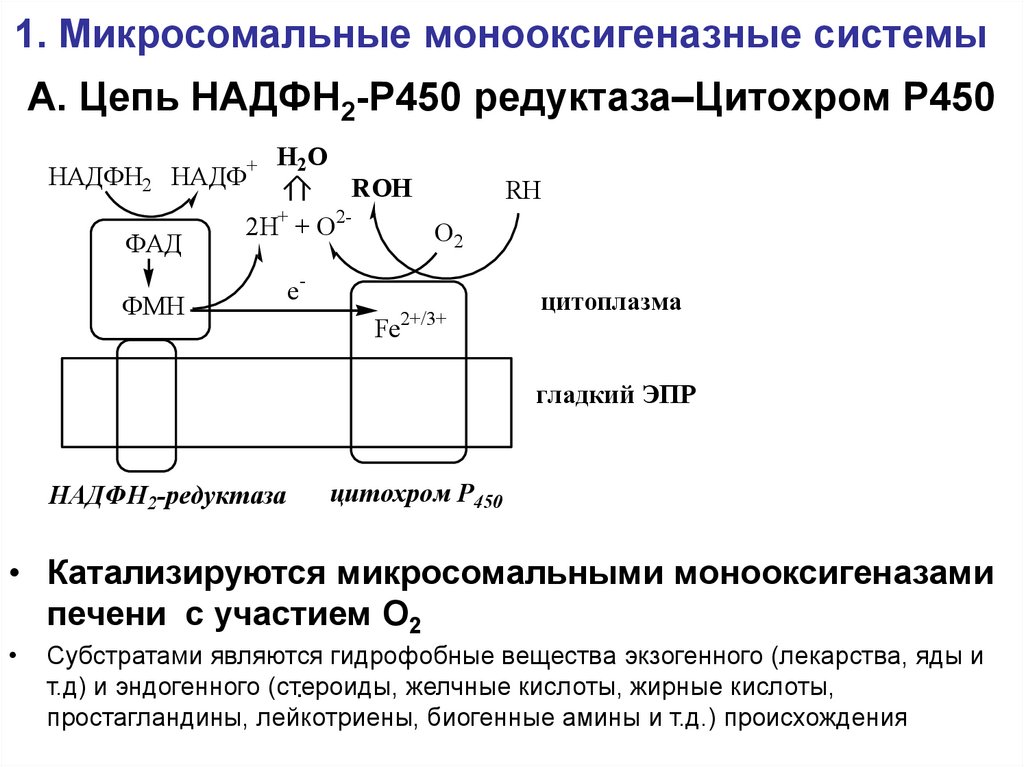
12. А. Цепь НАДФН2-Р450 редуктаза–Цитохром Р450
1. Микросомальные монооксигеназные системыА. Цепь НАДФН2-Р450 редуктаза–Цитохром Р450
НАДФН2 НАДФ+
ФАД
Н 2О
ROH
2Н+ + О2-
ФМН
RH
О2
eFe
2+/3+
цитоплазма
гладкий ЭПР
НАДФН2-редуктаза
цитохром Р450
• Катализируются микросомальными монооксигеназами
печени с участием О2
Субстратами являются гидрофобные вещества экзогенного (лекарства, яды и
т.д) и эндогенного (стероиды,
желчные кислоты, жирные кислоты,
.
простагландины, лейкотриены, биогенные амины и т.д.) происхождения
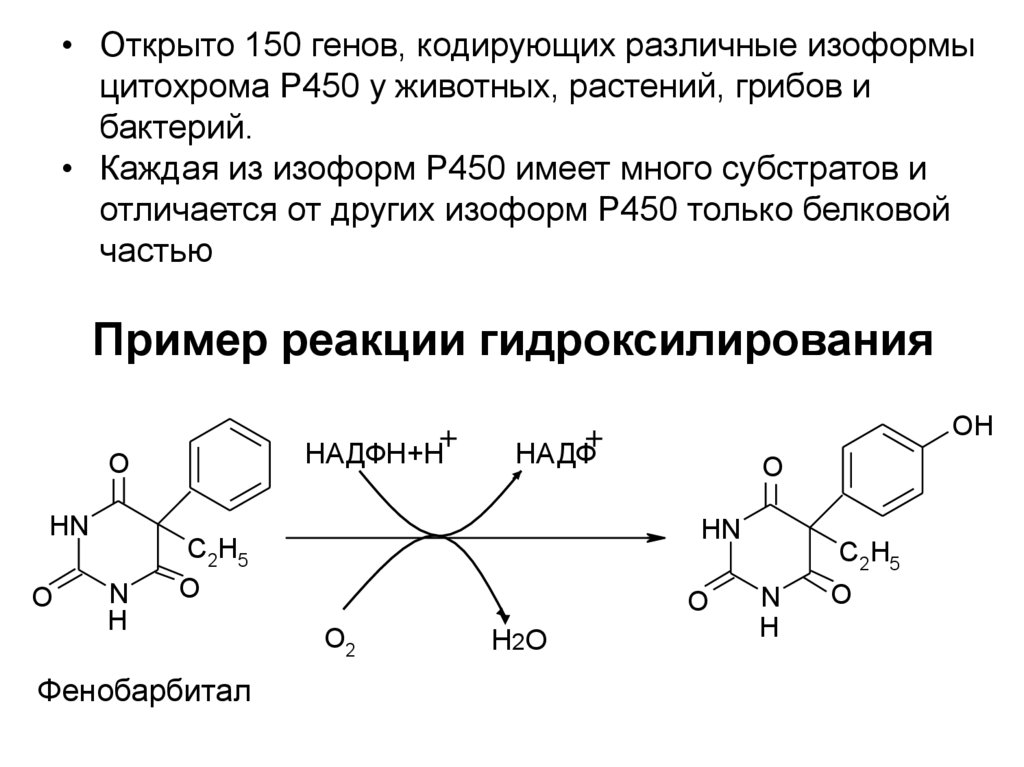
13. Пример реакции гидроксилирования
• Открыто 150 генов, кодирующих различные изоформыцитохрома Р450 у животных, растений, грибов и
бактерий.
• Каждая из изоформ Р450 имеет много субстратов и
отличается от других изоформ Р450 только белковой
частью
Пример реакции гидроксилирования
НАДФН+Н
O
HN
O
N
H
НАДФ
O
HN
C2H5
O
Фенобарбитал
OH
O
O2
Н 2О
C2H5
N
H
O
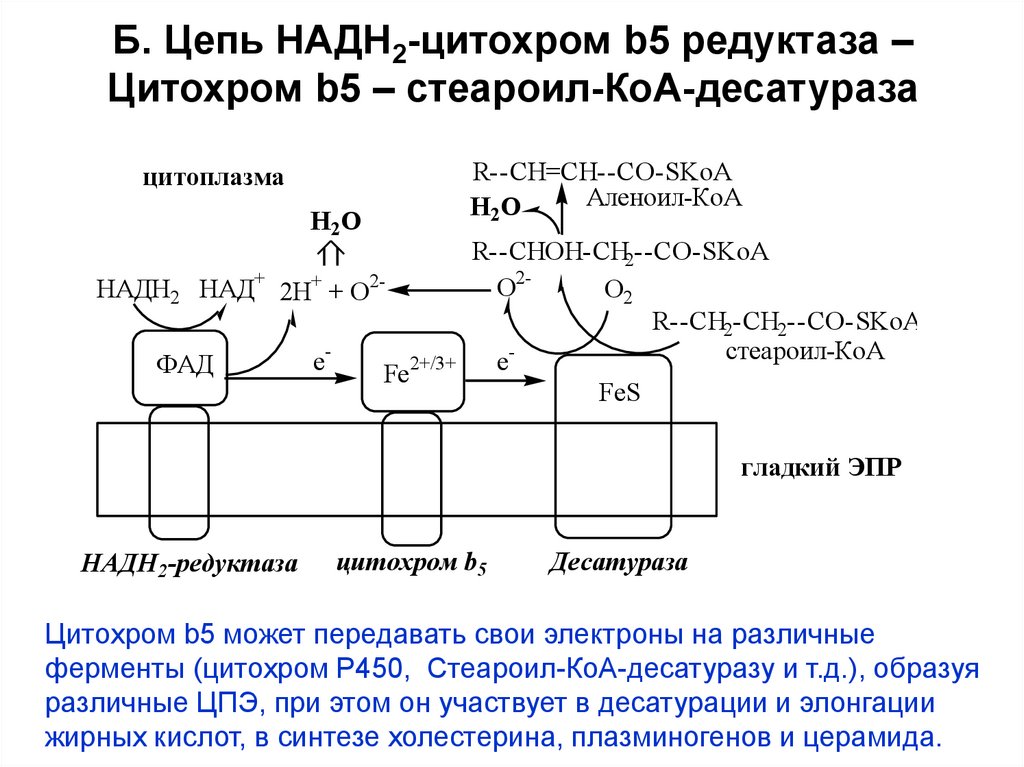
14. Б. Цепь НАДН2-цитохром b5 редуктаза – Цитохром b5 – стеароил-КоА-десатураза
R--CH=CH--CO-SKoAАленоил-КоА
Н2О
цитоплазма
Н2О
НАДН2 НАД+ 2Н+ + О2ФАД
e-
Fe
R--CHOH-CH2--CO-SKoA
О2О2
R--CH2-CH2--CO-SKoA
стеароил-КоА
2+/3+
eFeS
гладкий ЭПР
НАДН2-редуктаза
цитохром b5
Десатураза
Цитохром b5 может передавать свои электроны на различные
ферменты (цитохром Р450, Стеароил-КоА-десатуразу и т.д.), образуя
различные ЦПЭ, при этом он участвует в десатурации и элонгации
жирных кислот, в синтезе холестерина, плазминогенов и церамида.
15. Биологическая роль микросомального окисления:
• Инактивация ксенобиотиков, т.е. уменьшение ихфармакологической активности и токсичности.
• Повышение
активности
ксенобиотиков
(пролекарства).
• Образование
токсичных
метаболитов
–
«летальный синтез».
Пример: метиловый спирт окисляется в
формальдегид
и
муравьиную
кислоту.
Хлороформ, средство для общего наркоза,
превращается в боевое отравляющее вещество
– фосген (CHCl3
Cl2C=O).
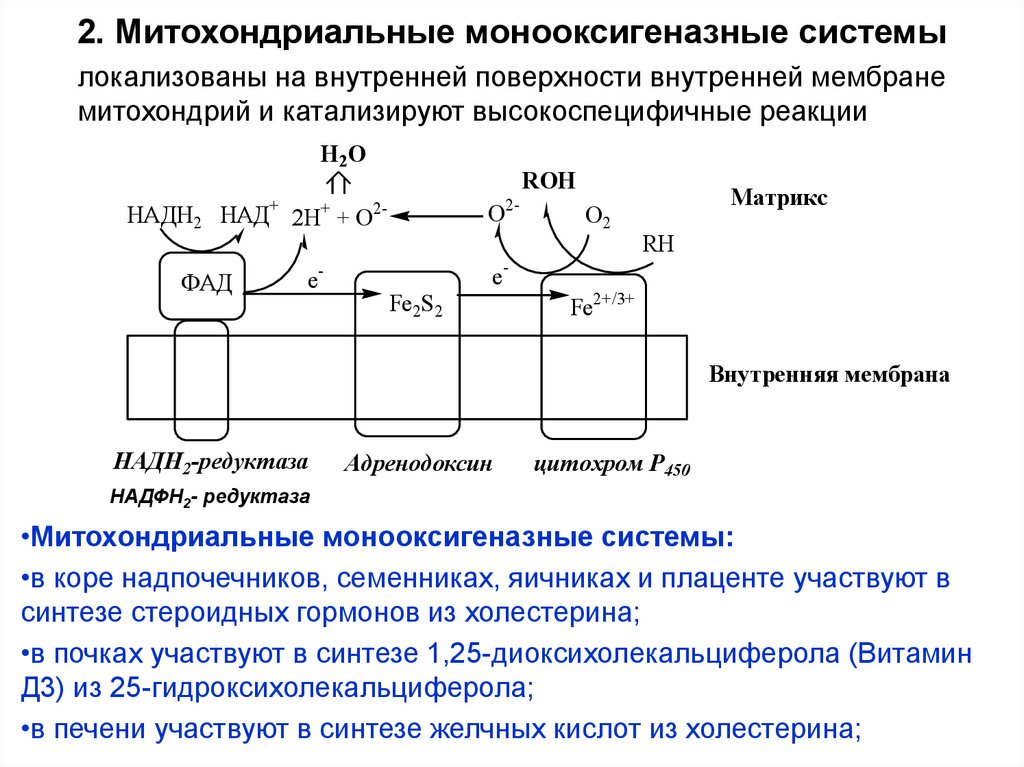
16. 2. Митохондриальные монооксигеназные системы
локализованы на внутренней поверхности внутренней мембранемитохондрий и катализируют высокоспецифичные реакции
Н2О
ROH
О2-
НАДН2 НАД+ 2Н+ + О2ФАД
e-
eFe2S2
О2
Матрикс
RH
Fe2+/3+
Внутренняя мембрана
НАДН2-редуктаза
Адренодоксин
цитохром P450
НАДФН2- редуктаза
•Митохондриальные монооксигеназные системы:
•в коре надпочечников, семенниках, яичниках и плаценте участвуют в
синтезе стероидных гормонов из холестерина;
•в почках участвуют в синтезе 1,25-диоксихолекальциферола (Витамин
Д3) из 25-гидроксихолекальциферола;
•в печени участвуют в синтезе желчных кислот из холестерина;
17. Факторы, влияющие на активность ферментов биотрансформации
Есть соединения, которые индуцируютскорость
синтеза
микросомальных
ферментов – барбитураты, спирты, кетоны,
стероиды, ароматические углеводороды.
Некоторые вещества угнетают активность
цитохрома Р450 и замедляют метаболизм
ксенобиотиков – фторотан, тетрациклин,
эритромицин,
эстрогены,
левомицетин,
биофлаваноиды сока грейпфрута.
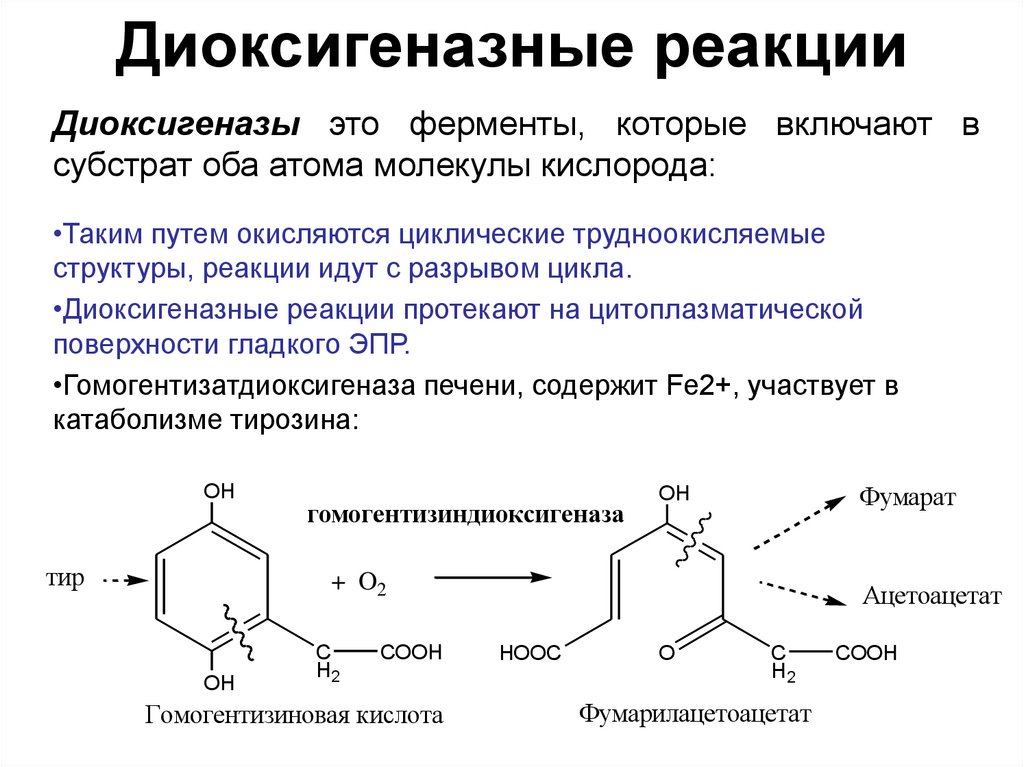
18. Диоксигеназные реакции
Диоксигеназы это ферменты, которые включают всубстрат оба атома молекулы кислорода:
•Таким путем окисляются циклические трудноокисляемые
структуры, реакции идут с разрывом цикла.
•Диоксигеназные реакции протекают на цитоплазматической
поверхности гладкого ЭПР.
•Гомогентизатдиоксигеназа печени, содержит Fe2+, участвует в
катаболизме тирозина:
OH
тир
гомогентизиндиоксигеназа
Фумарат
OH
+ O2
OH
C
H2
COOH
Гомогентизиновая кислота
Ацетоацетат
HOOC
O
C
H2
Фумарилацетоацетат
COOH
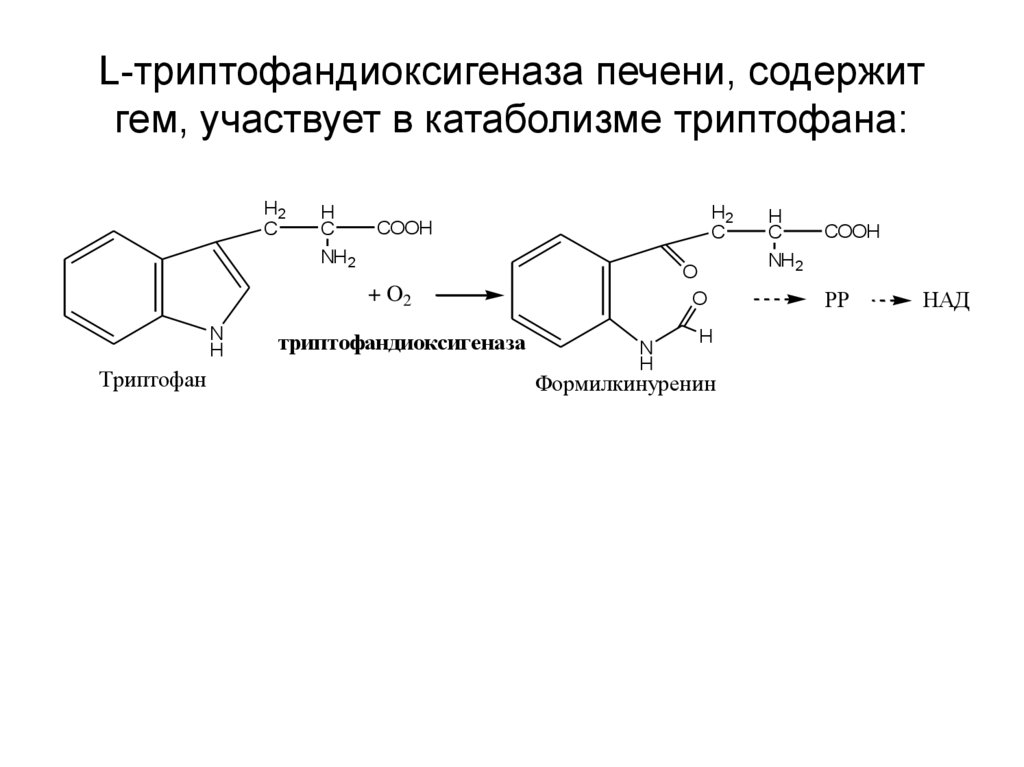
19. L-триптофандиоксигеназа печени, содержит гем, участвует в катаболизме триптофана:
H2C
H
C
NH2
H2
C
COOH
O
O
+ O2
N
H
Триптофан
триптофандиоксигеназа
N
H
H
Формилкинуренин
H
C
NH2
COOH
РР
НАД
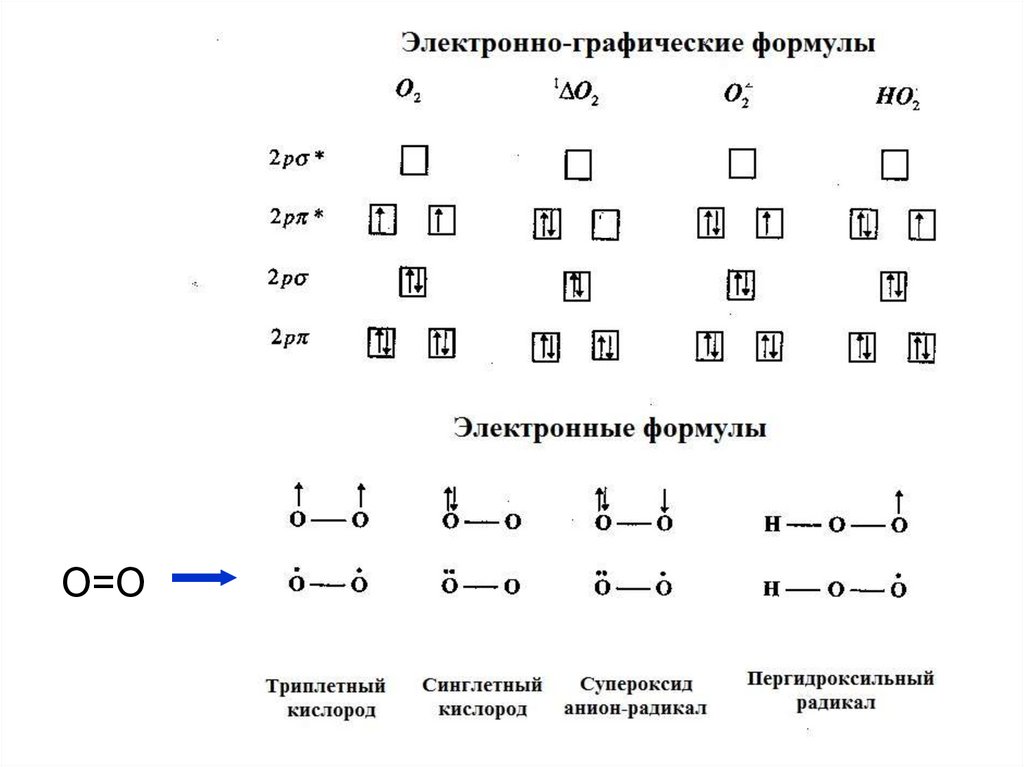
20. ПЕРОКСИДАЗНЫЙ И РАДИКАЛЬНЫЙ ПУТИ ИСПОЛЬЗОВАНИЯ КИСЛОРОДА
• Химические соединения, в составе которыхкислород
имеет
промежуточную
степень
окисления,
имеют
высокую
реакционную
способность
и
называются
активными
формами кислорода (АФК).
• К активным формам кислорода относятся
свободные радикалы кислорода и перекиси,
синглетный кислород.
• Свободный радикал - свободный атом или
частица с неспаренным электроном.
21. Образование АФК
Соединения О + высокая энергияАФК
Рентген
УФИ
Температура
Гомолитический разрыв связей под
действием высокой энергии (УФ-излучения,
рентген и др.). Пример, радиолиз воды с
образованием Н2; Н2О2 и свободных
радикалов: Н·, НО∙, О·. На солнце
фотостарение кожи.
22.
Основнаячасть
АФК
образуются
в
неферментативных
и
ферментативных
реакциях
в
результате
последовательного
присоединения е- к кислороду
Соединения О + е-
АФК
1. О2 + 1е- → О∙2 супероксидный анион-радикал (˙О::О:).
2. О∙2 +1е- → О2-2 пероксидный анион (:О::О:), он быстро
протонируется О2-2 + 2Н+ → Н2О2 (Н:О::О:Н)
3. Н2О2 + 1е- → НО∙ + ОН- гидроксильный радикал,
ОН- протонируется с образованием воды
ОН- + Н+ → Н2О
4. ОН∙ + 1е- → Н2О (Н:О:Н)
23.
О=О24. Неферментативные реакции образования АФК
•Электроны, необходимые для образования АФК могут давать:•1). Металлы переменной валентности.
•Hb(Fe2+) + O2 → MetHb(Fe3+) + О∙2
•H2O2 + Fe2+ → Fe3+ + HO- + HO· (реакция Фентона)
•HOCl + Fe2+ → Fe3+ + Cl- + HO· (реакция Осипова)
•2). Радикалы. АФК, обмениваясь е-, легко переходят друг в друга:
О∙2 + Н2О2 → О2 + НО∙ + ОН-
25. Ферментативные реакции образования АФК
1. В ЦОФ: Q + 1е- → НQ∙ (семихинон), при реоксигенацииишемических тканей он может взаимодействовать с
О2, образуя супероксидный анион-радикал: HQ· + O2
→ Q + О∙2 + H+;
2. в реакциях МСО е- с Р450 переходит на О2 с
образованием супероксидного анион-радикала,
который иногда теряется с активного центра.
3. Аэробные дегидрогеназы (ФАД-зависимые оксидазы)
переносят е- и Н+ с субстрата на О2 → Н2О2. Примеры:
оксидазы аминокислот, супероксиддисмутаза,
оксидазы пероксисом.
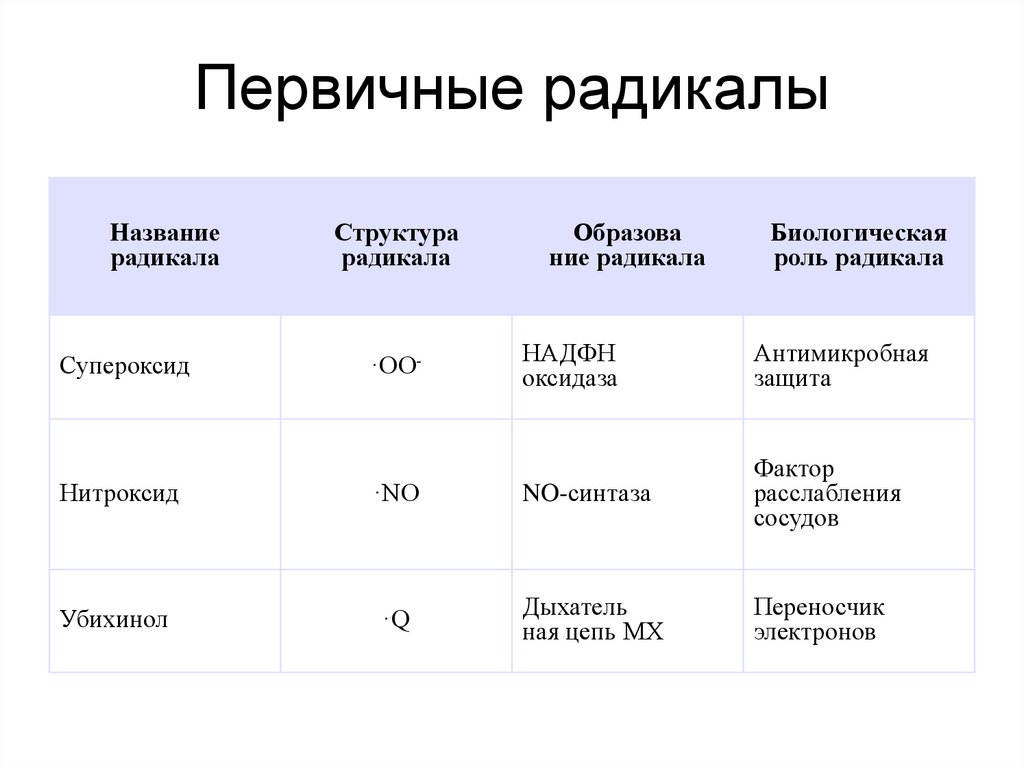
26. Первичные радикалы
Названиерадикала
Супероксид
Структура
радикала
·OO-
Образова
ние радикала
Биологическая
роль радикала
НАДФН
оксидаза
Антимикробная
защита
Нитроксид
·NO
NO-синтаза
Фактор
расслабления
сосудов
Убихинол
·Q
Дыхатель
ная цепь МХ
Переносчик
электронов
27. Вторичные радикалы
Названиерадикала
Структура
радикала
Образуется в реакции
Радикал
гидроксила
·OH
Fe2+ + HOOH → Fe3+ + HO- +·OH
Fe2+ + ClO- + H+ → Fe3+ +Cl - +
·OH
Липидные
радикалы
LO·
L·
LOO·
Fe2+ + LOOH → Fe3+ + HO- + LO·
LO· + LH → LOH + L·
L· + O2 → LOO·
28. Использование АФК в организме
1. Иммунная система. АФК используются фагоцитами тканевыми макрофагами, моноцитами и гранулоцитамикрови для разрушения бактерий, вирусов и онкоклеток.
Фагоциты с участием НАДФН2-оксидазы выделяют
супероксидный анион-радикал: НАДФН2 + 2O2 →
НАДФ+ + 2О∙2 + 2Н+
Супероксиддисмутаза (СОД) превращает супероксидный
радикал в перекись водорода: 2О∙2 + 2H+ → H2O2+ O2
Под действием миелопероксидазы H2O2, превращается в
гипохлорит – соединение, разрушающее стенки
бактериальных клеток: H2O2 + Cl- → H2O + ClO-.
2. Поддержание гомеостаза.
Эйказаноиды – медиаторы воспаления
3. Внутриклеточное пищеварение. В пероксисомах
образуются АФК. Когда пероксисомы сливаются с
фагосомами, АФК обеспечивают внутриклеточное
пищеварение.
29. Повреждающее действие АФК в организме
Радикалы гидроксила химически исключительно активныи вызывают повреждение
1. белков,
2. нуклеиновых кислот
3. и липидов биологических мембран.
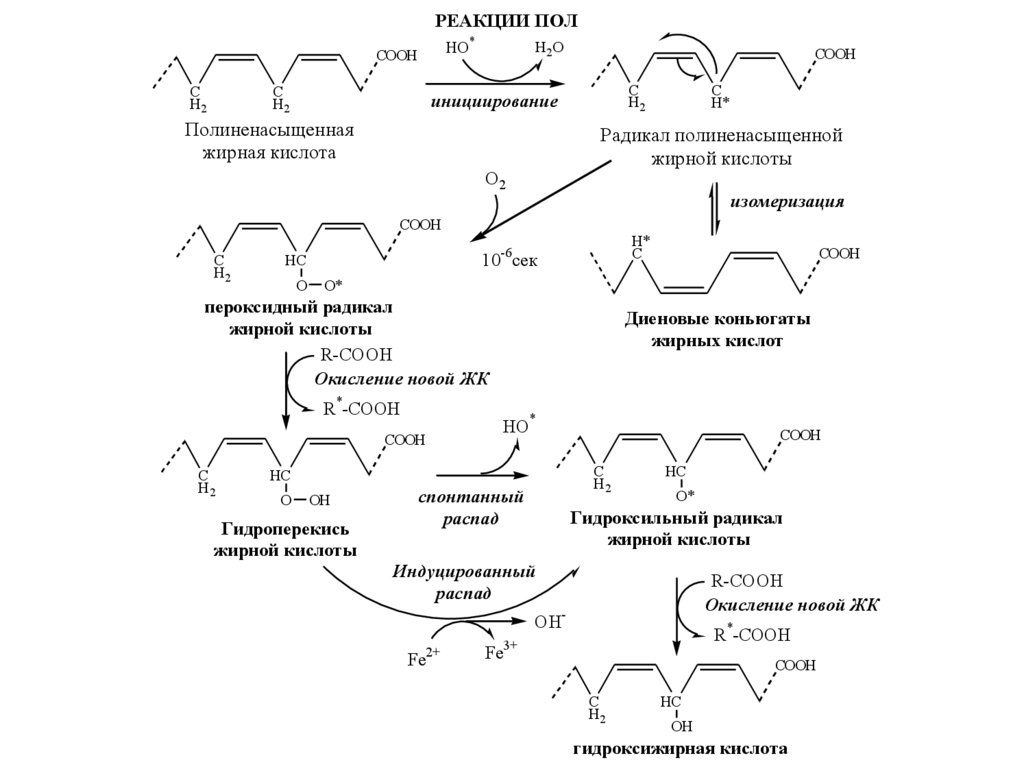
30. ПОНЯТИЕ СРО ПОЛ Субстраты ПОЛ – полиненасыщенные ЖК
• Линоленовая кислота —CH3(CH2CH=CH)3(CH2)7COOH.
• Арахидоновая кислота, витамин F,
CH3(CH2)4(CH=CHCH2)4(CH2)2COOH
и др.
31.
РЕАКЦИИ ПОЛHО*
СООН
C
H2
C
H2
H2O
СООН
C
H2
инициирование
Полиненасыщенная
жирная кислота
Радикал полиненасыщенной
жирной кислоты
О2
изомеризация
СООН
C
H2
O
H*
C
10-6сек
HC
R*-COOH
СООН
Диеновые коньюгаты
жирных кислот
HO*
OH
Гидроперекись
жирной кислоты
СООН
C
H2
HC
O
COOH
O*
пероксидный радикал
жирной кислоты
R-COOH
Окисление новой ЖК
C
H2
C
H*
спонтанный
распад
HC
O*
Гидроксильный радикал
жирной кислоты
Индуцированный
распад
R-COOH
Окисление новой ЖК
OHFe2+
R*-COOH
Fe3+
СООН
C
H2
HC
OH
гидроксижирная кислота
32.
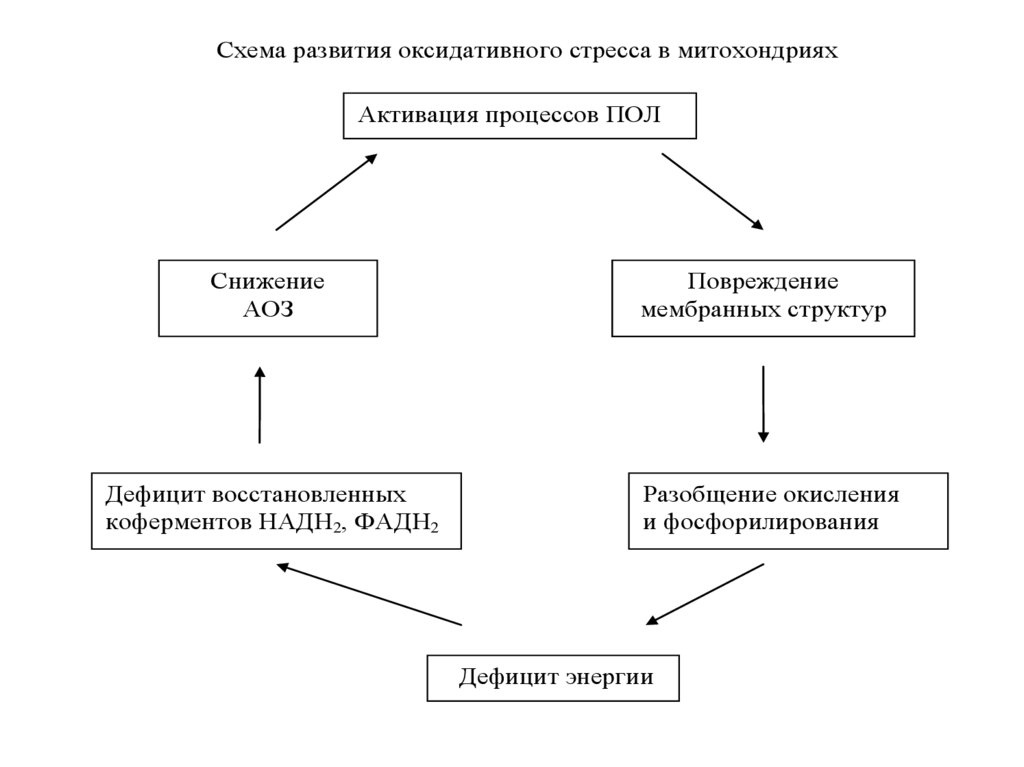
Схема развития оксидативного стресса в митохондрияхАктивация процессов ПОЛ
Снижение
АОЗ
Повреждение
мембранных структур
Дефицит восстановленных
коферментов НАДН2, ФАДН2
Разобщение окисления
и фосфорилирования
Дефицит энергии
33. Антиоксидантная защита
• В нормальных условиях процесс СРО находится подстрогим контролем ферментативных и
неферментативных систем клетки, от чего скорость
его невелика.
• Химические соединения и физические воздействия,
влияющие на скорость СРО, делят на прооксиданты
и антиоксиданты
• Прооксиданты усиливают процессы СРО. Это
высокие концентрации кислорода (например, при
длительной гипербарической оксигенации больного),
ферментные системы, генерирующие супероксидные
радикалы (например, ксантиноксидаза, ферменты
плазматической мембраны фагоцитов и др.), ионы
двухвалентного железа.
• Антиоксиданты тормозят СРО. Антиоксиданты,
находящиеся в организме, образуют его
ферментативную и неферментативную
антиоксидантную систему
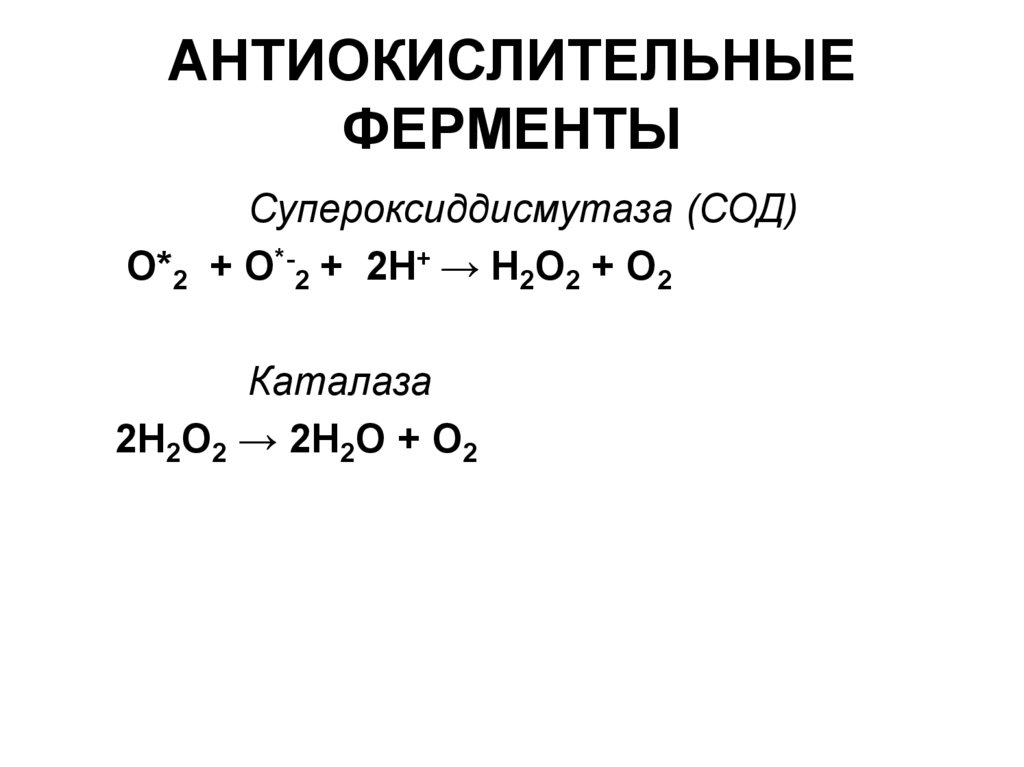
34. АНТИОКИСЛИТЕЛЬНЫЕ ФЕРМЕНТЫ
Супероксиддисмутаза (СОД)О*2 + О*-2 + 2Н+ → Н2О2 + О2
Каталаза
2Н2О2 → 2Н2О + О2
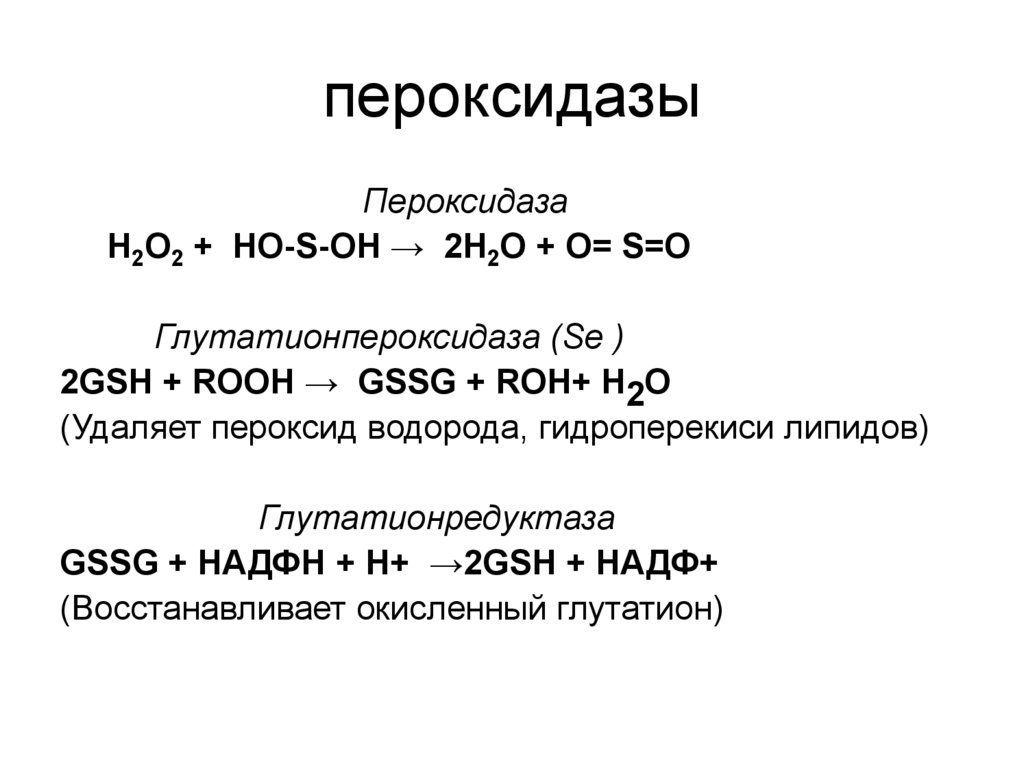
35. пероксидазы
ПероксидазаН2О2 + НО-S-ОН → 2Н2О + О= S=О
Глутатионпероксидаза (Se )
2GSH + ROOH → GSSG + ROH+ Н2О
(Удаляет пероксид водорода, гидроперекиси липидов)
Глутатионредуктаза
GSSG + НАДФН + Н+ →2GSH + НАДФ+
(Восстанавливает окисленный глутатион)
36.
• Фосфолипаза в мембране отщепляетот фосфолипидов окисленные жирные
кислоты, содержащие гидроперекисную
группу (ROOH), тем самым
разрушаются гидроперекиси липидов,
предотвращается разветвление цепей
окисления липидов в мембранах.
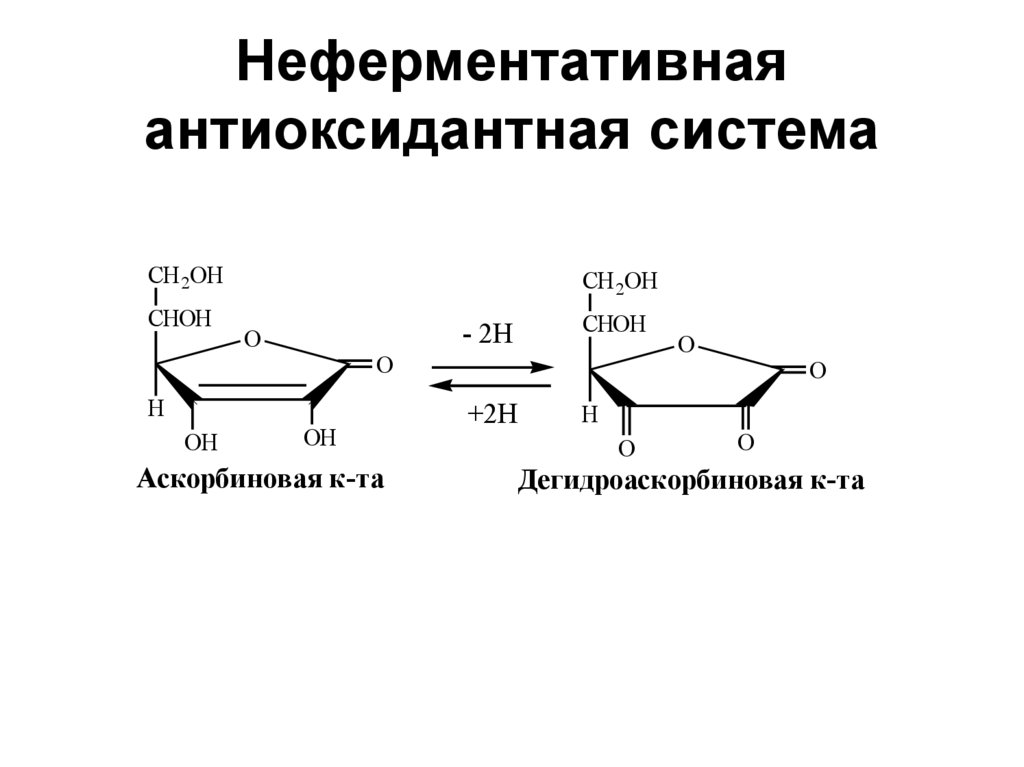
37. Неферментативная антиоксидантная система
CH 2OHCHOH
CH 2OH
O
H
OH
CHOH
- 2H
O
OH
Аскорбиновая к-та
+2H
O
O
H
O
O
Дегидроаскорбиновая к-та
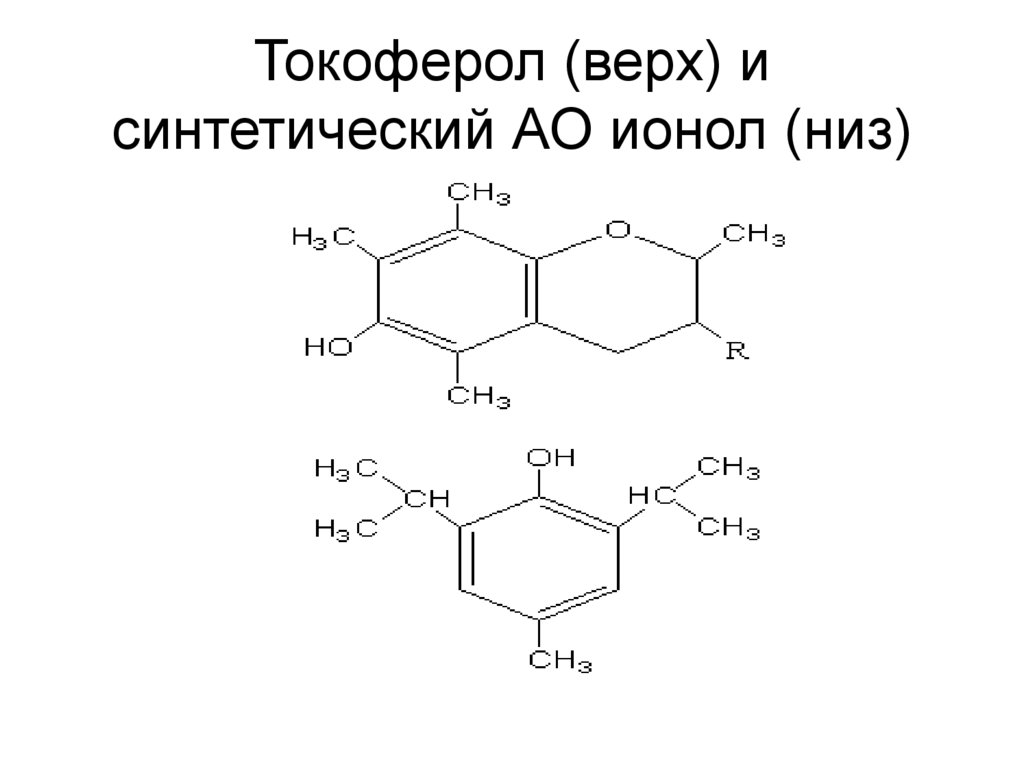
38. Токоферол (верх) и синтетический АО ионол (низ)
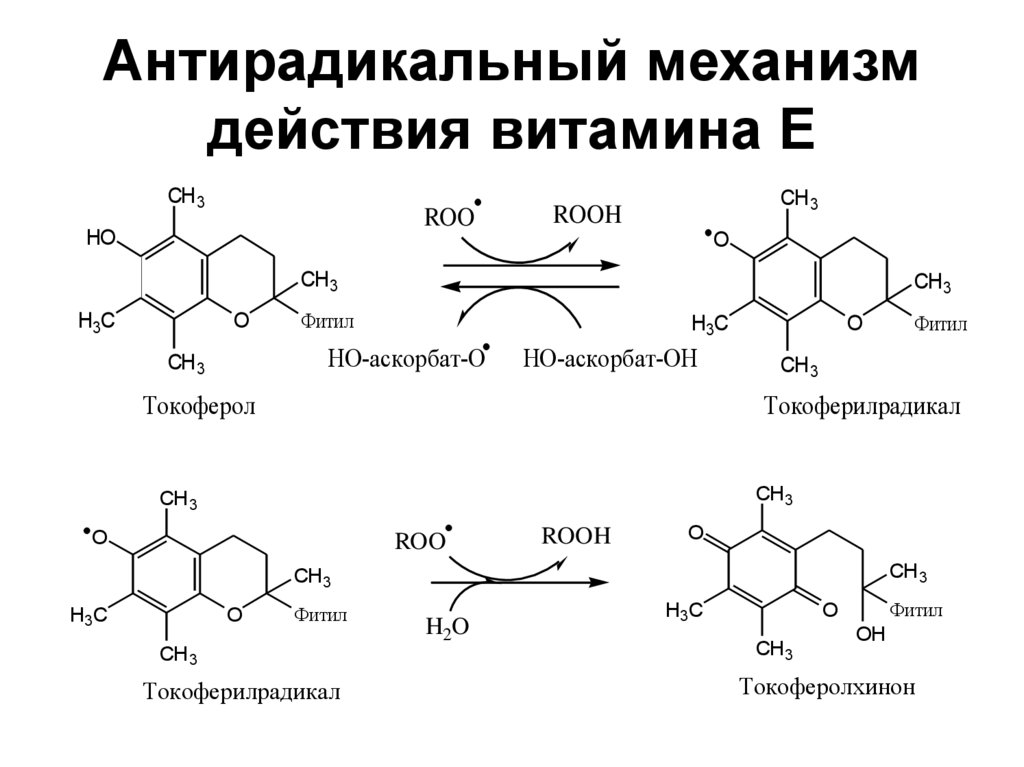
39. Антирадикальный механизм действия витамина Е
CH 3ROO
HO
CH 3
ROOH
O
CH 3
H3C
O
CH 3
Фитил
H3C
НО-аскорбат-О
CH 3
НО-аскорбат-ОН
Токоферол
O
CH 3
Токоферилрадикал
CH 3
CH 3
O
ROO
ROOH
O
CH 3
CH 3
H3C
Фитил
O
Фитил
CH 3
Токоферилрадикал
H2O
H3C
Фитил
O
CH 3
OH
Токоферолхинон
40. Антиоксиданты крови и цитоплазмы
• Церулоплазмин (плазма крови) окисляет Fe2+ до Fe3+ молекулярнымкислородом
• Апо-белок трансферрина (плазма
крови) - связывает Fe3+
• Ферритин (цитоплазма)- окисляет Fe2+ и
депонирует Fe3+
• Карнозин - связывает Fe2+
41.
• Глутатион- восстановает пероксиды• Аскорбиновая кислота - регенерирует
окисленные токоферол и убихинон
• Глутатионредуктаза - восстанавливает
окисленный глутатион























 Биология
Биология








