Похожие презентации:
Биологическое окисление -1 (лекция № 4)
1. ЛЕКЦИЯ № 4
ФГБОУ ВО УГМУ Минздрава РоссииКафедра биохимии
Дисциплина: Биохимия
ЛЕКЦИЯ № 4
Биологическое
окисление-1
Лектор: Гаврилов И.В.
Факультет: лечебно-профилактический,
Курс: 2
Екатеринбург, 2017г
2. Обмен энергии
3.
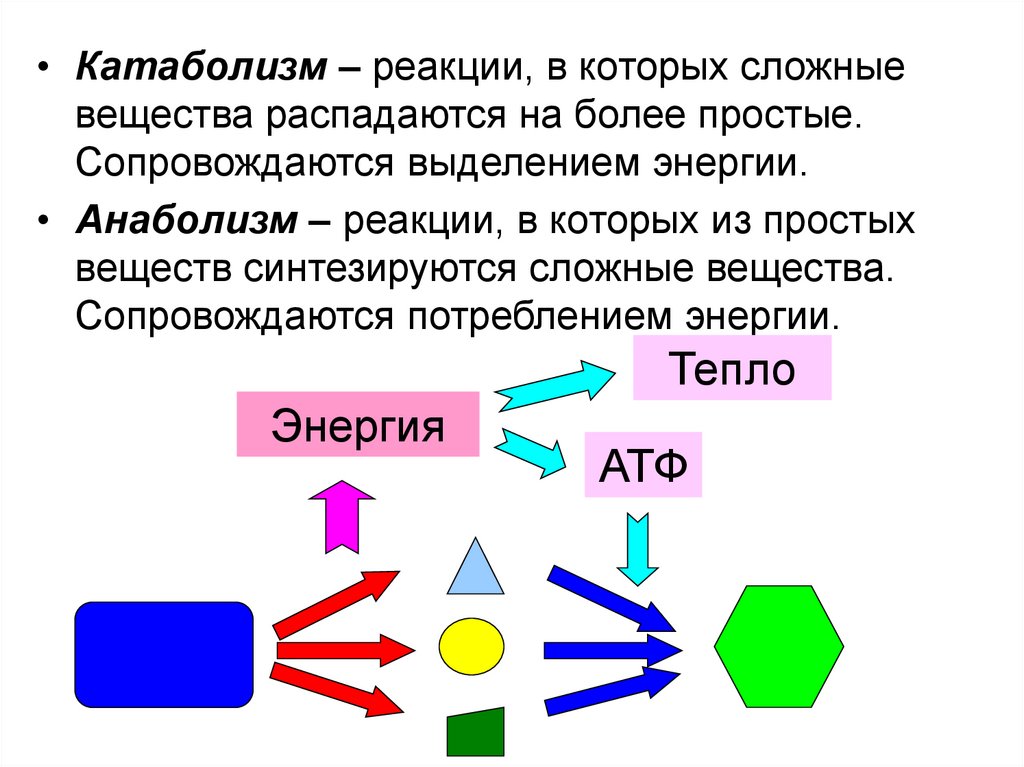
• Катаболизм – реакции, в которых сложныевещества распадаются на более простые.
Сопровождаются выделением энергии.
• Анаболизм – реакции, в которых из простых
веществ синтезируются сложные вещества.
Сопровождаются потреблением энергии.
Тепло
Энергия
АТФ
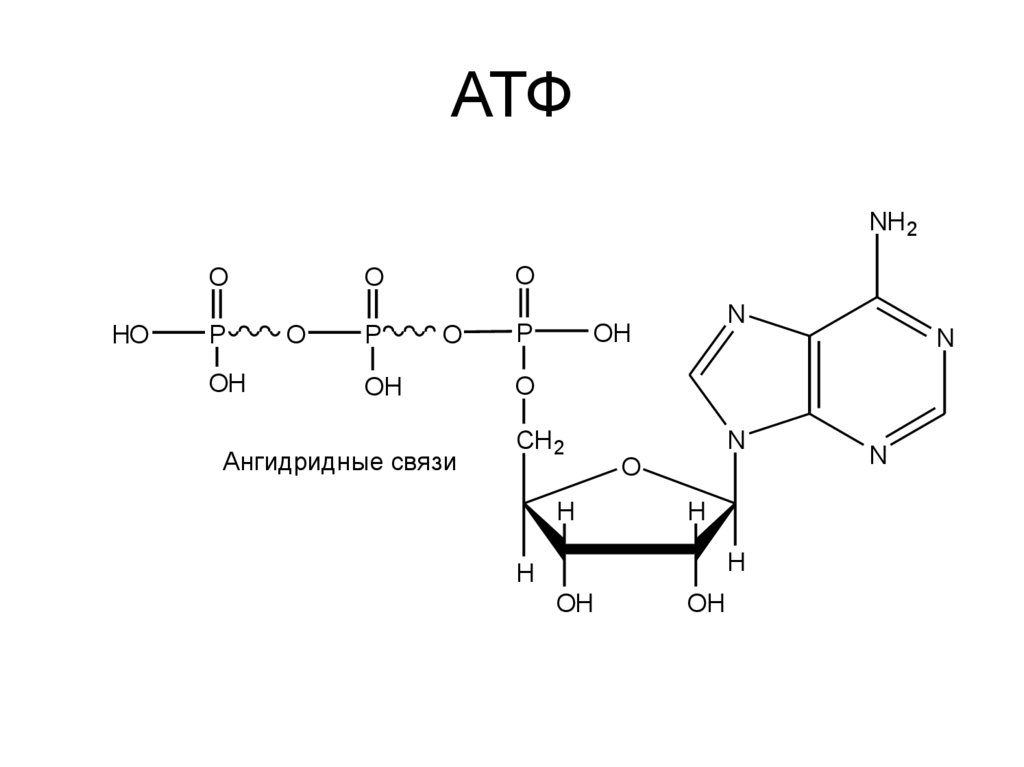
4. АТФ
NH 2O
HO
P
OH
O
O
O
P
O
OH
Ангидридные связи
P
N
OH
N
O
CH 2
H
N
O
H
H
H
OH
OH
N
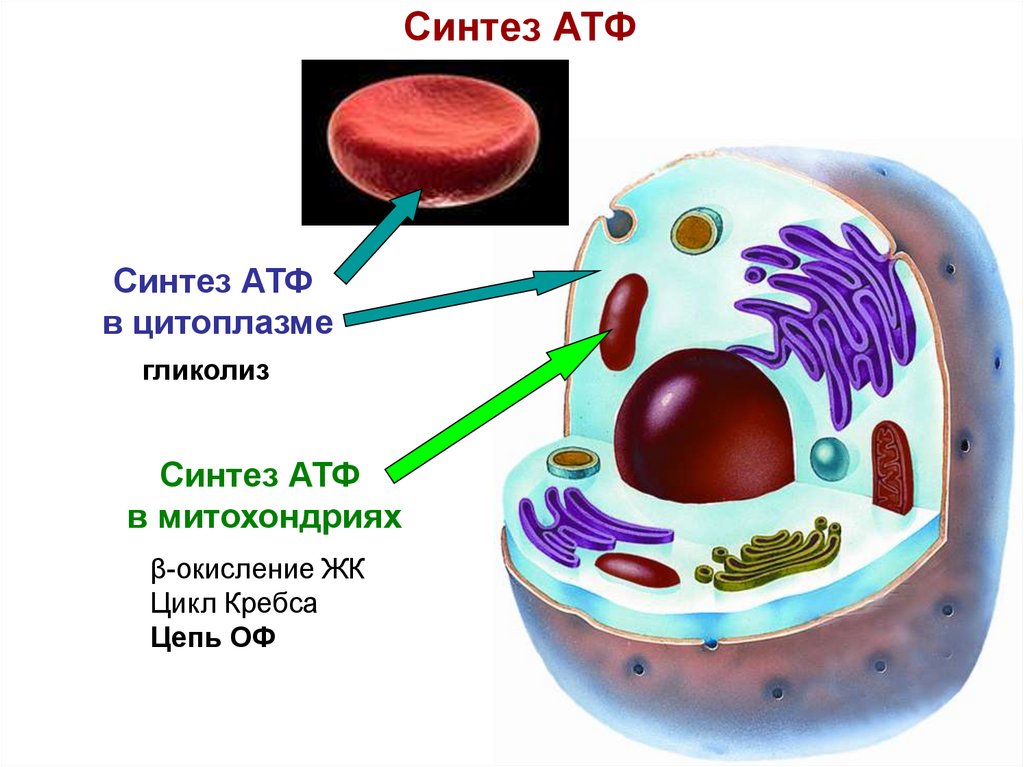
5. Синтез АТФ
Синтез АТФв цитоплазме
гликолиз
Синтез АТФ
в митохондриях
β-окисление ЖК
Цикл Кребса
Цепь ОФ
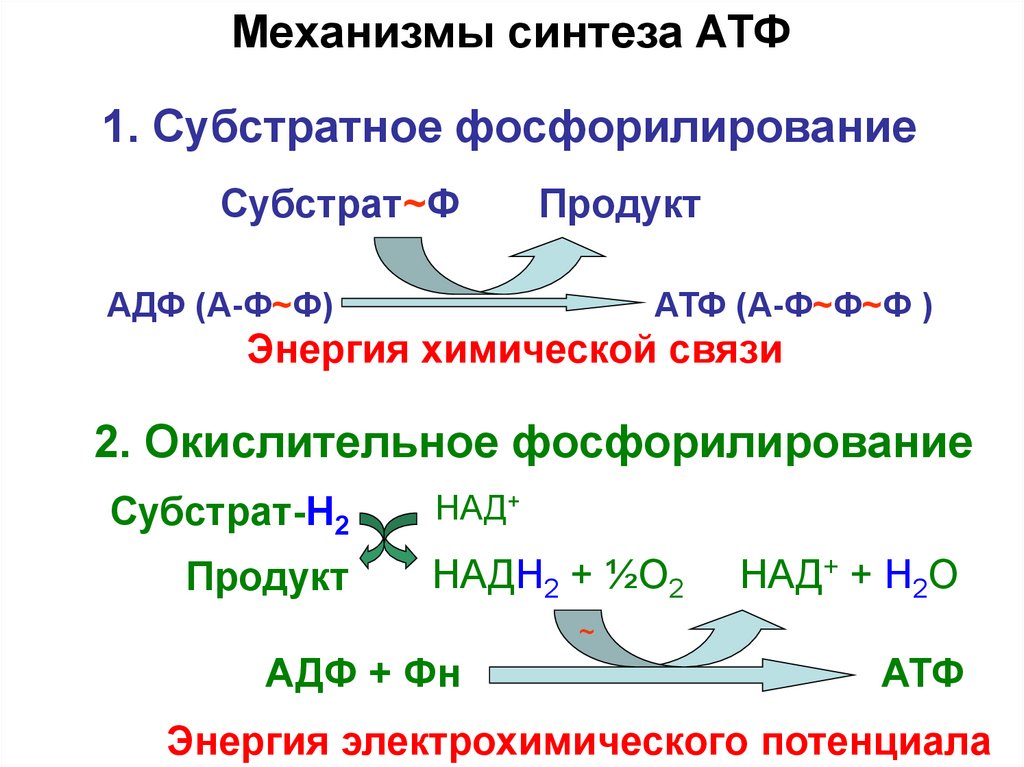
6.
Механизмы синтеза АТФ1. Субстратное фосфорилирование
Субстрат~Ф
Продукт
АДФ (А-Ф~Ф)
АТФ (А-Ф~Ф~Ф )
Энергия химической связи
2. Окислительное фосфорилирование
Субстрат-H2
Продукт
НАД+
НАДН2 + ½О2
НАД+ + Н2О
~
АДФ + Фн
АТФ
Энергия электрохимического потенциала
7. Митохондрии
Ключевую роль в энергетическом обмене клетки играютмитохондрии – в них протекают реакции окислительного
фосфорилирования
1. Наружная мембрана (содержит
белок порин – поры 2-3нм, высокая
проницаемость молекул до 5кДа.
Также есть переносчики для крупных
молекул)
2. Межмембранное пространство (1020нм, состав похож на цитоплазму)
3. Внутренняя мембрана (имеет
складки, содержит белки 70%
(ферменты ЦОФ, транспортные),
фосфолипид кардиолипин с 4 ЖК,
непроницаема для протонов)
4. Матрикс (до 50% белков: ферменты
ЦТК, β-окисления ЖК, АТ и др.,
мтДНК, мтРНК, рибосомы)
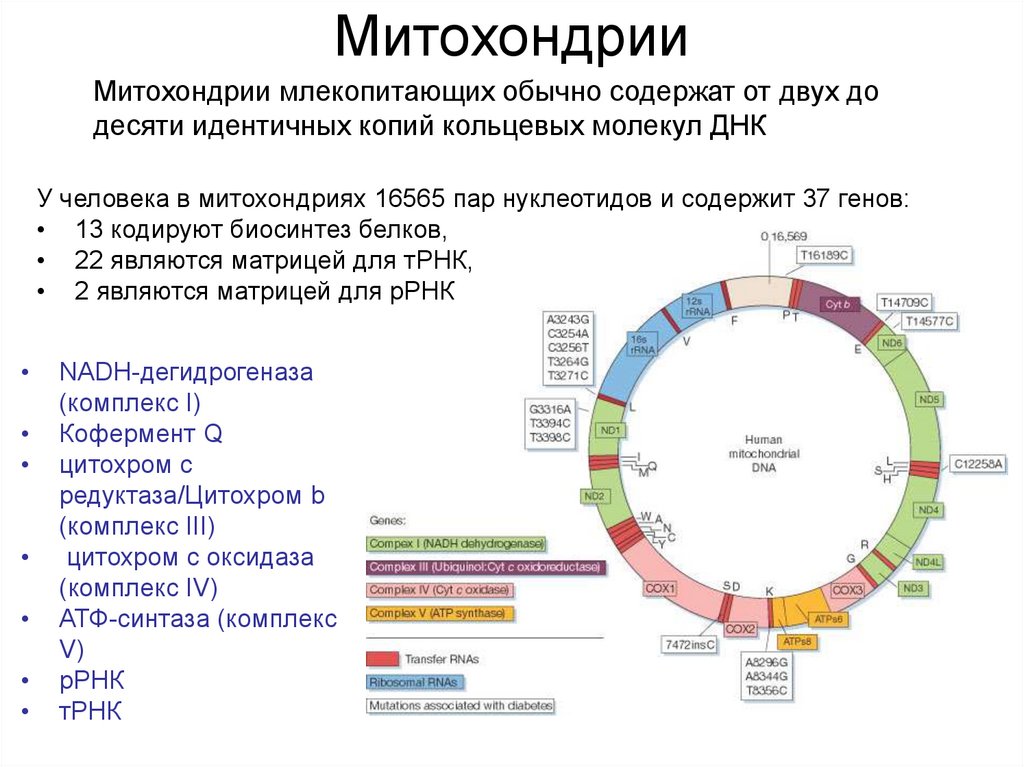
8. Митохондрии
Митохондрии млекопитающих обычно содержат от двух додесяти идентичных копий кольцевых молекул ДНК
У человека в митохондриях 16565 пар нуклеотидов и содержит 37 генов:
• 13 кодируют биосинтез белков,
• 22 являются матрицей для тРНК,
• 2 являются матрицей для рРНК
NADH-дегидрогеназа
(комплекс I)
Кофермент Q
цитохром c
редуктаза/Цитохром b
(комплекс III)
цитохром c оксидаза
(комплекс IV)
АТФ-синтаза (комплекс
V)
рРНК
тРНК
9.
История развития ученияо биологическом окислении
I.
Антуан Лоран Лавуазье (1743 – 1794) – французский
химик – в 1777г. впервые правильно истолковал явление
горения как процесс соединения веществ с О2.
CО2
H2О
Тепло
О2
Сn(H2О)m, Me
MeО
10.
Т.к. горение и дыхание сопровождаются потреблением О2 ивыделение СО2, он предположил что, в их основе лежит
один процесс.
Но у дыхания были существенные отличия от горения, идёт:
при низкой температуре;
без пламени;
в присутствии воды.
11. В конце XIX века русские исследователи А.Н. Бах и В.И. Палладин, работая независимо друг от друга, предложили 2 основные теории
для объяснения процессов, протекающих в ходебиологического окисления.
Алексей Николаевич Бах (1857 – 1946).
II.
В 1897г сформулировал «ПЕРЕКИСНУЮ ТЕОРИЮ
МЕДЛЕННОГО ОКИСЛЕНИЯ», согласно которой
молекула О2 сначала активируется в результате
разрыва одной его связи (-О-О-) и присоединения к
органическим веществам – оксидазам.
Активированный О2 при взаимодействии с
окисляемым веществом образует перекись.
O
O
+ оксидаза
O
O
оксидаза + S
оксидаза + SO2
12.
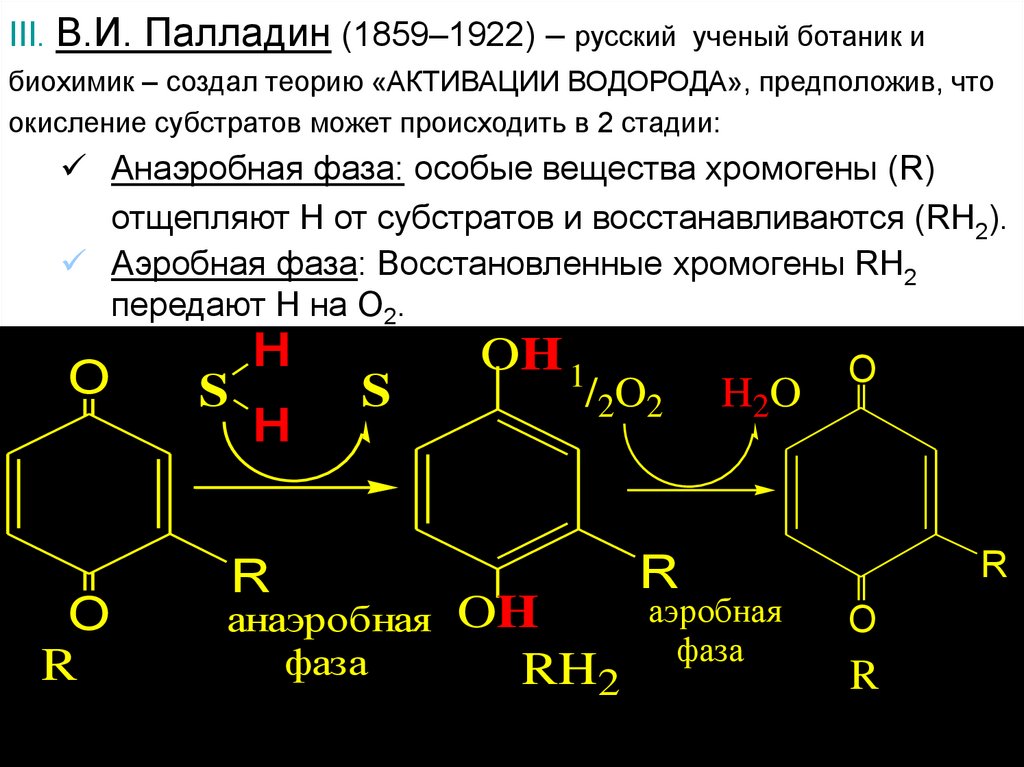
III. В.И. Палладин (1859–1922) – русский ученый ботаник ибиохимик – создал теорию «АКТИВАЦИИ ВОДОРОДА», предположив, что
окисление субстратов может происходить в 2 стадии:
Анаэробная фаза: особые вещества хромогены (R)
отщепляют Н от субстратов и восстанавливаются (RH2).
Аэробная фаза: Восстановленные хромогены RH2
передают Н на О2.
O
O
R
S
H
H
S
OH 1
/2O2
R
R
R
анаэробная OH
фаза
RH
H2O
O
аэробная
фаза
2
O
R
13.
В дальнейшем значительный вклад в исследованиеБО внесли ряд и других учёных.
Вот некоторые из них:
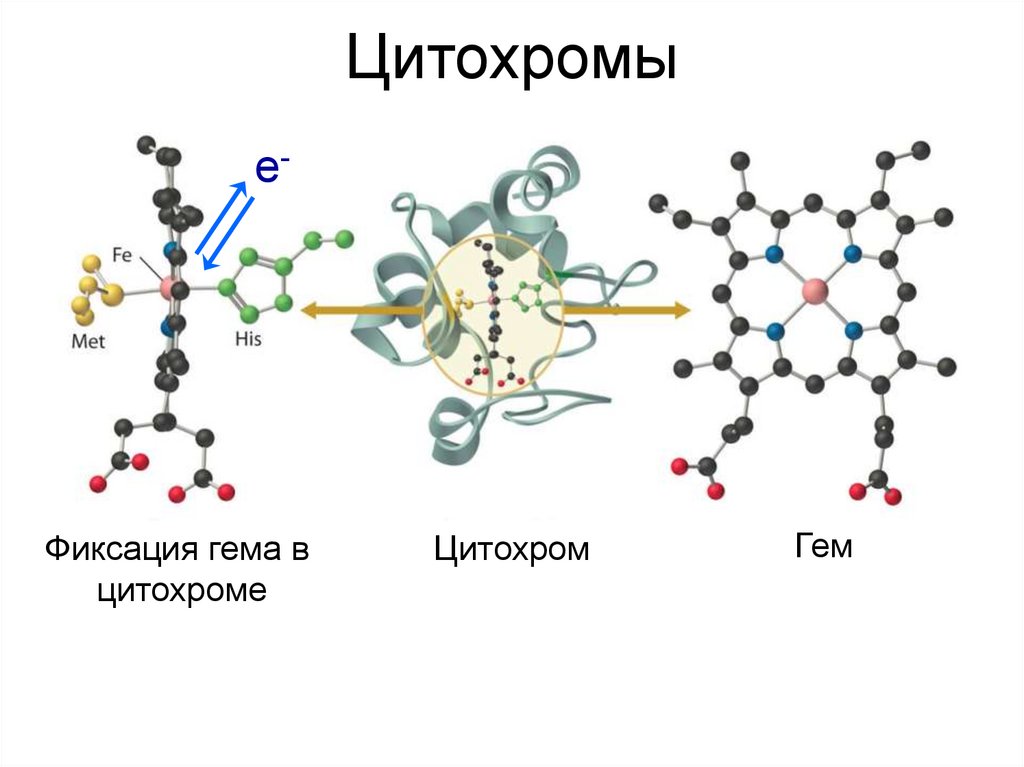
Кейлин Дейвид (1881-1963) открыл цитохромы.
Установил, что они способны передавать H+ и e- с
IV.
окисляемого S на O2.
Шенбайн показал, что БО – каталитический процесс, в
котором используется активный кислород.
Отто Генрих Варбург открыл
фермент(E) – цитохромоксидазу,
работающую на заключительном этапе БО.
Процесс БО представляет не только
процессы дегидрирования, но и
активирования О2 железосодержащими E.
14.
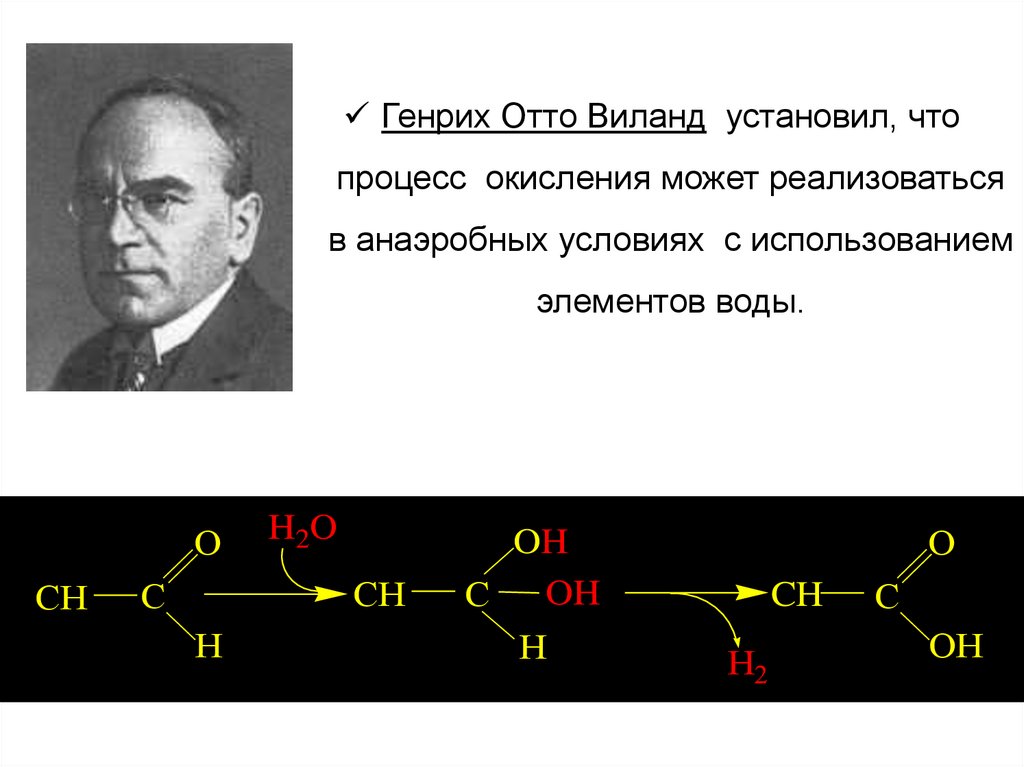
Генрих Отто Виланд установил, чтопроцесс окисления может реализоваться
в анаэробных условиях с использованием
элементов воды.
O
СН
H2O
СН
С
Н
O
OH
OH
С
Н
CH
Н2
С
OН
15. Современные представления о БО
Согласно современной теории БО:1. БО является сложным, многостадийным
процессом, в котором ведущую роль
играют ферменты -оксидоредуктазы.
2. окисление происходит как в аэробных, так
и в анаэробных условиях;
3. в организмах существует несколько путей
использования О2.
16. Пути использования О2 в клетке
Выделено 4 основные пути использования О2 ворганизме:
1. Оксидазный путь
Функция: 90% О2 используется для синтеза АТФ;
2. Монооксигеназный путь (Обеспечивает
включение 1 атома кислорода в молекулу субстрата)
Функции:
синтез новых веществ (стероидные гормоны),
обезвреживание ксенобиотиков и токсических
продуктов обмена в митохондриях и ЭПР;
17.
3. Диоксигеназный путь (Обеспечиваетвключение молекулы кислорода в молекулу
субстрата)
Функция:
деградация АК;
синтез новых веществ;
4. Свободно-радикальный путь
Функции:
внутриклеточное пищеварение;
разрушение бактерий, вирусов, онко- и
стареющих клеток;
образование БАВ.
18. Основные понятия БО
Биологическое окисление – совокупностьокислительно-восстановительных реакций
протекающих в организме
Субстрат БО – вещество, способное отдавать
электрон. (вещества, способные вступать в
реакции окисления) Субстрат-H2
19.
Окислительно-восстановительные реакции(ОВР) – реакции, в которых меняется степень
окисления субстрата за счет присоединения /
отщепления:
1) 1 е-; (Цитохромы: Р450, В5, С и т.д.)
Цит1(Fe3+) + Цит2(Fe2+)
Цит1(Fe2+) + Цит2(Fe3+)
2) 2е- и 2Н+; (НАДН2, ФАДН2) (Дегидрогеназы)
Субстрат-H2 + R
Продукт + RH2
3) атомов кислорода (Оксидазы, оксигеназы)
Субстрат-H2 + ½O2
Продукт + H2O
20.
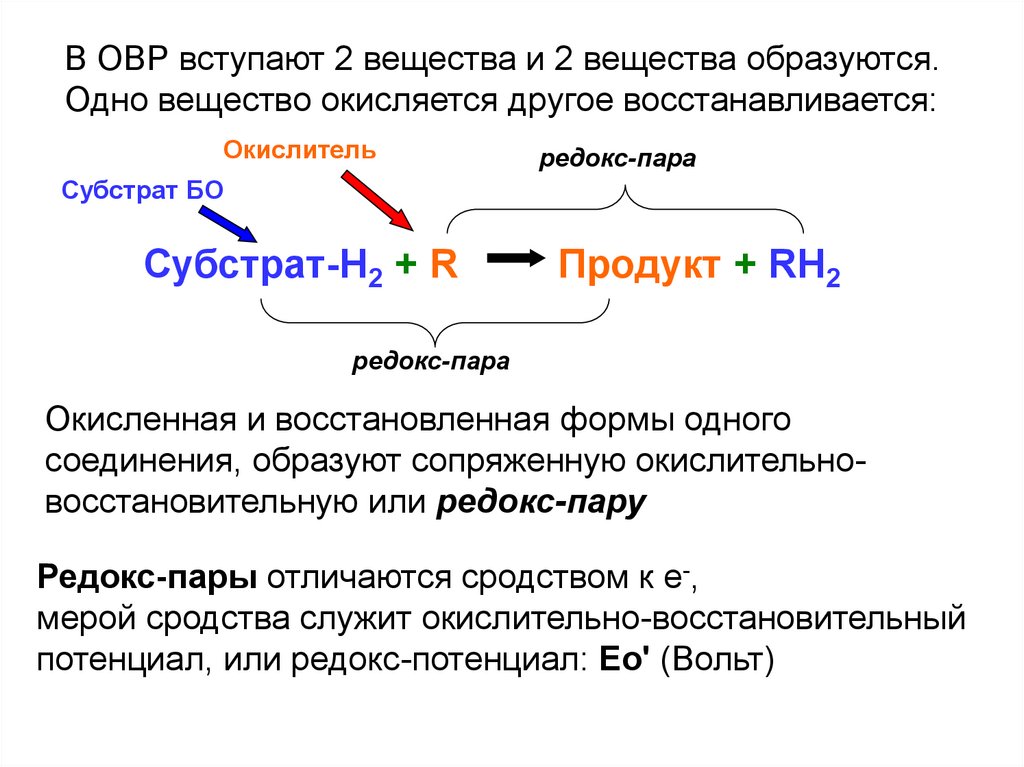
В ОВР вступают 2 вещества и 2 вещества образуются.Одно вещество окисляется другое восстанавливается:
Окислитель
редокс-пара
Субстрат БО
Субстрат-H2 + R
Продукт + RH2
редокс-пара
Окисленная и восстановленная формы одного
соединения, образуют сопряженную окислительновосстановительную или редокс-пару
Редокс-пары отличаются сродством к е-,
мерой сродства служит окислительно-восстановительный
потенциал, или редокс-потенциал: Ео' (Вольт)
21.
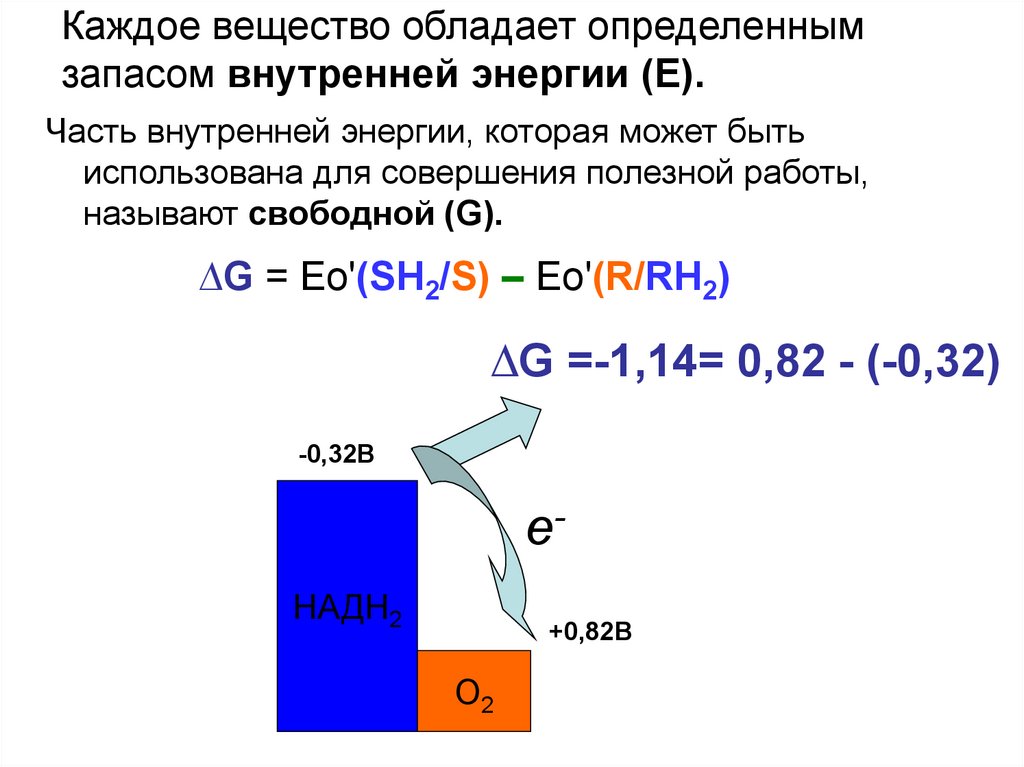
Каждое вещество обладает определеннымзапасом внутренней энергии (Е).
Часть внутренней энергии, которая может быть
использована для совершения полезной работы,
называют свободной (G).
∆G = Ео'(SH2/S) – Ео'(R/RH2)
∆G =-1,14= 0,82 - (-0,32)
-0,32В
еНАДН2
+0,82В
О2
22.
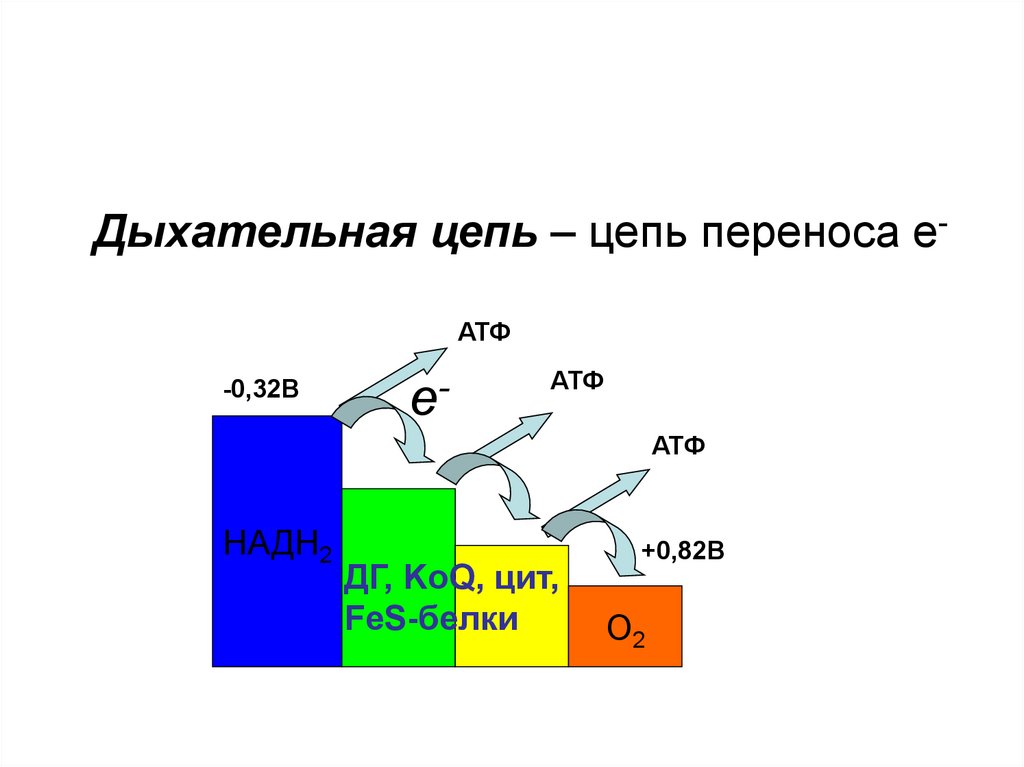
Дыхательная цепь – цепь переносаэлектронов.
В переносе электронов от субстратов БО к О2
принимают участие:
1. НАД– и НАДФ– зависимые ДГ;
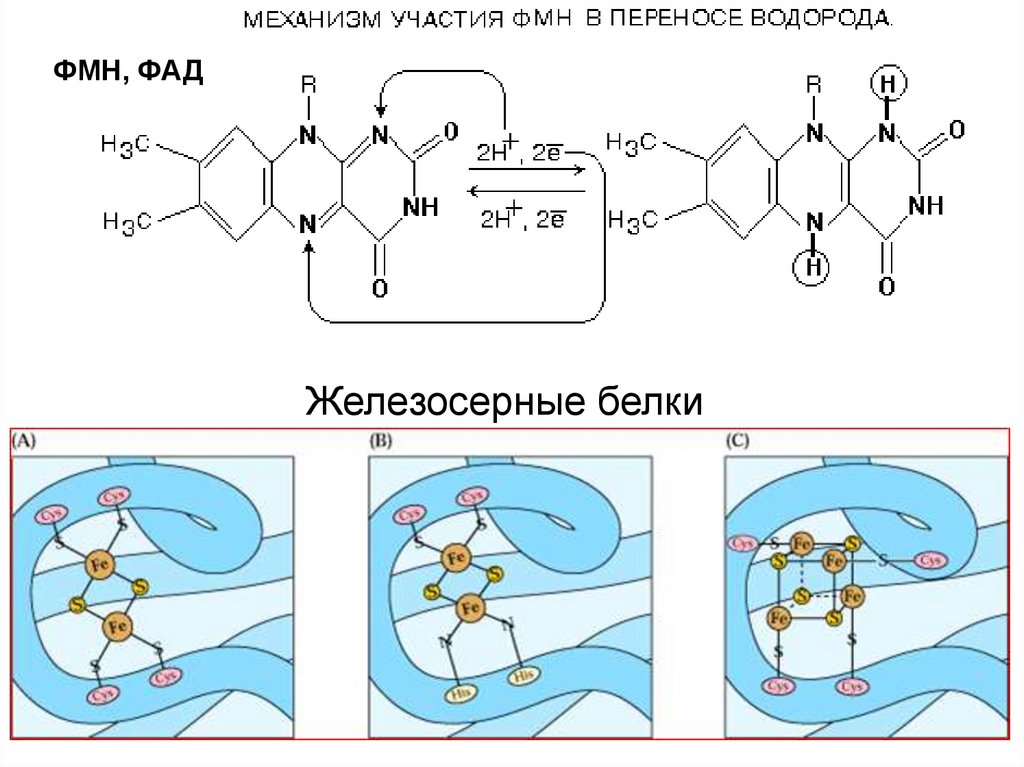
2. ФАД–
и ФМН– зависимые ДГ;
3. Цитохромы;
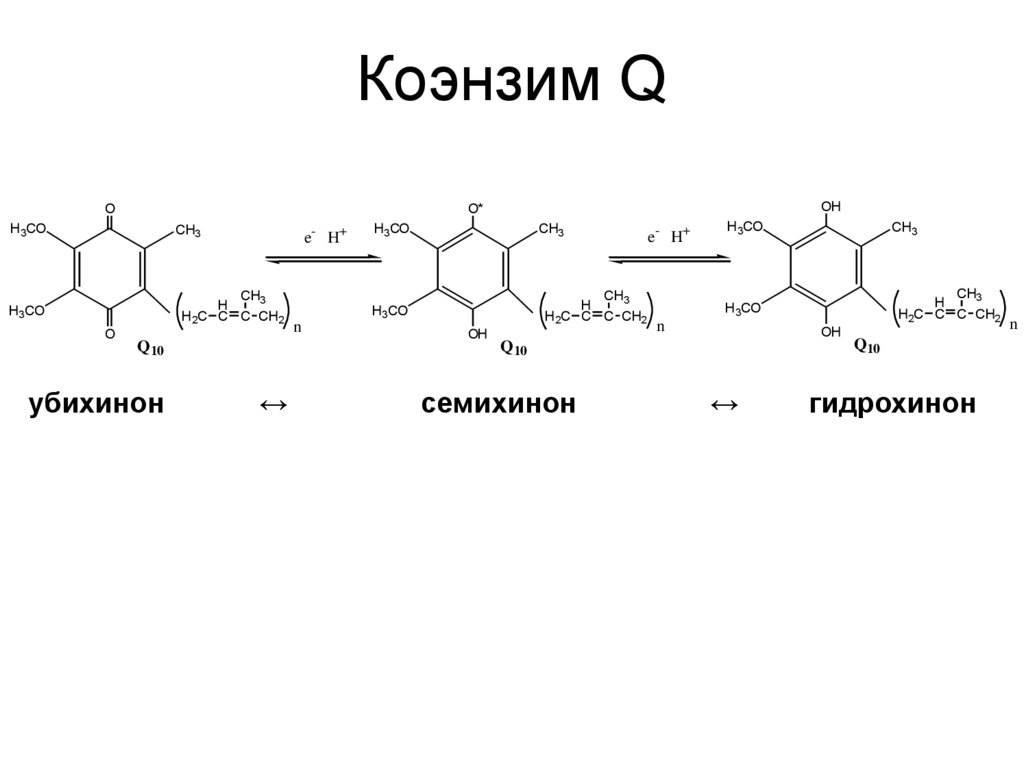
4. Коэнзим Q;
5. Белки, содержащие негеминовое
железо.
23. Цитохромы
е-Фиксация гема в
цитохроме
Цитохром
Гем
24. Коэнзим Q
OH3CO
CH3
H3CO
CH3
H
H2C C C CH2
O
OH
O*
e- H+
Q10
убихинон
↔
n
H3CO
CH3
H3CO
CH3
H
H2C C C CH2
OH
e- H+
H3CO
CH3
H3CO
CH3
H
H2C C C CH2
n
OH
Q10
семихинон
↔
Q10
гидрохинон
n
25. Железосерные белки
ФМН, ФАДЖелезосерные белки
26.
Дыхательная цепь – цепь переноса еАТФ-0,32В
е-
АТФ
АТФ
НАДН2
ДГ, KoQ, цит,
FeS-белки
+0,82В
О2
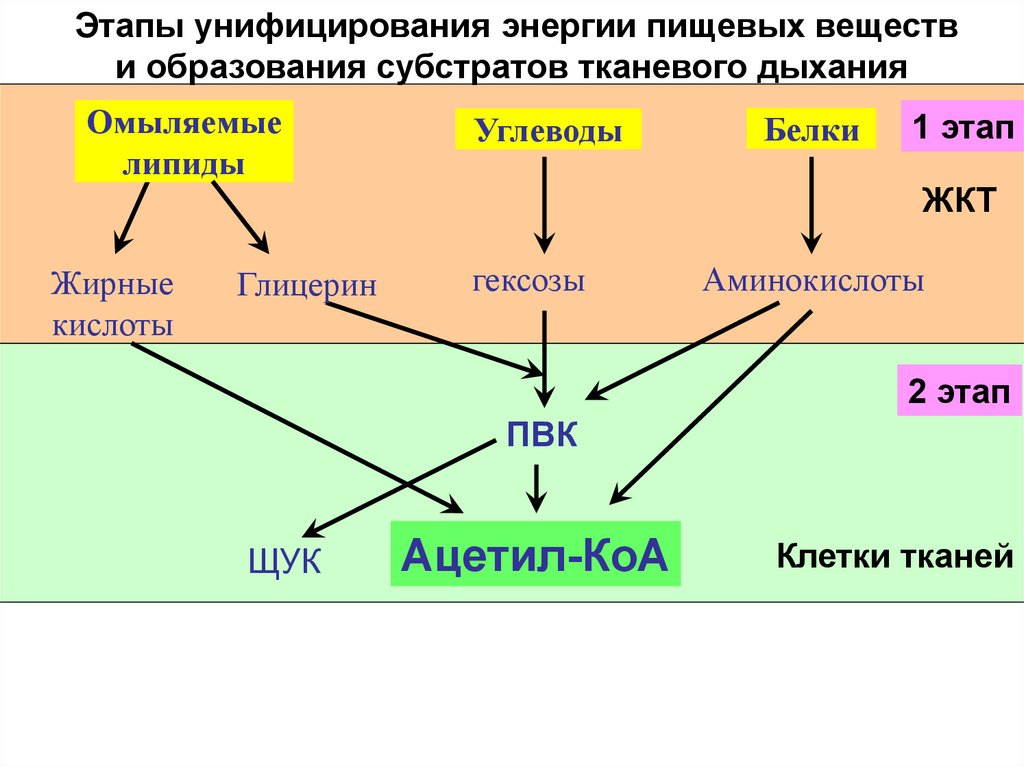
27. Этапы унифицирования энергии пищевых веществ и образования субстратов тканевого дыхания
Омыляемыелипиды
Жирные
кислоты
Глицерин
Углеводы
Белки
1 этап
ЖКТ
гексозы
Аминокислоты
2 этап
ПВК
ЩУК
Ацетил-КоА
Клетки тканей
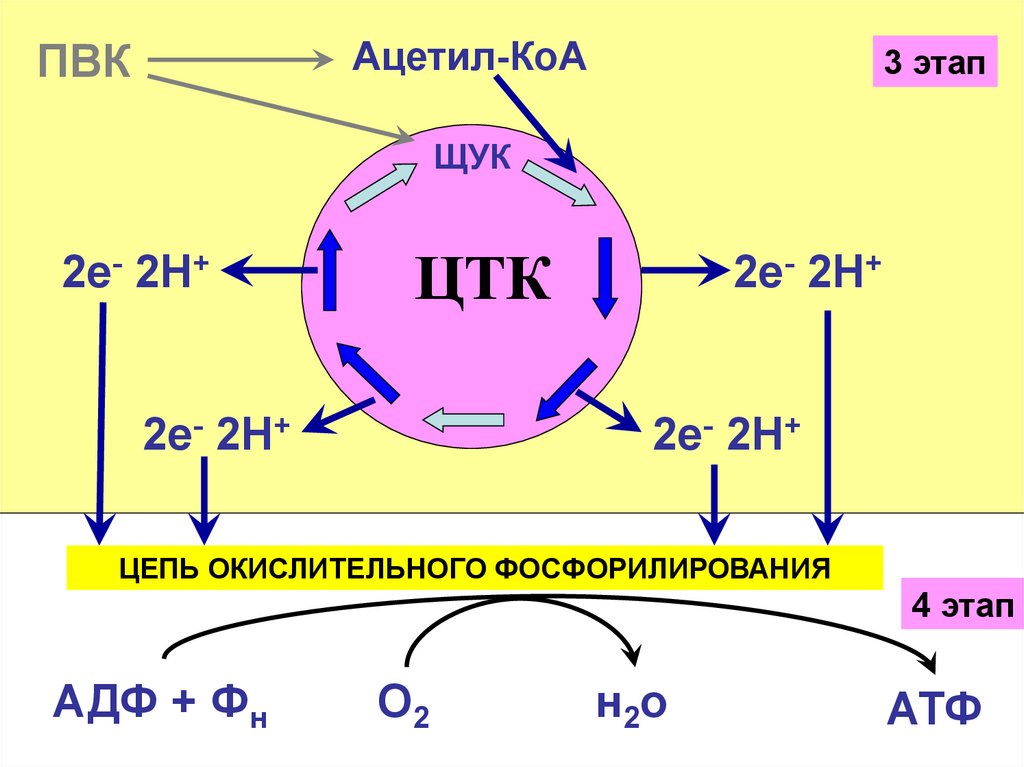
28.
Ацетил-КоАПВК
3 этап
ЩУК
2е- 2Н+
ЦТК
2е- 2Н+
2е- 2Н+
2е- 2Н+
ЦЕПЬ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ
4 этап
АДФ + Фн
О2
н2о
АТФ
29.
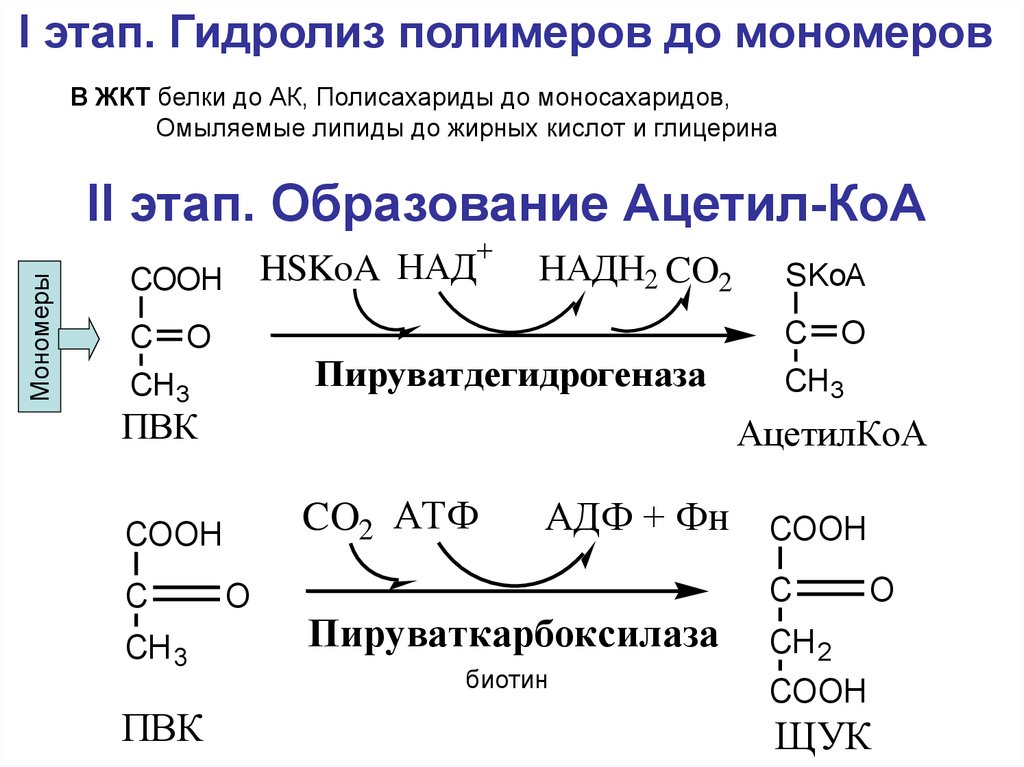
I этап. Гидролиз полимеров до мономеровВ ЖКТ белки до АК, Полисахариды до моносахаридов,
Омыляемые липиды до жирных кислот и глицерина
II этап. Образование Ацетил-КоА
Мономеры
+
HSKoA НАД
COOH
C
НАДН2 CO2
C
O
Пируватдегидрогеназа
CH 3
ПВК
CH 3
ПВК
O
CH3
АцетилКоА
CO2 АТФ
COOH
C
SKoA
O
АДФ + Фн COOH
C
Пируваткарбоксилаза
биотин
O
CH 2
COOH
ЩУК
30.
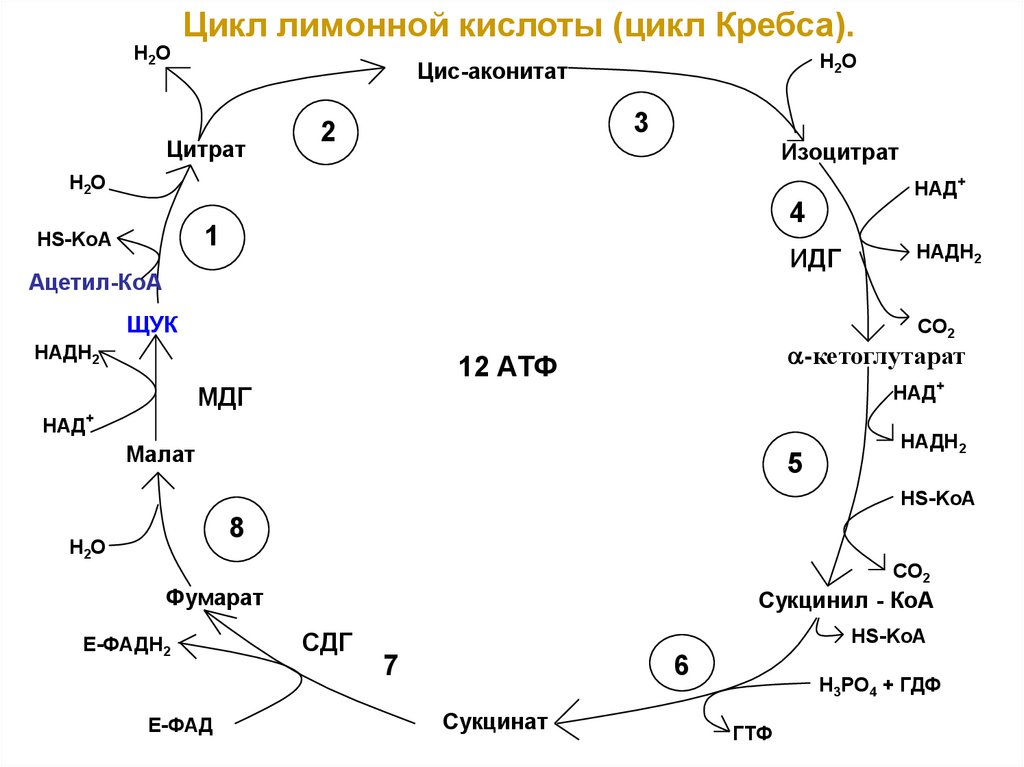
III этап. Цикл Кребса(цикл трикарбоновых кислот)
• ЦТК является процессом окисления Ацетил–КоА универсального продукта катаболизма углеводов,
белков и омыляемых липидов;
• ЦТК протекает в митохондриях с участием 8
ферментов, которые локализованы в матриксе в
свободном состоянии, или на внутренней
поверхности внутренней мембраны;
• В ЦТК участвуют 5 витаминов В1, В2, РР,
пантотеновая кислота и липоевая кислота в виде
коферментов тиаминпирофосфата, ФАД, НАД+,
КоА и липоата.
31.
Н2ОЦикл лимонной кислоты (цикл Кребса).
Н2О
Цис-аконитат
Цитрат
3
2
Изоцитрат
Н2О
НАД+
4
1
HS-KoA
ИДГ
Ацетил-КоА
ЩУК
НАДН2
СО2
НАДН2
-кетоглутарат
12 АТФ
НАД+
МДГ
НАД+
Малат
5
НАДН2
НS-KoA
8
Н2О
CO2
Фумарат
Е-ФАДН2
Е-ФАД
Сукцинил - КоА
СДГ
HS-KoA
7
6
Сукцинат
H3PO4 + ГДФ
ГТФ
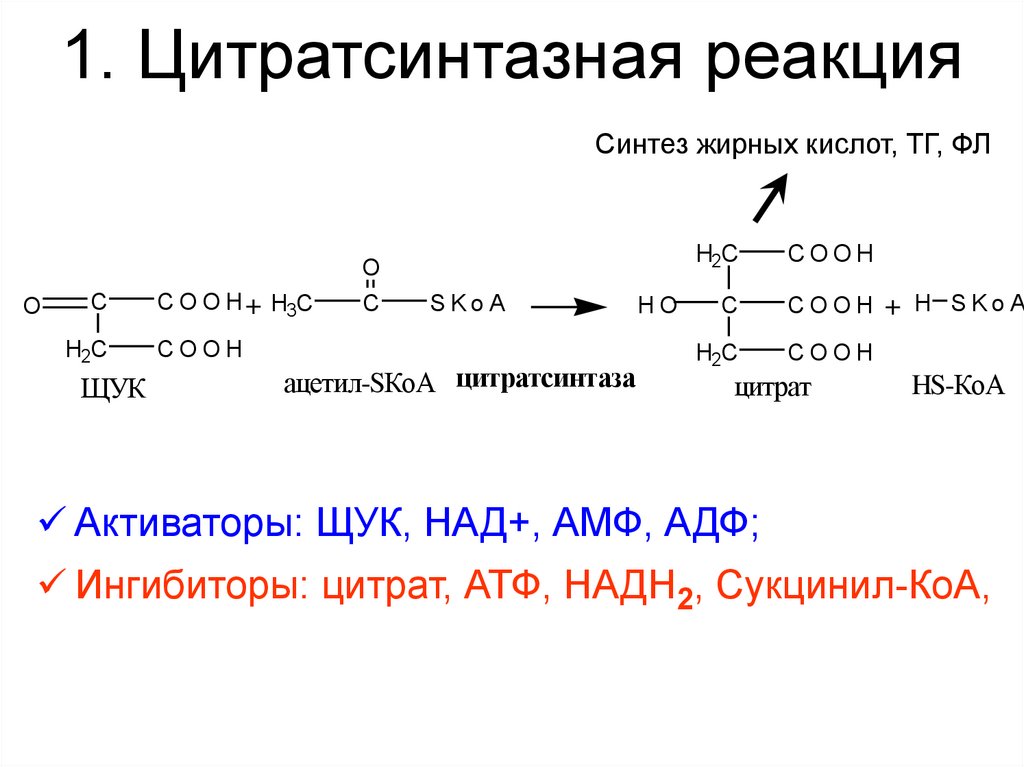
32. 1. Цитратсинтазная реакция
Синтез жирных кислот, ТГ, ФЛO
C
H2C
ЩУК
C O O H + H3C
COOH
O
C
H2C
SKoA
ацетил-SКоА цитратсинтаза
HO
C
H2C
COOH
COOH + H SKoA
COOH
цитрат
HS-КоА
Активаторы: ЩУК, НАД+, АМФ, АДФ;
Ингибиторы: цитрат, АТФ, НАДН2, Сукцинил-КоА,
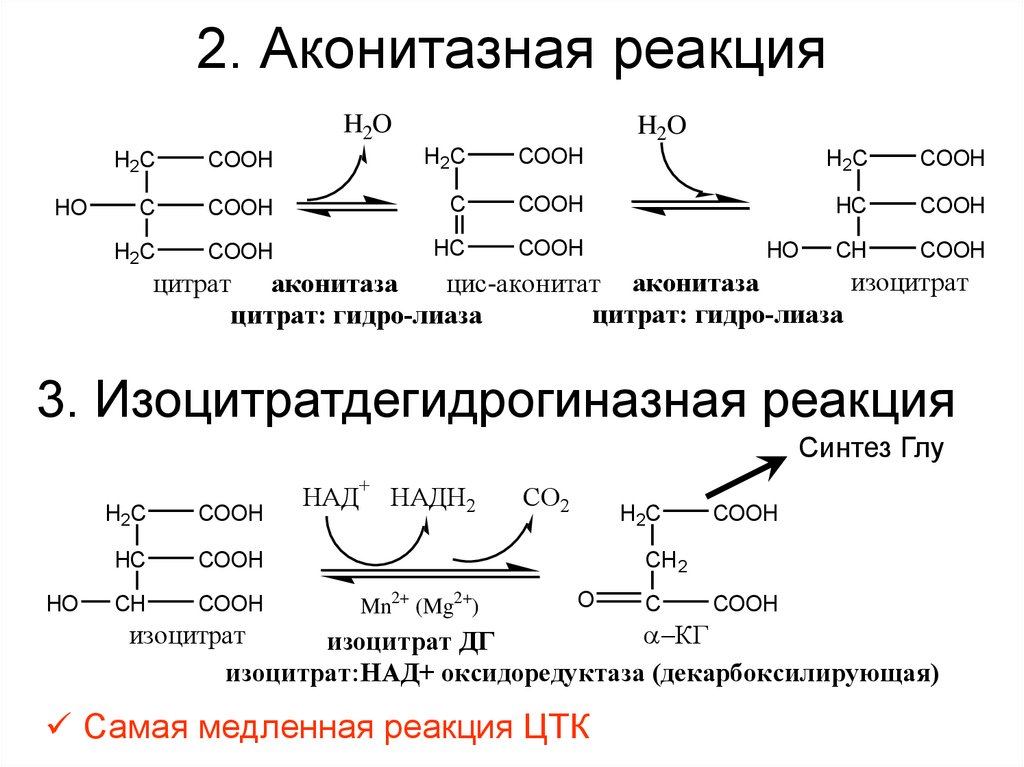
33. 2. Аконитазная реакция
H2OHO
H2O
H2C
COOH
H2C
COOH
H2C
COOH
C
COOH
C
COOH
HC
COOH
H2C
COOH
HC
COOH
CH
COOH
HO
изоцитрат
цис-аконитат аконитаза
цитрат аконитаза
цитрат: гидро-лиаза
цитрат: гидро-лиаза
3. Изоцитратдегидрогиназная реакция
Синтез Глу
HO
H2C
COOH
HC
COOH
CH
COOH
НАД+ НАДН2
СО2
H2C
COOH
CH 2
Mn2+ (Mg2+)
O
C
COOH
изоцитрат
КГ
изоцитрат ДГ
изоцитрат:НАД+ оксидоредуктаза (декарбоксилирующая)
Самая медленная реакция ЦТК
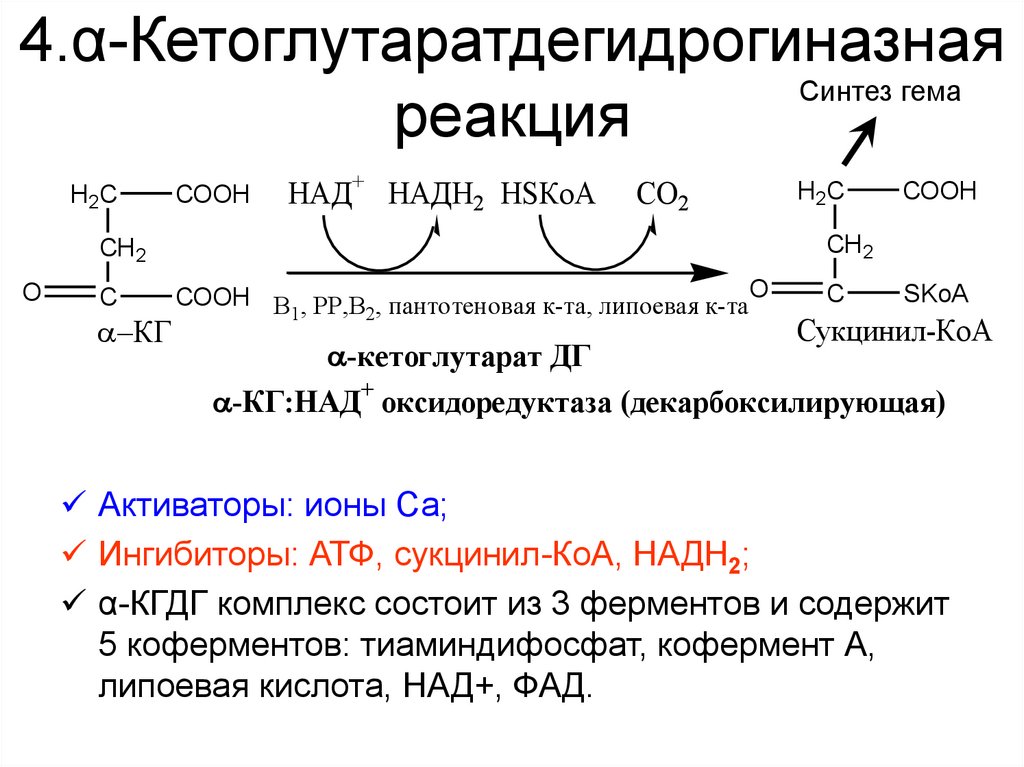
34. 4.α-Кетоглутаратдегидрогиназная реакция
4.α-КетоглутаратдегидрогиназнаяСинтез гема
реакция
H2C
COOH
НАД+ НАДН2 НSКоА
СО2
C
КГ
COOH
CH 2
CH 2
O
H2C
COOH В , РР,В , пантотеновая к-та, липоевая к-таO
1
2
-кетоглутарат ДГ
C
SKoA
Сукцинил-КоА
-КГ:НАД+ оксидоредуктаза (декарбоксилирующая)
Активаторы: ионы Са;
Ингибиторы: АТФ, сукцинил-КоА, НАДH2;
α-КГДГ комплекс состоит из 3 ферментов и содержит
5 коферментов: тиаминдифосфат, кофермент А,
липоевая кислота, НАД+, ФАД.
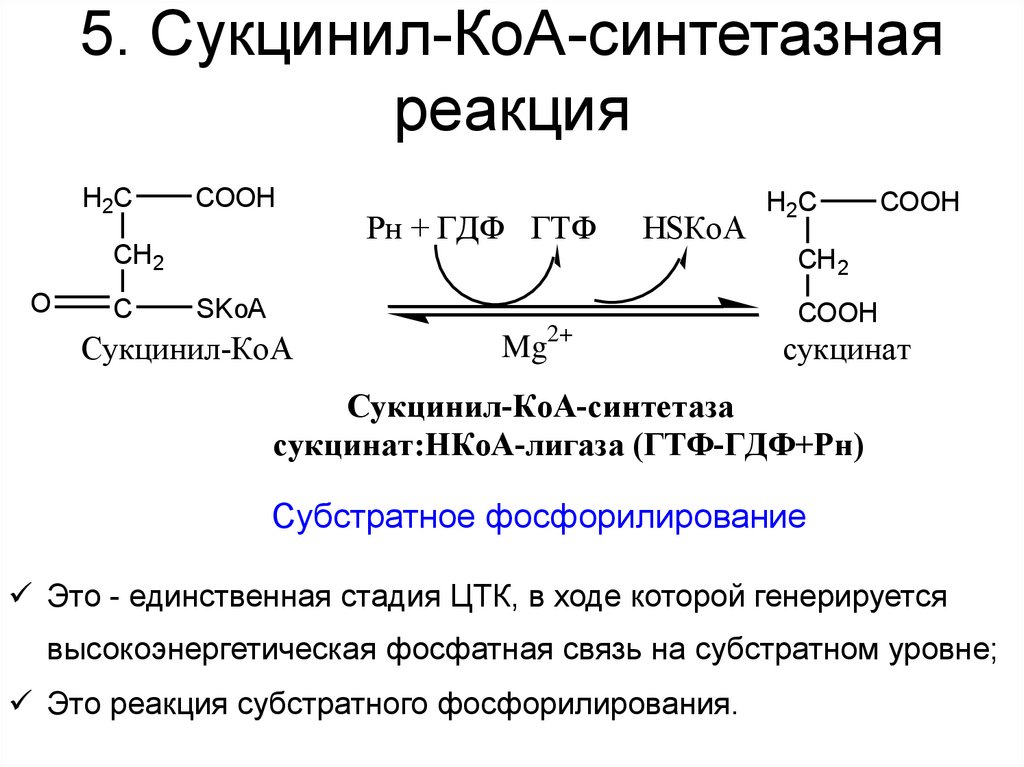
35. 5. Сукцинил-КоА-синтетазная реакция
H2CCOOH
CH 2
O
C
Рн + ГДФ ГТФ
HSКоА
H2C
COOH
CH 2
SKoA
Сукцинил-КоА
Mg2+
COOH
сукцинат
Сукцинил-КоА-синтетаза
сукцинат:НКоА-лигаза (ГТФ-ГДФ+Рн)
Субстратное фосфорилирование
Это - единственная стадия ЦТК, в ходе которой генерируется
высокоэнергетическая фосфатная связь на субстратном уровне;
Это реакция субстратного фосфорилирования.
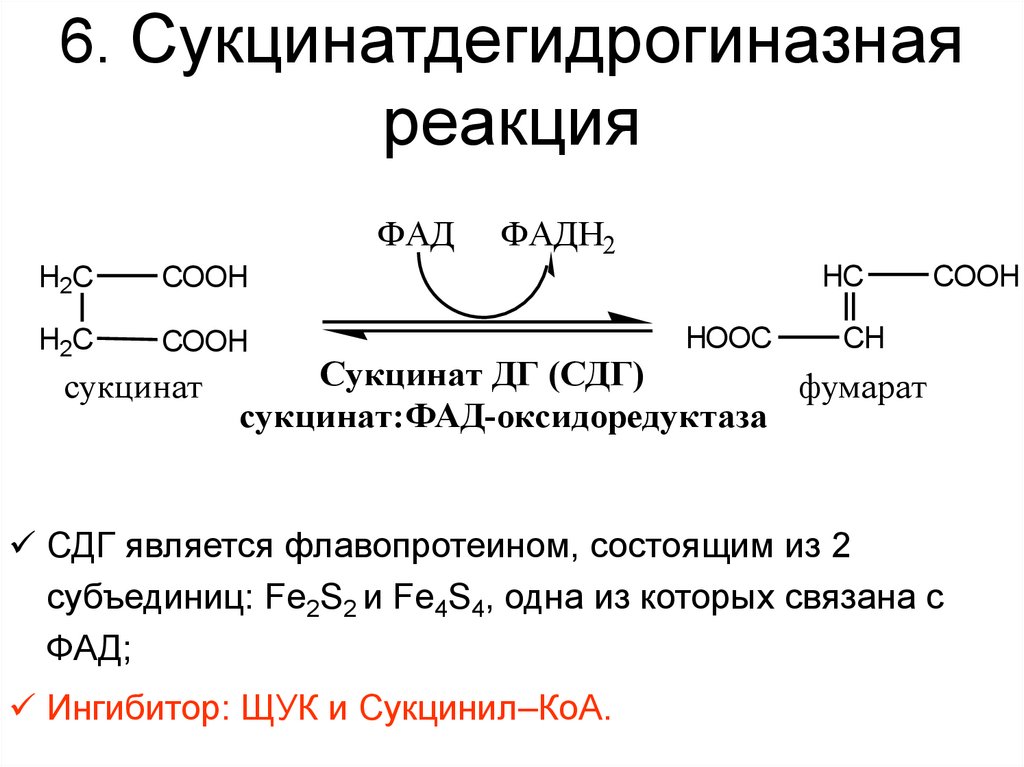
36. 6. Сукцинатдегидрогиназная реакция
ФАДH2C
COOH
H2C
COOH
сукцинат
ФАДН2
HC
HOOC
COOH
CH
Сукцинат ДГ (СДГ)
фумарат
сукцинат:ФАД-оксидоредуктаза
СДГ является флавопротеином, состоящим из 2
субъединиц: Fe2S2 и Fe4S4, одна из которых связана с
ФАД;
Ингибитор: ЩУК и Сукцинил–КоА.
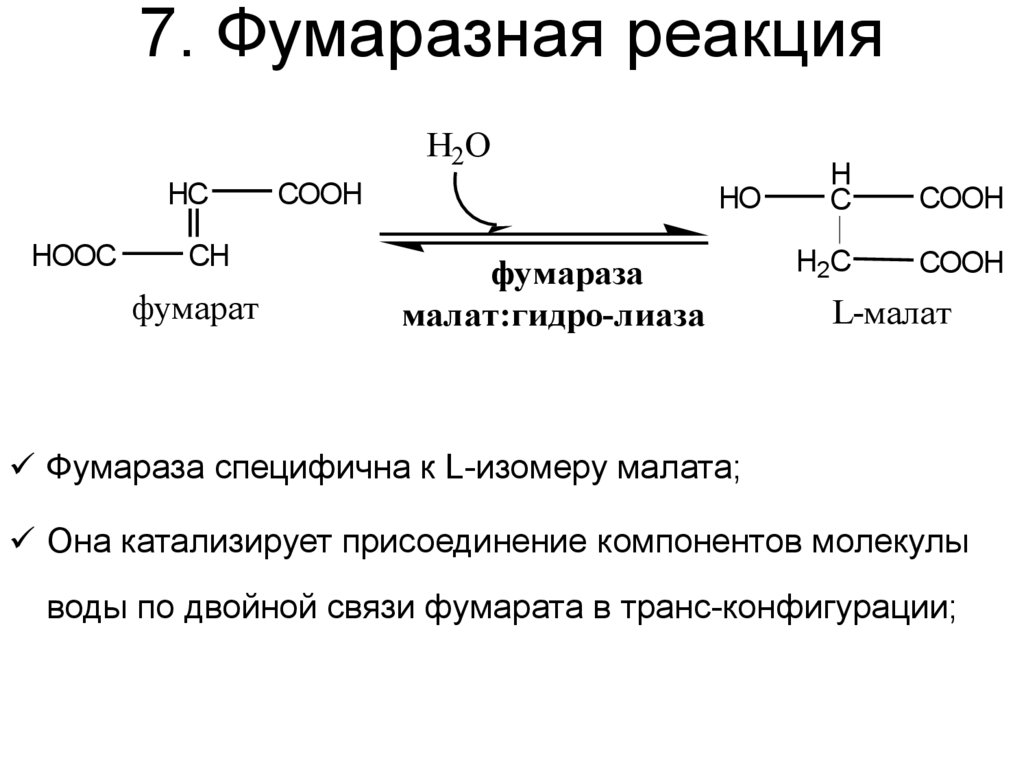
37. 7. Фумаразная реакция
Н2ОHC
HOOC
CH
фумарат
COOH
HO
фумараза
малат:гидро-лиаза
H
C
COOH
H2C
COOH
L-малат
Фумараза специфична к L-изомеру малата;
Она катализирует присоединение компонентов молекулы
воды по двойной связи фумарата в транс-конфигурации;
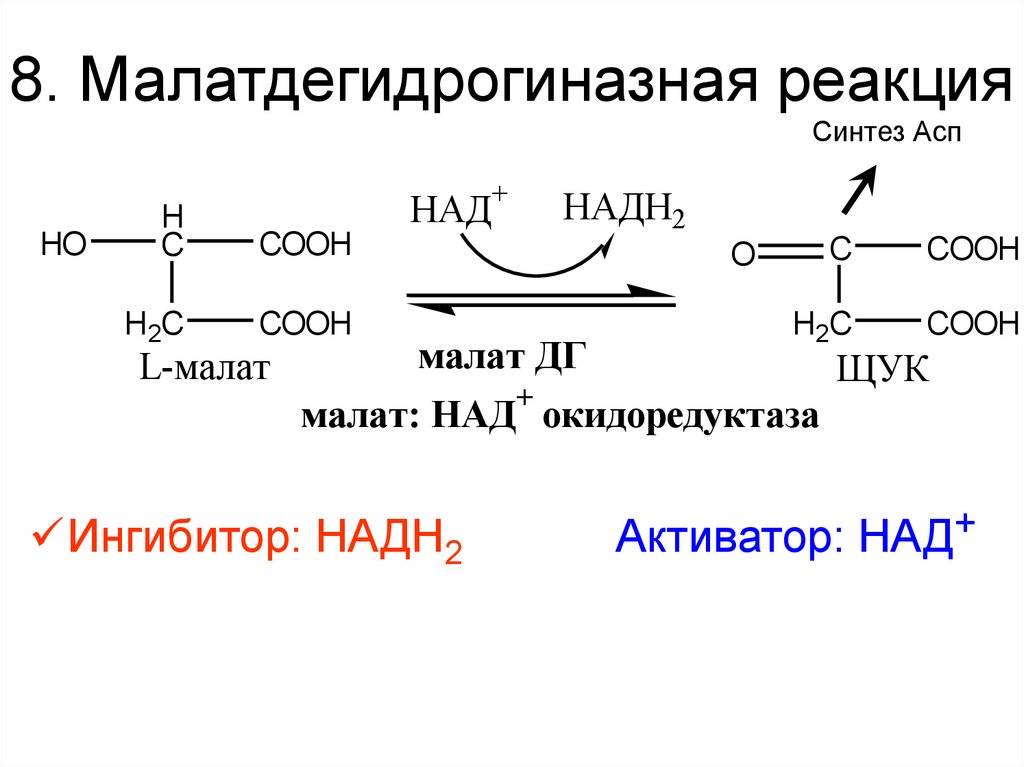
38. 8. Малатдегидрогиназная реакция
Синтез АспHO
+
НАДН2
НАД
H
C
COOH
H2C
COOH
L-малат
C
COOH
H2C
COOH
O
малат ДГ
+
ЩУК
малат: НАД окидоредуктаза
Ингибитор: НАДН2
Активатор: НАД+
39. Энергетический баланс одного оборота ЦТК
В 4 ОВР ЦТК образуются 3 НАДН2 и
1 ФАДН2, которые направляются далее в
дыхательную цепь окислительного
фосфорилирования.
В процессе окислительного
фосфорилирования из 1 НАДН2 образуется
3 АТФ, из 1 ФАДН2 – 2 АТФ.
Из ГТФ, образующейся в ЦТК, синтезируется
1 АТФ:
ГТФ + АДФ
ГДФ + АТФ
Таким образом, за 1 цикл ЦТК из 3 НАДН2, 1
ФАДН2 и 1 ГТФ получается 12 АТФ.
40. Регуляция ЦТК
1. Регуляторные ферменты:1. Цитратсинтаза
2. изоцитрат ДГ
3. α-КГ ДГ
4. СДГ
2. Активируют ЦТК – НАД+ и АДФ
3. Ингибирует ЦТК – НАДН2 и АТФ,
(являются продуктами ЦТК и
дыхательной цепи)
41.
4. Индуцирует ферменты ЦТК инсулин,репрессирует ферменты ЦТК глюкагон
5. Аммиак связывает α–КГ и разрывает ЦТК
42. Биологическое значение ЦТК
1. образование водородных эквивалентов,которые в цепи ОФ обеспечивают синтез
АТФ;
2. выполняет ведущую роль в:
глюконеогенезе;
переаминировании и дезаминировании
АК;
синтезе жирный кислот и липогенезе;
синтезе гема.
3. интегрирует все виды обмена веществ
43. IV этап. Окислительное фосфорилирование
История окислительногофосфорилирования
В 1966г. английский ученый
Питер Денис Митчелл
сформулировал
хемиосмотическую
гипотезу объясняющую
принцип окислительного
фосфорилирования.
В 1979г. - Нобелевская
премия
44.
Положения хемиосмотической теории• Цепь окислительного фосфорилирования последовательность переноса Н+ и е-.
• Белковые носители таким образом организованы во
внутренней митохондриальной мембране, что
переносят Н+ через мембрану.
• Т.к. митохондриальная мембрана не проницаема для
Н+ , в процессе дыхания генерируется
электрохимическая разность потенциалов –
мембранный потенциал.
• Под действием мембранного потенциала Н+ из
межмембранного пространства стремятся назад в
матрикс. Этот поток Н+, который можно сравнить с
электрическим током в батарее, он выполняет всю
работу соединяя АДФ с Фн в АТФ.
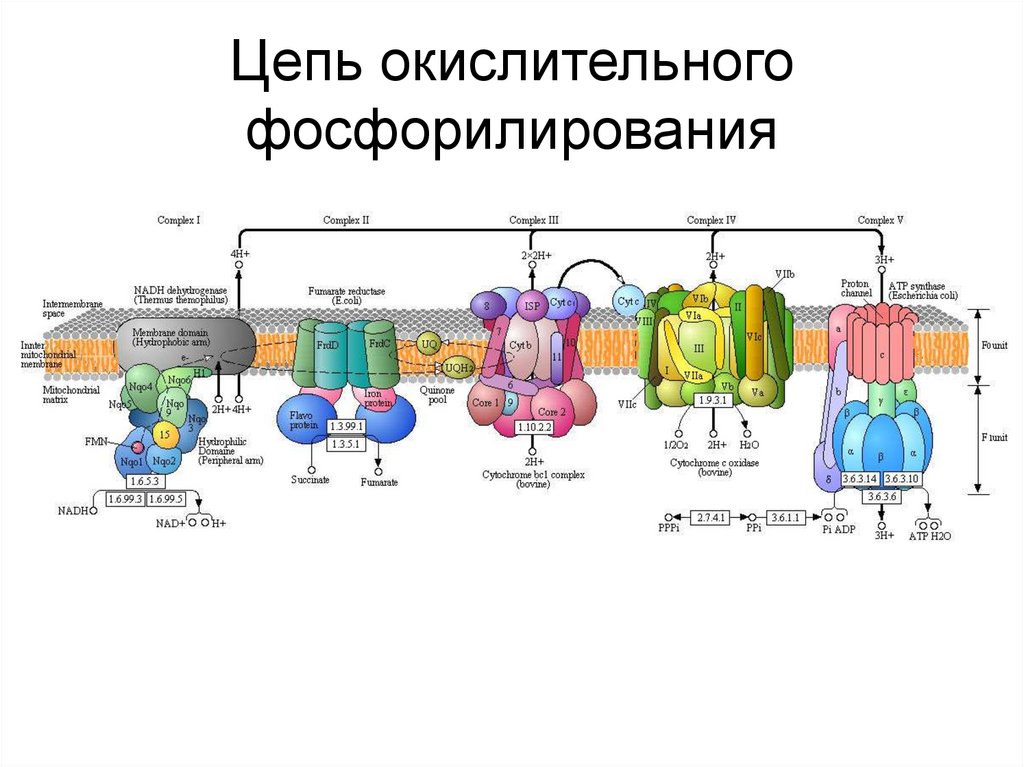
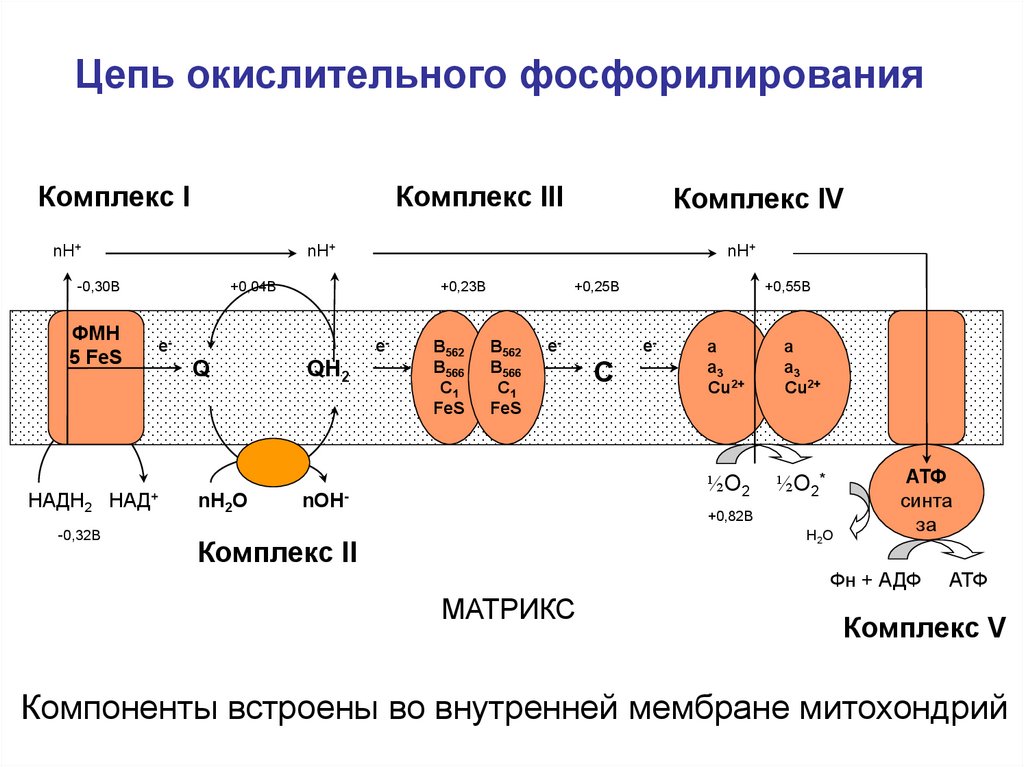
45. Цепь окислительного фосфорилирования
46. Цепь окислительного фосфорилирования
Комплекс IКомплекс III
nН+
nН+
е-
Q
nН2О
+0,25В
+0,23В
е-
НАДН2 НАД+
-0,32В
nН+
+0,04В
-0,30В
ФМН
5 FeS
Комплекс IV
QН2
B562
B566
C1
FeS
B562
B566
C1
FeS
е-
nОН-
+0,55В
е-
C
a
a3
Cu2+
a
a3
Cu2+
½О2
½О2*
+0,82В
Н2О
Комплекс II
АТФ
синта
за
Фн + АДФ
МАТРИКС
АТФ
Комплекс V
Компоненты встроены во внутренней мембране митохондрий
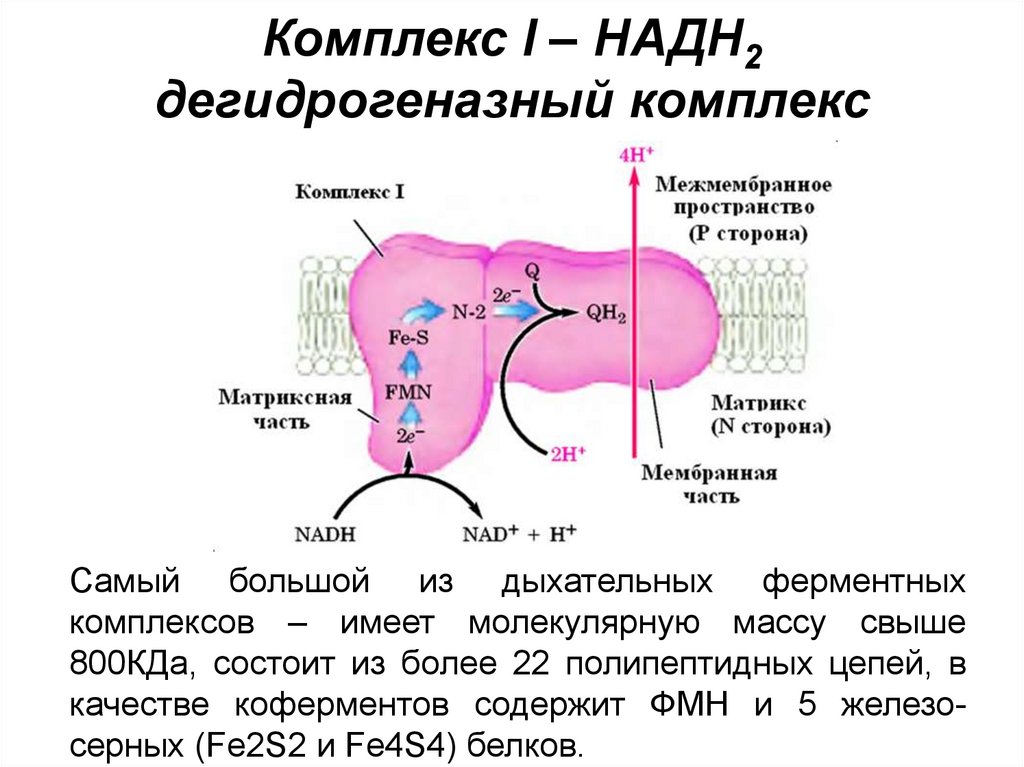
47. Комплекс I – НАДН2 дегидрогеназный комплекс
Cамый большой из дыхательных ферментныхкомплексов – имеет молекулярную массу свыше
800КДа, состоит из более 22 полипептидных цепей, в
качестве коферментов содержит ФМН и 5 железосерных (Fe2S2 и Fe4S4) белков.
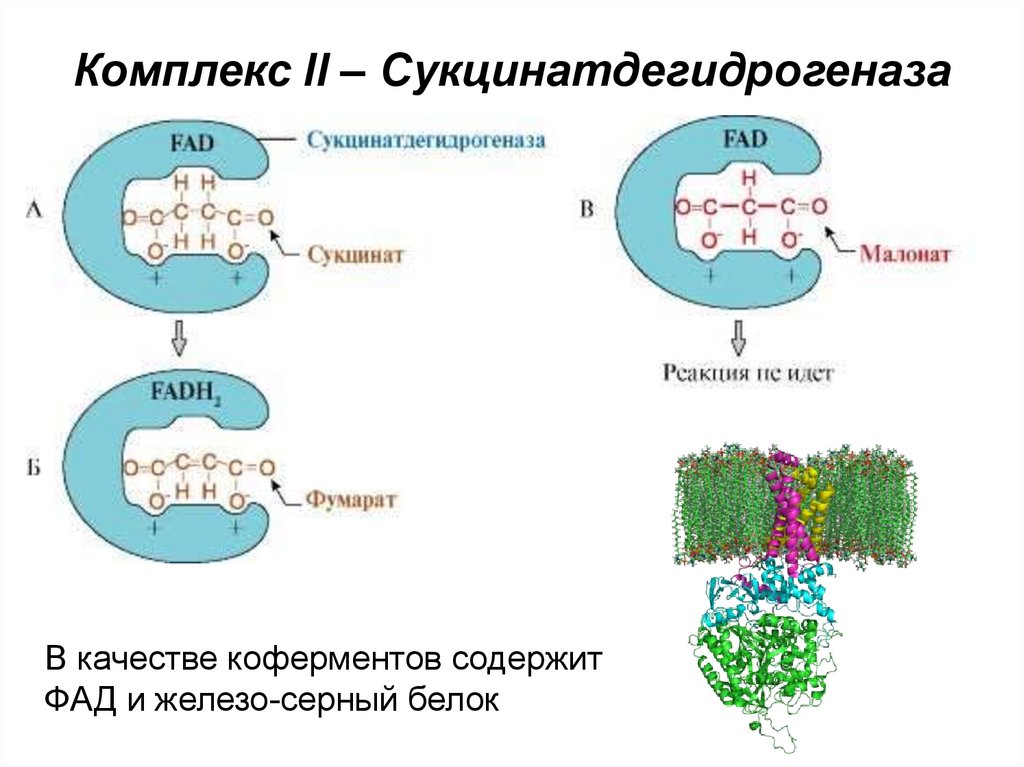
48. Комплекс II – Сукцинатдегидрогеназа
В качестве коферментов содержитФАД и железо-серный белок
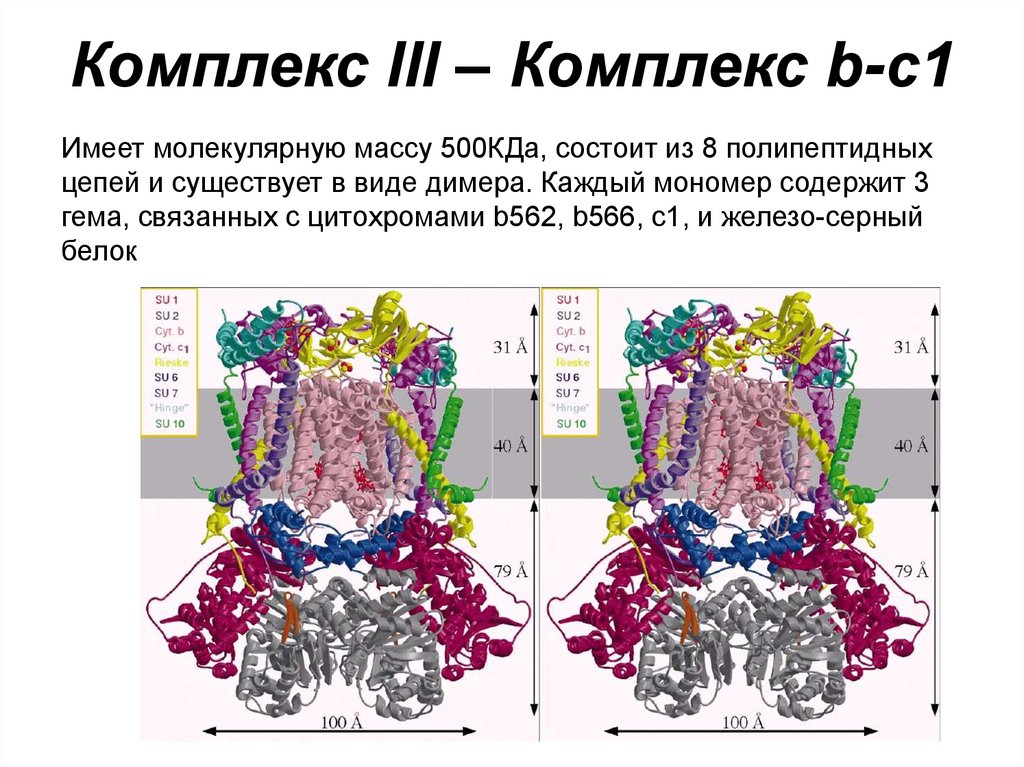
49. Комплекс III – Комплекс b-c1
Имеет молекулярную массу 500КДа, состоит из 8 полипептидныхцепей и существует в виде димера. Каждый мономер содержит 3
гема, связанных с цитохромами b562, b566, с1, и железо-серный
белок
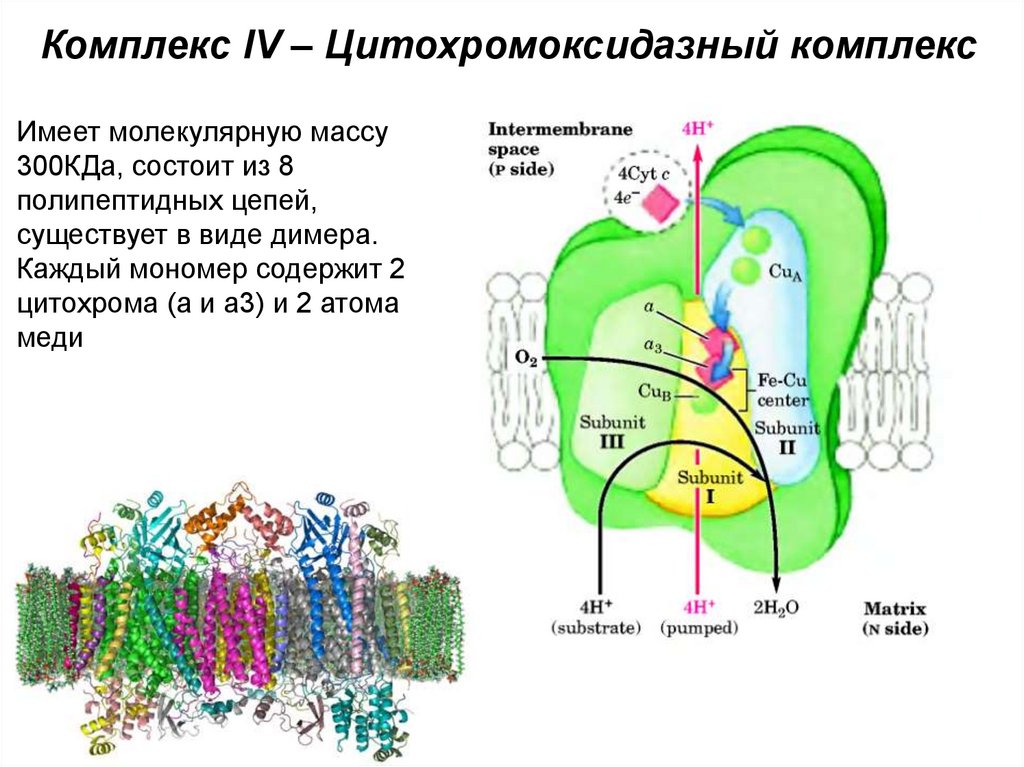
50. Комплекс IV – Цитохромоксидазный комплекс
Имеет молекулярную массу300КДа, состоит из 8
полипептидных цепей,
существует в виде димера.
Каждый мономер содержит 2
цитохрома (а и а3) и 2 атома
меди
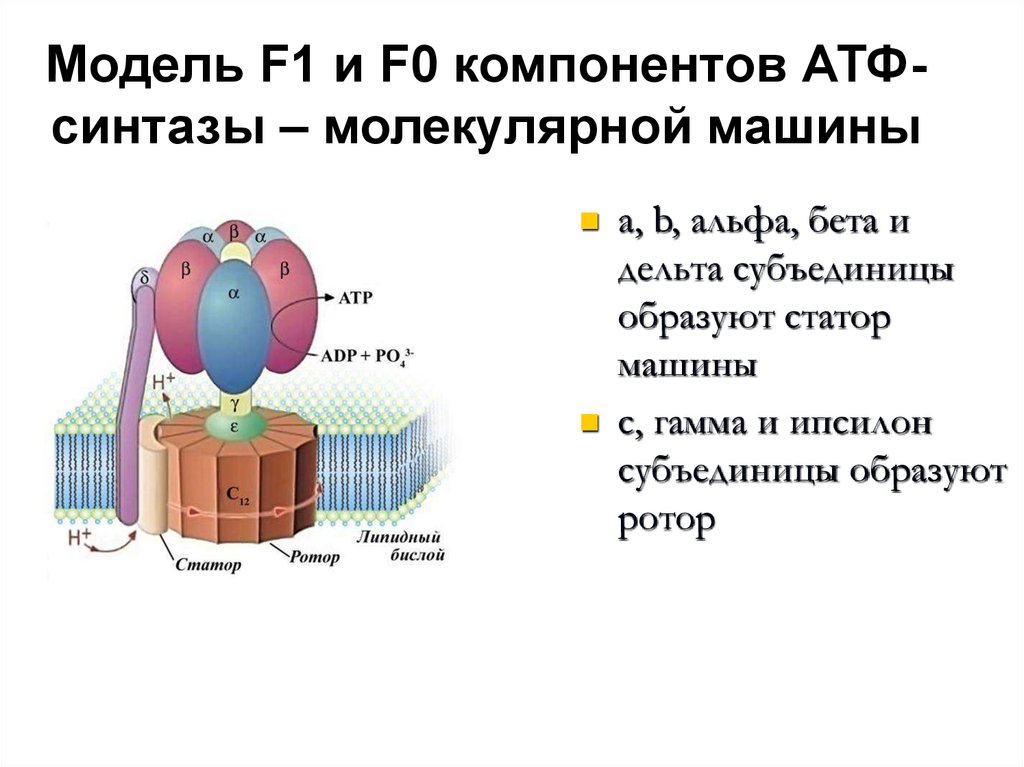
51. Модель F1 и F0 компонентов АТФ-синтазы – молекулярной машины
Модель F1 и F0 компонентов АТФсинтазы – молекулярной машиныa, b, альфа, бета и
дельта субъединицы
образуют статор
машины
с, гамма и ипсилон
субъединицы образуют
ротор
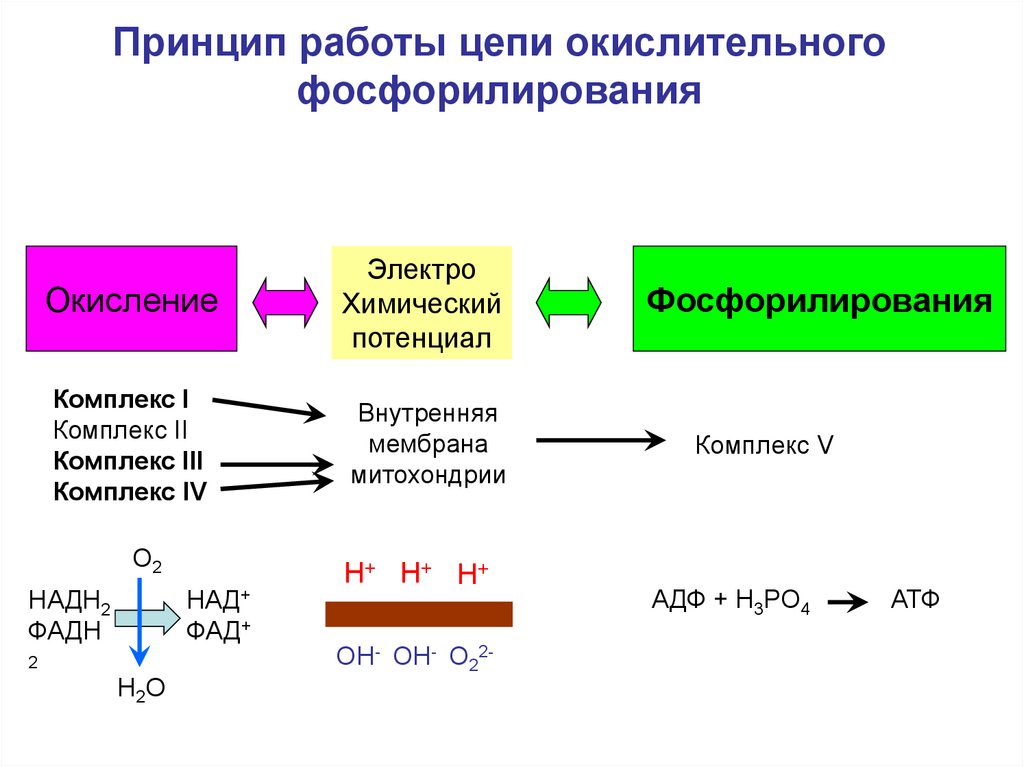
52. Принцип работы цепи окислительного фосфорилирования
ОкислениеЭлектро
Химический
потенциал
Комплекс I
Комплекс II
Комплекс III
Комплекс IV
Внутренняя
мембрана
митохондрии
О2
НАДН2
ФАДН
НАД+
ФАД+
2
Н2О
Н+ Н + Н+
ОН- ОН- О22-
Фосфорилирования
Комплекс V
АДФ + Н3РО4
АТФ
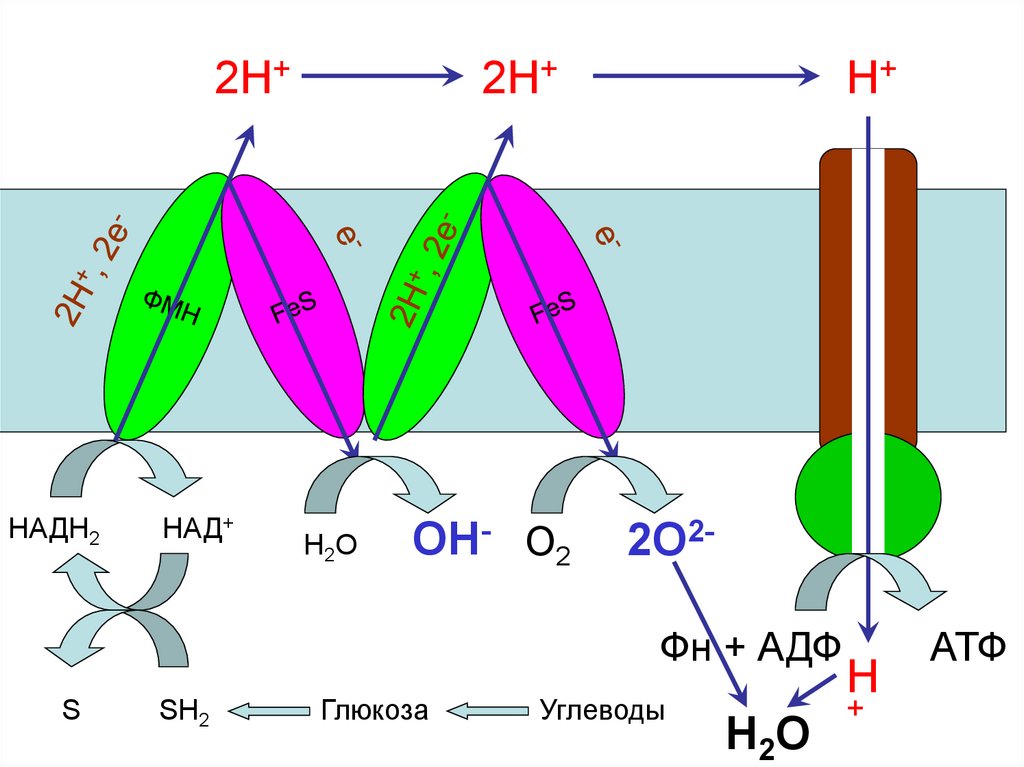
53.
2Н+НАДН2
НАД+
2Н+
Н 2О
ОН- О2
Н+
2О2Фн + АДФ
S
SH2
Глюкоза
Углеводы
Н 2О
Н
+
АТФ
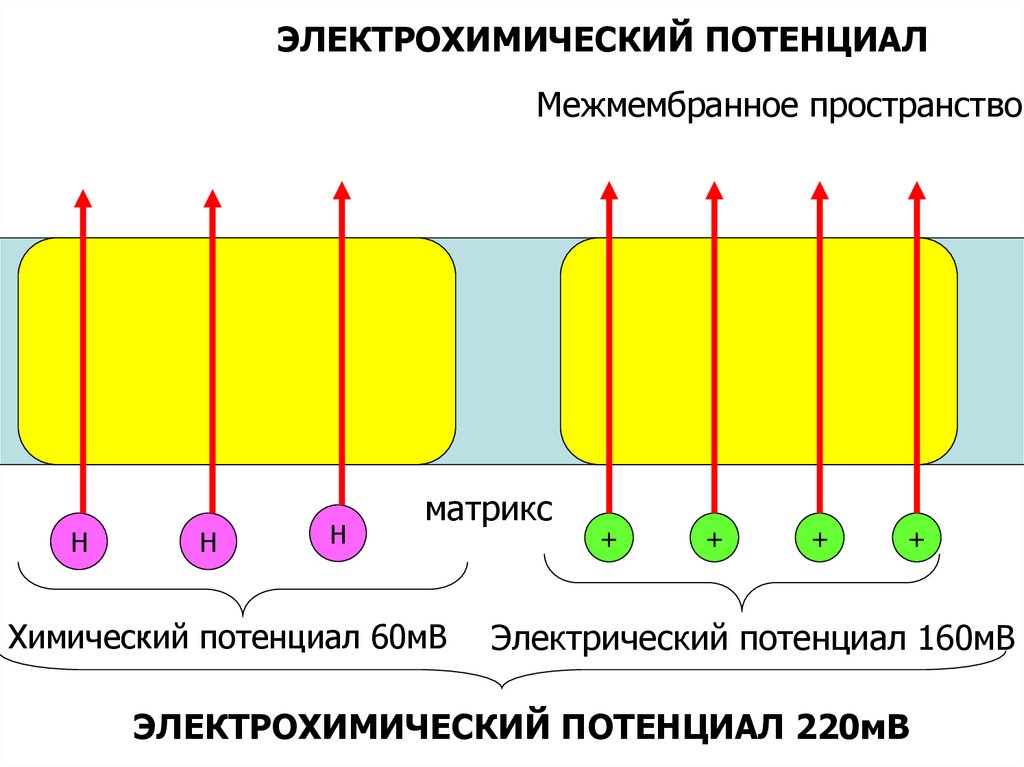
54.
ЭЛЕКТРОХИМИЧЕСКИЙ ПОТЕНЦИАЛМежмембранное пространство
Н
Н
Н
матрикс
Химический потенциал 60мВ
+
+
+
+
Электрический потенциал 160мВ
ЭЛЕКТРОХИМИЧЕСКИЙ ПОТЕНЦИАЛ 220мВ
55.
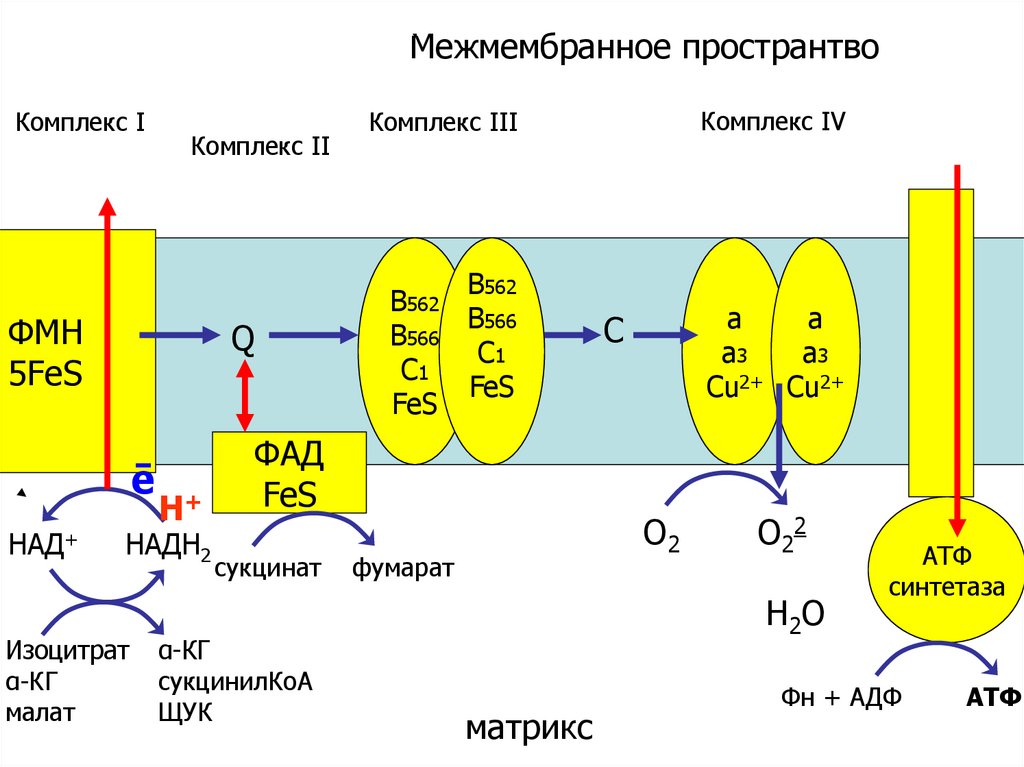
окислениеМежмембранное пространтво
Комплекс Ι
Комплекс ΙΙ
ФМН
5FеS
Q
ē
НАД+
Н+
НАДН2
Изоцитрат
α-КГ
малат
В562
В562
В566
В566
С1
С1
FeS
FeS
ФАД
FeS
сукцинат
α-КГ
сукцинилКоА
ЩУК
Комплекс ΙV
Комплекс ΙΙΙ
а
а
а3
а3
Сu2+ Сu2+
C
О2
фумарат
О22
Н2 О
матрикс
АТФ
синтетаза
Фн + АДФ
АТФ
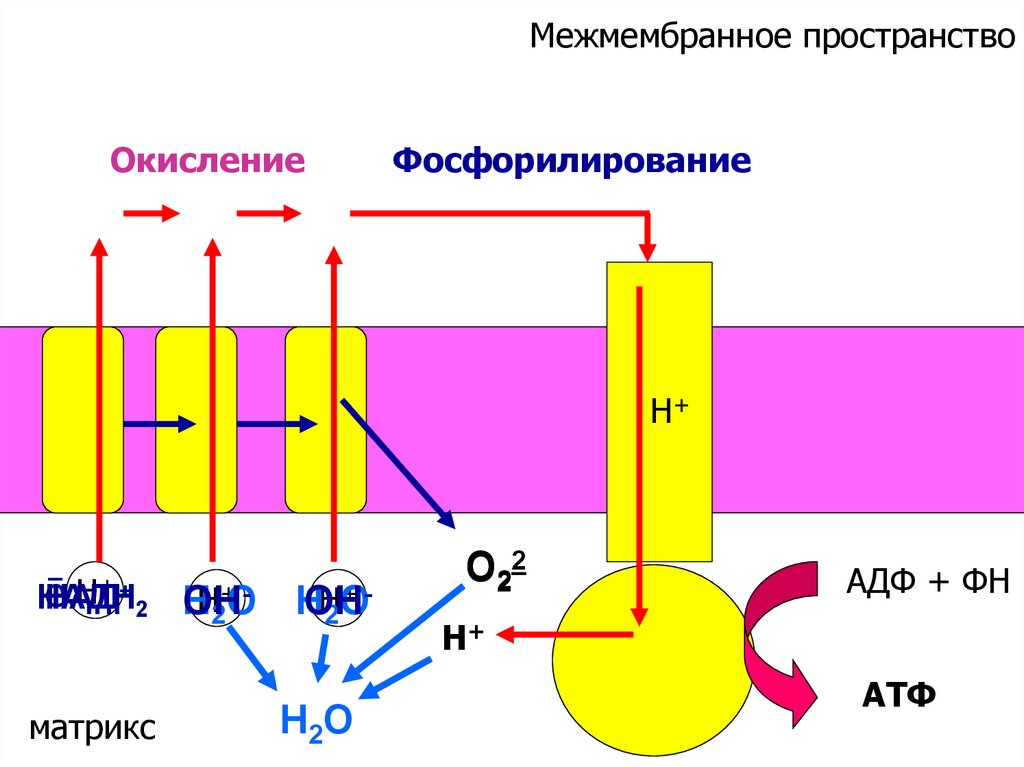
56.
Межмембранное пространствоОкисление
Фосфорилирование
Н+
ē Н+ + 2 Н
НАДН
НАД
Н2+ООН
матрикс
+Н2О
Н
ОН
Н2О
О22
АДФ + ФН
Н+
АТФ
57.
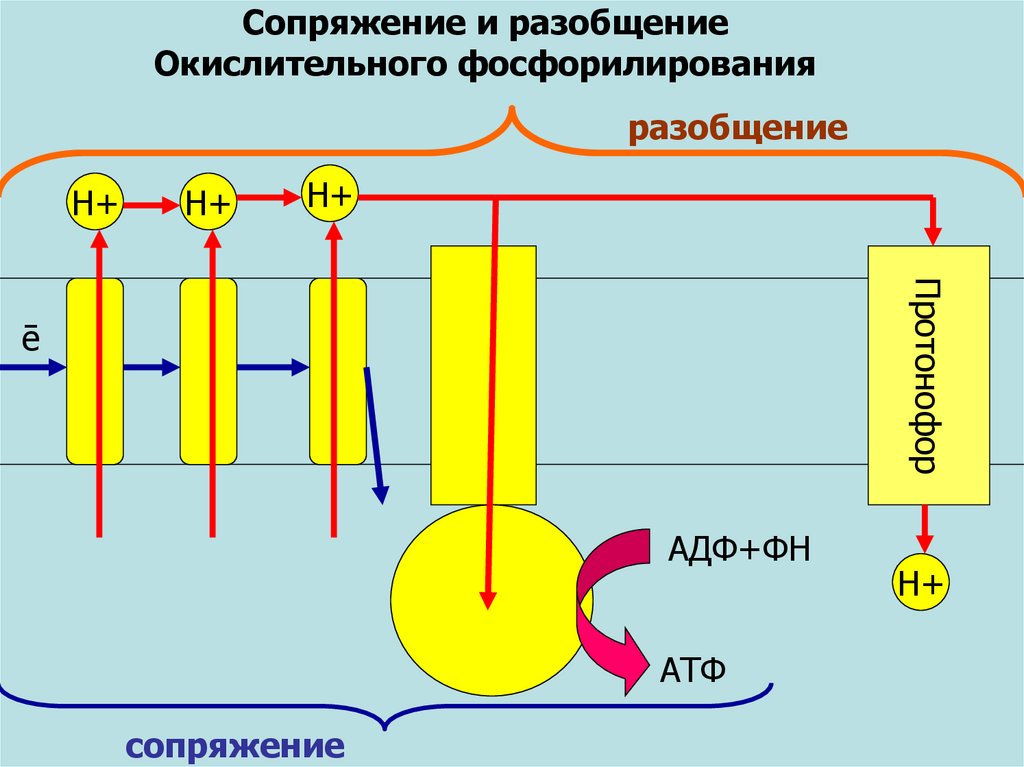
Сопряжение и разобщениеОкислительного фосфорилирования
разобщение
Н+
Н+
Н+
Протонофор
ē
АДФ+ФН
АТФ
сопряжение
Н+
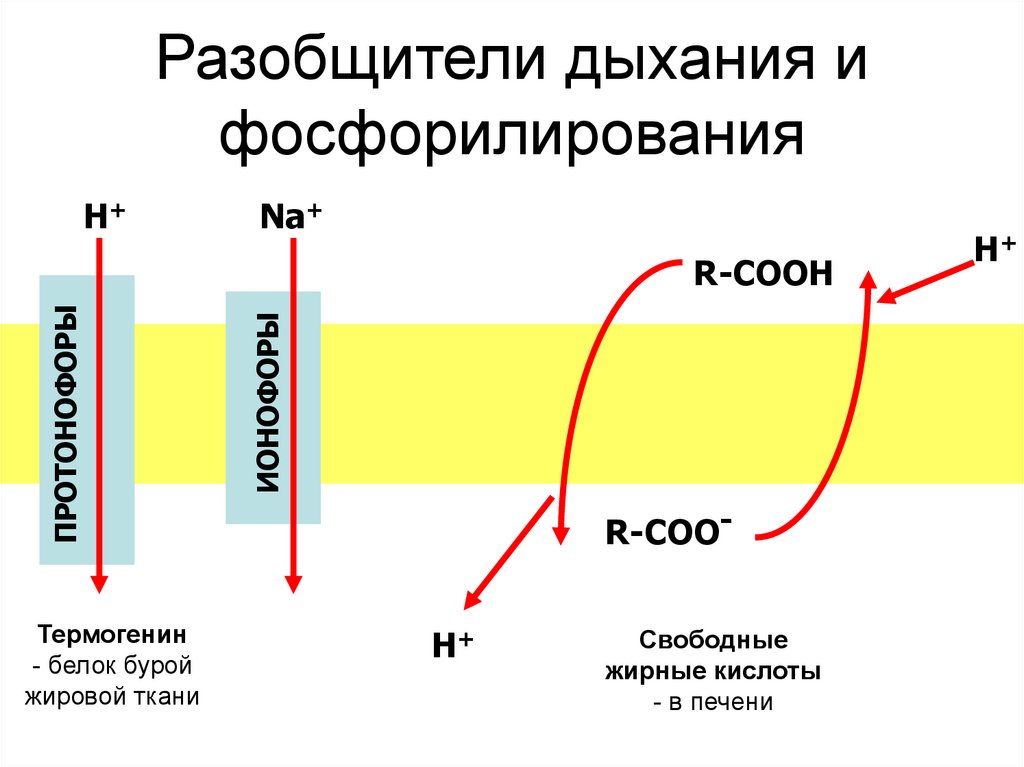
58. Разобщители дыхания и фосфорилирования
Н+Na+
Термогенин
- белок бурой
жировой ткани
ИОНОФОРЫ
ПРОТОНОФОРЫ
R-СООН
R-СОО-
Н+
Свободные
жирные кислоты
- в печени
Н+
59. 2,4-Динитрофенол
• 2,4-динитрофенол являетсяклассическим разобщителем
окислительного фосфорилирования.
При действии на митохондрии
стимулирует их дыхание, но ингибирует
сопряженное с ним фосфорилирование,
т.е. синтез АТФ из АДФ и фосфата.
60. Дыхательный контроль
Интенсивности дыхания митохондрий зависитот концентрации АДФ.
В результате дыхательного контроля скорость
синтеза АТФ соответствует потребностям
клетки в энергии.
Общее содержание АТФ в организме 30—50г
Молекула АТФ «живёт» меньше минуты.
В сутки у человека синтезируется 40—60 кг
АТФ и столько же распадается.























 Биология
Биология








