Похожие презентации:
Спектроскопия ядерного магнитного резонанса биомолекул
1.
Спектроскопияядерного магнитного резонанса
биомолекул
и.о. зав. лаб., внс, кбн Тимченко Мария Александровна
2.
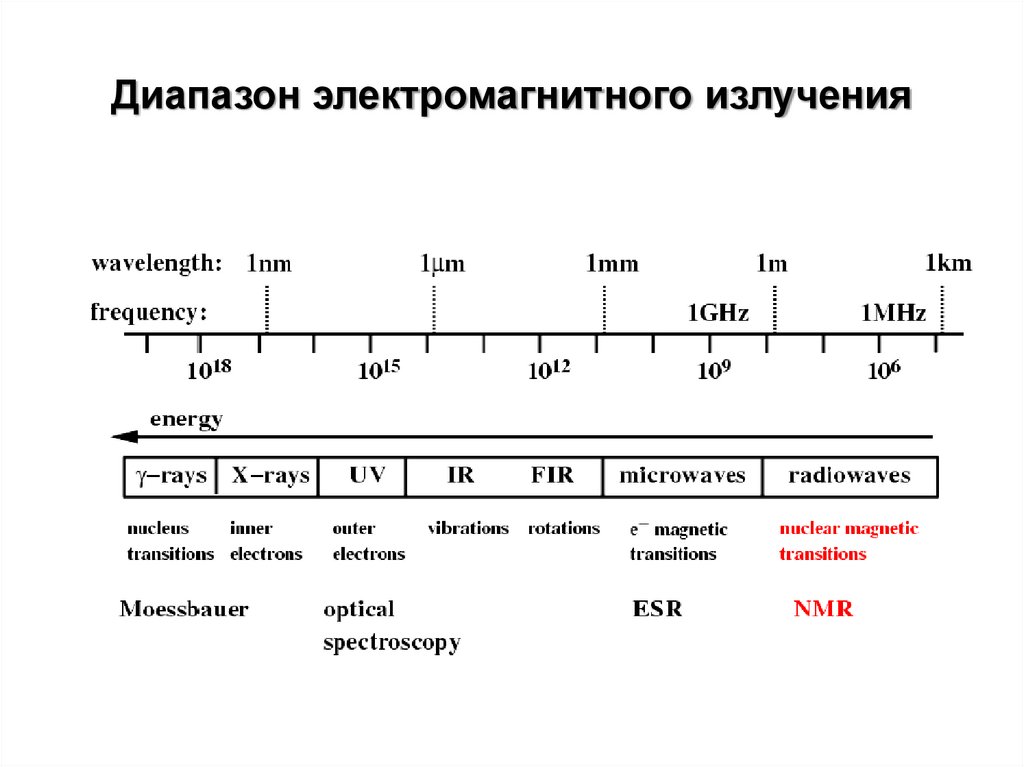
Диапазон электромагнитного излучения3.
Важнейшие области примененияспектроскопии ЯМР
1.
2.
3.
4.
5.
6.
7.
8.
Изучение строения и свойств органических соединений
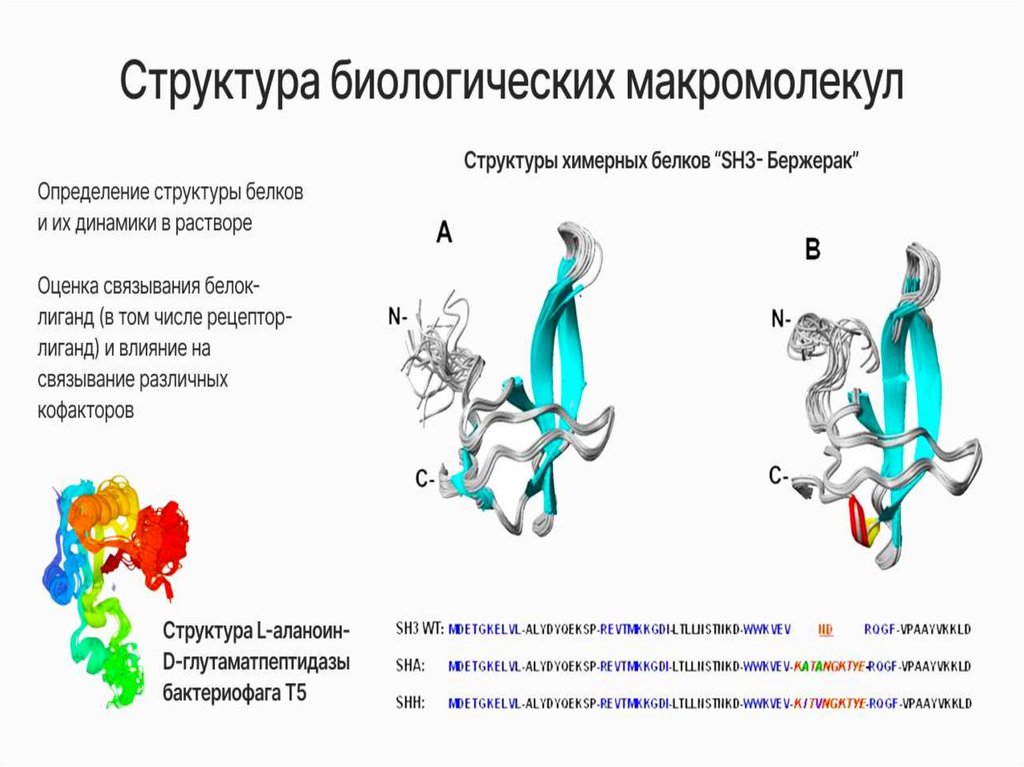
Определение структуры биомакромолекул
Изучение динамических свойств биомолекул
Изучение белок-лигандных взаимодействий (ЯМРскрининг биологически активных соединений)
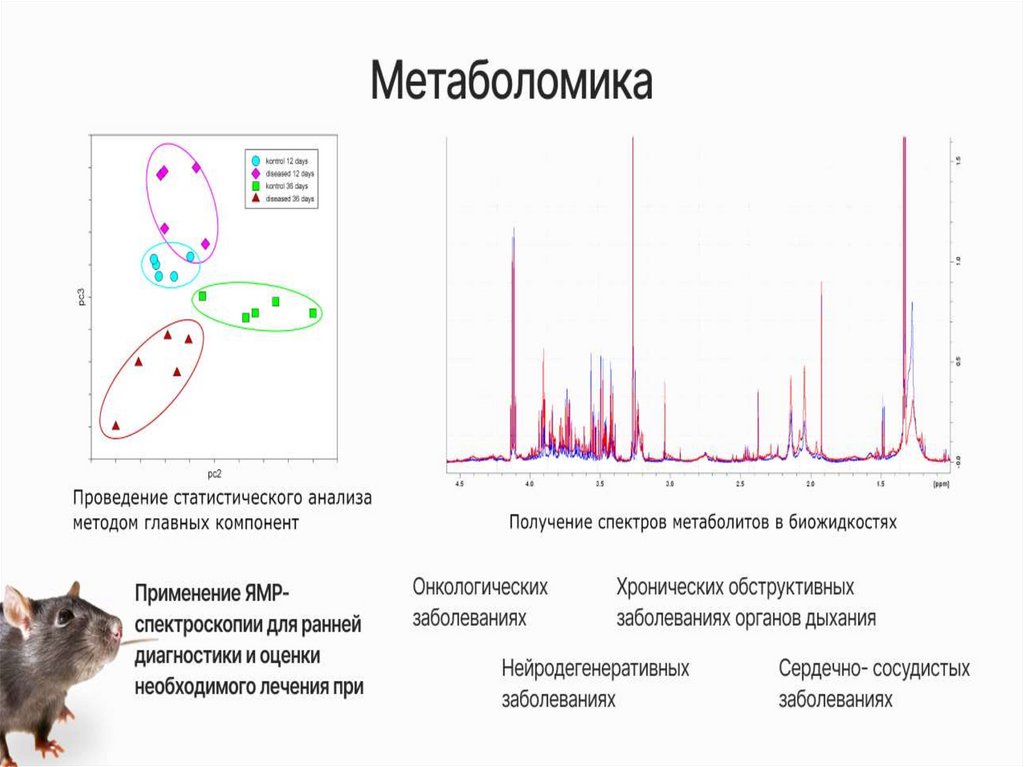
Мониторинг состава биологических жидкостей
(метабономика)
Визуализация объектов живой и неживой природы
(ЯМР-томография)
Мониторинг процессов, происходящих в живом
организме (in-vivo спектроскопия)
Исследование функциональной активности мозга (fMRI)
4.
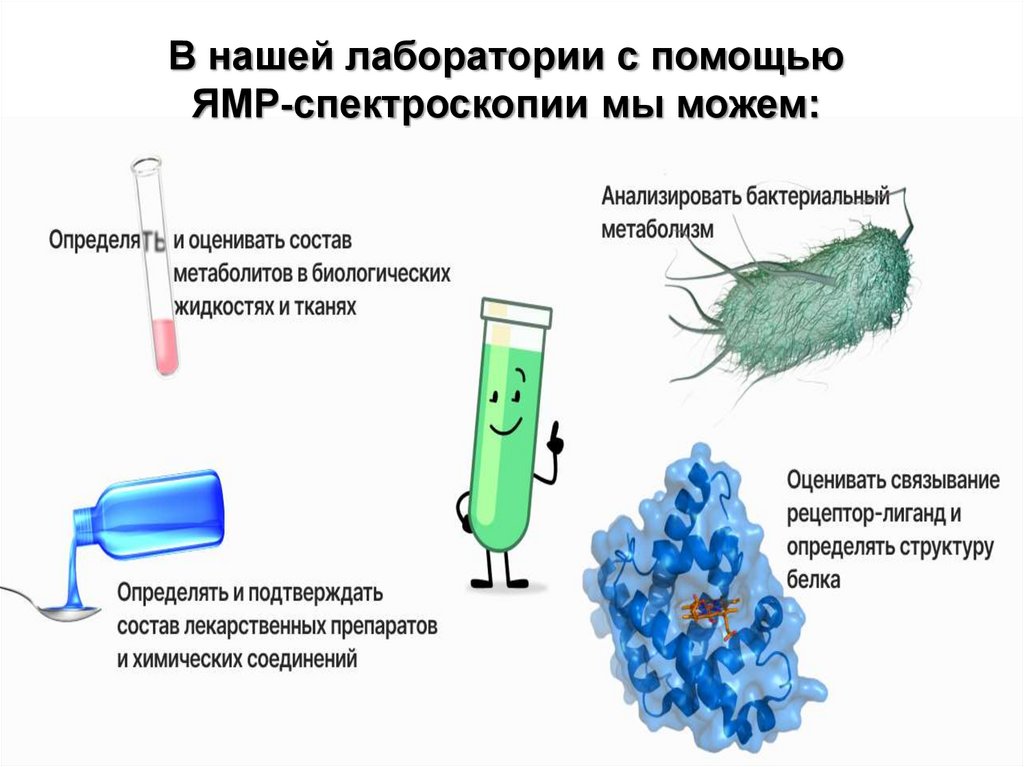
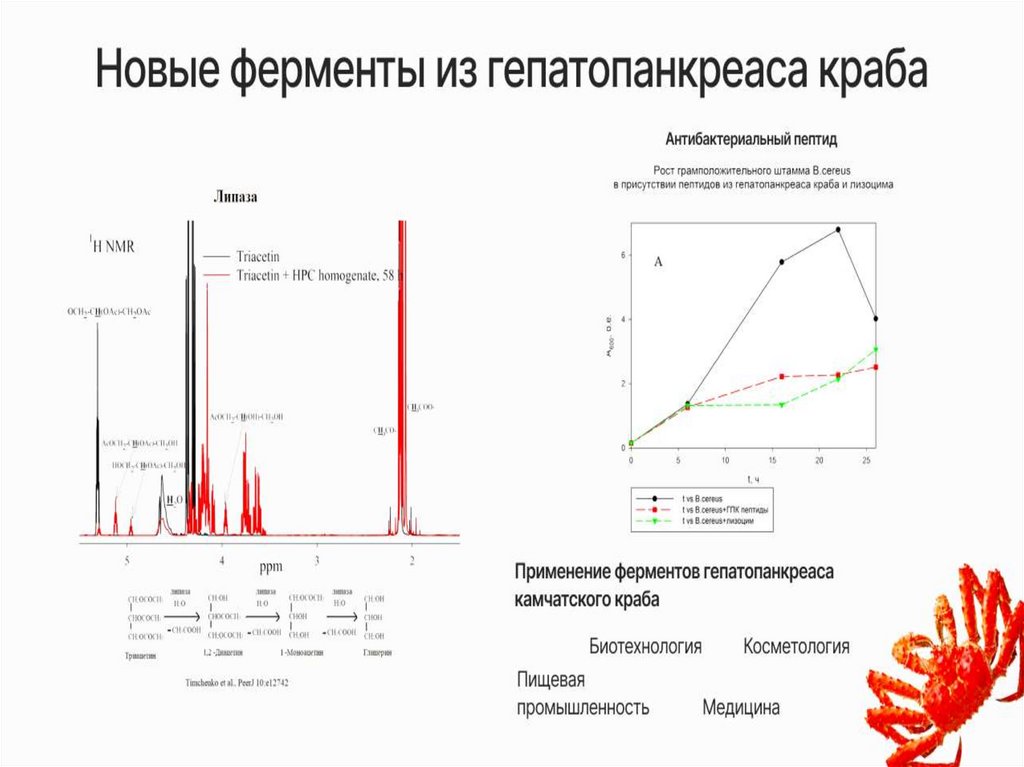
В нашей лаборатории с помощьюЯМР-спектроскопии мы можем:
5.
Статистика PDB от 03 декабря 2020 гhttp://www.rcsb.org/pdb/statistics/holdings.do
SHA
6.
ИСТОРИЯ ЯМРThe Nobel Prize
in Physics 1945
За вклад в развитие представлений о том, что
электрон и атомные ядра имеют собственные
магнитные моменты
Вольфганг Паули (1900-1958)
The Nobel Prize
in Physics 1943
За вклад в развитие метода молекулярных
пучков, открытие и измерение магнитного
момента протона
7.
ИСТОРИЯ ЯМРThe Nobel Prize
in Physics 1944
Isidor Isaac Rabi, USA
The Nobel Prize
in Physics 1952
Felix Bloch, USA
За резонансный метод записи магнитных
свойств атомных ядер
За создание нового метода измерения
ядерной магнитной прецессии и
последующие связанные с ним
открытия
Edward Mills Purcell, USA
The Nobel Prize in
Chemistry 1991
Richard R. Ernst, Switzerland
За вклад в развитие методологии
спектроскопии ядерного магнитного
резонанса (ЯМР) высокого разрешения
The Nobel Prize in
Chemistry 2002
Kurt Wűthrich , Switzerland
За развитие методов спектроскопии
ядерного магнитного резонанса для
исследования трехмерной структуры
биологических макромолекул в
растворе
The Nobel Prize in
Physiology or
Medicine 2003
Paul C. Lauterbur, USA
Sir Peter Mansfield, UK
За открытия в области визуализации
биообъектов
8.
ИСТОРИЯ ЯМРЕще до Блоха и Перселла
наблюдал сигналы ЯМР в
конденсированной фазе, но не добился
надежной воспроизводимости результатов
и не опубликовал их
1941 г. - впервые зарегистрировал сигнал ядерного магнитного
резонанса
1944 г. - открытие электронного парамагнитного резонанса
9.
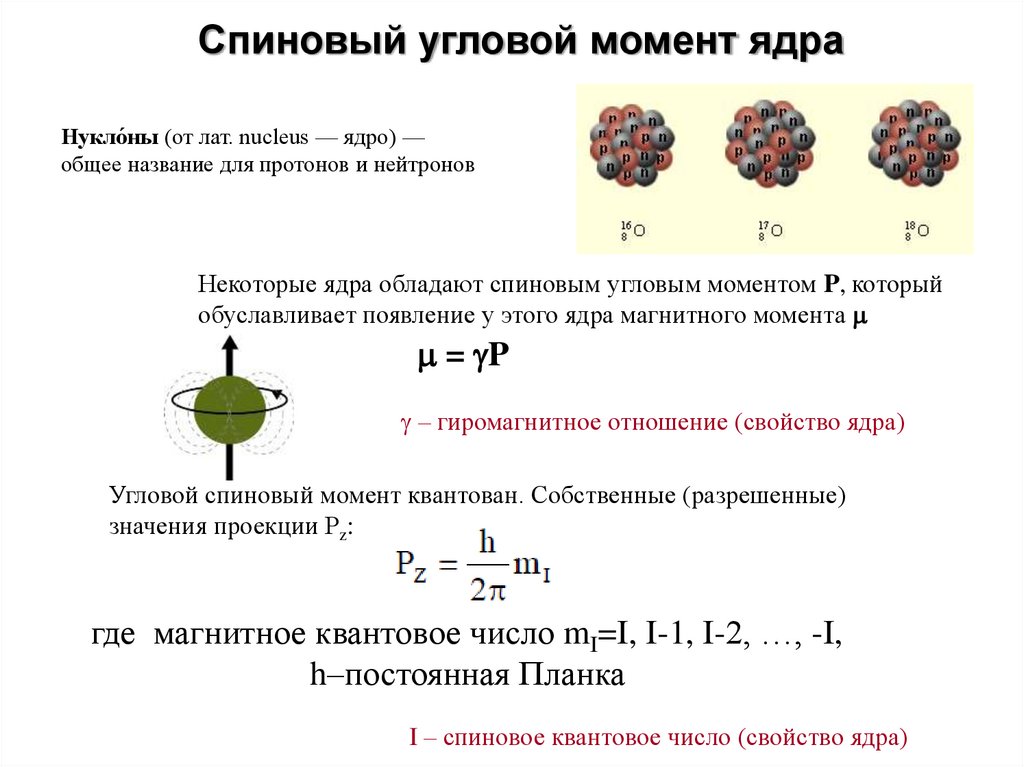
Спиновый угловой момент ядраНукло́ны (от лат. nucleus — ядро) —
общее название для протонов и нейтронов
Некоторые ядра обладают спиновым угловым моментом P, который
обуславливает появление у этого ядра магнитного момента
= P
– гиромагнитное отношение (свойство ядра)
Угловой спиновый момент квантован. Собственные (разрешенные)
значения проекции Рz:
Pz=ħmI
где магнитное квантовое число mI=I, I-1, I-2, …, -I,
h–постоянная Планка
I – спиновое квантовое число (свойство ядра)
10.
11.
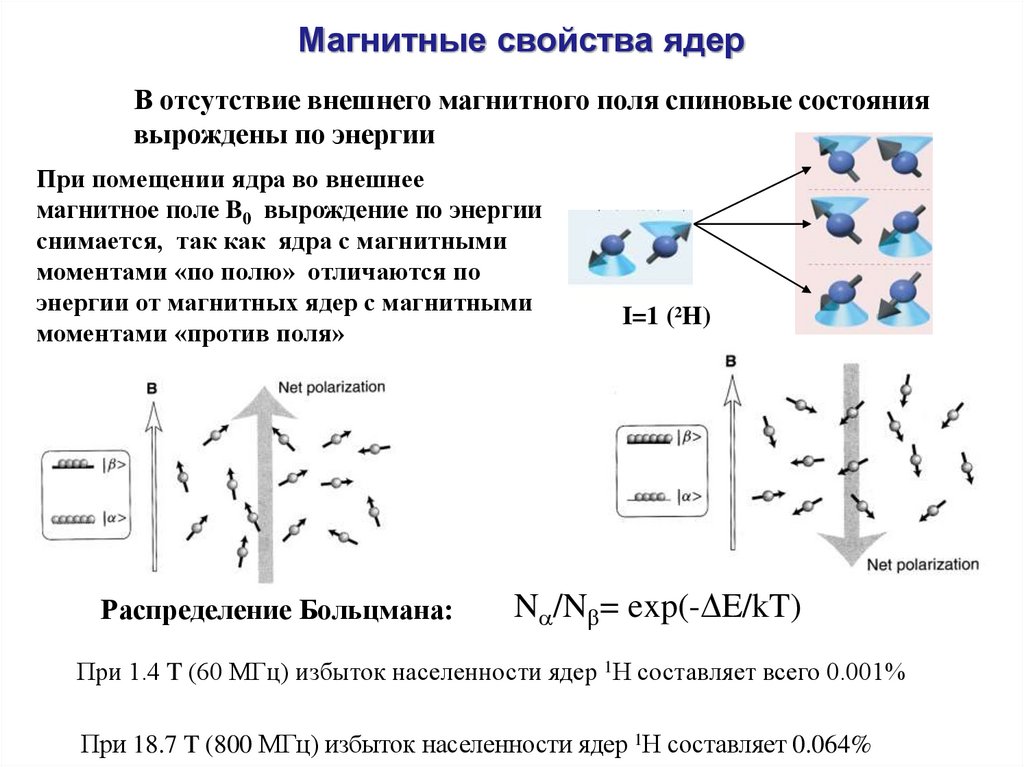
Магнитные свойства ядерВ отсутствие внешнего магнитного поля спиновые состояния
вырождены по энергии
При помещении ядра во внешнее
магнитное поле B0 вырождение по энергии
снимается, так как ядра с магнитными
моментами «по полю» отличаются по
энергии от магнитных ядер с магнитными
моментами «против поля»
Распределение Больцмана:
I=1 (2H)
N /N = exp(- E/kT)
При 1.4 T (60 МГц) избыток населенности ядер 1Н составляет всего 0.001%
При 18.7 T (800 МГц) избыток населенности ядер 1Н составляет 0.064%
12.
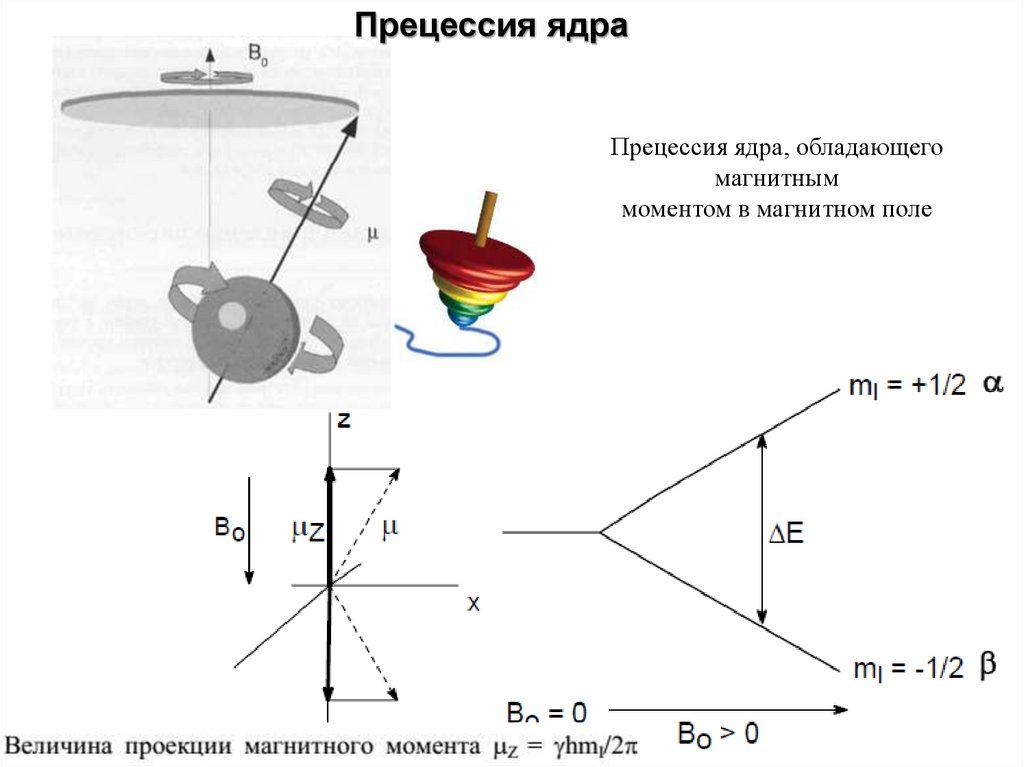
Прецессия ядраПрецессия ядра, обладающего
магнитным
моментом в магнитном поле
13.
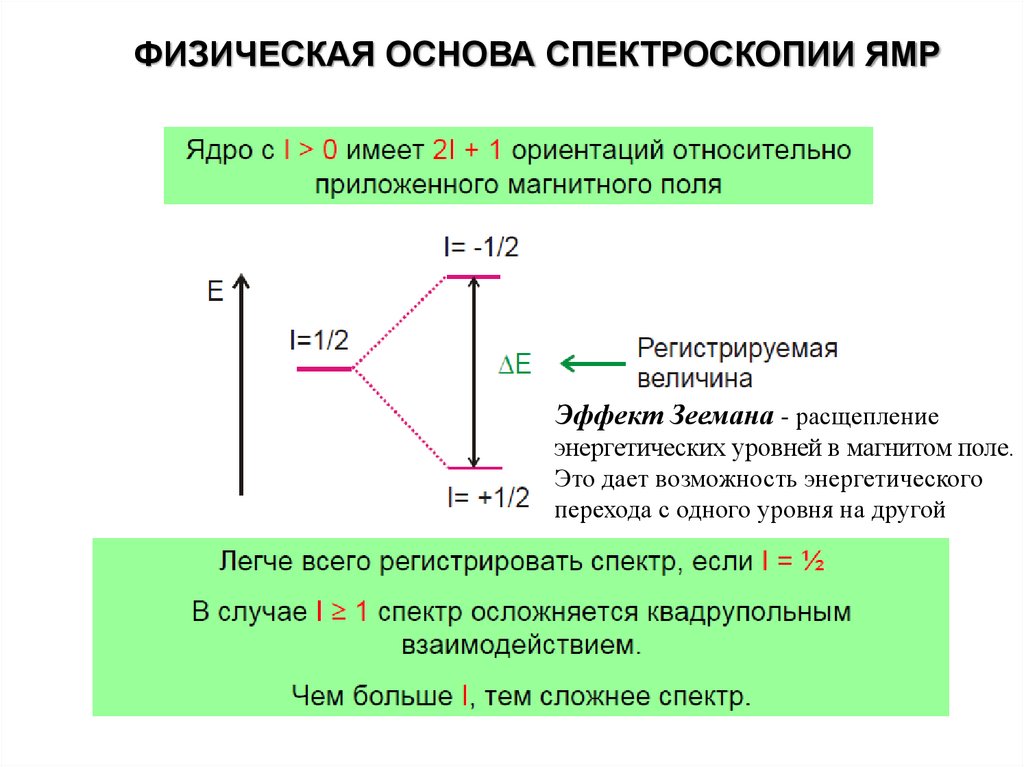
ФИЗИЧЕСКАЯ ОСНОВА СПЕКТРОСКОПИИ ЯМРЭффект Зеемана - расщепление
энергетических уровней в магнитом поле.
Это дает возможность энергетического
перехода с одного уровня на другой
14.
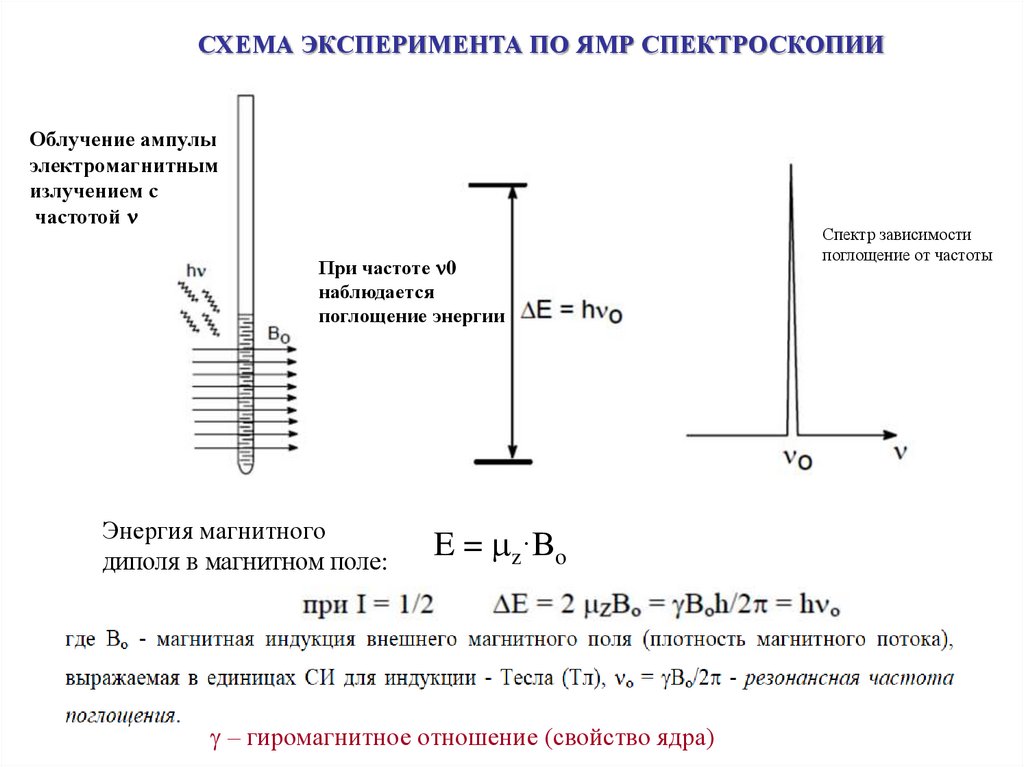
СХЕМА ЭКСПЕРИМЕНТА ПО ЯМР СПЕКТРОСКОПИИОблучение ампулы
электромагнитным
излучением с
частотой
При частоте 0
наблюдается
поглощение энергии
Энергия магнитного
диполя в магнитном поле:
E = z·Bo
– гиромагнитное отношение (свойство ядра)
Спектр зависимости
поглощение от частоты
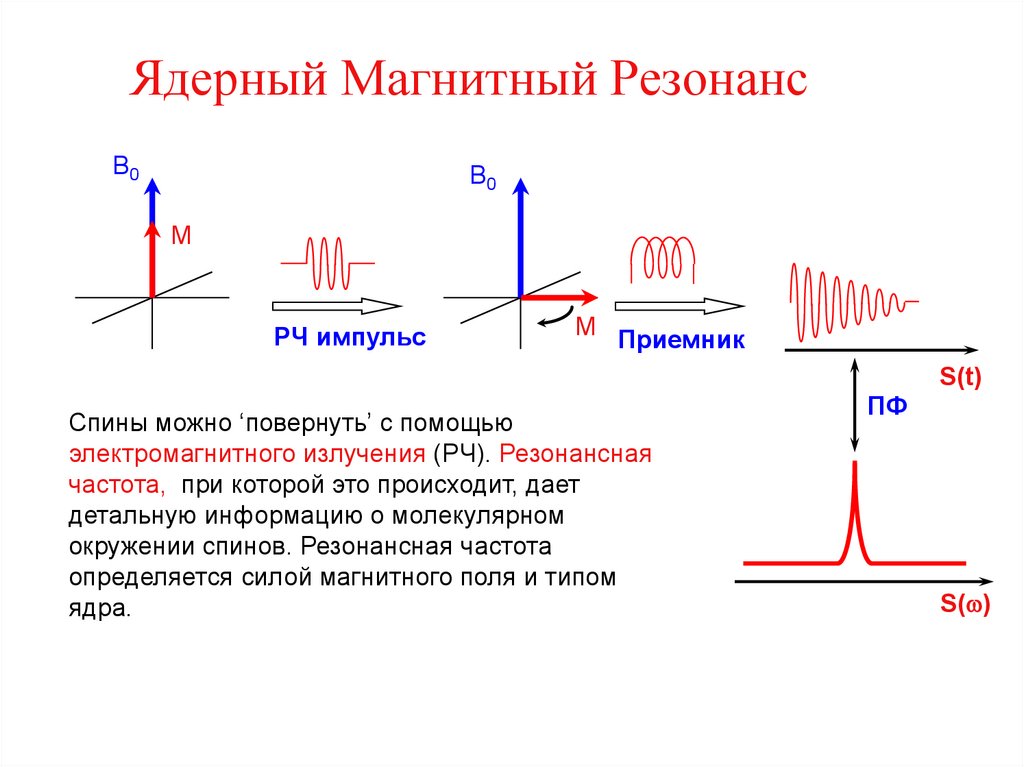
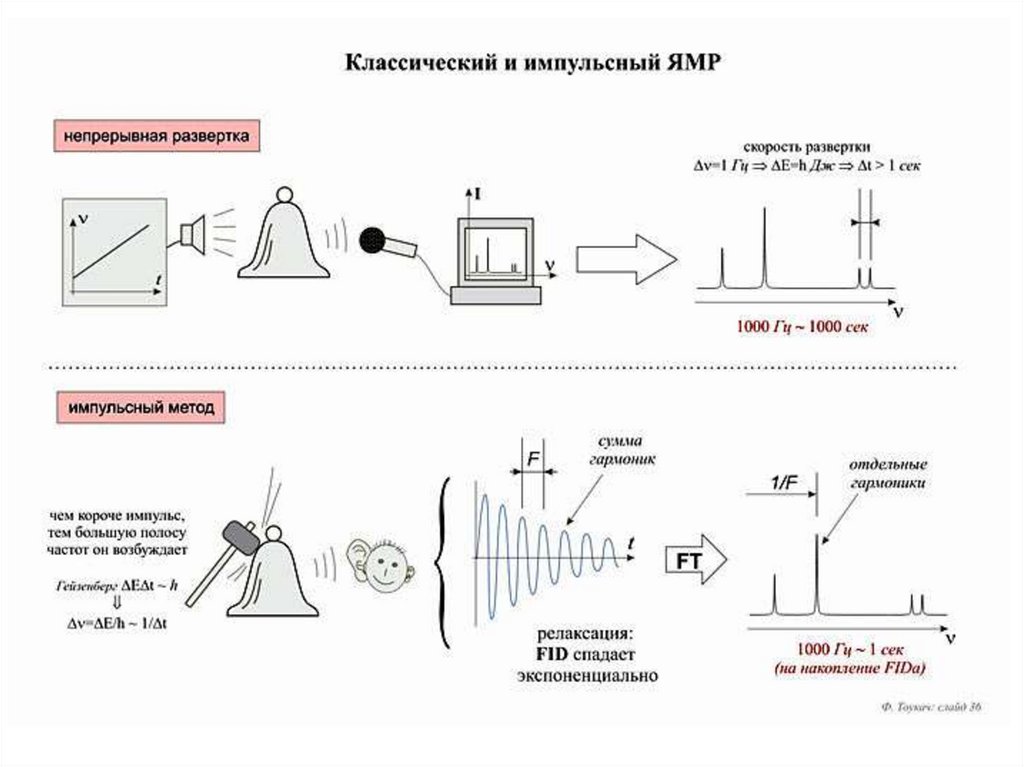
15. Ядерный Магнитный Резонанс
B0B0
M
РЧ импульс
M Приемник
S(t)
Спины можно ‘повернуть’ с помощью
электромагнитного излучения (РЧ). Резонансная
частота, при которой это происходит, дает
детальную информацию о молекулярном
окружении спинов. Резонансная частота
определяется силой магнитного поля и типом
ядра.
ПФ
S(w)
16.
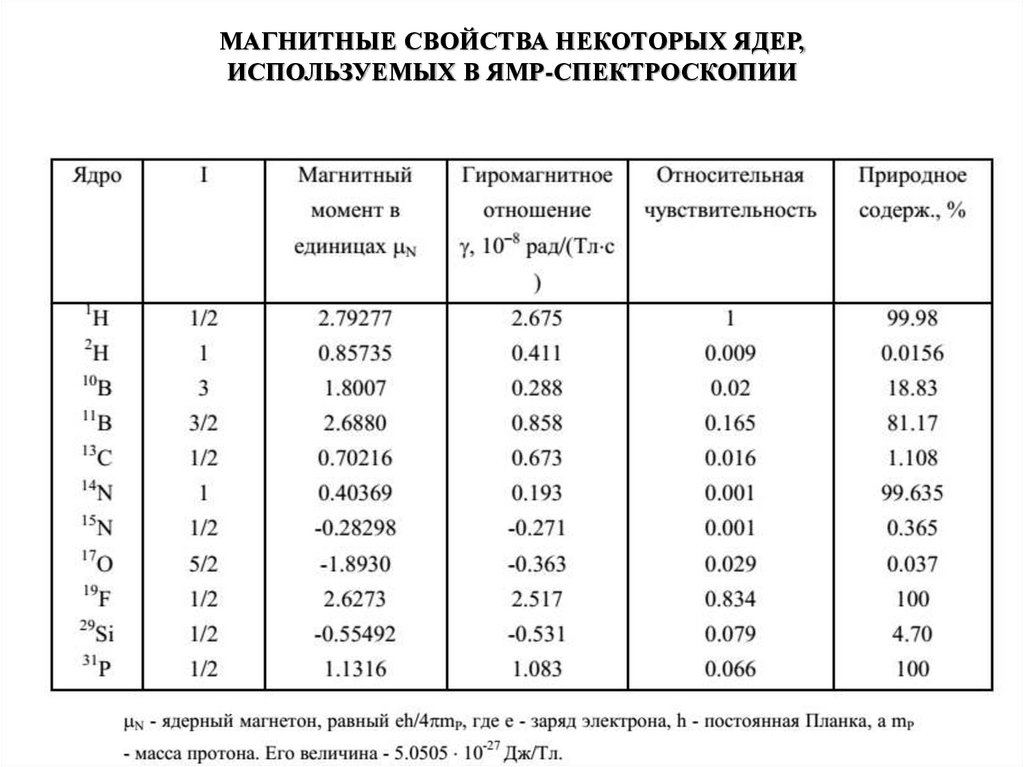
МАГНИТНЫЕ СВОЙСТВА НЕКОТОРЫХ ЯДЕР,ИСПОЛЬЗУЕМЫХ В ЯМР-СПЕКТРОСКОПИИ
17.
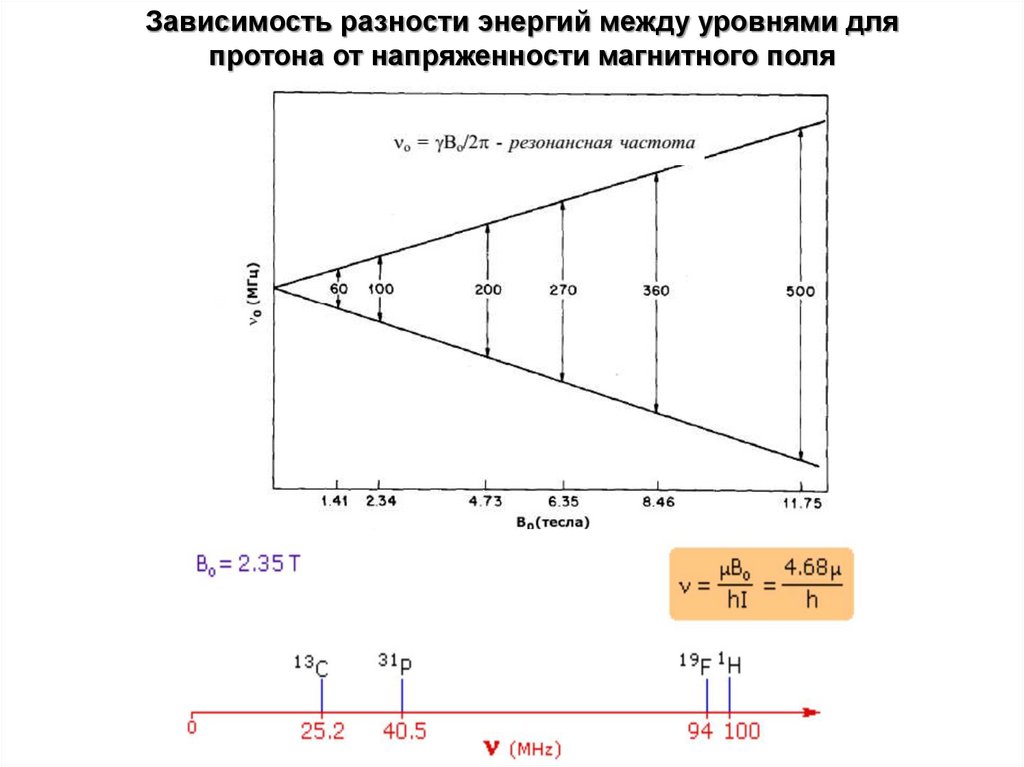
Зависимость разности энергий между уровнями дляпротона от напряженности магнитного поля
18.
19.
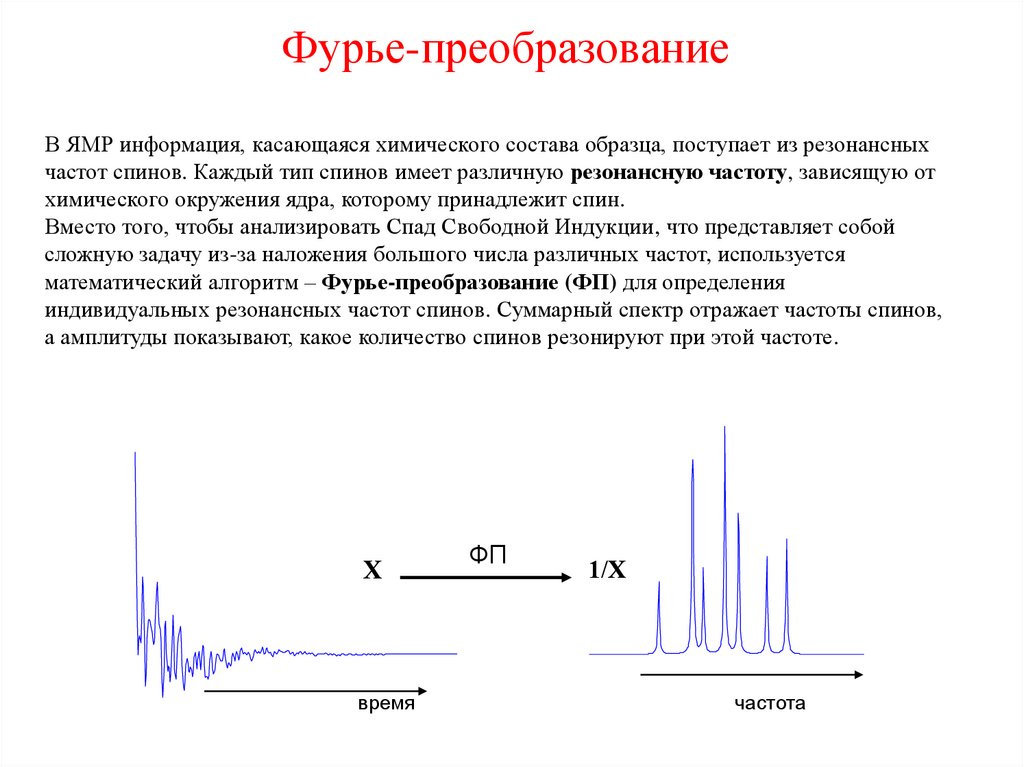
20. Фурье-преобразование
В ЯМР информация, касающаяся химического состава образца, поступает из резонансныхчастот спинов. Каждый тип спинов имеет различную резонансную частоту, зависящую от
химического окружения ядра, которому принадлежит спин.
Вместо того, чтобы анализировать Спад Свободной Индукции, что представляет собой
сложную задачу из-за наложения большого числа различных частот, используется
математический алгоритм – Фурье-преобразование (ФП) для определения
индивидуальных резонансных частот спинов. Суммарный спектр отражает частоты спинов,
а амплитуды показывают, какое количество спинов резонируют при этой частоте.
Х
время
ФП
1/Х
частота
21.
22.
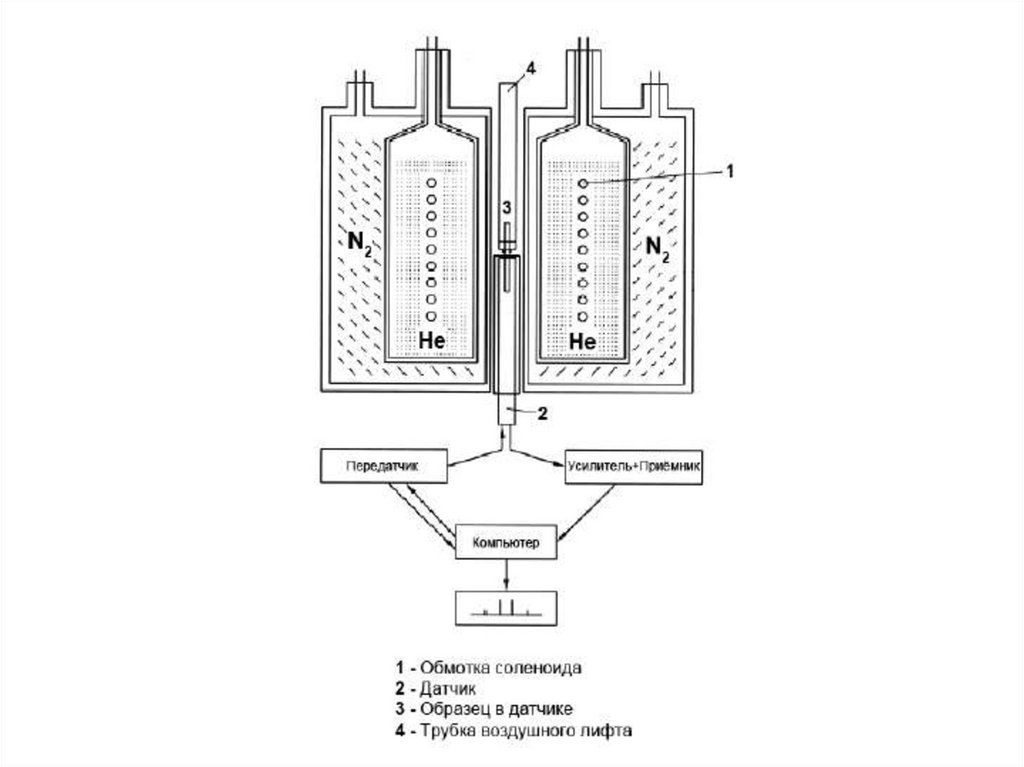
Сердце спектрометра ЯМР - магнитМагнит спектрометра Bruker
AVANCE 600 МГц
Магнит спектрометра Varian
900 МГц
23.
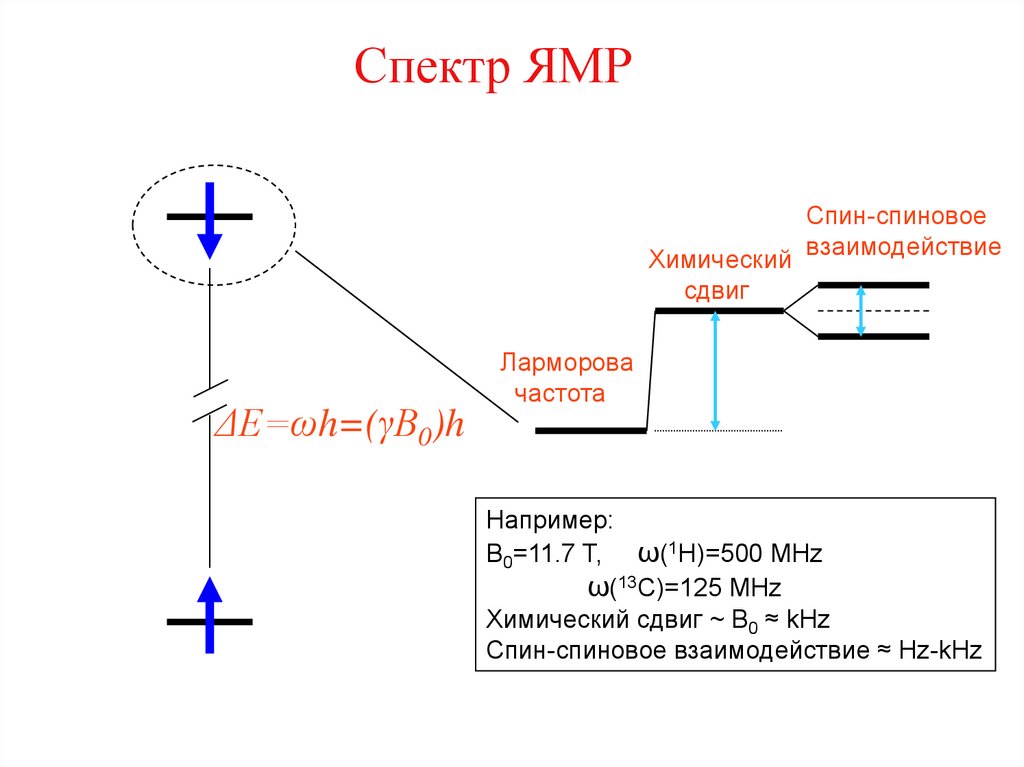
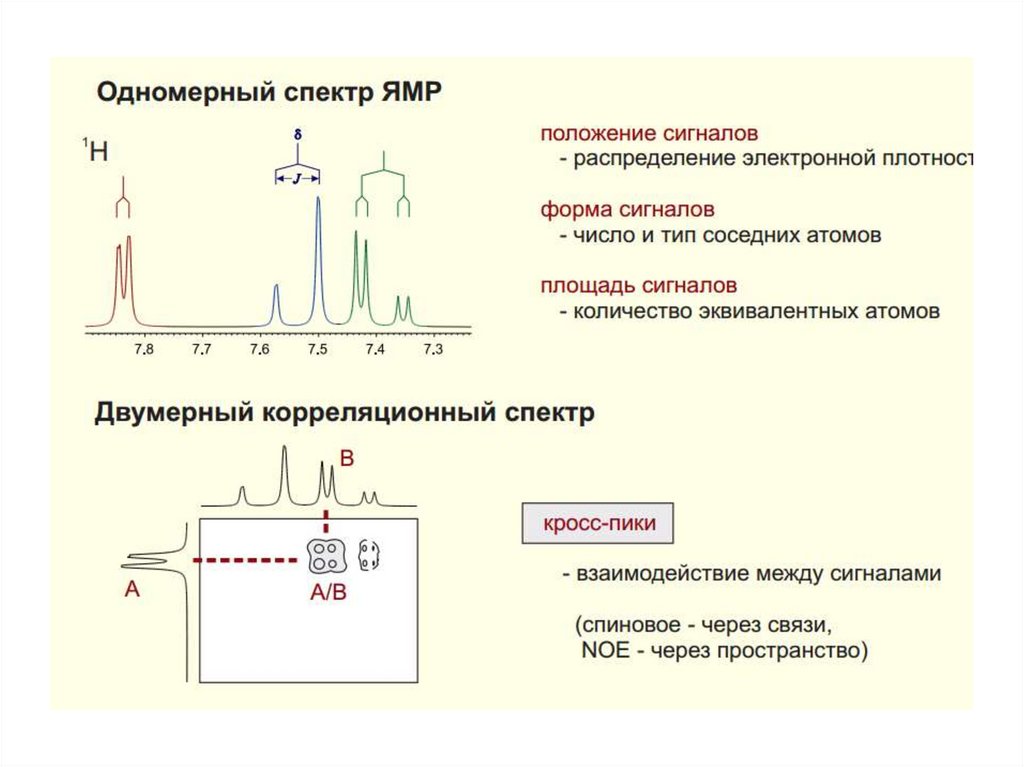
24. Спектр ЯМР
Химическийсдвиг
ΔЕ=ωh=(γВ0)h
Спин-спиновое
взаимодействие
Ларморова
частота
Например:
B0=11.7 T, ω(1H)=500 MHz
ω(13C)=125 MHz
Химический сдвиг ~ B0 ≈ kHz
Спин-спиновое взаимодействие ≈ Hz-kHz
25.
Магнитное экранирование ядерЛарморова частота (частота прецессии ядра): w = - Bloc
Bloc = B0 - Binduced
Внешнее магнитное поле
индуцирует токи электронов
Индуцированное локальное
магнитное поле
Локальное магнитное
поле:
B = (1-σ) B0
где σ – химический
сдвиг.
Ядро окружено облаком электронов. Во внешнем магнитном поле вращающиеся
электроны создают небольшое собственное магнитное поле, направленное против
основного магнитного поля. В результате, магнитное поле, в котором находятся
спины ядер немного меньше общего магнитного поля, или, иными словами,
спины частично экранированы от основного поля. Это называется химическим
сдвигом или экранированием.
26.
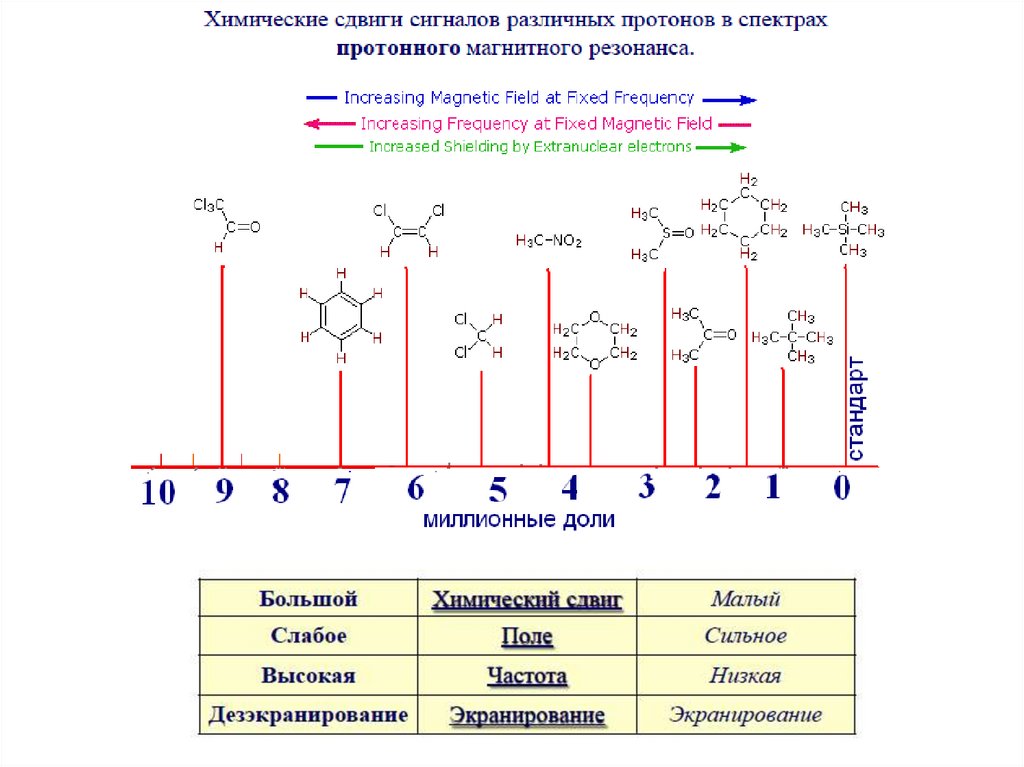
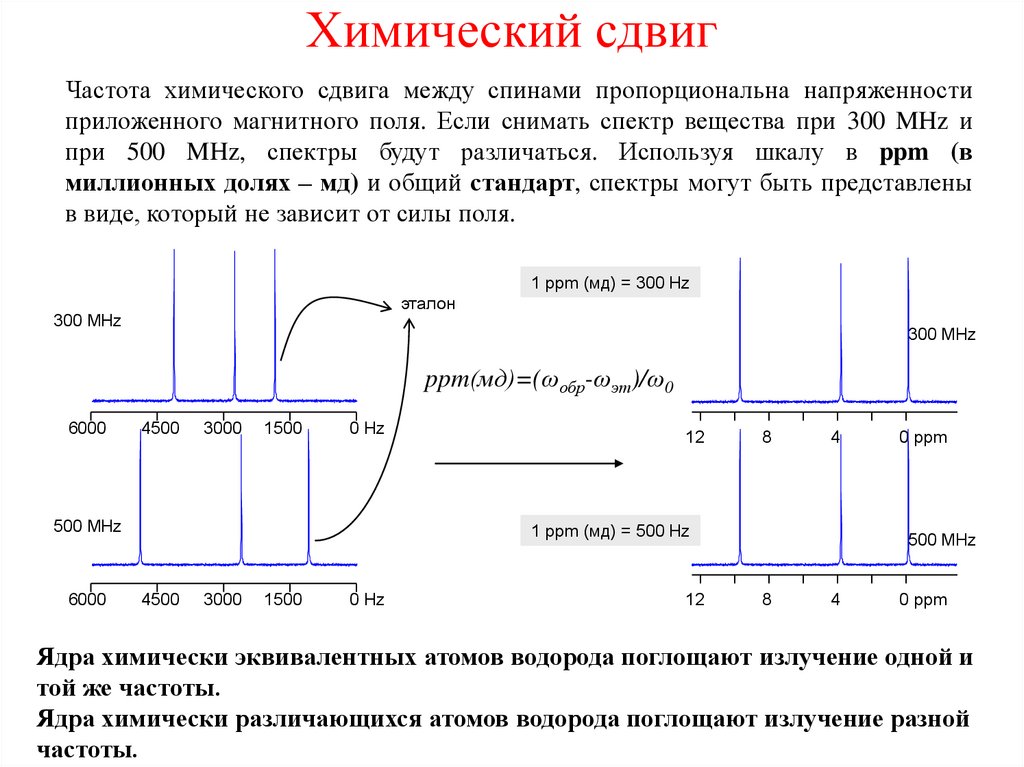
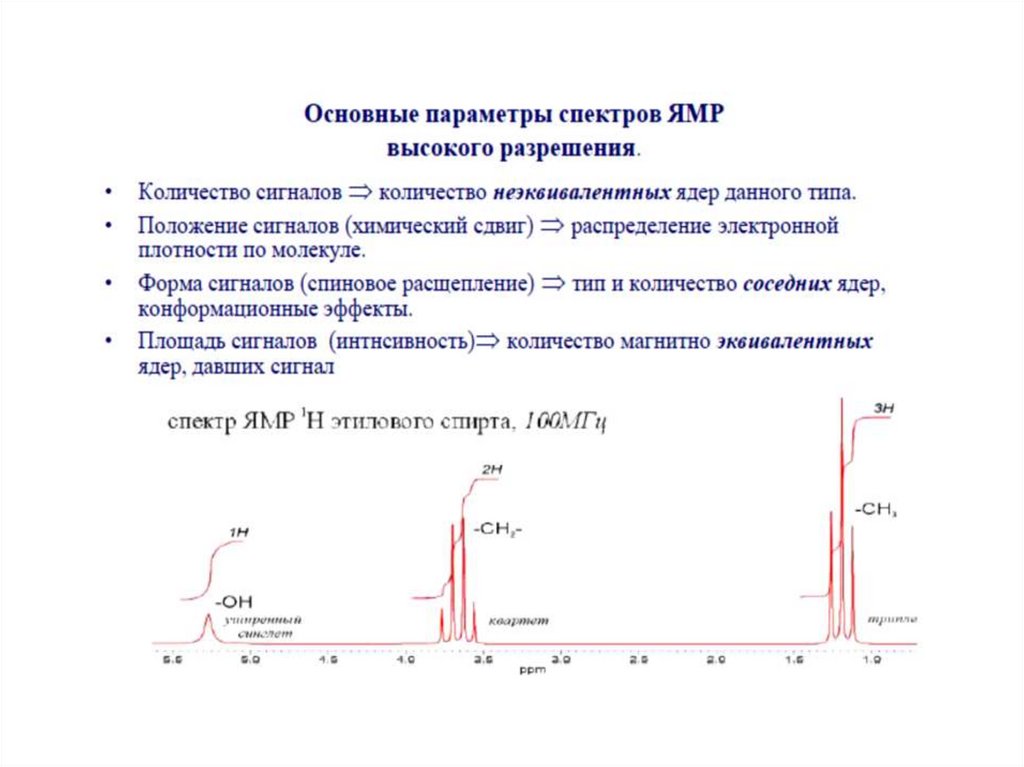
27. Химический сдвиг
Частота химического сдвига между спинами пропорциональна напряженностиприложенного магнитного поля. Если снимать спектр вещества при 300 MHz и
при 500 MHz, спектры будут различаться. Используя шкалу в ppm (в
миллионных долях – мд) и общий стандарт, спектры могут быть представлены
в виде, который не зависит от силы поля.
1 ppm (мд) = 300 Hz
эталон
300 MHz
300 MHz
ppm(мд)=(ωобр-ωэт)/ω0
6000
4500
3000
1500
0 Hz
500 MHz
6000
12
8
4
1 ppm (мд) = 500 Hz
4500
3000
1500
0 Hz
12
0 ppm
500 MHz
8
4
0 ppm
Ядра химически эквивалентных атомов водорода поглощают излучение одной и
той же частоты.
Ядра химически различающихся атомов водорода поглощают излучение разной
частоты.
28.
Для сравнения результатов разных экспериментов в ЯМРвводится относительная шкала,
выражаемая в миллионных долях м.д. или ppm
В качестве эталона используют Si(CH3)4 (TMS),
дающий интенсивный одиночный сигнал в стороне от остальных сигналов
29.
30.
31.
32.
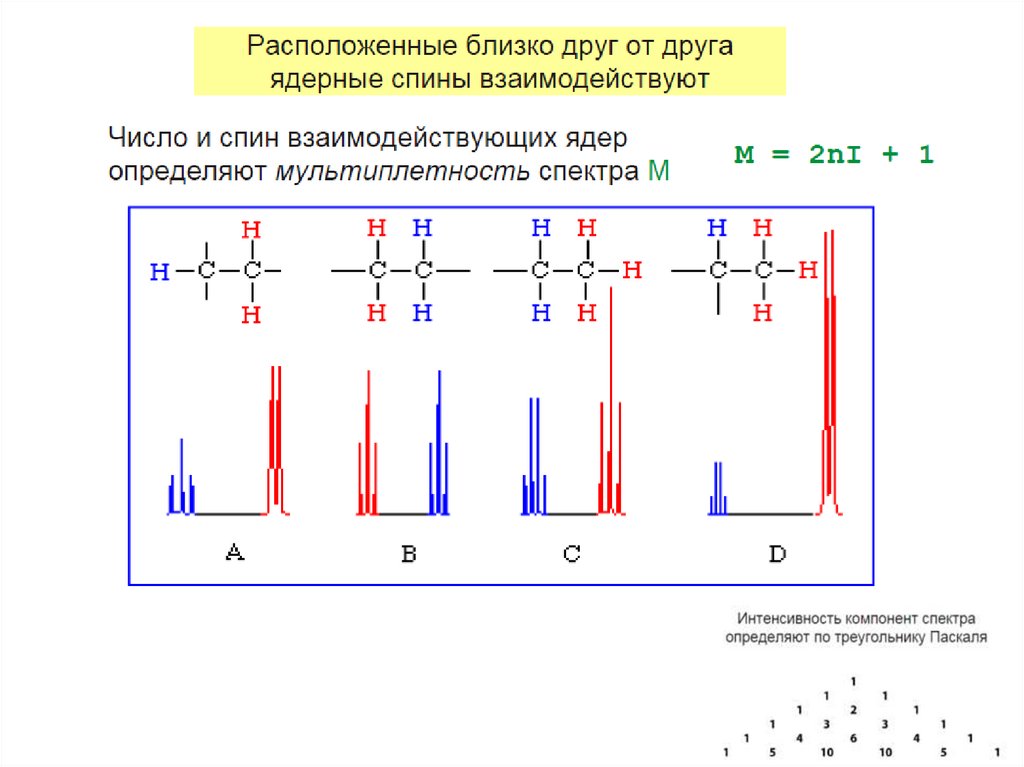
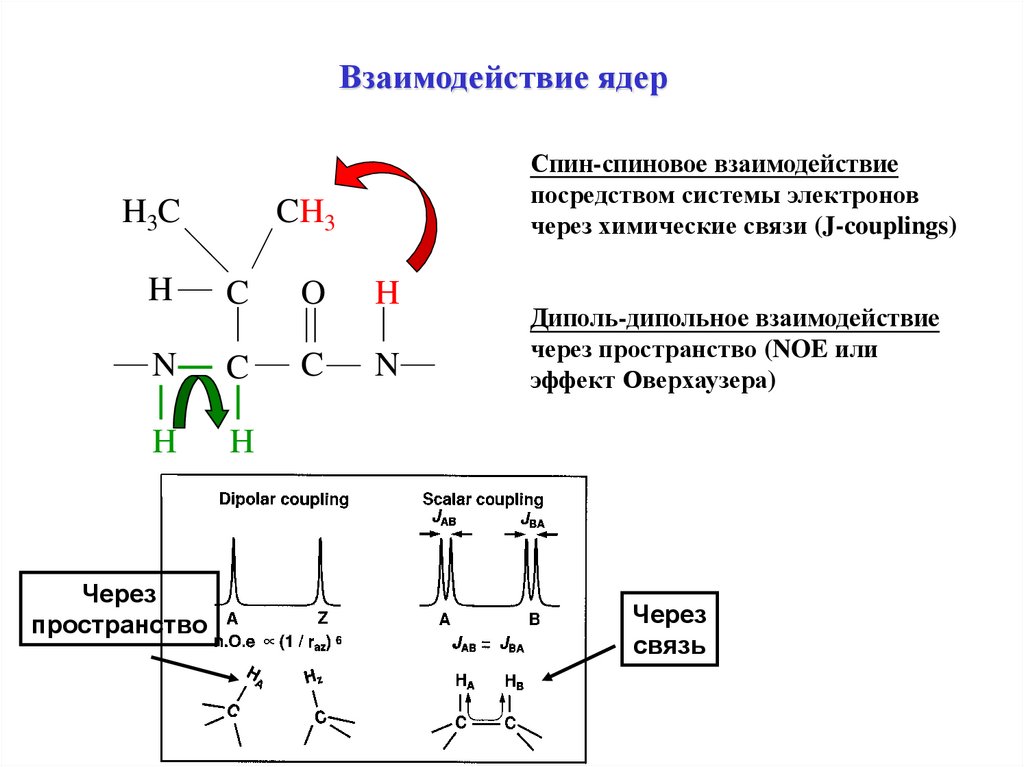
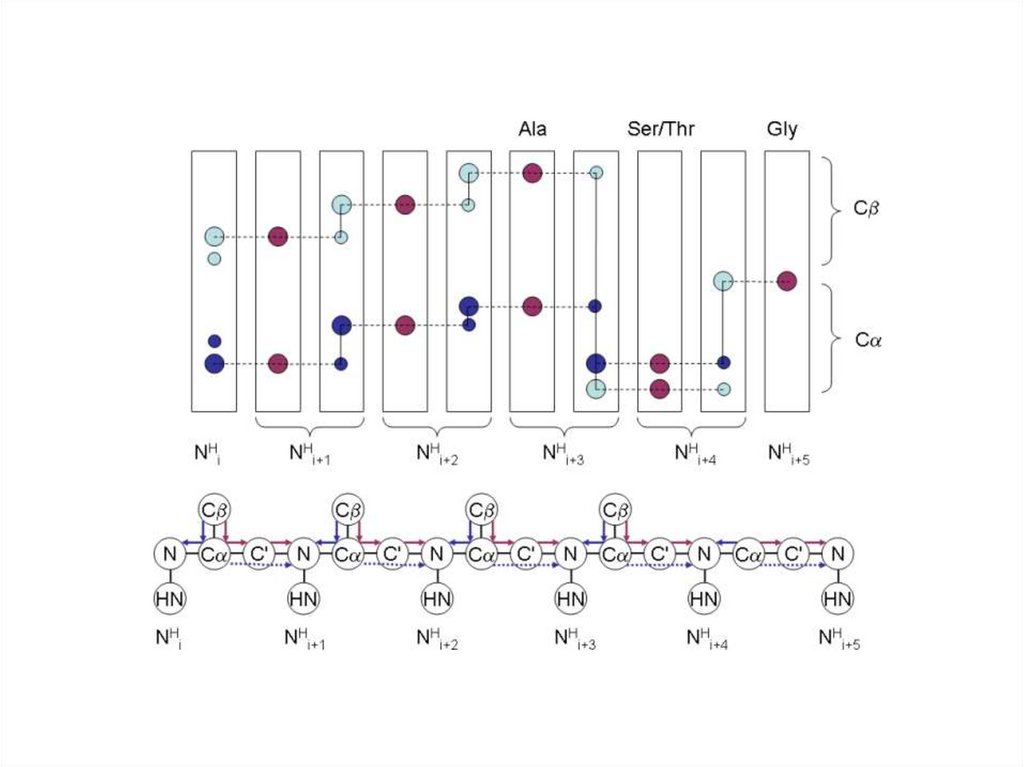
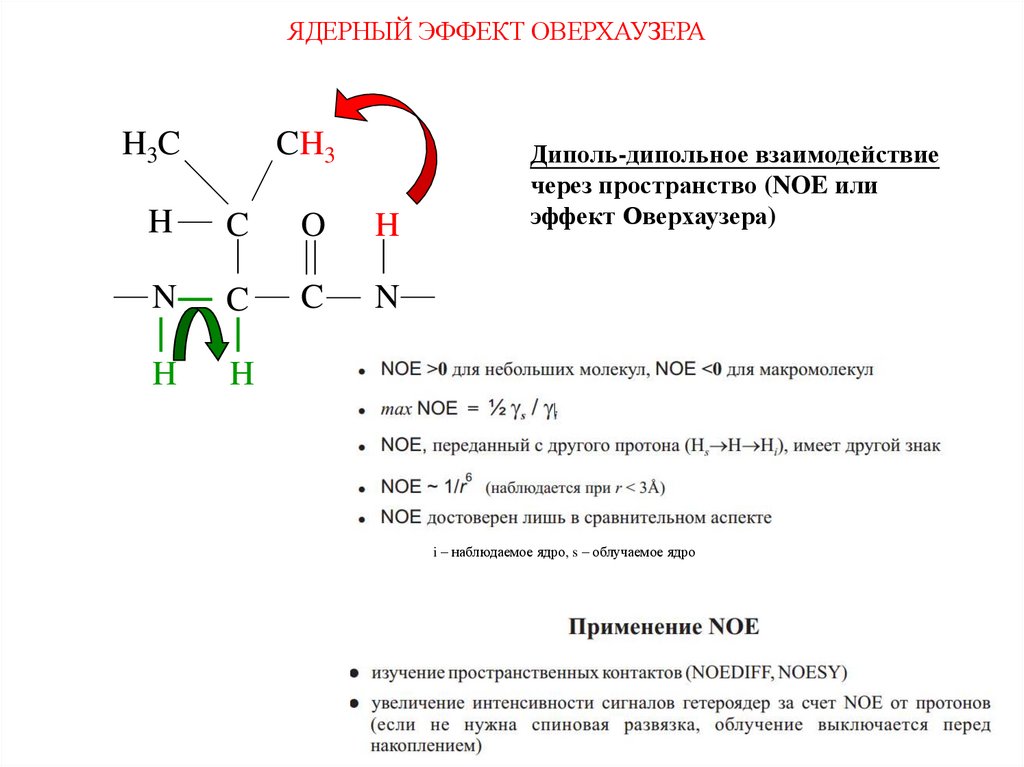
Взаимодействие ядерH3C
Спин-спиновое взаимодействие
посредством системы электронов
через химические связи (J-couplings)
CH3
H
C
O
H
N
C
C
N
H
H
Через
пространство
Диполь-дипольное взаимодействие
через пространство (NOE или
эффект Оверхаузера)
Через
связь
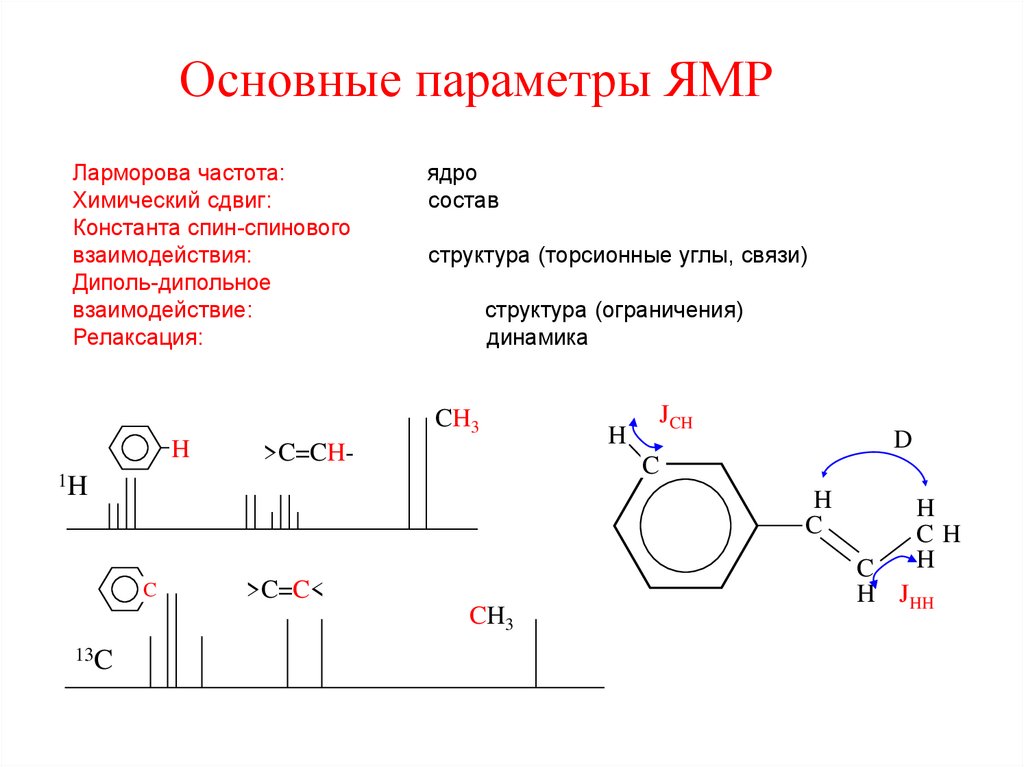
33. Основные параметры ЯМР
Ларморова частота:Химический сдвиг:
Константа спин-спинового
взаимодействия:
Диполь-дипольное
взаимодействие:
Релаксация:
ядро
состав
структура (торсионные углы, связи)
структура (ограничения)
динамика
CH3
H
>C=CH-
JCH
D
C
1H
H
C
C
>C=C<
CH3
13C
H
H
CH
H
C
H JHH
34.
35.
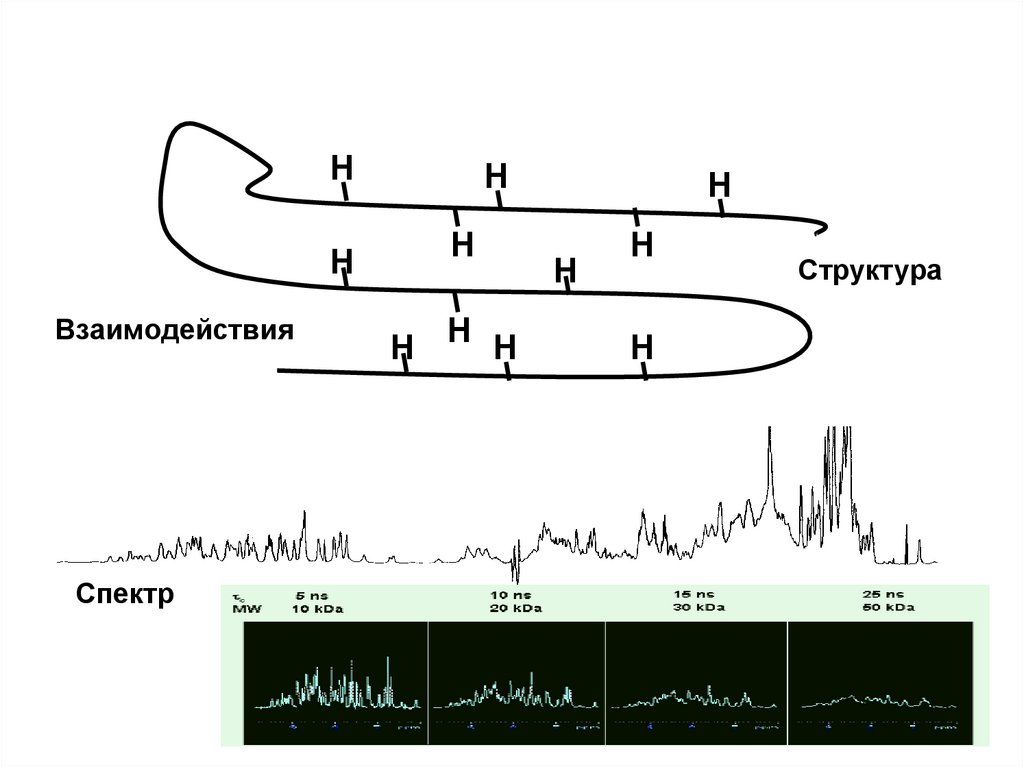
Чувствительность эксперимента ЯМР36.
HH
Взаимодействия
Спектр
H
H
H H H
H
H
H
H
Структура
37.
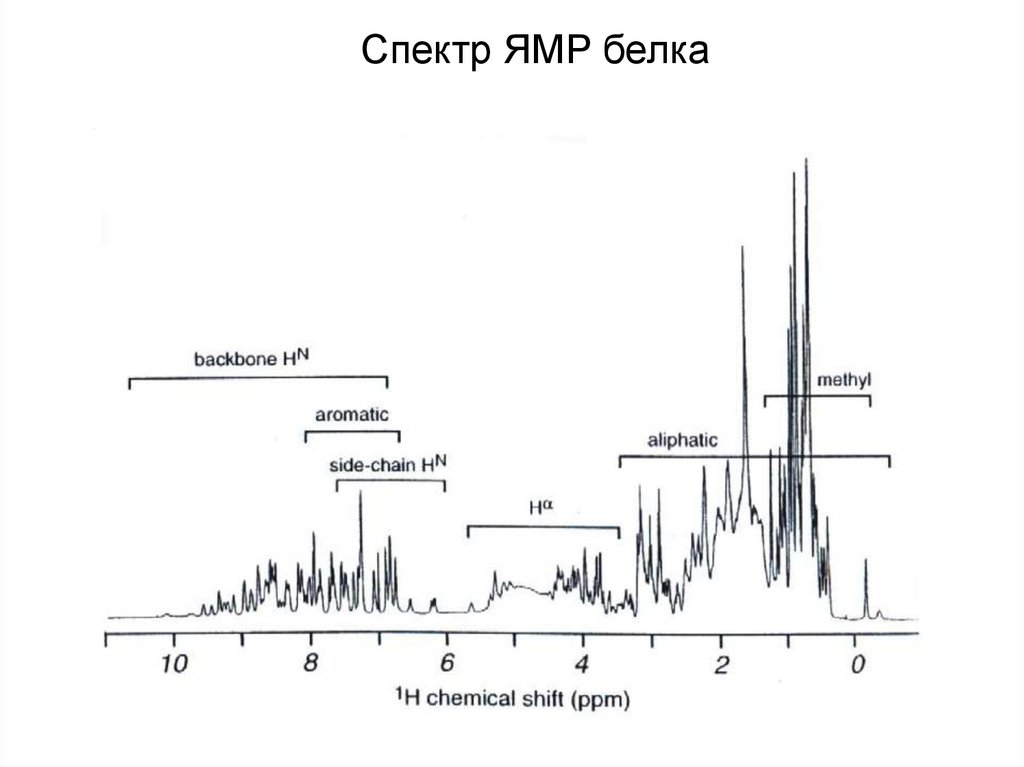
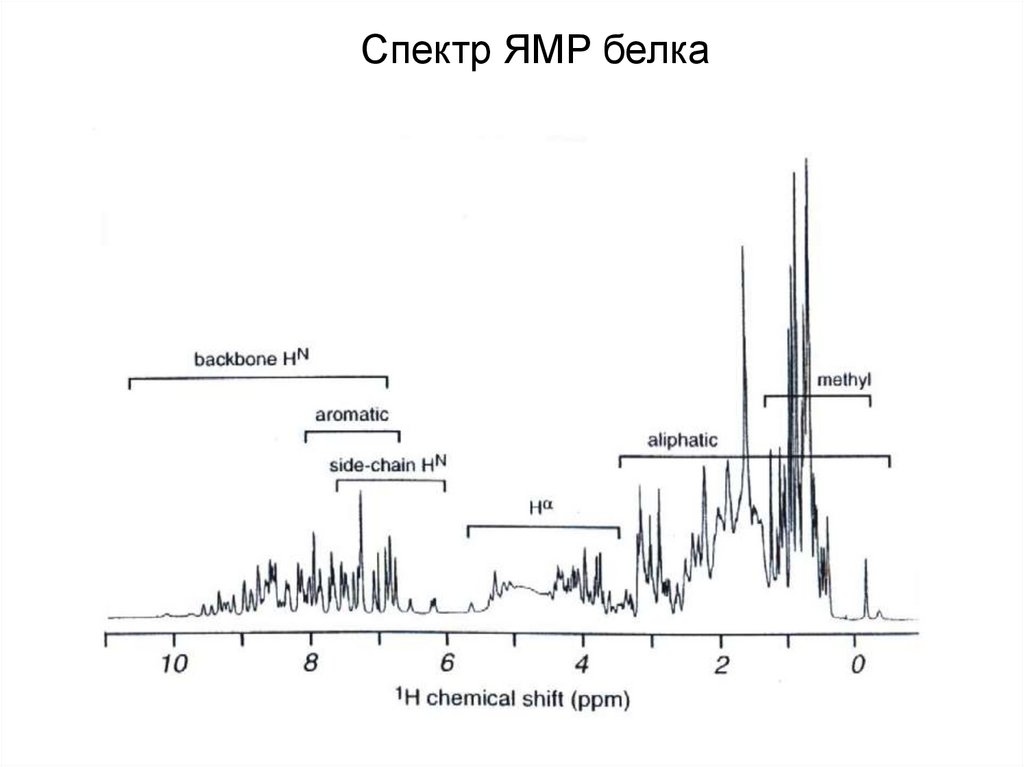
Спектр ЯМР белка38.
От 1D к 2D и 3D NMRin structural
nuclear
magnetic
biology,
resonance
part I
1D
nuclear magnetic resonance
in structural biology, part I
2D
hjebrhyovnobehro;vubr[
qwertyuiopasdfghjklzxc
yuhgjvnmhkhltofuygdh
iubpIYPNoeyroWENV[
vbnmmfgcbfhutsfvcjku
dvcbdgdteurhgfnvkgblj
Ouet[NBW[OUVWE[O
oui’nejtbnoi\psetn;jklsd
opklmnvtfsrwdaexvvhjn
puoytkfdjsgsfxbgksghef
RTONV[ENIUSDUHO
jfnijnl’bjsg/.kxjg’pojtn’j
yoihpjklmghvgydgstsrfc
iuonvohfoonvouebn]pu
SHFOOHWEBYORCB
b\g;kntbjlgjgz’nljg’lz;nj
vxmgjbiurytgcbdmlocp
pnvjpibujnvupiwuenvjv
NYUhoevoeurnuoiauvn
b/\jsjgnp’jrpijn’\rjgpkdj
uhgfdbvfnhwtadgffkvpo
itugoivnoiuevboviuvnid
[uoiunveuoinjljglkjnboi
gpiuntbjgpjmg’j’ptg\ubi
kmncbdhjirurteysjbbnv
jiuefnbvoipuefpjw\pwjn
ue[iewutnb’j\ivnldjfn;oi
nouroytino\btoiutn0847
nmvm,kfjvnjhvnlvmlpo
vuiepnuupeoiunveuopru
envjelinreeijn\pjseipjnbt
08nbujgoiuremtiubn’u[
ukhggfdtrebvxlkhjiuyiut
evnu\envop\eiunv\uerpu
j’nb’ipjtnmvj’pjntb’jpfg
04un’uginbj;tlijmrzv’ijr
hgdkljh,mbnbvjkfjidhop
nevuroientevotumjhjkh
mvpjgnjpjrepjtn’piunbj
tnzijr;tojn;rzj;zordjtino’
[iiuyiouykjgmhvb
khkhhgkhskghkhgkhk
njtjnpbiuntbjtjtn’jinpt
abjmrujtirnb’iurnb’an
jhjhkhshhkhs
hhkjlshjhkhkf
jhjhkhshhkhs
hkshhhjhfkjsh
hhkjlshjhkhkf
jhjhkhshhkhs
dfkhkhfkjhfkj
hkshhhjhfkjsh
hhkjlshjhkhkf
jhjhkhshhkhs
hfkhkjfhkhfkh
dfkhkhfkjhfkj
hkshhhjhfkjsh
hhkjlshjhkhkf
jhhdjfhjkfhoo
jhjhkhshhkhs
hfkhkjfhkhfkh
dfkhkhfkjhfkj
hkshhhjhfkjsh
yeywuhiwhui
hhkjlshjhkhkf
jhhdjfhjkfhoo
jhjhkhshhkhs
hfkhkjfhkhfkh
dfkhkhfkjhfkj
yurihuifhjkhkj
hkshhhjhfkjsh
yeywuhiwhui
hhkjlshjhkhkf
jhhdjfhjkfhoo
jhjhkhshhkhs
hfkhkjfhkhfkh
hfkhfkhkfhkh
dfkhkhfkjhfkj
yurihuifhjkhkj
hkshhhjhfkjsh
yeywuhiwhui
hhkjlshjhkhkf
jhhdjfhjkfhoo
jhjhkhshhkhs
fkd hfkhfkhkfhkh
hfkhkjfhkhfkh
dfkhkhfkjhfkj
yurihuifhjkhkj
hkshhhjhfkjsh
yeywuhiwhui
hhkjlshjhkhkf
jhhdjfhjkfhoo
fkd hfkhfkhkfhkh
hfkhkjfhkhfkh
dfkhkhfkjhfkj
yurihuifhjkhkj
hkshhhjhfkjsh
yeywuhiwhui
jhhdjfhjkfhoo
fkd hfkhfkhkfhkh
hfkhkjfhkhfkh
dfkhkhfkjhfkj
yurihuifhjkhkj
yeywuhiwhui
jhhdjfhjkfhoo
fkd hfkhfkhkfhkh
hfkhkjfhkhfkh
yurihuifhjkhkj
yeywuhiwhui
jhhdjfhjkfhoo
fkd hfkhfkhkfhkh
yurihuifhjkhkj
yeywuhiwhui
fkd hfkhfkhkfhkh
yurihuifhjkhkj
fkd hfkhfkhkfhkh
fkd
3D
jhjhkhshhkhs
hhkjlshjhkhkf
hkshhhjhfkjsh
dfkhkhfkjhfkj
hfkhkjfhkhfkh
jhhdjfhjkfhoo
yeywuhiwhui
yurihuifhjkhkj
hfkhfkhkfhkh
fkd
jhjhkhshhkhs
hhkjlshjhkhkf
hkshhhjhfkjsh
dfkhkhfkjhfkj
hfkhkjfhkhfkh
jhhdjfhjkfhoo
yeywuhiwhui
yurihuifhjkhkj
hfkhfkhkfhkh
fkd
39.
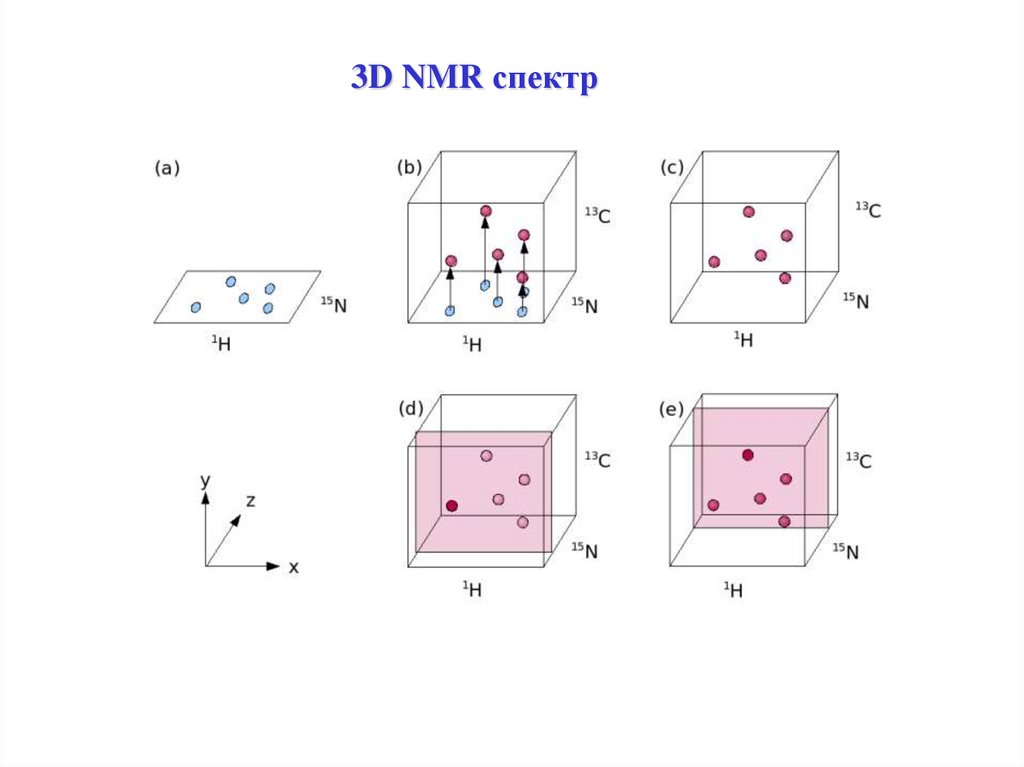
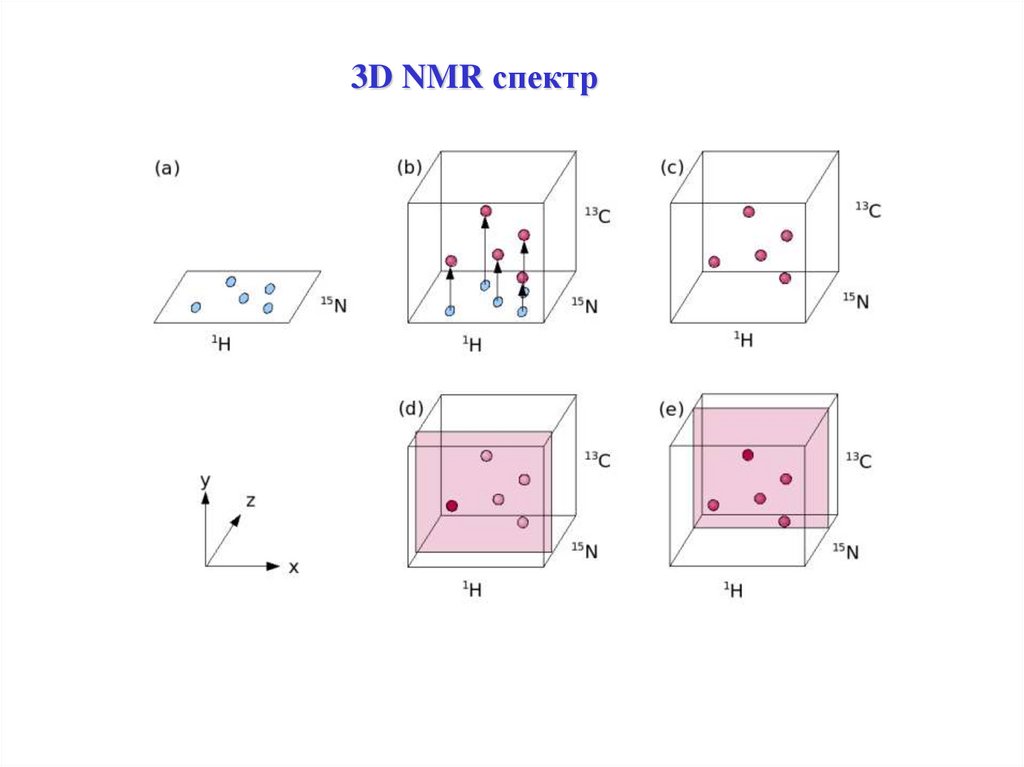
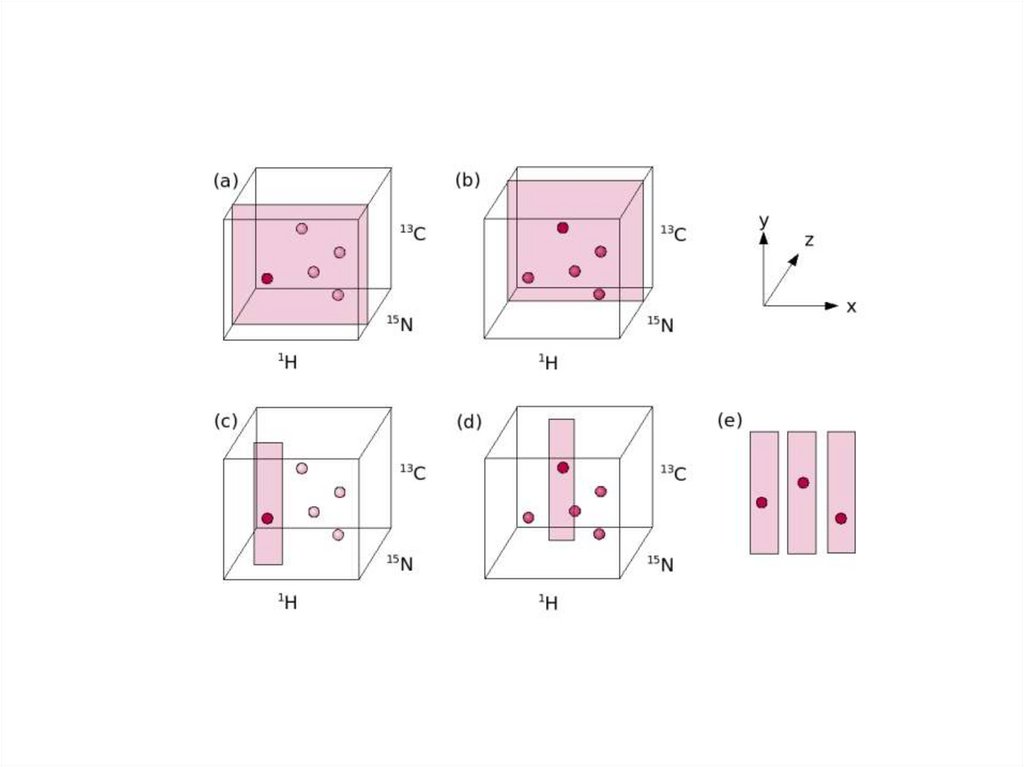
3D NMR спектр40.
41.
42.
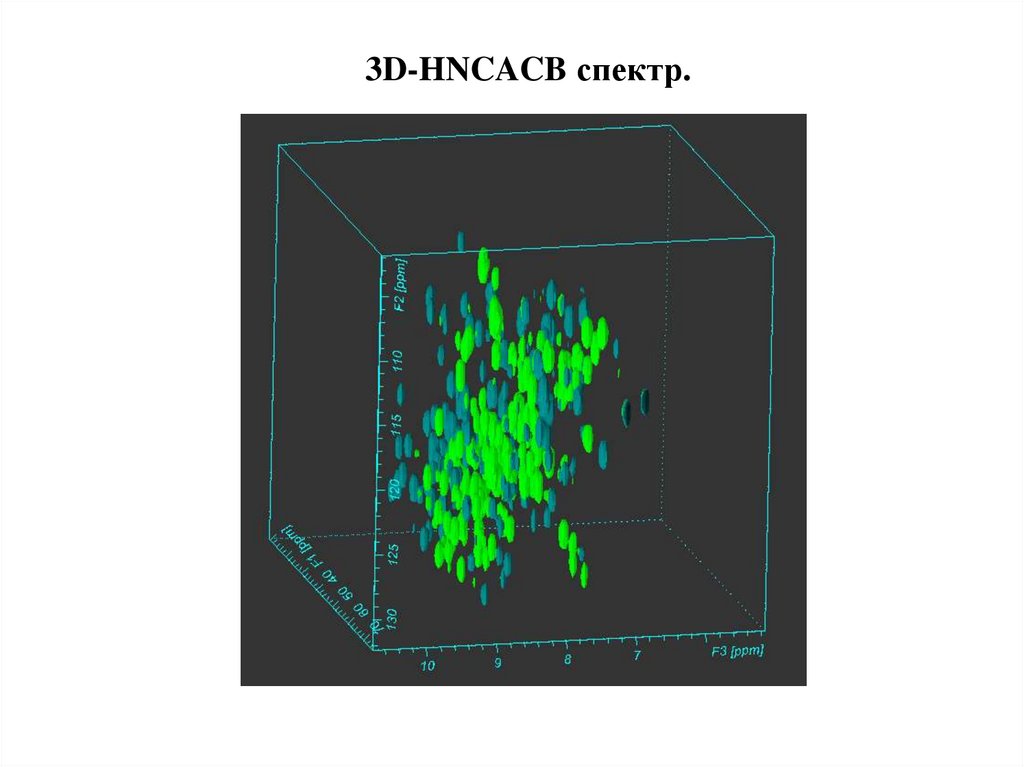
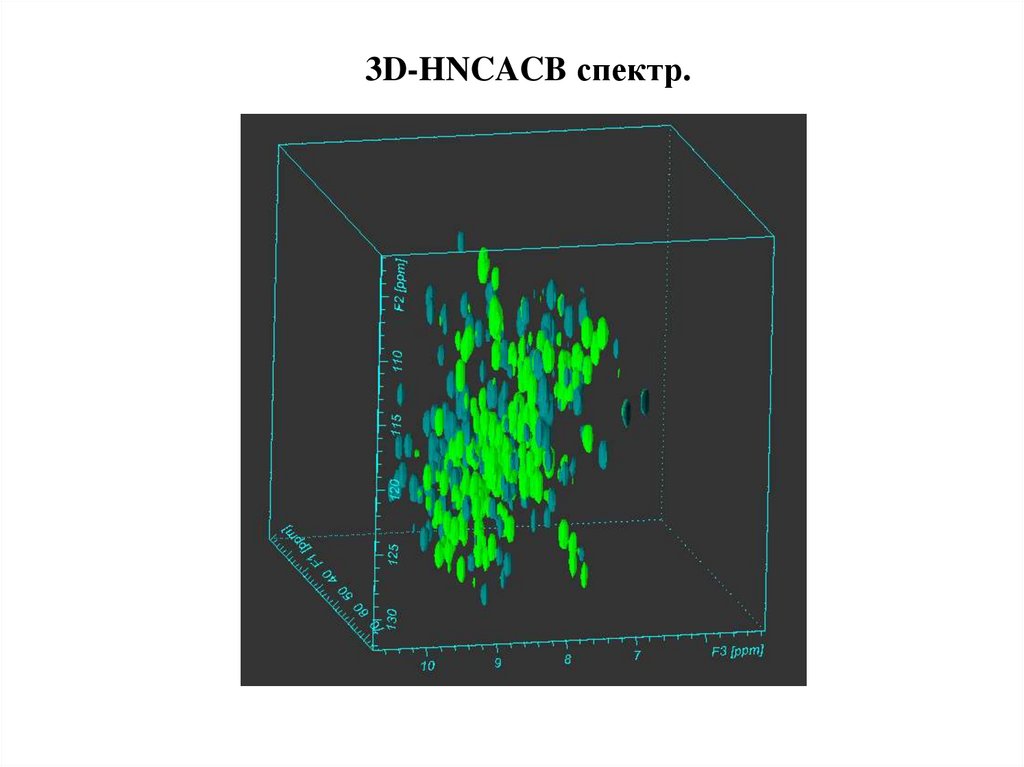
3D-HNCACB спектр.43.
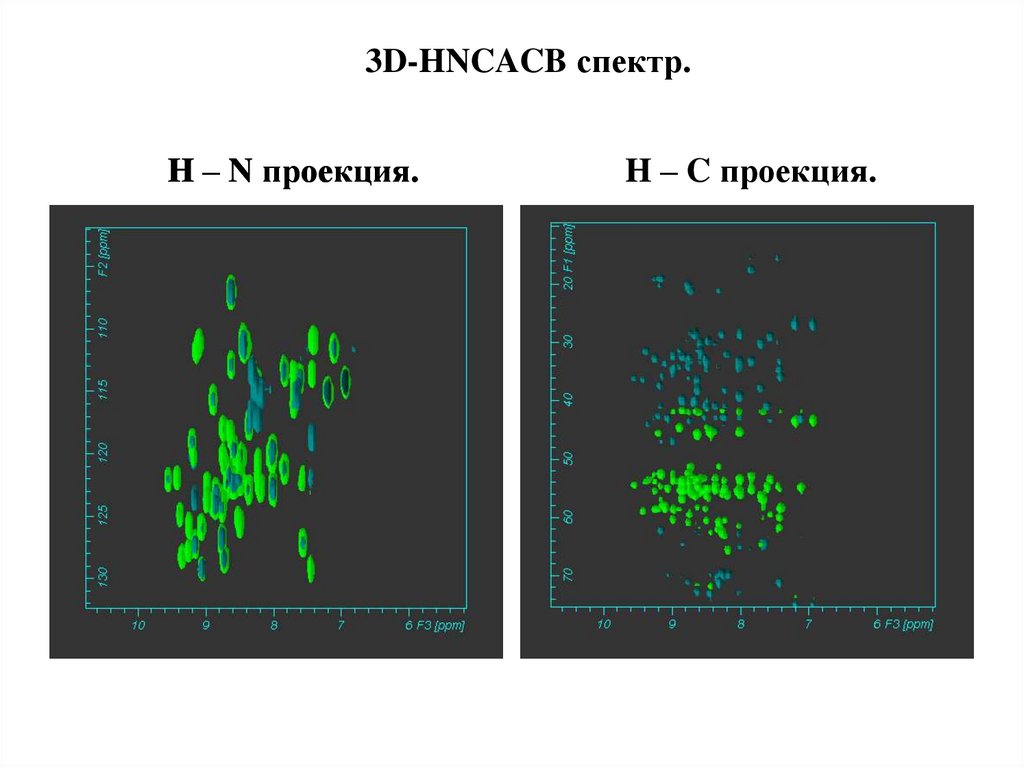
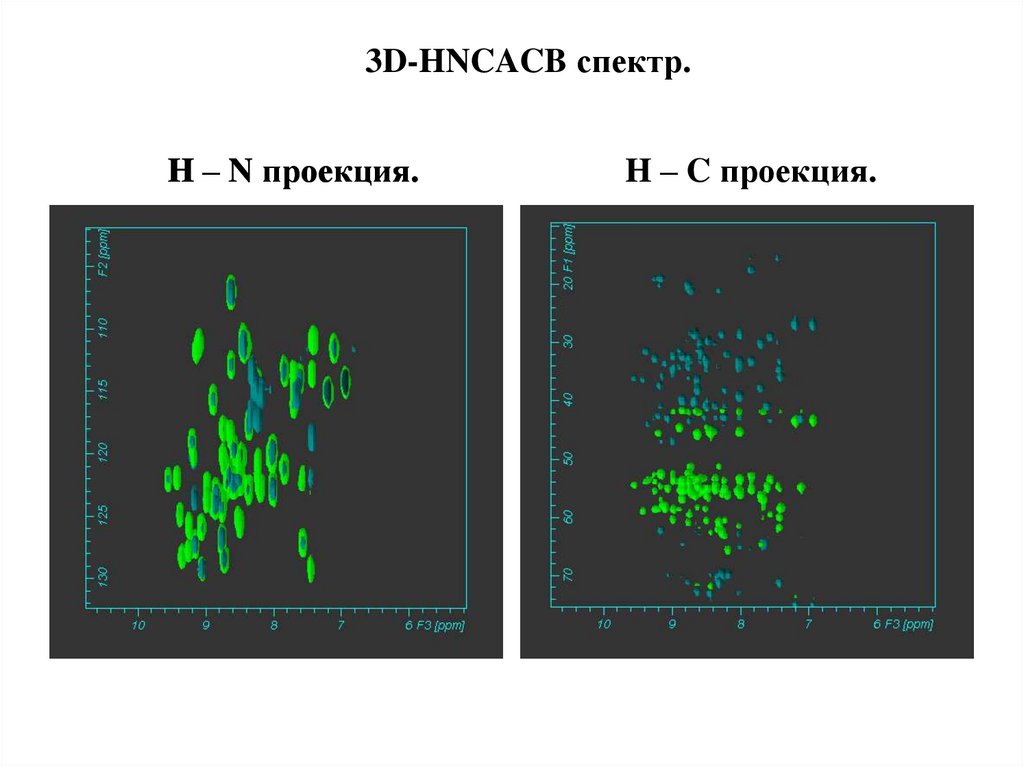
3D-HNCACB спектр.H – N проекция.
H – C проекция.
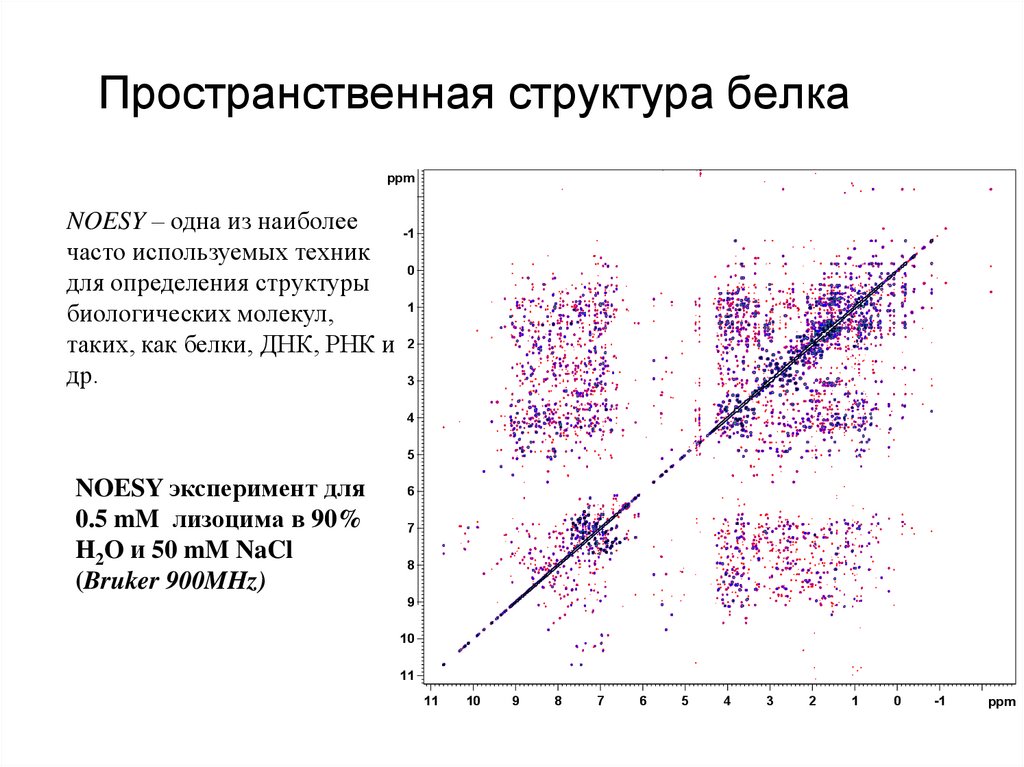
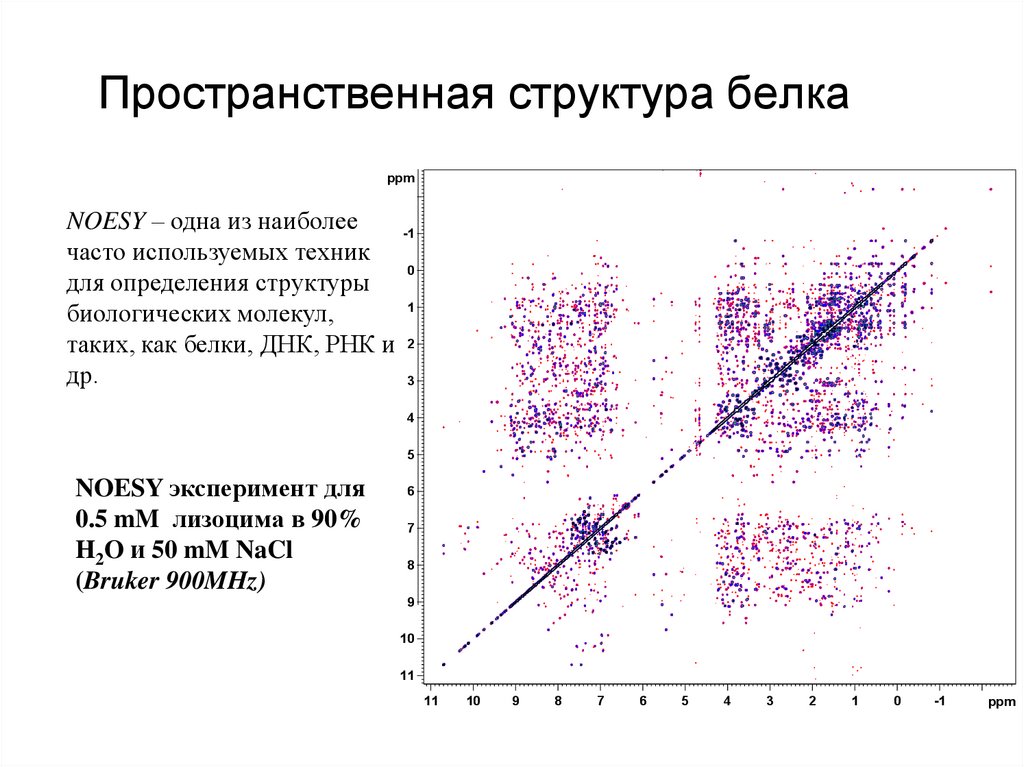
44. Пространственная структура белка
ppmNOESY – одна из наиболее
-1
часто используемых техник
0
для определения структуры
1
биологических молекул,
таких, как белки, ДНК, РНК и 2
др.
3
4
5
NOESY эксперимент для
0.5 mM лизоцима в 90%
H2O и 50 mM NaCl
(Bruker 900MHz)
6
7
8
9
10
11
11
10
9
8
7
6
5
4
3
2
1
0
-1
ppm
45.
46.
47.
48.
УШИРЕНИЕ ЛИНИЙ В СПЕКТРЕ. РЕЛАКСАЦИЯУширение линий зависит от:
• однородности магнитного и радиочастотного полей;
• спонтанного излучения энергии ядром, обуславливающее т.н. естественную
ширину линий (вносит пренебрежимо малый вклад);
• ширины, обусловленная релаксацией
Релаксация - это переход между энергетическими состояниями, восстанавливающий
обычное больцмановское распределение.
Ядерные магнитные моменты в постоянном магнитном поле B0 прецессируют с круговой частотой ω (это
резонансная частота) вокруг направления B0 под углом θ. Из-за распределения Больцмана в образце возникает
макроскопическая«продольная» намагниченность М0, направленная по оси Z.
Но, поскольку магнитные моменты разных ядер прецессируют с разными фазами, в плоскости xy пока
отсутствует.
При включении радиочастотного поля В1 с той же
частотой ω синхронизируются прецессии всех
индивидуальных магнитных моментов- спиновая
когерентность. В плоскости xy возникает «поперечная»
намагниченность с компонентами Мх и Мy, которые
различаются по фазе на 90°. Ее регистрирует приемный
тракт нашего спектрометра, который можно настроить на
любую из этих компонент. Одна из них даст нам сигнал
поглощения, а вторая – сигнал дисперсии.
49.
Спин-решеточная релаксация1) Спин-решеточная релаксация (обозначается T1) – возникает из-за взаимодействия
магнитного ядра с локальными электромагнитными полями окружающей среды.
В случае сильных радиочастотных полей В1 интенсивность I в максимуме сигнала (при
резонансной частоте νo) задается выражением:
длинные времена релаксации и большие амплитуды высокочастотного поля уменьшают
интенсивность сигнала (насыщение резонансной линии).
Если время Т1 мало, наблюдается уширение резонансной линии. Это уширение является
результатом уменьшения времени жизни ядра в возбужденном состоянии, что приводит
к неопределенности в значении разности энергий.
Согласно принципу неопределенности:
Ширина линии (связанная с неопределенностью в значении частоты) зависит от 1/δt,
т.е. от 1/Т1
50.
Спин-решеточная релаксацияМеханизмы спин-решеточной релаксации:
• обусловленный диполь-дипольным магнитным взаимодействием с молекулами
растворителя, в результате которого магнитная энергия преобразуется в тепловую.
Более полярные растворители являются и более эффективными релаксирующими
агентами. Величина Т1 связана с вязкостью исследуемого образца - в более вязком
образце релаксационные процессы ускоряются, что приводит к уширению линий.
•обусловленный наличием у исследуемого ядра квадрупольного электрического
момента. Такой момент имеют ядра с I > 1/2. Они имеют сферически несимметричное
распределение заряда и характеризуются т.н. электрическим квадрупольным моментом
Q. В случае ядер 14N сигналы уширены очень сильно, сигналы же 2H также уширены,
но незначительно.
•обусловленный диполь-дипольными взаимодействиями между соседними ядрами,
приводящим к уменьшению T1. Очевидно, подобные взаимодействия эффективны,
когда оба взаимодействующих ядра являются магнитными. Этот механизм проявляется
сильнее всего, если рядом с исследуемым ядром находится ядро с электрическим
квадрупольным моментом.
•обусловленный взаимодействием магнитных ядер с парамагнитными частицами,
приводящим к резкому уменьшению Т1. Это связано с тем, что неспаренный электрон
обладает очень большим магнитным моментом.
51.
Спин-спиновая релаксацияCпин-спиновая релаксация T2, заключается в обмене энергией внутри спиновой
системы.
Этот процесс практически не влияет на относительные населенности спиновых
состояний, но сокращает время существования данного спинового состояния, т.к.
любой переход ядра между его спиновыми состояниями изменяет локальное поле
на соседних ядрах на частоте, которая вызывает переход в обратном направлении.
Сокращение времени жизни спинового состояния приводит к уширению линий.
Спектроскопия ЯМР мало применима для анализа парамагнитных образцов
(малое время T1 обуславливает широкие и мало интерпретируемые сигналы
спектра) и твердых тел (малое время Т2).
52.
Константы спин-спинового взаимодействияЭнергия спин-спинового взаимодействия между ядрами A и X пропорциональна
скалярному произведению их ядерных спиновых моментов mA и mX, и ее можно записать в
виде:
где IA и IX – ядерные спиновые векторы взаимодействующих ядер, пропорциональные их
магнитным моментам m, а JAX – константа спин-спинового взаимодействия (КССВ)
между A и X
В спектрах первого порядка КССВ представляют собой выраженные в Гц расстояния
между соседними линиями в мультиплете.
КССВ не зависит от напряженности внешнего поля (рабочей частоты спектрометра)
Магнитно эквивалентными мы называем такие ядра, которые являются химически
эквивалентными, имеют одну и ту же резонансную частоту и общие для каждого из них
значения КССВ с ядрами любой соседней группы.
Спин-спиновое взаимодействие между магнитно эквивалентными ядрами в спектре
не проявляется!
53.
Константы спин-спинового взаимодействия54.
ЯДЕРНЫЙ ЭФФЕКТ ОВЕРХАУЗЕРАH3C
CH3
H
C
O
H
N
C
C
N
H
H
Диполь-дипольное взаимодействие
через пространство (NOE или
эффект Оверхаузера)
i – наблюдаемое ядро, s – облучаемое ядро
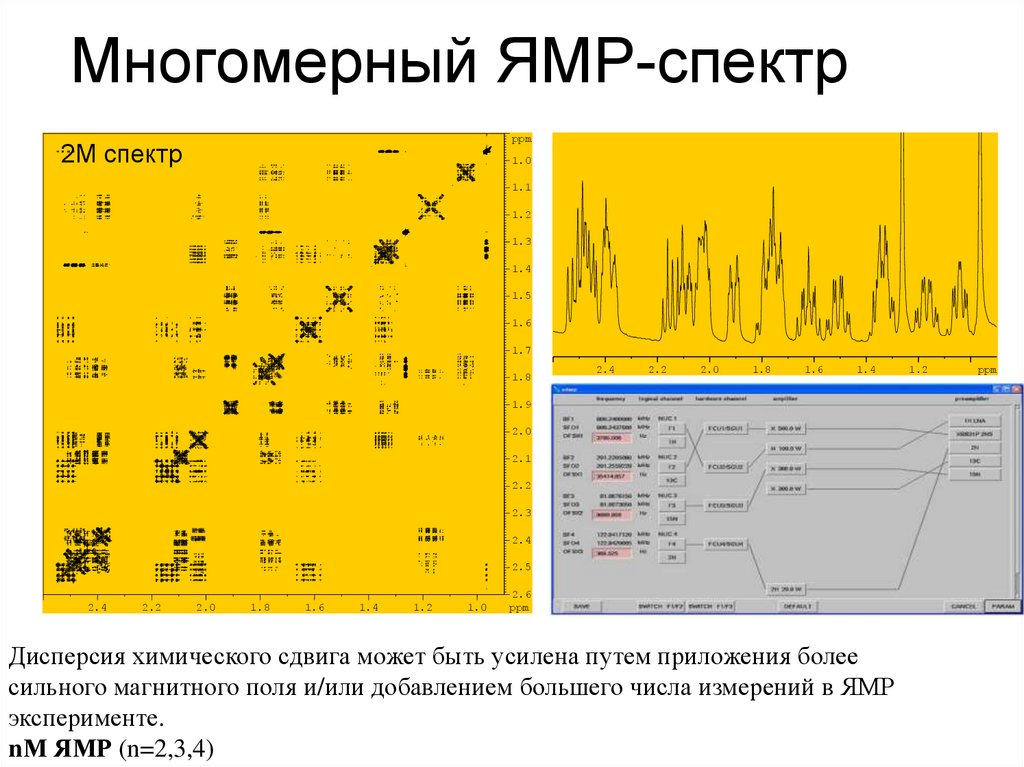
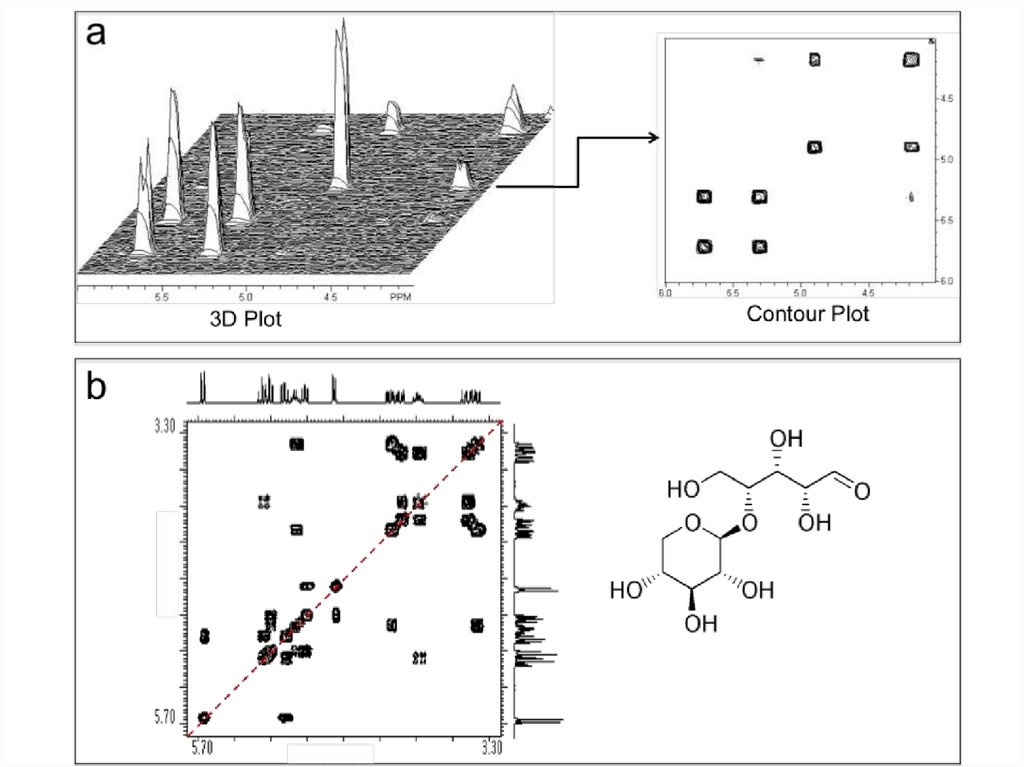
55. Многомерный ЯМР-спектр
ppm2М спектр
1.0
1.1
1.2
1.3
1.4
1.5
1.6
1.7
1.8
2.4
2.2
2.0
1.8
1.6
1.4
1.9
2.0
2.1
1М спектр
2.2
2.3
2.4
2.5
2.4
2.2
2.0
1.8
1.6
1.4
1.2
1.0
2.6
ppm
Дисперсия химического сдвига может быть усилена путем приложения более
сильного магнитного поля и/или добавлением большего числа измерений в ЯМР
эксперименте.
nМ ЯМР (n=2,3,4)
1.2
ppm
56.
57. История далекая
Джен ДжинерВ середине 70х впервые
показал принципиальную
возможность двумерной
ЯМР спектроскопии
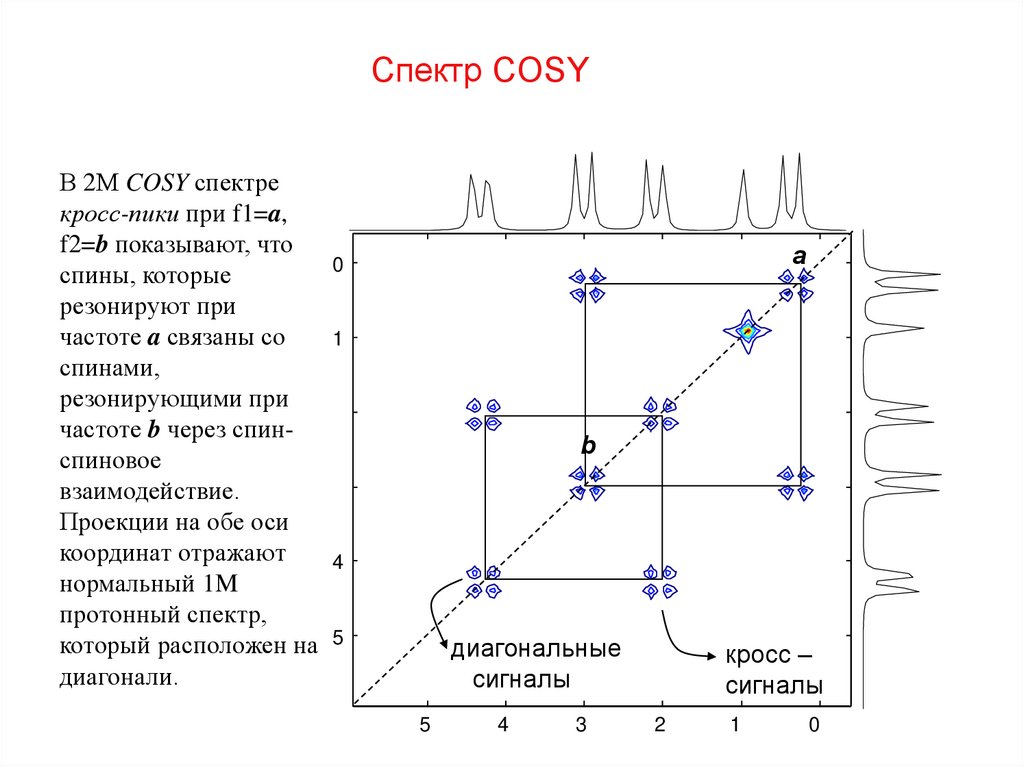
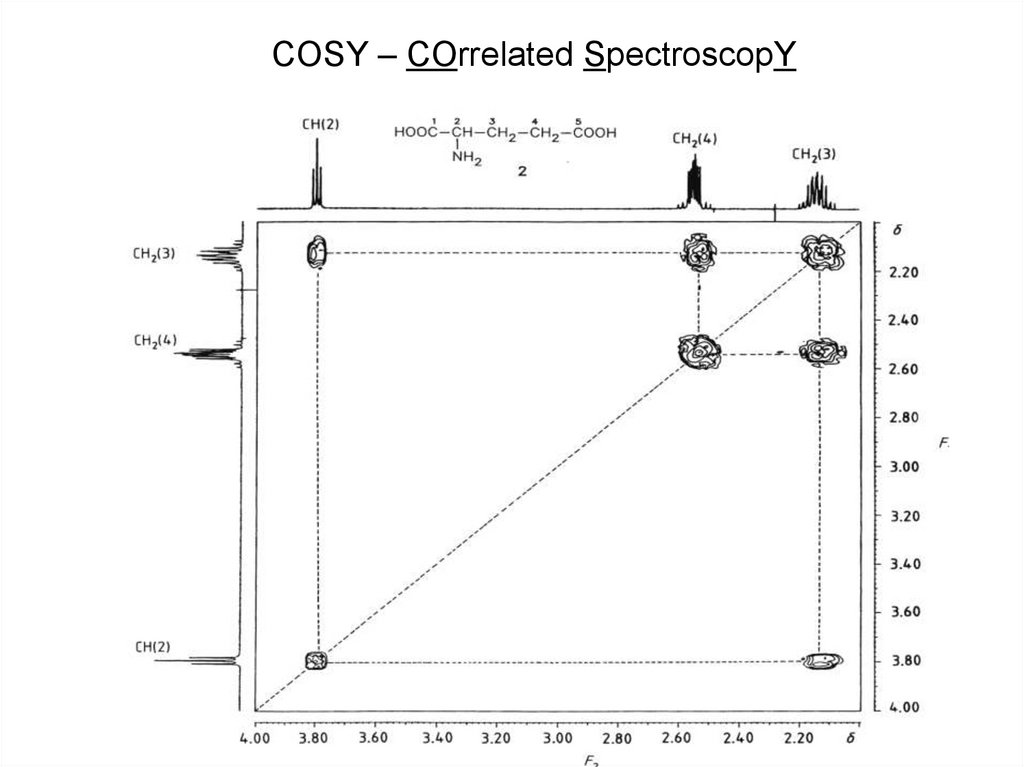
58. Спектр COSY
В 2М COSY спектрекросс-пики при f1=a,
f2=b показывают, что
0
спины, которые
резонируют при
частоте a связаны со
1
спинами,
резонирующими при
2
частоте b через спинспиновое
3
взаимодействие.
Проекции на обе оси
координат отражают
4
нормальный 1M
протонный спектр,
который расположен на 5
диагонали.
a
b
диагональные
сигналы
5
4
3
кросс –
сигналы
2
1
0
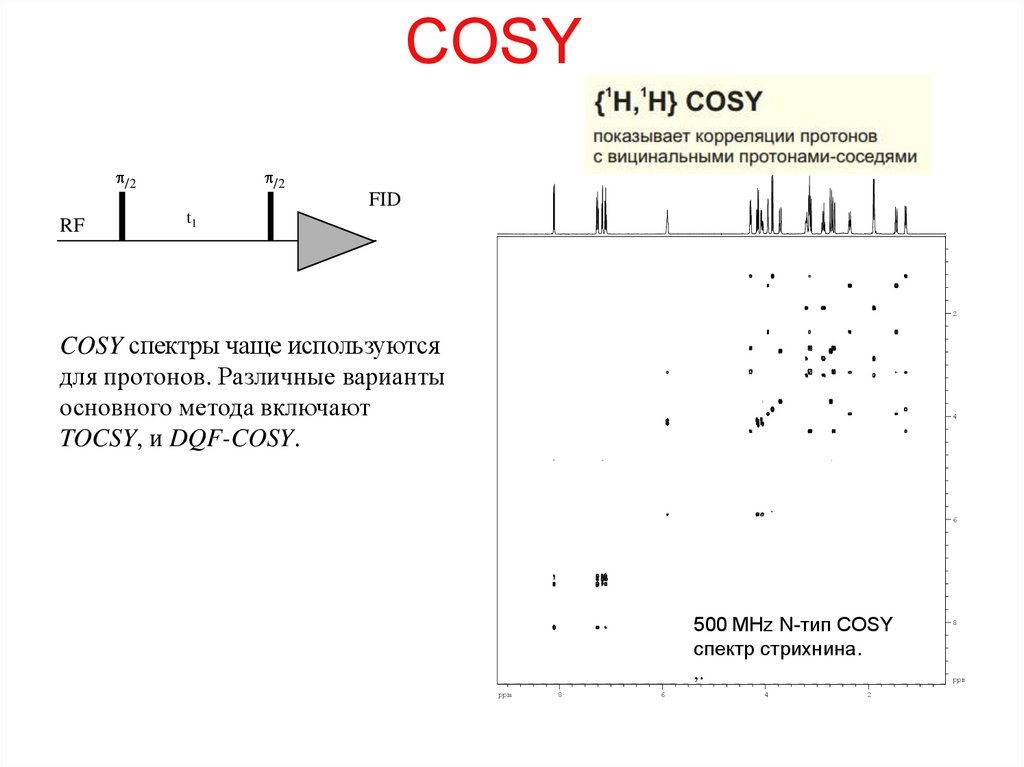
59. COSY
p/2p/2
FID
RF
t1
2
COSY спектры чаще используются
для протонов. Различные варианты
основного метода включают
TOCSY, и DQF-COSY.
4
6
500 MHz N-тип COSY
спектр стрихнина.
,.
ppm
8
6
4
2
8
ppm
60.
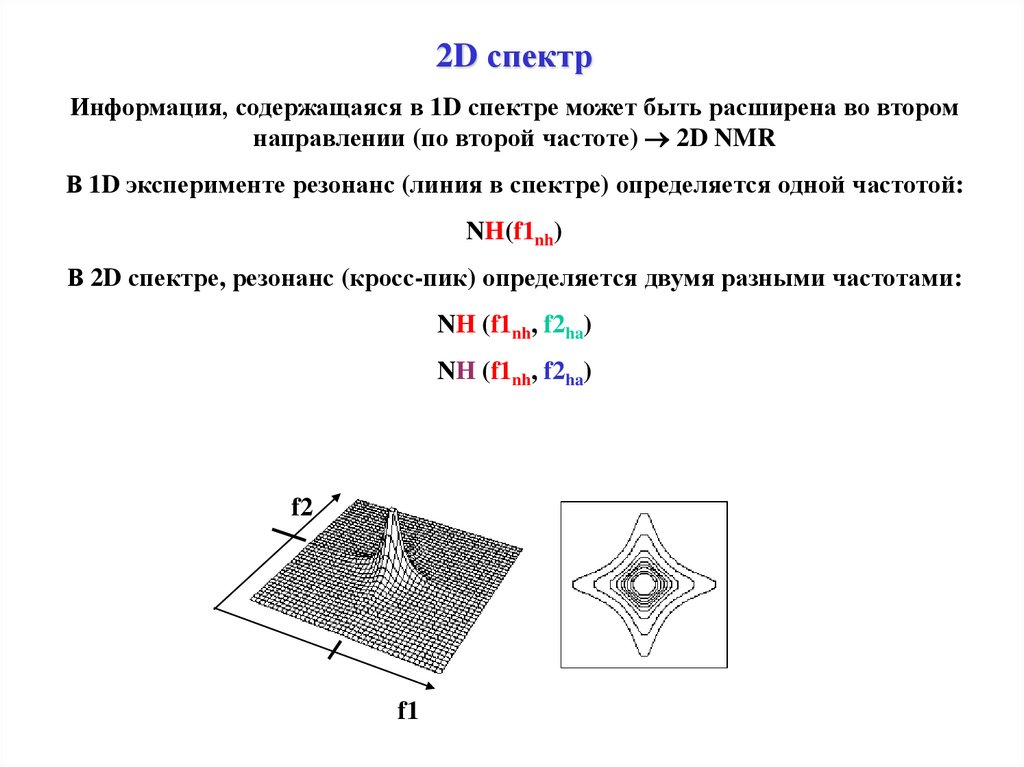
2D спектрИнформация, содержащаяся в 1D спектре может быть расширена во втором
направлении (по второй частоте) 2D NMR
В 1D эксперименте резонанс (линия в спектре) определяется одной частотой:
NH(f1nh)
В 2D спектре, резонанс (кросс-пик) определяется двумя разными частотами:
NH (f1nh, f2ha)
NH (f1nh, f2ha)
f2
f1
61.
62.
COSY – COrrelated SpectroscopY63.
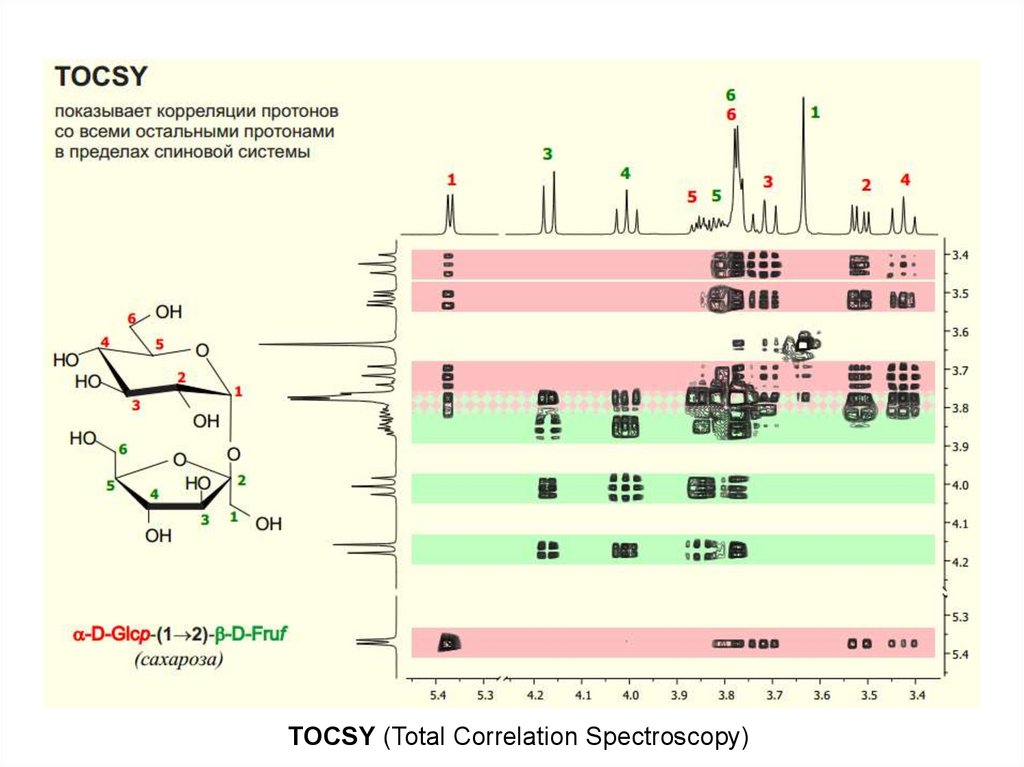
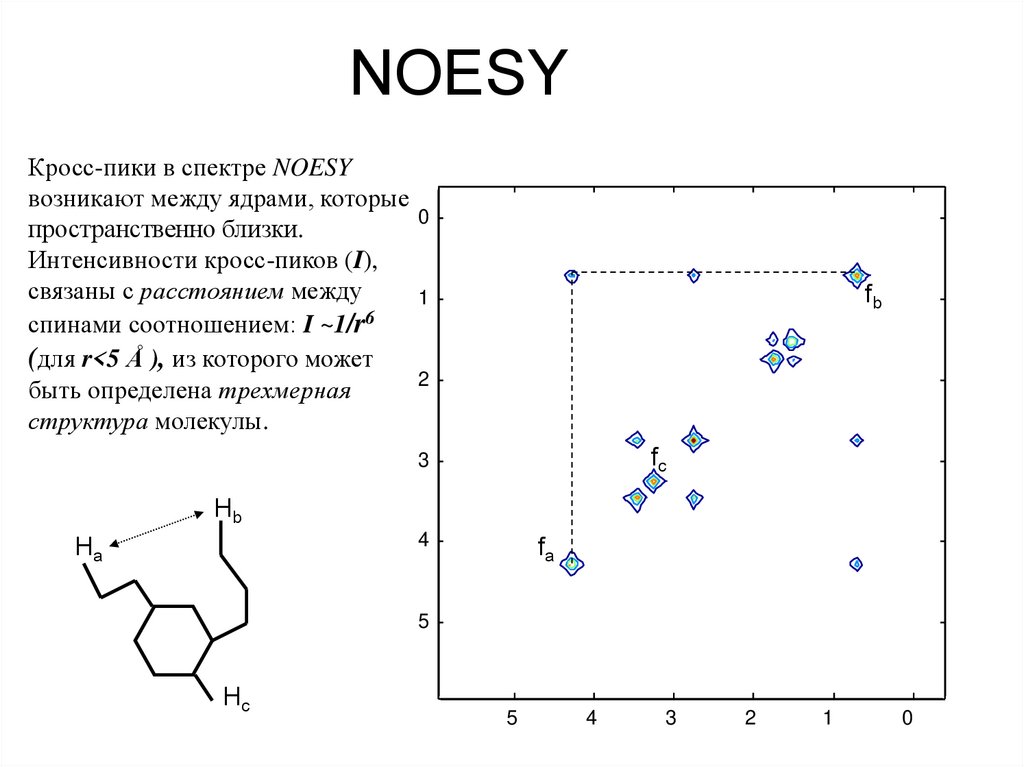
TOCSY (Total Correlation Spectroscopy)64. NOESY
Кросс-пики в спектре NOESYвозникают между ядрами, которые
0
пространственно близки.
Интенсивности кросс-пиков (I),
связаны с расстоянием между
1
спинами соотношением: I ~1/r6
(для r<5 Å ), из которого может
2
быть определена трехмерная
структура молекулы.
fb
fc
3
Hb
4
Ha
fa
5
Hc
5
4
3
2
1
0
65. История уже далекая
АльбертОверхаузер
В 1953 году предсказал
явление, получившее в
последствие его имя.
В ядерном магнитном
резонансе оно известно как
ядерный эффект Оверхаузера
(ЯЭО или NOE)
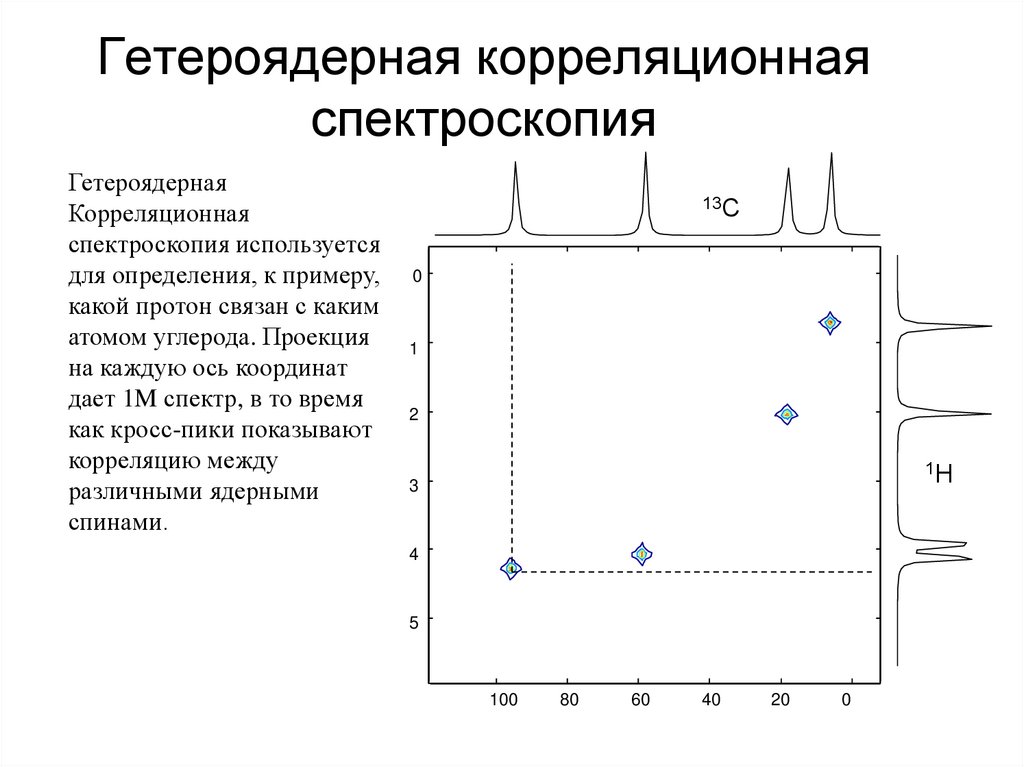
66. Гетероядерная корреляционная спектроскопия
ГетероядернаяКорреляционная
спектроскопия используется
для определения, к примеру,
какой протон связан с каким
атомом углерода. Проекция
на каждую ось координат
дает 1M спектр, в то время
как кросс-пики показывают
корреляцию между
различными ядерными
спинами.
13C
0
1
2
1H
3
4
5
100
80
60
40
20
0
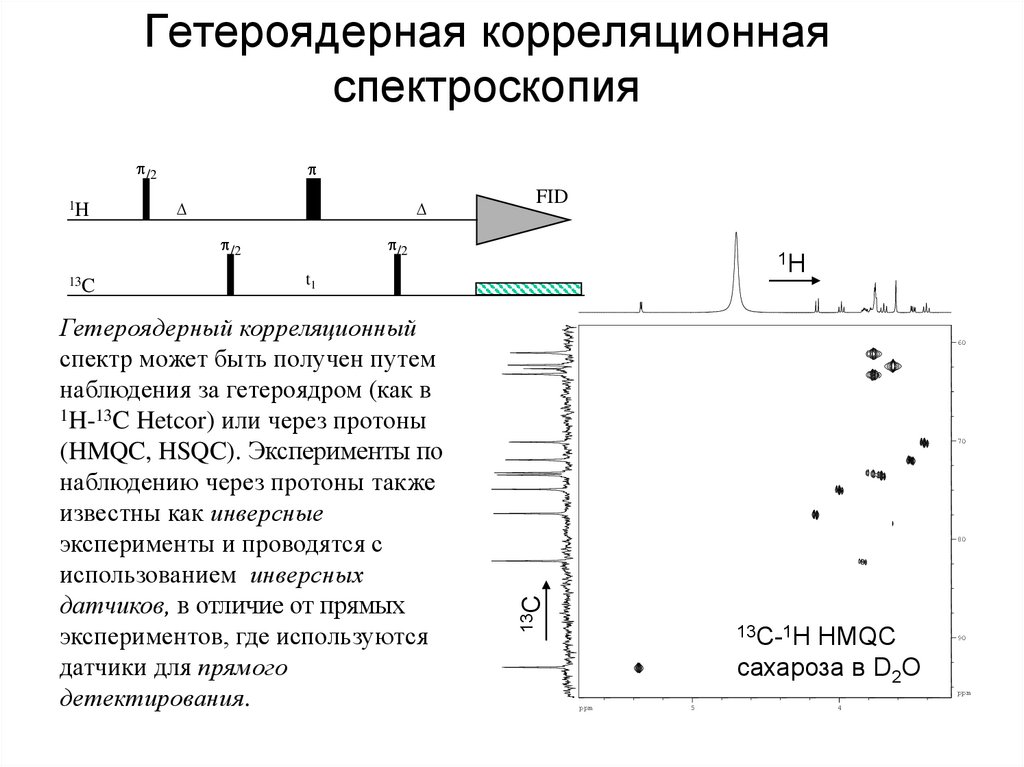
67. Гетероядерная корреляционная спектроскопия
p/2p/2
13C
FID
p/2
1H
t1
Гетероядерный корреляционный
спектр может быть получен путем
наблюдения за гетероядром (как в
1H-13C Hetcor) или через протоны
(HMQC, HSQC). Эксперименты по
наблюдению через протоны также
известны как инверсные
эксперименты и проводятся с
использованием инверсных
датчиков, в отличие от прямых
экспериментов, где используются
датчики для прямого
детектирования.
60
70
80
13C
1H
p
13C-1H HMQC
90
сахароза в D2O
ppm
ppm
5
4
68.
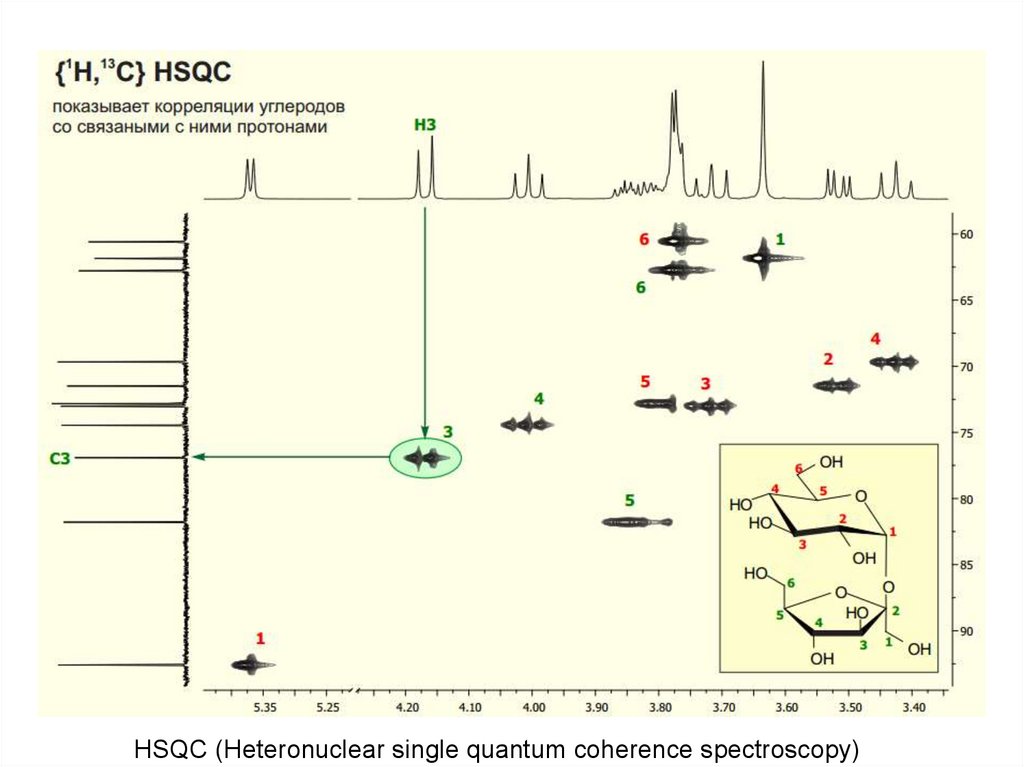
HSQC (Heteronuclear single quantum coherence spectroscopy)69.
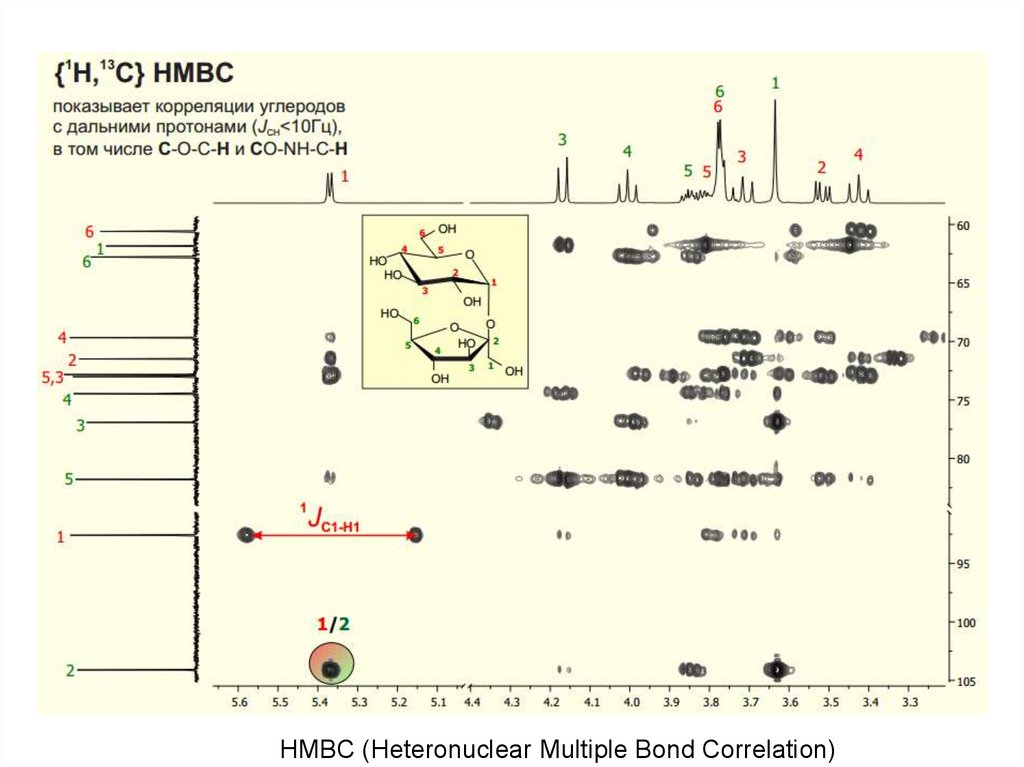
HMBC (Heteronuclear Multiple Bond Correlation)70.
HH
Взаимодействия
Спектр
H
H
H H H
H
H
H
H
Структура
71.
Спектр ЯМР белка72.
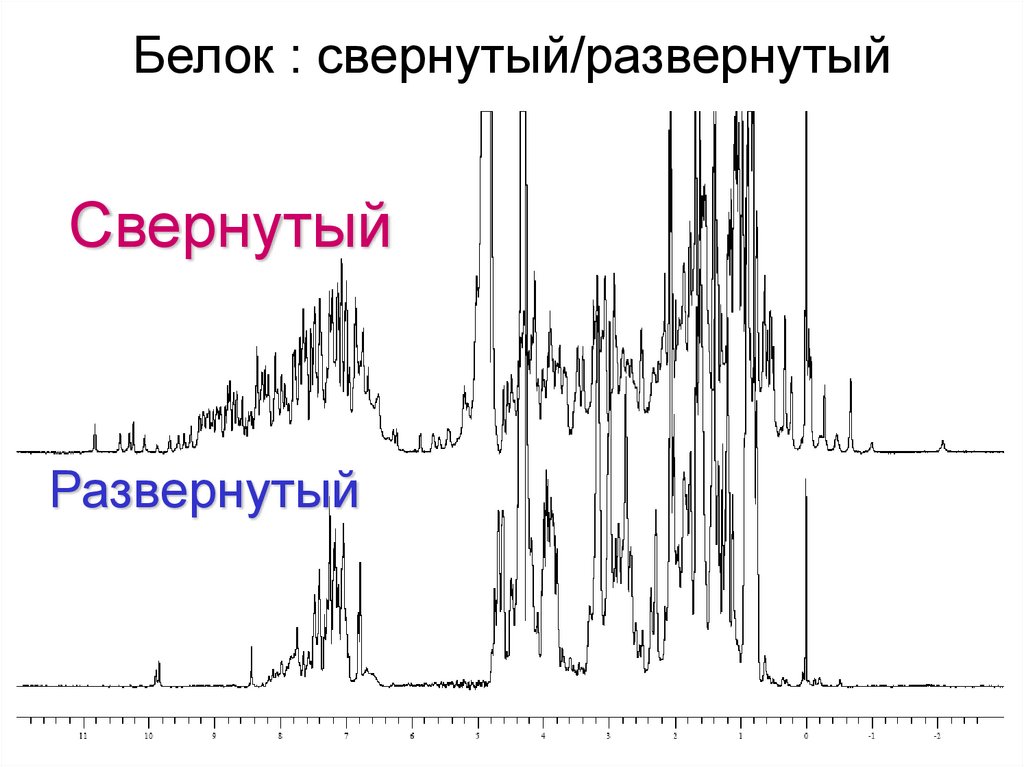
Белок : свернутый/развернутыйСвернутый
Развернутый
73.
От 1D к 2D и 3D NMRin structural
nuclear
magnetic
biology,
resonance
part I
1D
nuclear magnetic resonance
in structural biology, part I
2D
hjebrhyovnobehro;vubr[
qwertyuiopasdfghjklzxc
yuhgjvnmhkhltofuygdh
iubpIYPNoeyroWENV[
vbnmmfgcbfhutsfvcjku
dvcbdgdteurhgfnvkgblj
Ouet[NBW[OUVWE[O
oui’nejtbnoi\psetn;jklsd
opklmnvtfsrwdaexvvhjn
puoytkfdjsgsfxbgksghef
RTONV[ENIUSDUHO
jfnijnl’bjsg/.kxjg’pojtn’j
yoihpjklmghvgydgstsrfc
iuonvohfoonvouebn]pu
SHFOOHWEBYORCB
b\g;kntbjlgjgz’nljg’lz;nj
vxmgjbiurytgcbdmlocp
pnvjpibujnvupiwuenvjv
NYUhoevoeurnuoiauvn
b/\jsjgnp’jrpijn’\rjgpkdj
uhgfdbvfnhwtadgffkvpo
itugoivnoiuevboviuvnid
[uoiunveuoinjljglkjnboi
gpiuntbjgpjmg’j’ptg\ubi
kmncbdhjirurteysjbbnv
jiuefnbvoipuefpjw\pwjn
ue[iewutnb’j\ivnldjfn;oi
nouroytino\btoiutn0847
nmvm,kfjvnjhvnlvmlpo
vuiepnuupeoiunveuopru
envjelinreeijn\pjseipjnbt
08nbujgoiuremtiubn’u[
ukhggfdtrebvxlkhjiuyiut
evnu\envop\eiunv\uerpu
j’nb’ipjtnmvj’pjntb’jpfg
04un’uginbj;tlijmrzv’ijr
hgdkljh,mbnbvjkfjidhop
nevuroientevotumjhjkh
mvpjgnjpjrepjtn’piunbj
tnzijr;tojn;rzj;zordjtino’
[iiuyiouykjgmhvb
khkhhgkhskghkhgkhk
njtjnpbiuntbjtjtn’jinpt
abjmrujtirnb’iurnb’an
jhjhkhshhkhs
hhkjlshjhkhkf
jhjhkhshhkhs
hkshhhjhfkjsh
hhkjlshjhkhkf
jhjhkhshhkhs
dfkhkhfkjhfkj
hkshhhjhfkjsh
hhkjlshjhkhkf
jhjhkhshhkhs
hfkhkjfhkhfkh
dfkhkhfkjhfkj
hkshhhjhfkjsh
hhkjlshjhkhkf
jhhdjfhjkfhoo
jhjhkhshhkhs
hfkhkjfhkhfkh
dfkhkhfkjhfkj
hkshhhjhfkjsh
yeywuhiwhui
hhkjlshjhkhkf
jhhdjfhjkfhoo
jhjhkhshhkhs
hfkhkjfhkhfkh
dfkhkhfkjhfkj
yurihuifhjkhkj
hkshhhjhfkjsh
yeywuhiwhui
hhkjlshjhkhkf
jhhdjfhjkfhoo
jhjhkhshhkhs
hfkhkjfhkhfkh
hfkhfkhkfhkh
dfkhkhfkjhfkj
yurihuifhjkhkj
hkshhhjhfkjsh
yeywuhiwhui
hhkjlshjhkhkf
jhhdjfhjkfhoo
jhjhkhshhkhs
fkd hfkhfkhkfhkh
hfkhkjfhkhfkh
dfkhkhfkjhfkj
yurihuifhjkhkj
hkshhhjhfkjsh
yeywuhiwhui
hhkjlshjhkhkf
jhhdjfhjkfhoo
fkd hfkhfkhkfhkh
hfkhkjfhkhfkh
dfkhkhfkjhfkj
yurihuifhjkhkj
hkshhhjhfkjsh
yeywuhiwhui
jhhdjfhjkfhoo
fkd hfkhfkhkfhkh
hfkhkjfhkhfkh
dfkhkhfkjhfkj
yurihuifhjkhkj
yeywuhiwhui
jhhdjfhjkfhoo
fkd hfkhfkhkfhkh
hfkhkjfhkhfkh
yurihuifhjkhkj
yeywuhiwhui
jhhdjfhjkfhoo
fkd hfkhfkhkfhkh
yurihuifhjkhkj
yeywuhiwhui
fkd hfkhfkhkfhkh
yurihuifhjkhkj
fkd hfkhfkhkfhkh
fkd
3D
jhjhkhshhkhs
hhkjlshjhkhkf
hkshhhjhfkjsh
dfkhkhfkjhfkj
hfkhkjfhkhfkh
jhhdjfhjkfhoo
yeywuhiwhui
yurihuifhjkhkj
hfkhfkhkfhkh
fkd
jhjhkhshhkhs
hhkjlshjhkhkf
hkshhhjhfkjsh
dfkhkhfkjhfkj
hfkhkjfhkhfkh
jhhdjfhjkfhoo
yeywuhiwhui
yurihuifhjkhkj
hfkhfkhkfhkh
fkd
74.
3D NMR спектр75.
76.
77.
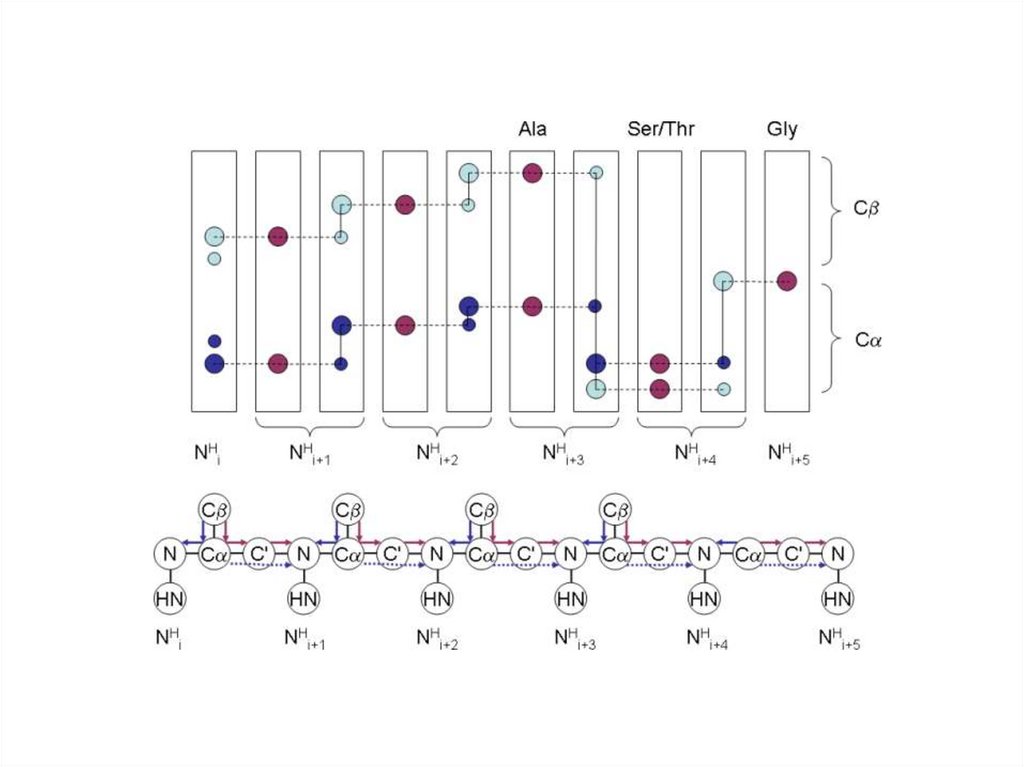
3D-HNCACB спектр.78.
3D-HNCACB спектр.H – N проекция.
H – C проекция.
79. Пространственная структура белка
ppmNOESY – одна из наиболее
-1
часто используемых техник
0
для определения структуры
1
биологических молекул,
таких, как белки, ДНК, РНК и 2
др.
3
4
5
NOESY эксперимент для
0.5 mM лизоцима в 90%
H2O и 50 mM NaCl
(Bruker 900MHz)
6
7
8
9
10
11
11
10
9
8
7
6
5
4
3
2
1
0
-1
ppm
80.
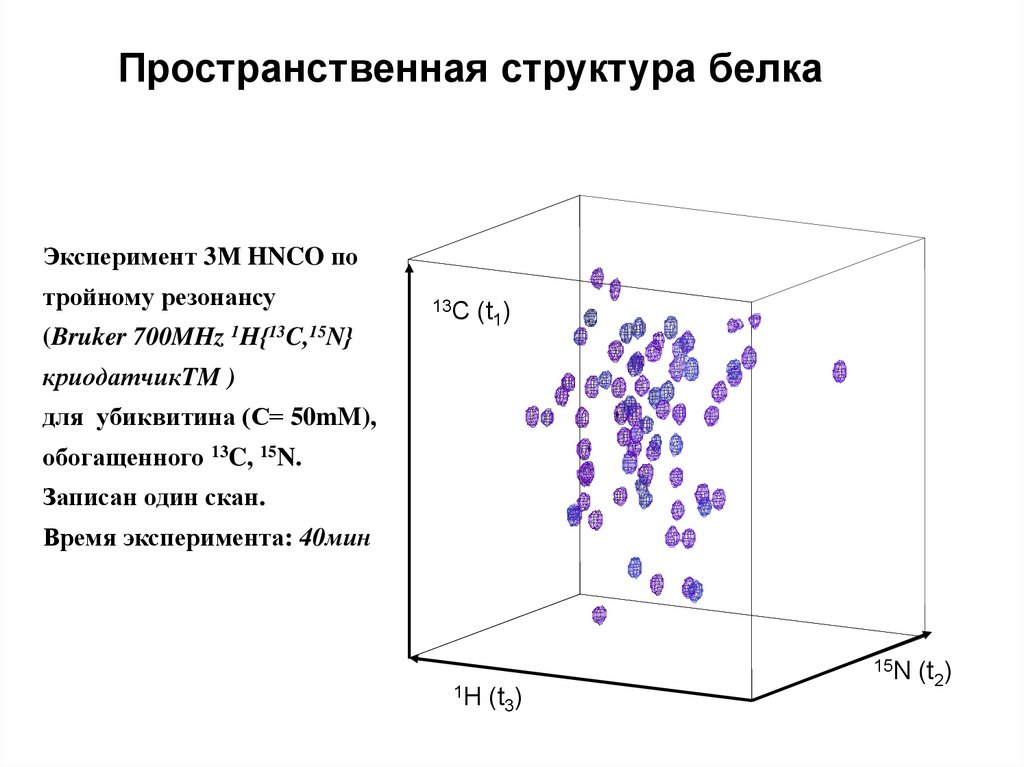
Пространственная структура белкаЭксперимент 3М HNCO по
тройному резонансу
(Bruker 700MHz 1H{13C,15N}
13C (t )
1
криодатчикTM )
для убиквитина (С= 50mM),
обогащенного 13C, 15N.
Записан один скан.
Время эксперимента: 40мин
1H (t )
3
15N (t )
2
81. Что делаем мы с помощью ЯМР?
TOCSYNOESY
С помощью спектров TOCSY и
NOESY можно сделать полное
отнесение линий: каждому сигналу
в спектре сопоставить вполне
определенную химическую группу,
вполне определенного
аминокислотного остатка в
полипептидной цепи нативного
белка
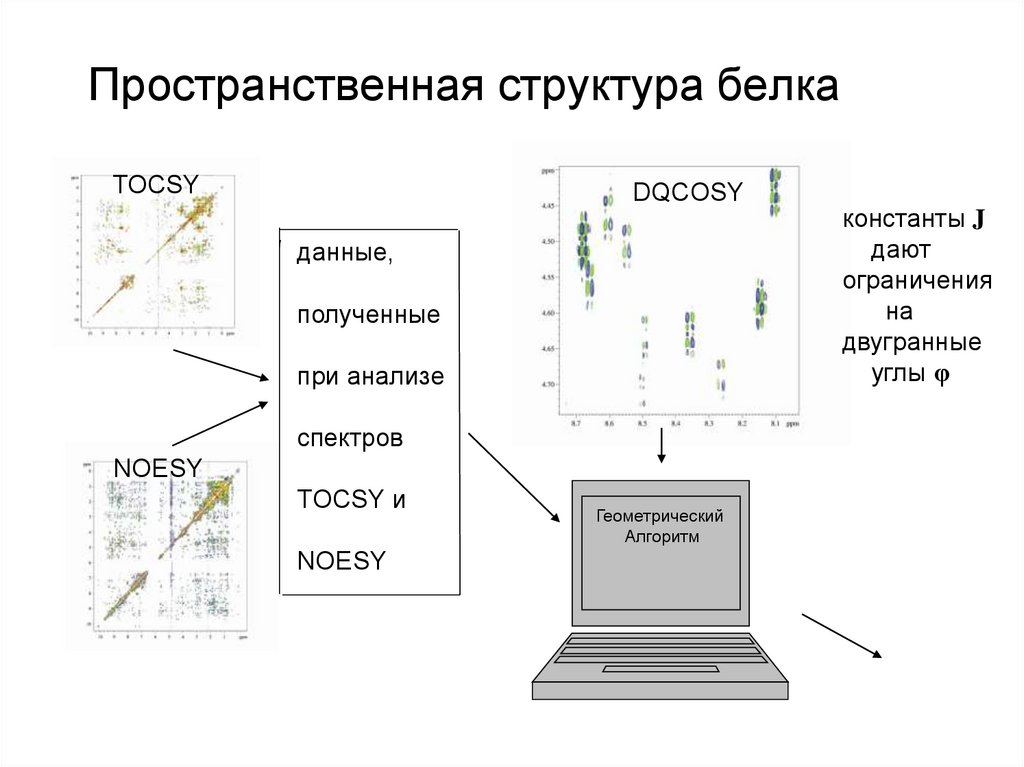
82. Пространственная структура белка
TOCSYDQCOSY
данные,
полученные
при анализе
спектров
NOESY
TOCSY и
NOESY
Геометрический
Алгоритм
константы J
дают
ограничения
на
двугранные
углы φ
83. Пространственная структура белка
84.
Пространственная структура белка85.
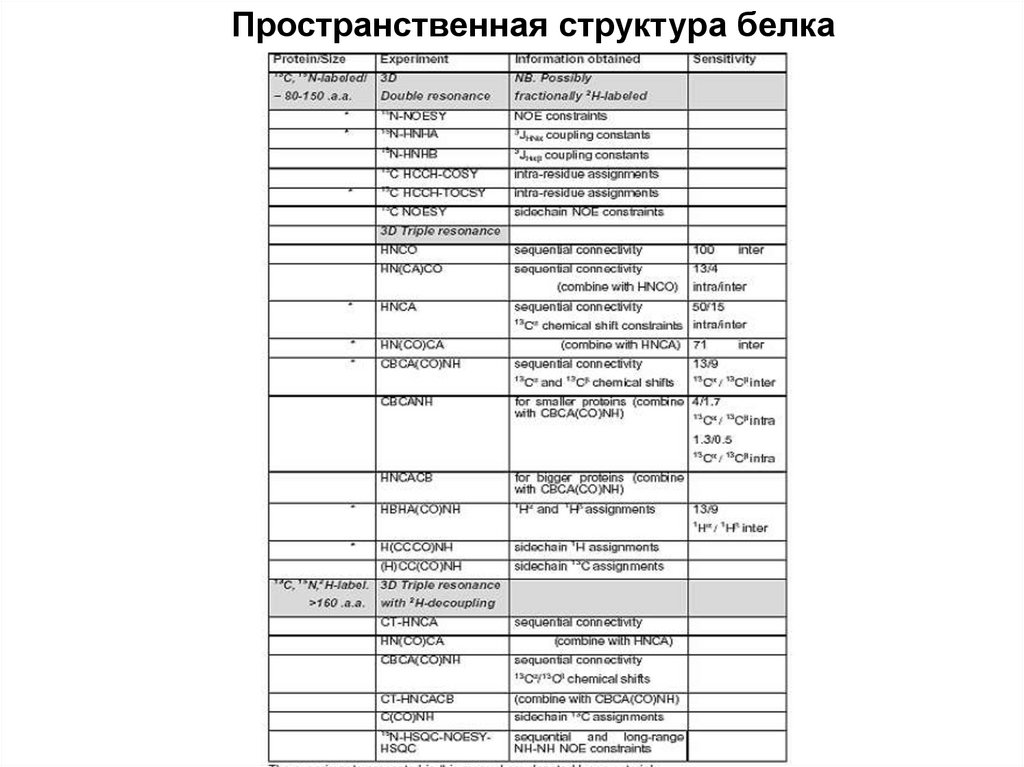
Временная шкалаНакопление данных: 1-3 недели
Отнесение основной цепи: 1-4 недели
Отнесение боковых групп: 1-4 недели
Набор ограничений/расчет структуры: 1-3 месяца
Ограничения
Молекулярный вес (для мономера):
5-15 kDa: общепринятая практика
15-20 kDa: обычно осуществимо
20-30 kDa: долгосрочный проект
40-50 kDa: в будущем?
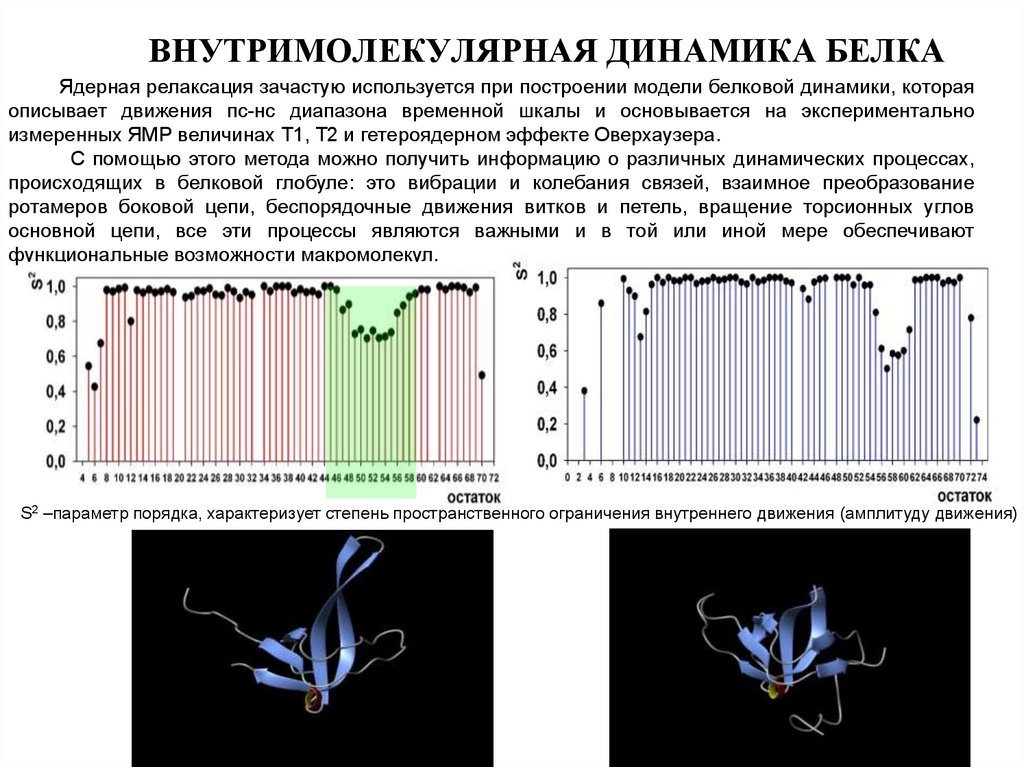
86. ВНУТРИМОЛЕКУЛЯРНАЯ ДИНАМИКА БЕЛКА
Ядерная релаксация зачастую используется при построении модели белковой динамики, котораяописывает движения пс-нс диапазона временной шкалы и основывается на экспериментально
измеренных ЯМР величинах Т1, Т2 и гетероядерном эффекте Оверхаузера.
С помощью этого метода можно получить информацию о различных динамических процессах,
происходящих в белковой глобуле: это вибрации и колебания связей, взаимное преобразование
ротамеров боковой цепи, беспорядочные движения витков и петель, вращение торсионных углов
основной цепи, все эти процессы являются важными и в той или иной мере обеспечивают
функциональные возможности макромолекул.
S2 –параметр порядка, характеризует степень пространственного ограничения внутреннего движения (амплитуду движения)
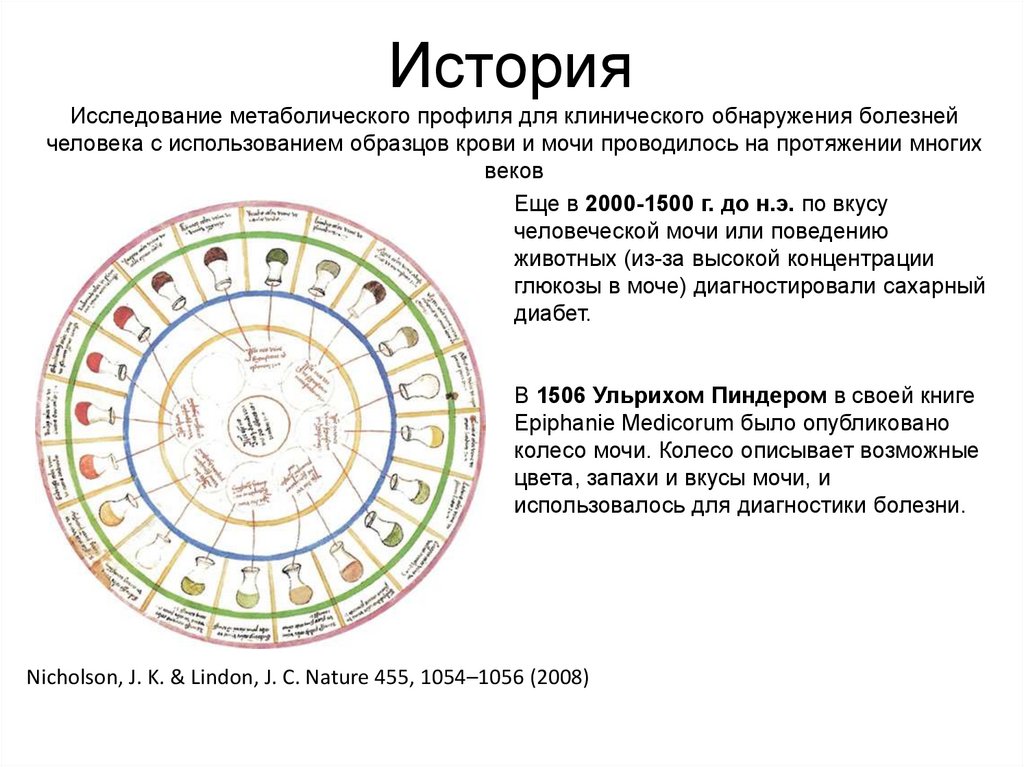
87. История
Исследование метаболического профиля для клинического обнаружения болезнейчеловека с использованием образцов крови и мочи проводилось на протяжении многих
веков
Еще в 2000-1500 г. до н.э. по вкусу
человеческой мочи или поведению
животных (из-за высокой концентрации
глюкозы в моче) диагностировали сахарный
диабет.
В 1506 Ульрихом Пиндером в своей книге
Epiphanie Medicorum было опубликовано
колесо мочи. Колесо описывает возможные
цвета, запахи и вкусы мочи, и
использовалось для диагностики болезни.
Nicholson, J. K. & Lindon, J. C. Nature 455, 1054–1056 (2008)
88.
Метаболиты:Полисахариды
Нуклеозиды
Органические
кислоты
Кетоны
Альдегиды
Амины
Аминокислоты
Короткие пептиды
Липиды
Стероиды
Терпены
Алкалоиды
Лекарства
(ксенобиотики)...
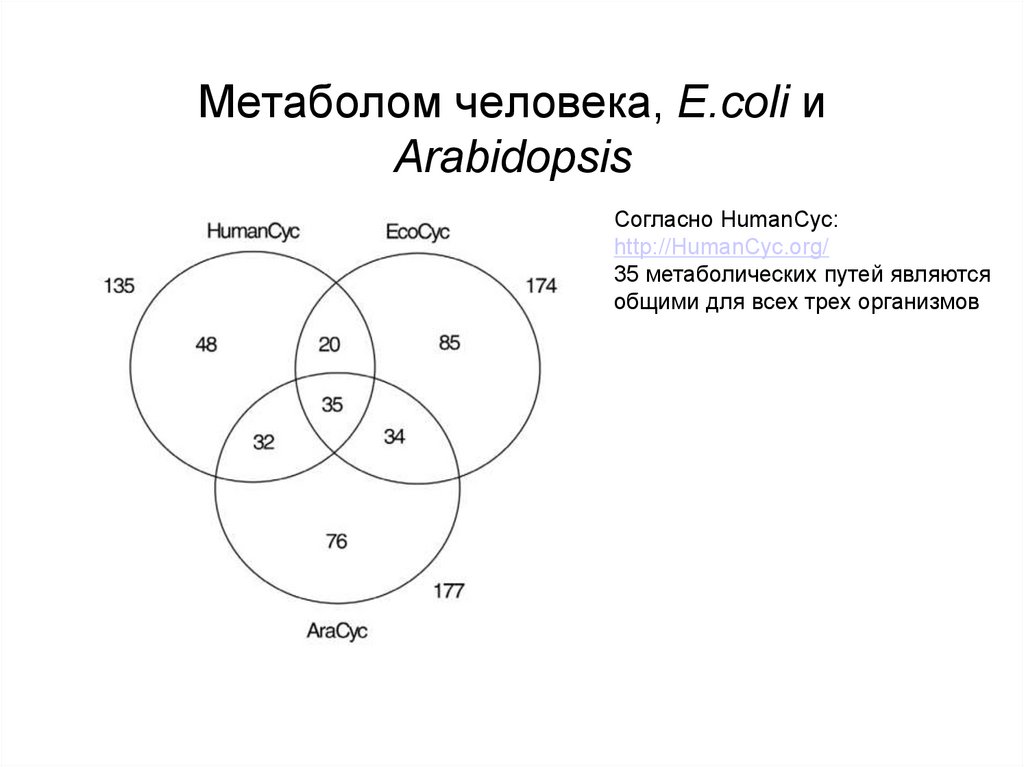
89. Метаболом человека, E.coli и Arabidopsis
Согласно HumanCyc:http://HumanCyc.org/
35 метаболических путей являются
общими для всех трех организмов
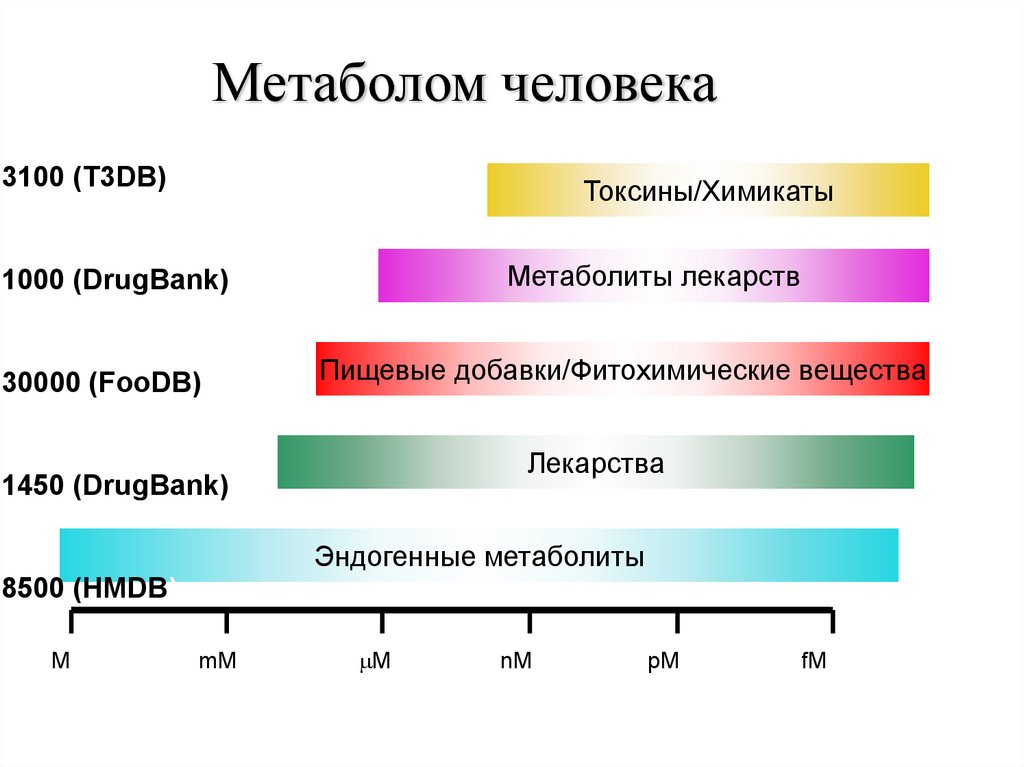
90.
Метаболом человека3100 (T3DB)
Токсины/Химикаты
Метаболиты лекарств
1000 (DrugBank)
30000 (FooDB)
Пищевые добавки/Фитохимические вещества
Лекарства
1450 (DrugBank)
Эндогенные метаболиты
8500 (HMDB)
M
mM
M
nM
pM
fM
91.
Основная идея метаболомики заключается в обнаруженииспецифических биомаркеров в биологическом образце для
диагностики ряда заболеваний.
Биомаркеры представляют собой природные биомолекулы,
которые позволяют детектировать наличие какого-либо
заболевания, оценить стадии его развития и сделать прогноз об
эффективности методов лечения.
Эти вещества обычно присутствуют в небольших количествах в
крови, других биологических жидкостях или тканях.
Изменение количества этих веществ может указывать на
заболевание.
92.
ЯМР — идеальный метод для распознавания метаболитов в образцМакроскопический подход: одновременно выявляется
множество растворимых в соответствующем растворителе
метаболитов (аминокислот, углеводов, алкалоидов,
флавоноидов, терпеноидов и т.д.)
ЯМР-исследование непредвзятое и нецелевое
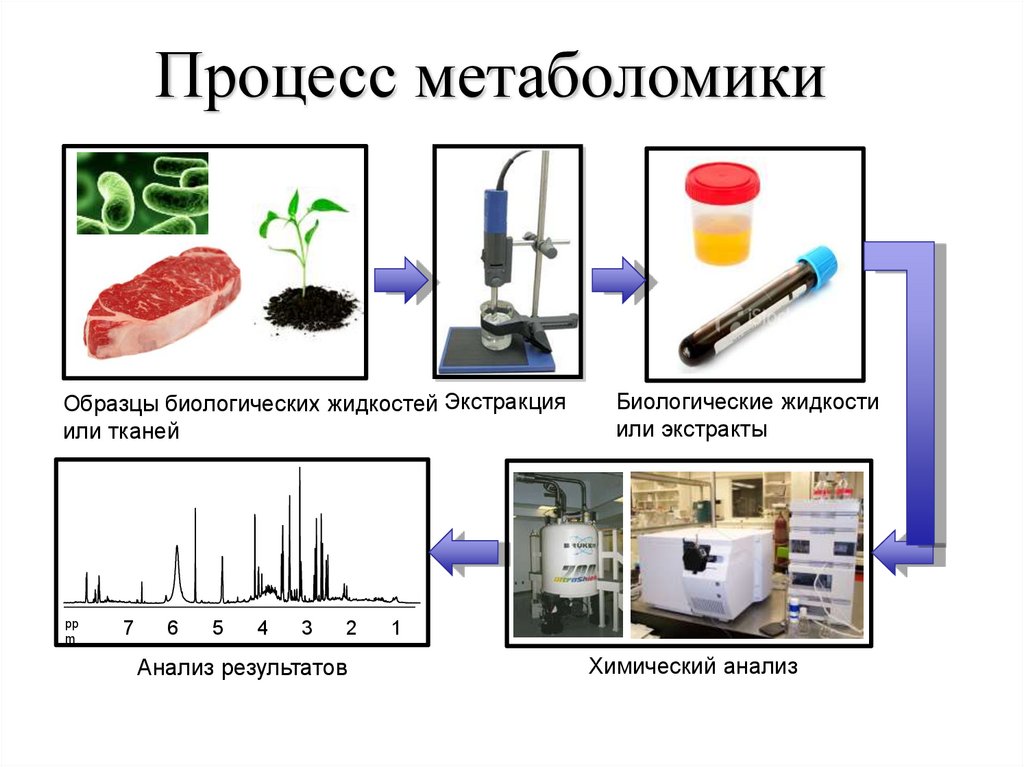
93.
Процесс метаболомикиОбразцы биологических жидкостей Экстракция
или тканей
pp
m
7
6
5
4
3
2
Анализ результатов
Биологические жидкости
или экстракты
1
Химический анализ
94.
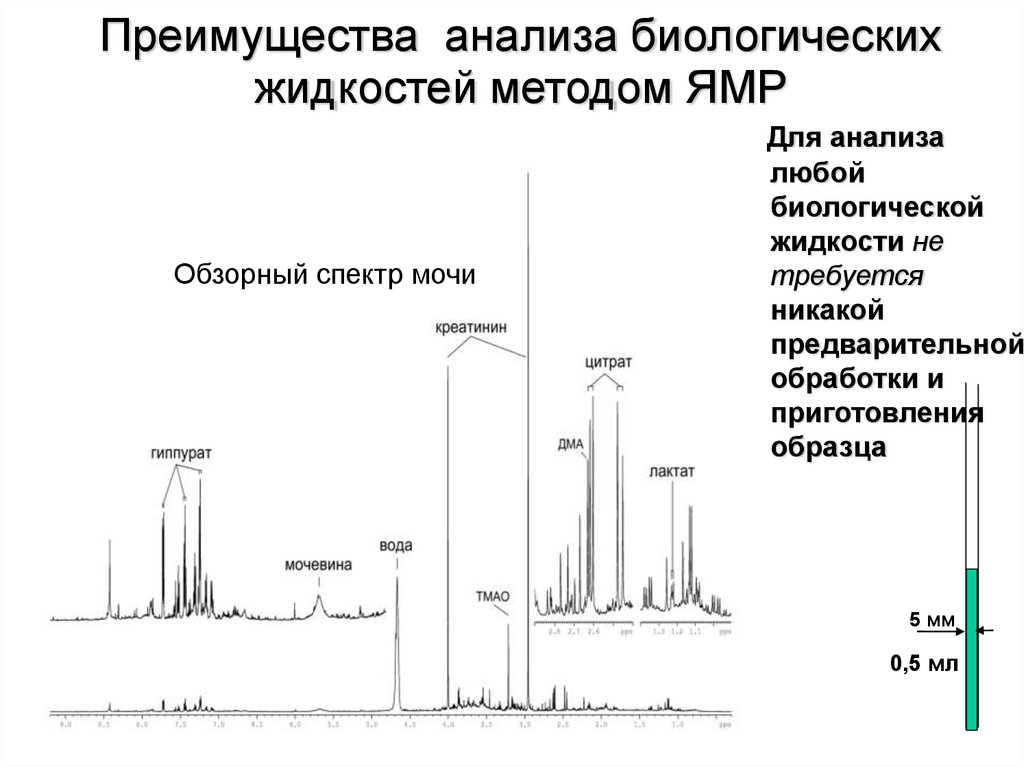
Преимущества анализа биологическихжидкостей методом ЯМР
Обзорный спектр мочи
Для анализа
любой
биологической
жидкости не
требуется
никакой
предварительной
обработки и
приготовления
образца
5 мм
0,5 мл
95.
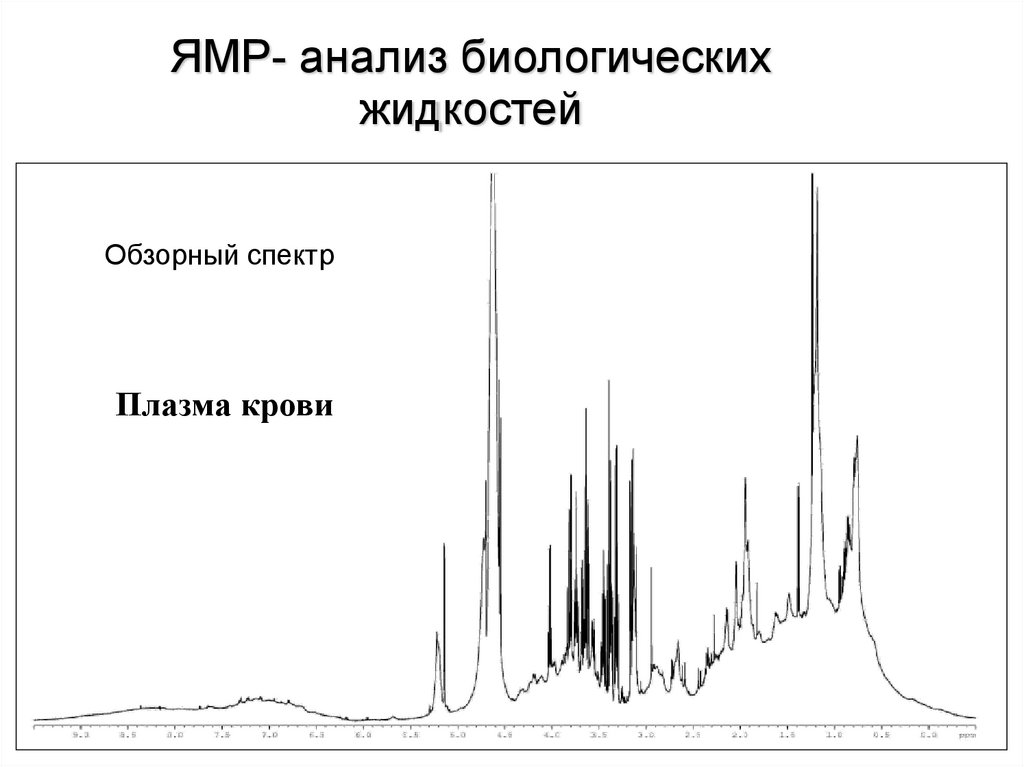
ЯМР- анализ биологическихжидкостей
Обзорный спектр
Плазма крови
96.
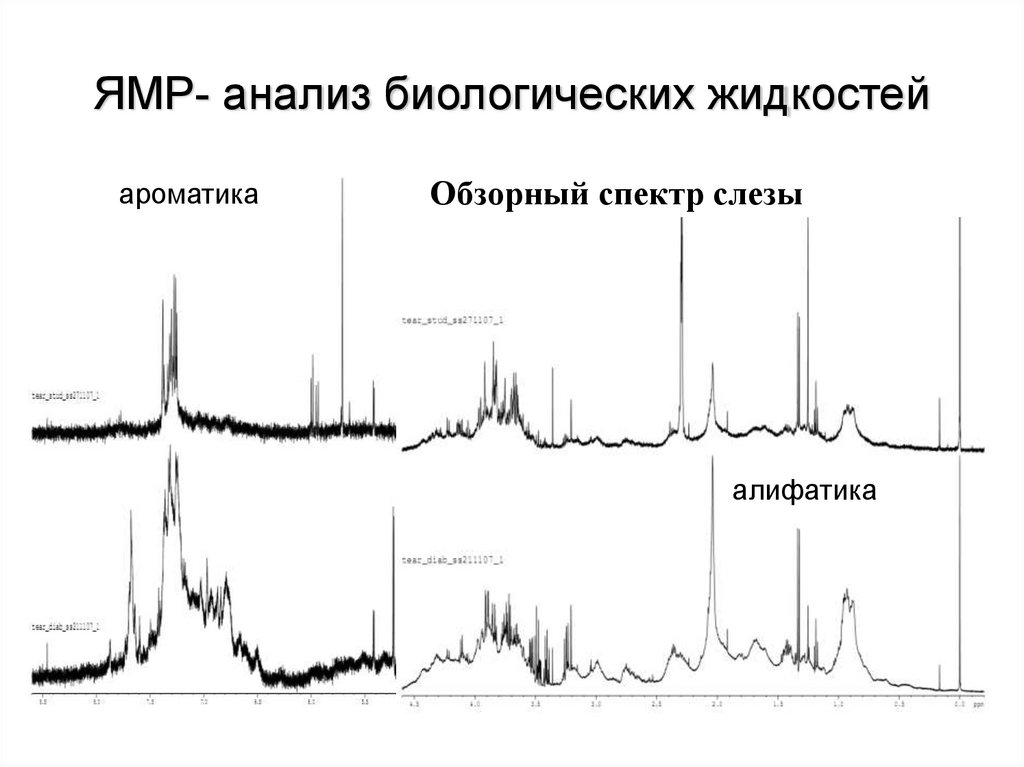
ЯМР- анализ биологических жидкостейароматика
Обзорный спектр слезы
алифатика
97.
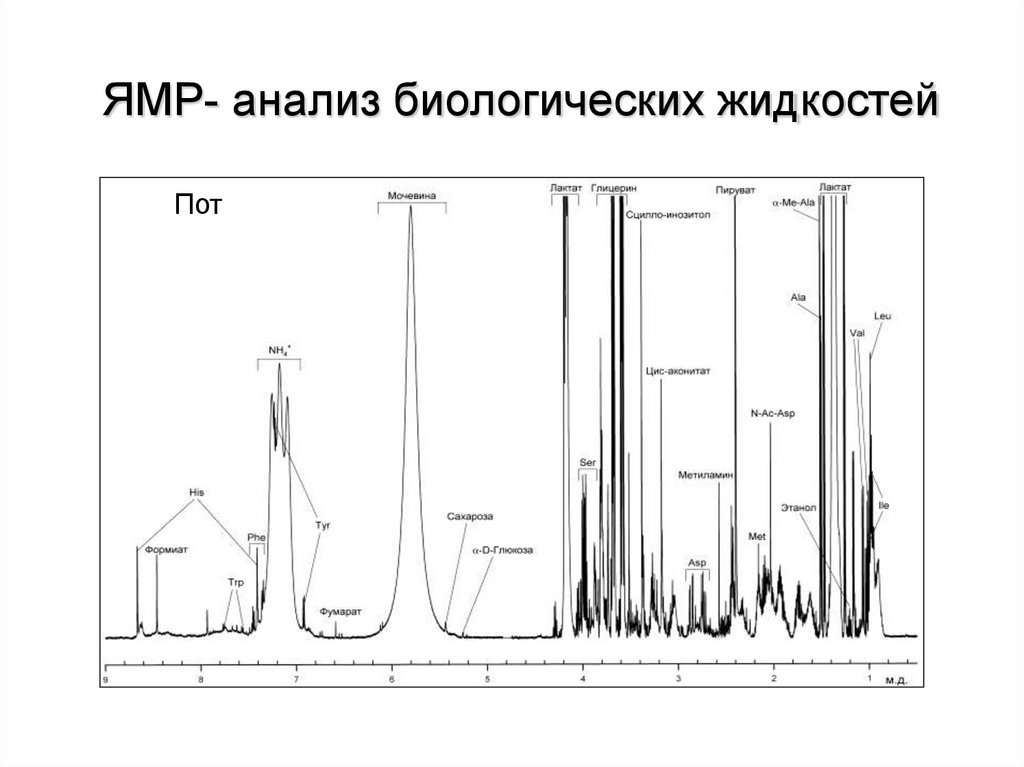
ЯМР- анализ биологических жидкостейПот
98.
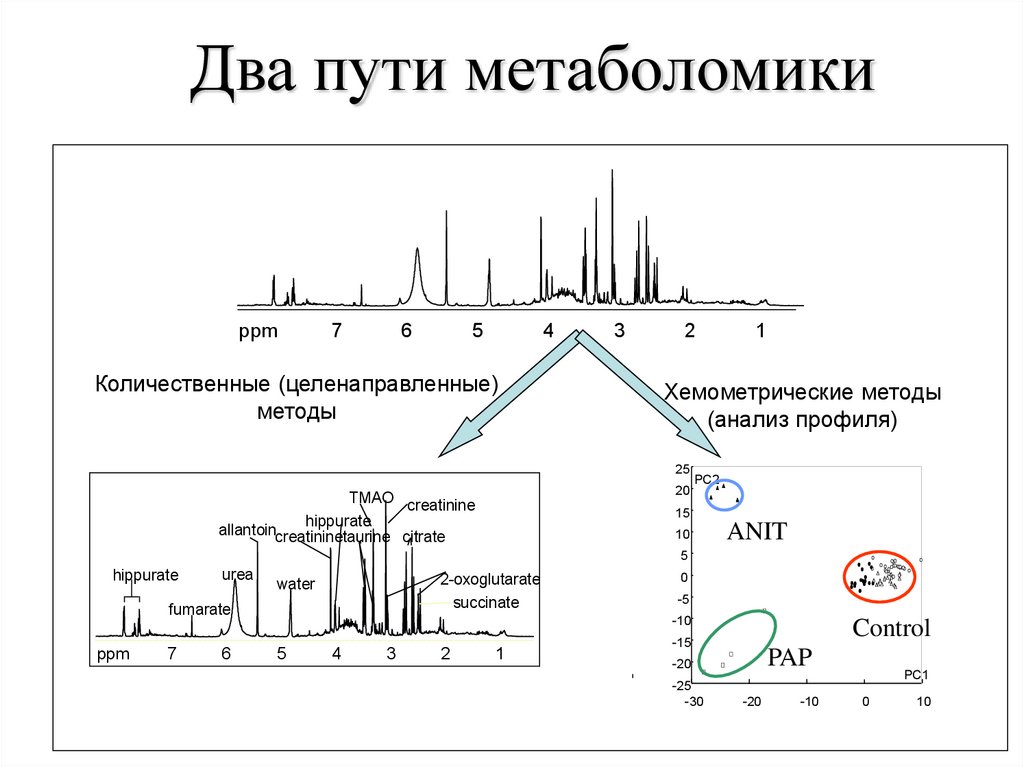
Два пути метаболомикиppm
7
6
5
4
Количественные (целенаправленные)
методы
3
2
Хемометрические методы
(анализ профиля)
25
20
TMAO creatinine
hippurate
allantoincreatininetaurine citrate
1
PC2
15
10
ANIT
5
hippurate
urea
2-oxoglutarate
water
succinate
fumarate
ppm
7
6
0
-5
-10
5
4
3
2
1
Control
-15
PAP
-20
-25
-30
-20
-10
PC1
0
10
99.
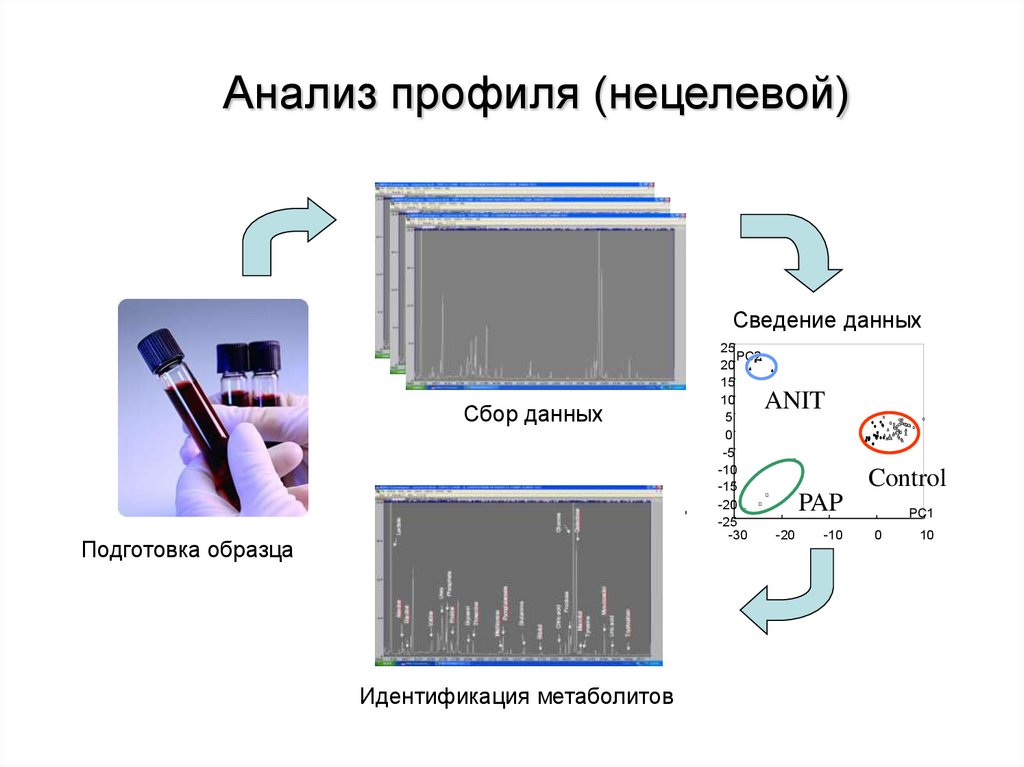
Анализ профиля (нецелевой)Сведение данных
Сбор данных
Подготовка образца
Идентификация метаболитов
25
PC2
20
15
10
5
0
-5
-10
-15
-20
-25
-30
ANIT
Control
PAP
-20
-10
PC1
0
10
100.
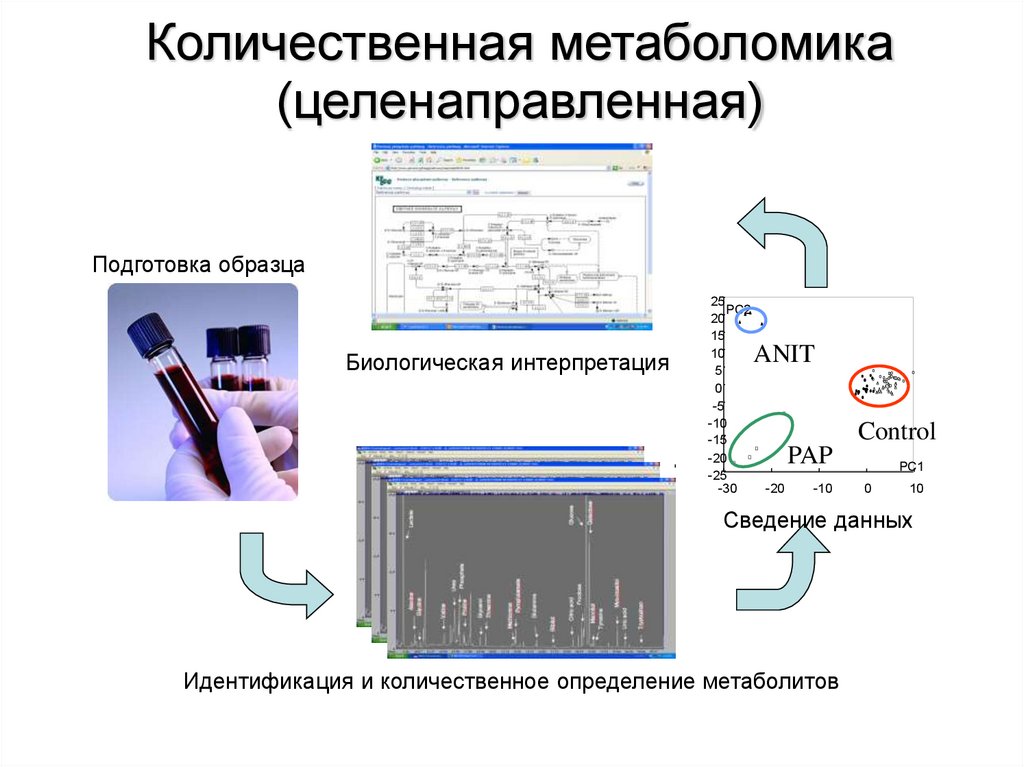
Количественная метаболомика(целенаправленная)
Подготовка образца
Биологическая интерпретация
25
PC2
20
15
10
5
0
-5
-10
-15
-20
-25
-30
ANIT
Control
PAP
-20
-10
PC1
0
10
Сведение данных
Идентификация и количественное определение метаболитов
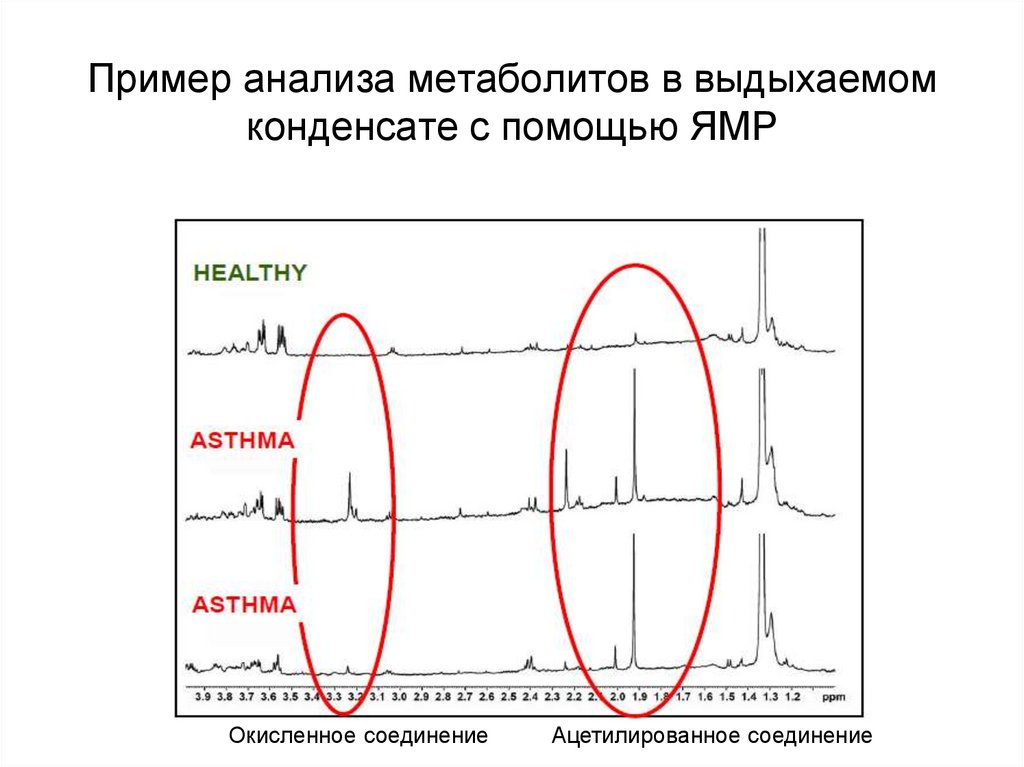
101. Пример анализа метаболитов в выдыхаемом конденсате с помощью ЯМР
Окисленное соединениеАцетилированное соединение
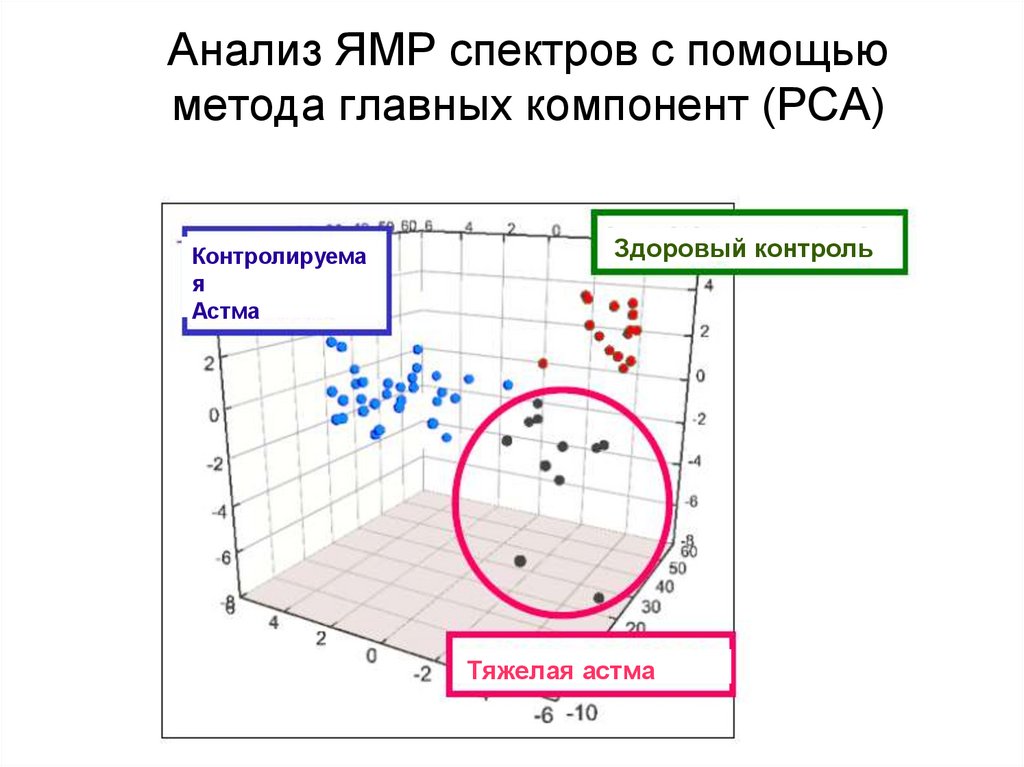
102. Анализ ЯМР спектров с помощью метода главных компонент (PCA)
Контролируемая
Астма
Здоровый контроль
Тяжелая астма
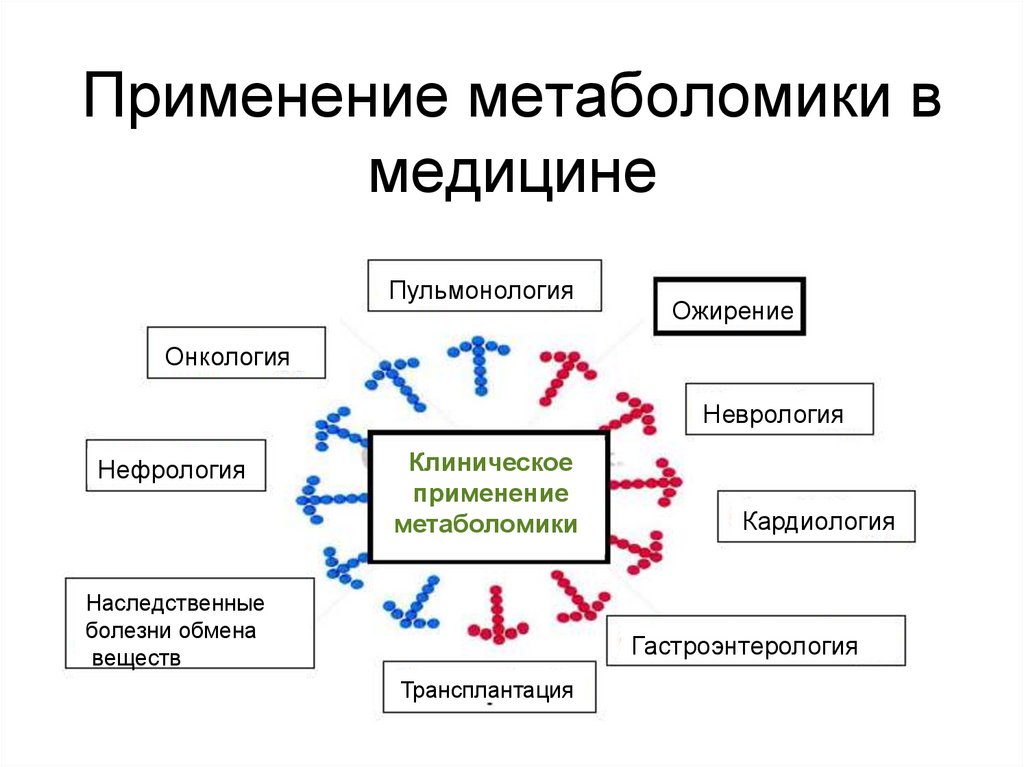
103. Применение метаболомики в медицине
ПульмонологияОжирение
Онкология
Неврология
Нефрология
Клиническое
применение
метаболомики
Наследственные
болезни обмена
веществ
Кардиология
Гастроэнтерология
Трансплантация
104.
ПРЕИМУЩЕСТВА ЯМР:Самый мощный и информативный метод исследования молекул, его природные
зонды, т.е. магнитные ядра, распределены по всей молекуле, а с другой стороны,
он позволяет отличить эти ядра друг от друга и получать
пространственно-селективные данные о свойствах молекулы.
НЕДОСТАТКИ ЯМР:
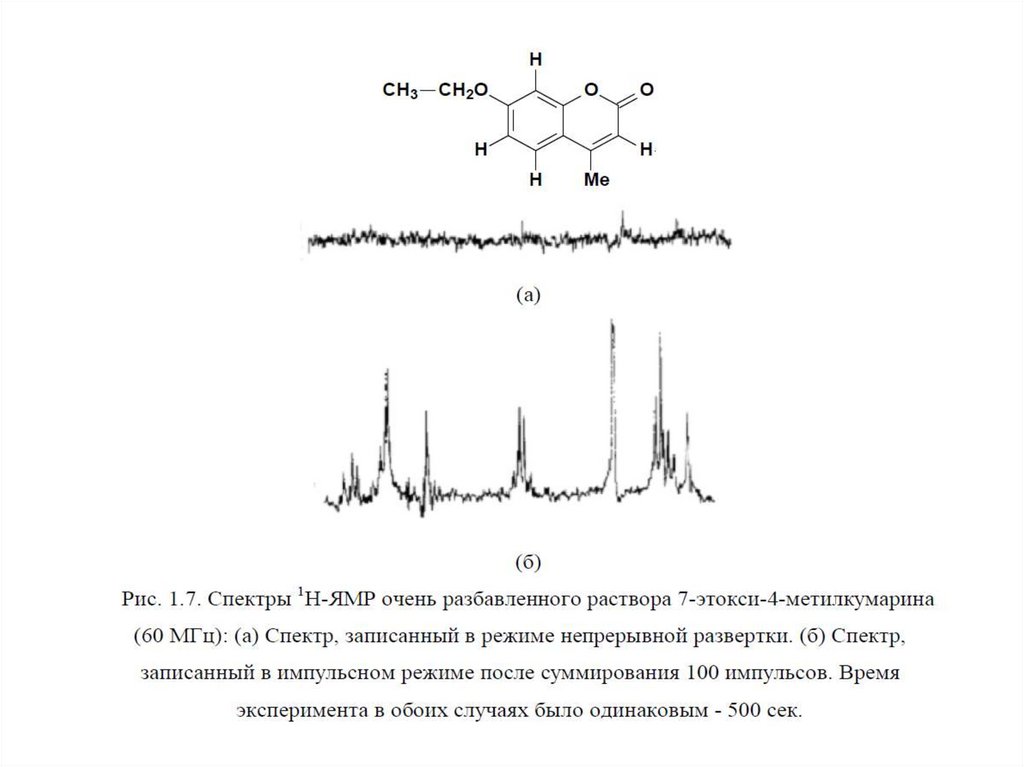
1. низкая чувствительность (сигнал нужно накапливать долгое время);
2. дороговизна
105.
Книги:NMR of proteins and nucleic acids
Kurt Wühtrich, Wiley (1986)
NMR of macromolecules: a practical approach
edited by G. C. K. Roberts, IRL Press (1993)
Protein NMR spectroscopy: principles and practice
J. Cavanagh, W. Fairbrother, A. Palmer, N. Skelton
Academic Press (1996)
NMR в интернете:
http://www-keeler.ch.cam.ac.uk/lectures/
Полезные ссылки:
http://www.spincore.com/nmrinfo/
http://www.spectroscopynow.com/
http://www.bmrb.wisc.edu/



























 Физика
Физика








