Похожие презентации:
Ферум. Залізо. Будова атома, фізичні і хімічні властивості
1.
Ферум. Залізо:будова атома, фізичні і
хімічні властивості.
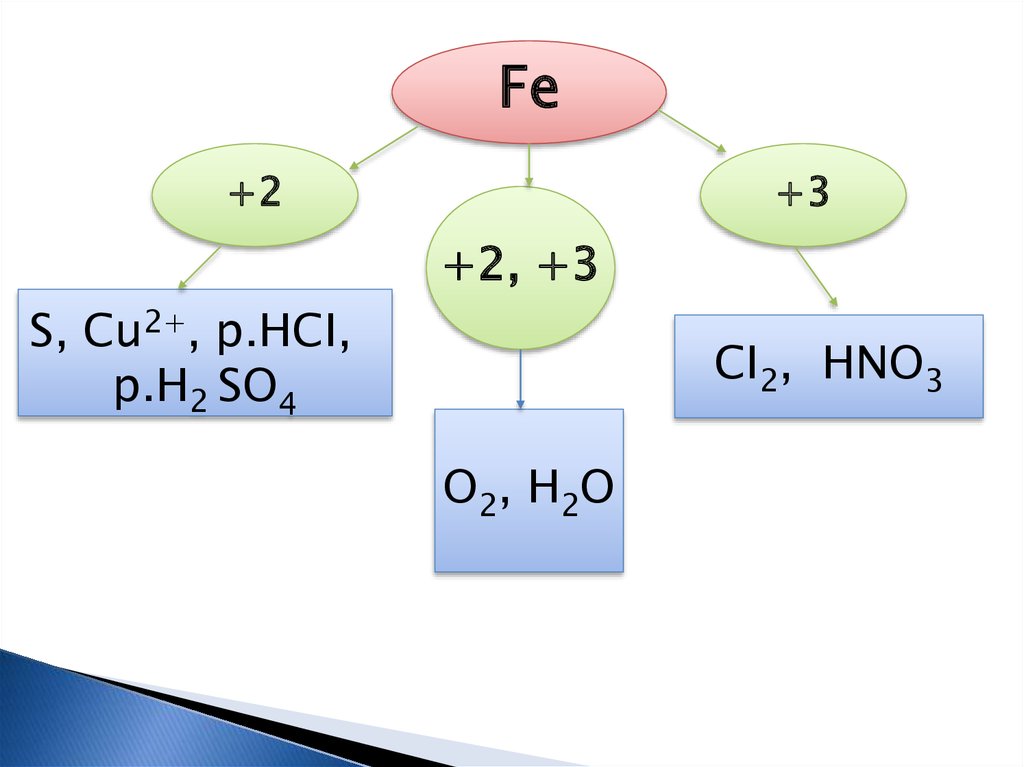
Генетичні ряди Феруму (II) і
Феруму (III).
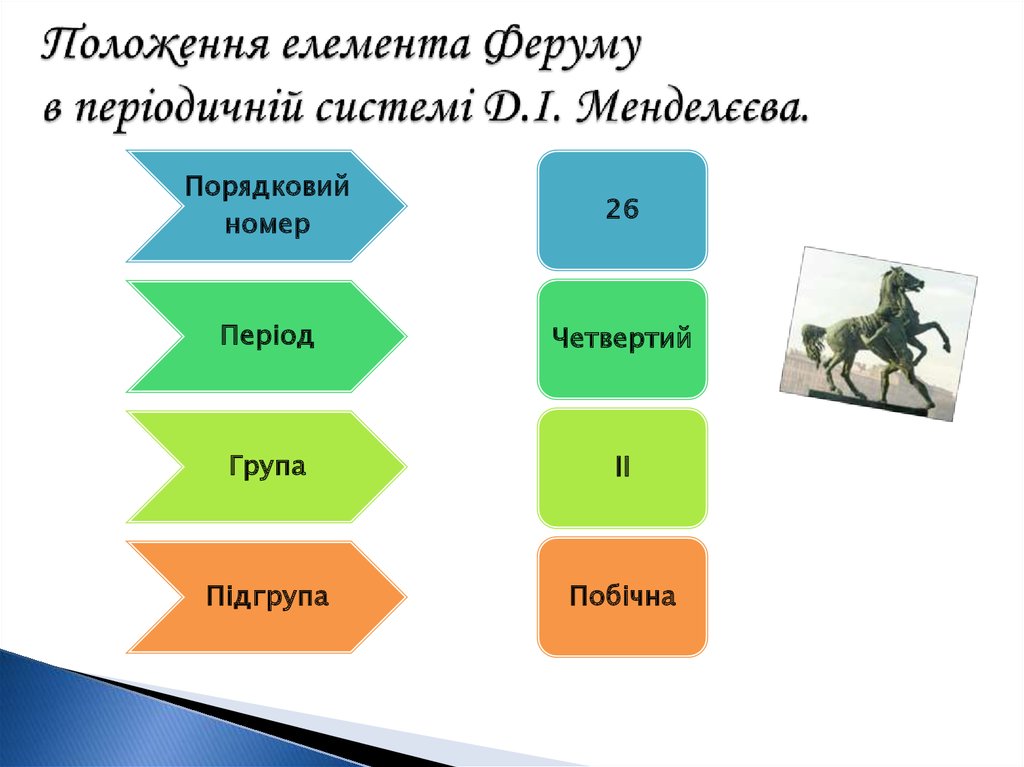
2. Положення елемента Феруму в періодичній системі Д.І. Менделєєва.
Порядковийномер
26
Період
Четвертий
Група
II
Підгрупа
Побічна
3. Будова атома Феруму
Дописати2
1s
2
2s
електронну формулу
6
2р
2
3s
6
3р ….
4. 1s2 2s2 2р6 3s2 3р6 3d6 4s2
Які електрони для елементів головних підгрупявляються валентними?
А які електрони для елементів побічних підгруп
являються валентними?
Запам’ятай!
Особливістю електронної будови елементів
побічних підгруп являється заповнення
електронами не останнього, а
передостаннього рівня.
5. Запам’ятай!
Валентні електрониатомів елементів побічних
підгруп розприділяються
на останньому і
передостанньому рівнях.
6.
Для Феруму характерні дваосновні ступені окиснення:
+2, +3.
0
+2
Fe –2e = Fe
Fe0 –3e = Fe+3
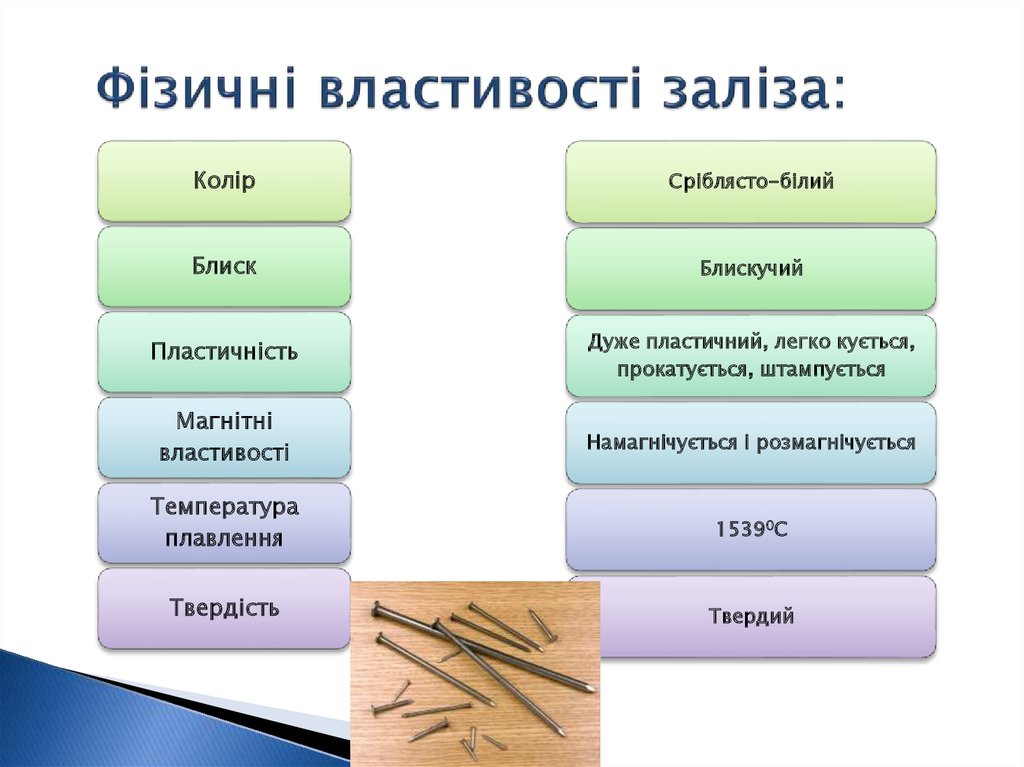
7. Фізичні властивості заліза:
КолірСріблясто-білий
Блиск
Блискучий
Пластичність
Дуже пластичний, легко кується,
прокатується, штампується
Магнітні
властивості
Намагнічується і розмагнічується
Температура
плавлення
15390С
Твердість
Твердий
8.
Fe+2
+3
+2, +3
S, Cu2+, p.HCI,
p.H2 SO4
CI2, HNO3
O2, H2O
9.
Закінчити рівняння хімічних реакцій:Fe
Fe
Fe
Fe
Fe
Fe
Fe
+
+
+
+
+
+
+
CI2 =
S=
HCI =
O2 =
CuSO4 =
H2O =
O2 + H2O =
10. Хімічні властивості заліза
Взаємодія з простими речовинами -неметалами1) З киснем.
0
0
+2, +3
-2
3Fe + 2O2 —>Fe3O4
+2 -2
+3
-2
(FeO • Fe2O3)
2) З сіркою і хлором.
Запишіть рівняння реакції і складіть електронний
баланс.
11.
00
+2 -2
Fe + S —>FeS
електронний баланс
Fe0 – 2e- —> Fe2+
S0 + 2e- —> S2-
+3
-1
2Fe0 + 3Cl20 —> 2FeCl3
електронний баланс
Fe0 – 3e- —> Fe3+
Cl20 +2e- —> 2Cl1-
12. Хімічні властивості заліза
Взаємодія з складними речовинами1) З водою.
3Fe0
+2, +3
+ 4H2O
—> Fe3O4 + 4H20
при t =7000 - 9000
2) З кислотами.
Дослід: здійснити реакцію між порошком
заліза і хлоридною кислотою.
В якому випадку можливі реакції між
металом і кислотою?
Скласти рівняння реакції.
Зробити висновок.
13. Fe + 2HCl —>FeCl2 + H2
МеталиВзаємодіють з
кислотами коли:
1. Метал знаходиться в ряду
активності металів до
водню.
2. Повинні одержати
розчинну сіль.
3. Реакція характерна для
розчинів кислот.
4. Метал + кислота → сіль +
водень
14. Хімічні властивості заліза
3) З солями.Дослід: здійснити
реакцію між
порошком заліза і
розчином купрум
(II) хлориду
В якому випадку
можливі реакції
між металом і
розчином солі?
Скласти
рівняння
реакції.
Зробити висновок.
15. Fe + CuCl2 —> FeCl2 + Cu
МеталиВзаємодіють з
розчинами солей
коли:
1. Кожний метал
витісняє із розчинів
солей всі інші
метали, які
розміщенні правіше
нього в ряду напруг.
2. Обидві солі (і
реагуюча і утворена
в результаті реакції)
повинні бути
розчинні.
16. Сполуки Феруму :
Fe3O4 – магнітнийзалізняк
Fe2O3 – червоний
залізняк (гематит)
2Fe2O3 * 3H2O –
бурий залізняк
FeS2 –залізний
колчедан
17. Ступінь окиснення металу в оксиді повинна відповідати ступеню окиснення металу у відповідному гідроксиді
+2+2
FeO —>Fe(OH)2
Даний оксид
проявляє основний
характер.
Які реакції
підтверджують
основний характер
оксидів?
+3
+3
Fe2O3 —> Fe(OH)3
Які сполуки
називають
амфотерними?
18. Які реакції відповідають схемі Fe+2 =>Fe+3 ?
1)2)
3)
2FeCI2 + CI2 = 2FeCI3
FeCI3 + 3NaOH = Fe(OH)3 + 3NaCI
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
19. Якісні реаукції на йони Феруму Fe2+ і Fe3+
На йони Fe2++2
+3 +2
FeCl2 + K3[Fe(CN)6] —> KFe[Fe(CN)6]+2KCL
червона кровяна сіль
синій осад
----------------------------------------------------------------------------------------------------------
На йони Fe3+
+3
+3 +2
FeCl3 + K4[Fe(CN)6] —> KFe[Fe(CN)6]+3KCL
жовта кровяна сіль
+3
синій осад
+3
FeCl3 + KCNS —> Fe(CNS)3 + 3KCl
роданід калію
розчин червоного кольору
20. Лабораторний дослід Здійснити практично ланцюг хімічних перетворень . Скласти рівняння хімічних реакцій .
Вариант 1:Fe —> FeCl2 —> Fe(OH)2 —> FeO
Вариант 2:
Fe —> FeCl3 —> Fe(OH)3 —> Fe2O3

















 Химия
Химия








