Похожие презентации:
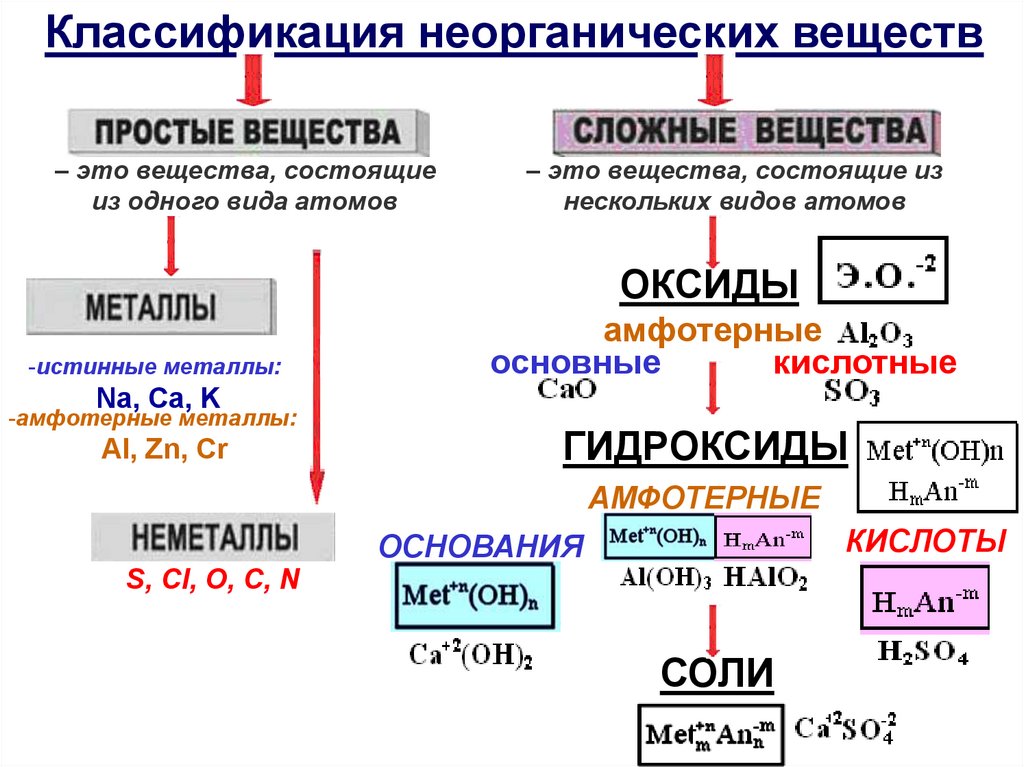
Классификация неорганических веществ
1.
Классификация неорганических веществ– это вещества, состоящие
из одного вида атомов
– это вещества, состоящие из
нескольких видов атомов
ОКСИДЫ
-истинные металлы:
амфотерные
основные
кислотные
Na, Ca, K
-амфотерные металлы:
Al, Zn, Cr
ГИДРОКСИДЫ
АМФОТЕРНЫЕ
КИСЛОТЫ
ОСНОВАНИЯ
S, Cl, O, C, N
СОЛИ
2.
3.
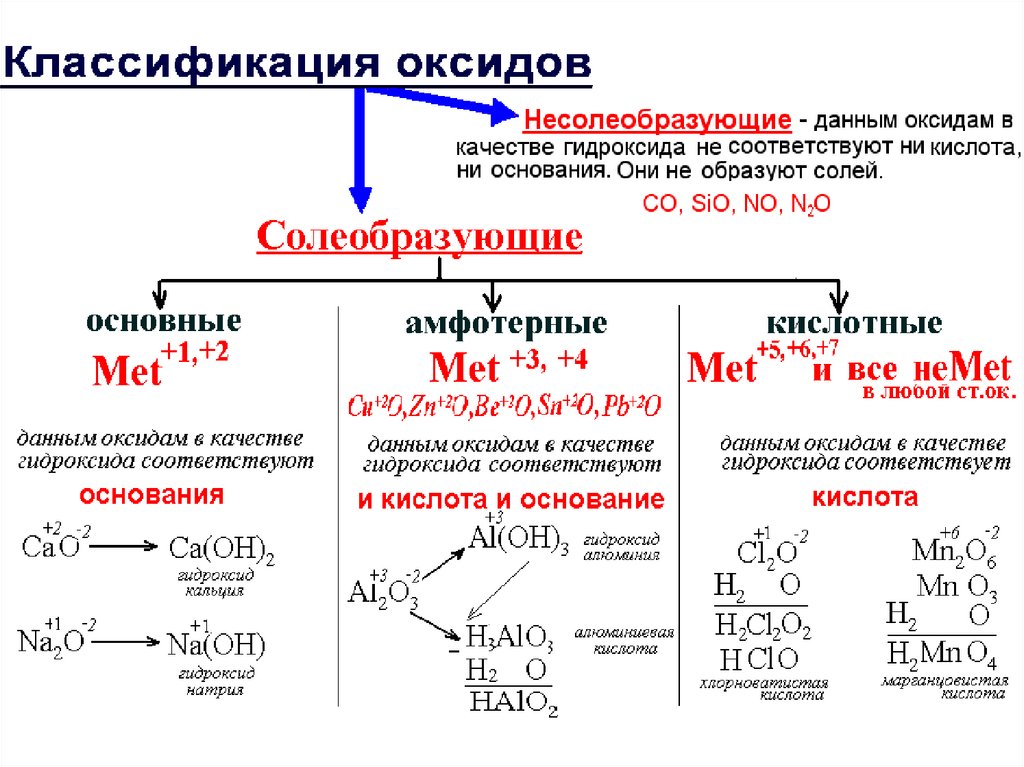
Кислотно-основные свойства металловс переменной валентностью (Mn, Cr и др.)
Основные
Амфотерные
Кислотные
Mn+2O-2
Mn(OН)2
Mn(OН)3
Mn(OН)4
НMnO2
Н2MnO3
Н2MnO4
НMnO4
При составлении названии оксидов, солей и оснований, в состав которых входит Met с
переменной валентностью необходимо указывать его валентность в данном соединении.
Пример: Mn+2O-2 оксид марганца (II)
Mn+2SO4 сульфат марганца (II)
Mn(OН)3 гидроксид марганца (III) Mn+4(SO4)2 сульфат марганца (IV)
4.
ОснованияОснования – это сложные вещества в которых катион металла
соединен с одной или несколькими гидроксо группами ОН-1
Классификация оснований
* по растворимости:
-растворимые в воде (щелочи)
NaOH RbOH KOH Ca(OH)2 Ba(OH)2
- нерастворимые в воде
Cu(OH)2 Mg(OH)2 Al(OH)3 и др.
* по кислотности:
-однокислотные
NaOH RbOH KOH
-двухкислотные
Ca(OH)2 Ba(OH)2
-трехкислотные
Al(OH)3 Cr(OH)3
5.
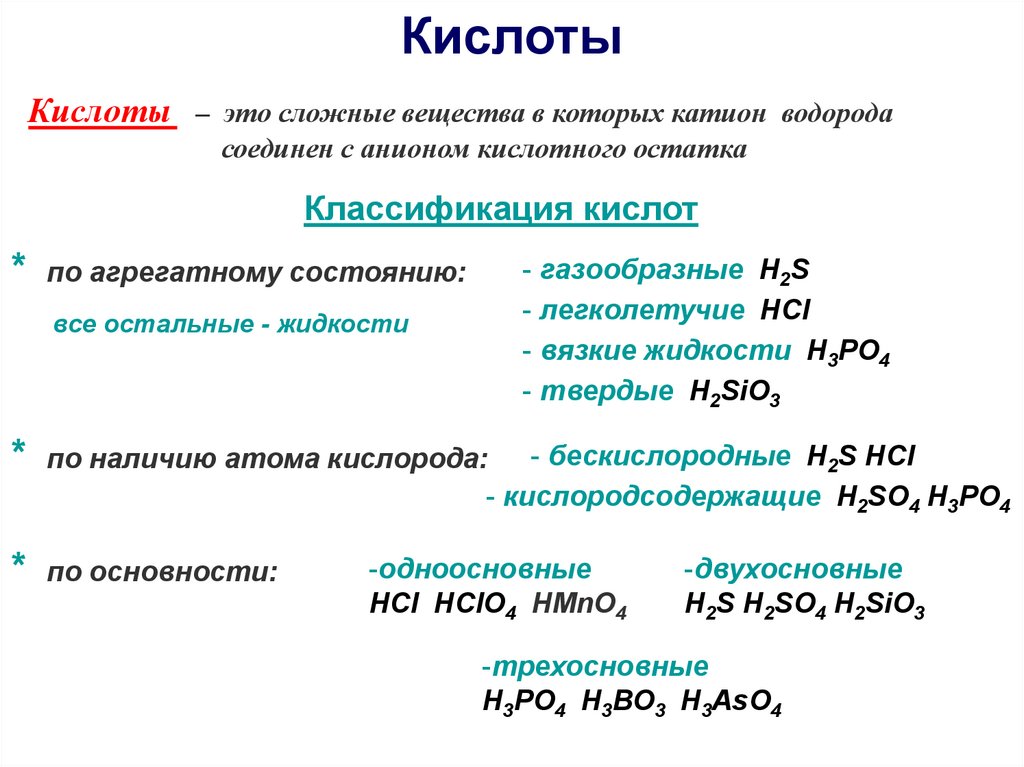
КислотыКислоты – это сложные вещества в которых катион водорода
соединен с анионом кислотного остатка
Классификация кислот
- газообразные H2S
- легколетучие HCl
- вязкие жидкости H3РО4
- твердые H2SiО3
* по агрегатному состоянию:
все остальные - жидкости
- бескислородные H2S HCl
- кислородсодержащие H2SО4 H3РО4
* по наличию атома кислорода:
* по основности:
-одноосновные
HCl HClO4 HMnO4
-двухосновные
H2S H2SO4 H2SiО3
-трехосновные
H3РО4 H3ВО3 H3AsО4
6.
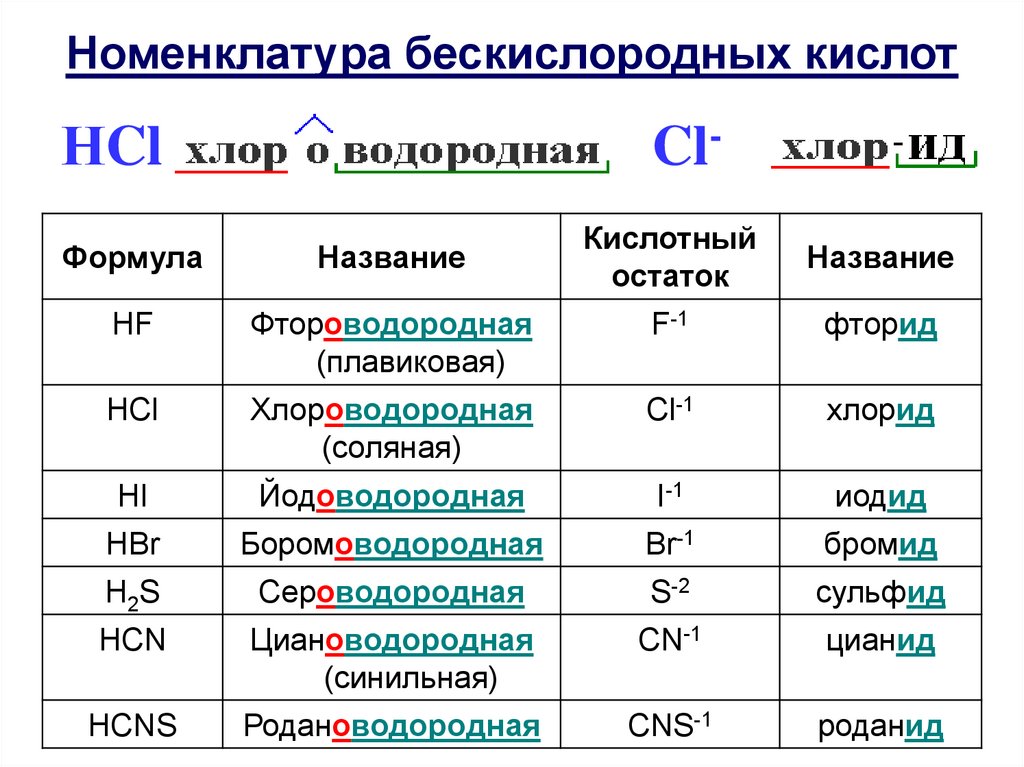
Номенклатура бескислородных кислотНCl
Cl-
Формула
Название
Кислотный
остаток
Название
HF
Фтороводородная
(плавиковая)
F-1
фторид
HCl
Хлороводородная
(соляная)
Cl-1
хлорид
HI
Йодоводородная
I-1
иодид
HBr
Боромоводородная
Br-1
бромид
H2S
Сероводородная
S-2
cульфид
НCN
Циановодородная
(синильная)
CN-1
цианид
НCNS
Родановодородная
CNS-1
роданид
7.
Номенклатура кислородсодержащих кислот* Если в состав кислоты входит кислотообразующий элемент в
максимальной степени окисления, то кислота будет иметь окончание:
+4
кремниевая
+6
серная
SО4
H2SiО3
H2SО4
+7
HMnО4
марганцовая
2-
SiО3
силикат
2-
сульфат
-
MnО4
перманганат
* Если в состав кислоты входит кислотообразующий элемент не в
максимальной степени окисления, то кислота будет иметь окончание:
+4
H2SО3
+3
H3РО3
сернистая
фосфористая
2-
SО3
сульфит
3-
фосфит
РО3
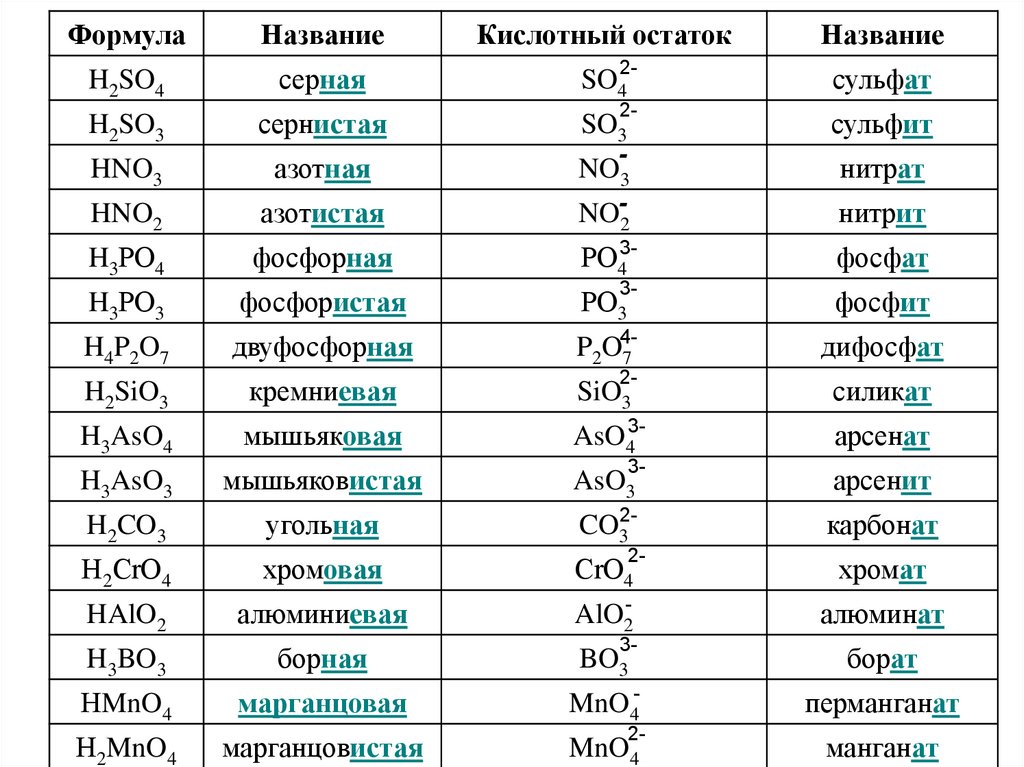
8.
ФормулаНазвание
Кислотный остаток
H2SO4
серная
SO4
2-
сульфат
H2SO3
сернистая
SO3
2-
сульфит
HNO3
азотная
NO3
-
нитрат
HNO2
азотистая
NO-2
нитрит
H3РO4
фосфорная
РO43-
фосфат
H3РO3
фосфористая
РO3
3-
фосфит
H 4 P2 O 7
двуфосфорная
P2O47
дифосфат
H2SiO3
кремниевая
SiO3
2-
силикат
H3AsO4
мышьяковая
AsO43-
арсенат
H3AsO3
мышьяковистая
AsO3
3-
арсенит
H2CO3
угольная
CO32-
карбонат
Н2СrO4
хромовая
СrO4
2-
хромат
HAlO2
алюминиевая
AlO2-
алюминат
H3BO3
борная
BO3
борат
НMnO4
марганцовая
MnO4-
перманганат
Н2MnO4
марганцовистая
MnO4
3-
2-
Название
манганат
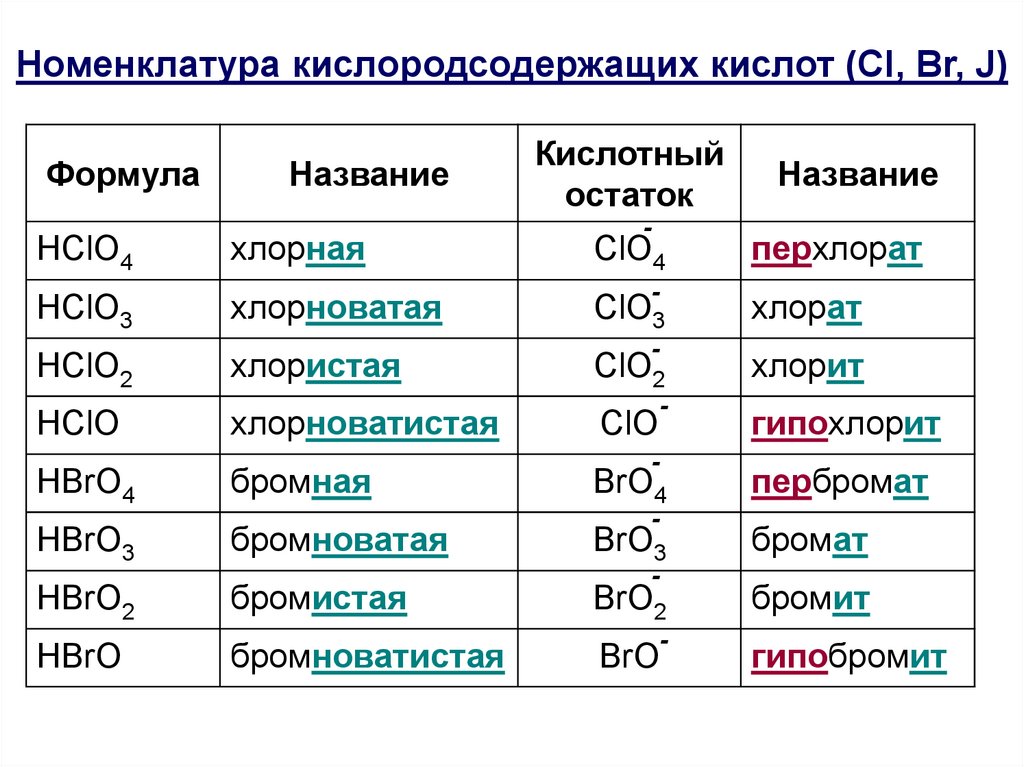
9.
Номенклатура кислородсодержащих кислот (Cl, Br, J)Формула
НСlO4
НClO3
НClO2
НСlO
НBrO4
Название
хлорная
хлорноватая
хлористая
хлорноватистая
бромная
НBrO3
бромноватая
НBrO2
бромистая
НBrO
бромноватистая
Кислотный
остаток
Название
-
перхлорат
-
ClO3
хлорат
-
хлорит
-
гипохлорит
-
пербромат
-
BrO3
бромат
BrO2
бромит
СlO4
ClO2
СlO
BrO4
-
BrO
-
гипобромит
10.
Принцип кислотно-основного взаимодействия* В основных соединениях (основный оксид, основание) выделяем
катион Met +m
+1
2
+2
Na O
CaO
+1
NaOН
+2
Ca(OН)2
* В кислотных соединениях (кислотный оксид, кислота) выделяем
анион кислотного остатка An-n
+
CO2
H2 О
-2
H2СО3
-2
H2SО4
-3
H3РО3
* В амфотерных соединениях можно выделить как
катион Met +m так и анион кислотного остатка An-n
+3
Al2O3
оксид
Al2O3
+
H2 О
Н2Al2O4
-1
Н Al O2
+3
Al(OН)3
гидроксид
Al(OН)3
- Н3 Al O3
H2 О
Н Al O-1
2
11.
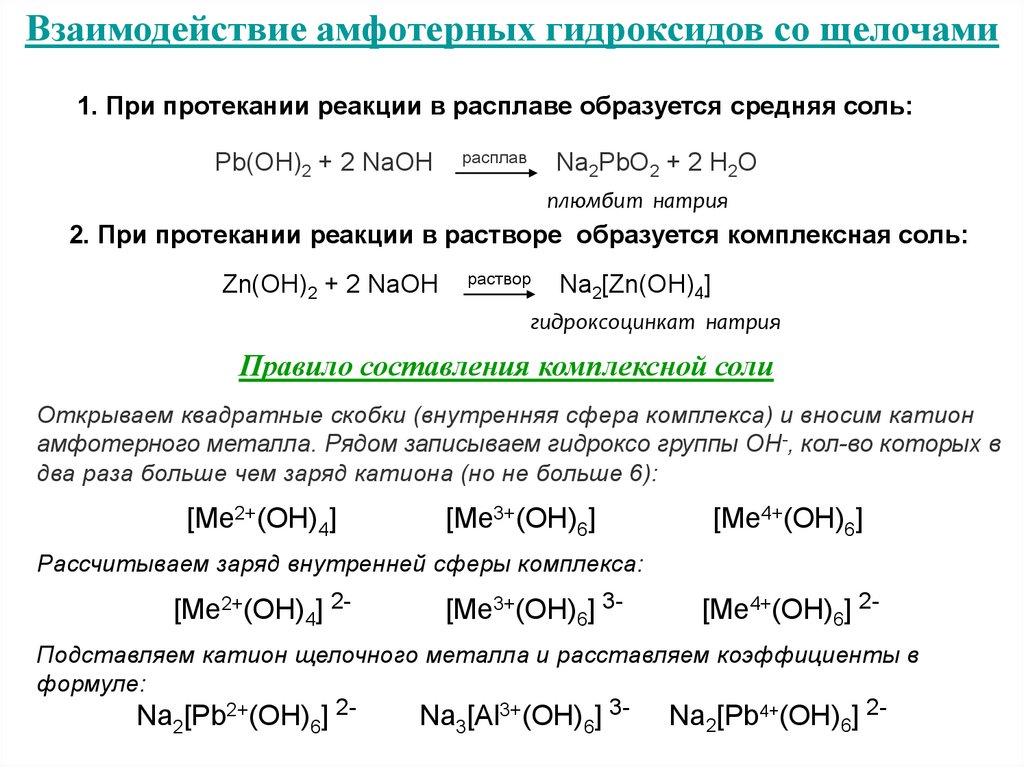
Взаимодействие амфотерных гидроксидов со щелочами1. При протекании реакции в расплаве образуется средняя соль:
Pb(OH)2 + 2 NaOH
расплав
Na2PbO2 + 2 H2O
плюмбит натрия
2. При протекании реакции в растворе образуется комплексная соль:
Zn(OH)2 + 2 NaOH
раствор
Na2[Zn(OH)4]
гидроксоцинкат натрия
Правило составления комплексной соли
Открываем квадратные скобки (внутренняя сфера комплекса) и вносим катион
амфотерного металла. Рядом записываем гидроксо группы ОН-, кол-во которых в
два раза больше чем заряд катиона (но не больше 6):
[Ме2+(OH)4]
[Ме3+(OH)6]
[Ме4+(OH)6]
Рассчитываем заряд внутренней сферы комплекса:
[Ме2+(OH)4] 2-
[Ме3+(OH)6] 3-
[Ме4+(OH)6] 2-
Подставляем катион щелочного металла и расставляем коэффициенты в
формуле:
Na2[Pb2+(OH)6] 2-
Na3[Al3+(OH)6] 3-
Na2[Pb4+(OH)6] 2-
12.
1. Закончить уравнения следующих реакцийK2O + N2O5
Li2O + HMnO4
CaO + Al2O3
Cr2O3 + H2SO4
Al(OH)3 + NaOH
Co(OH)2 + HNO3(нед.)
Ca(AlO2)2 + HCl
Na2ZnO2 + H2SO4
BaO + H2O
SO2 + H2O
2. С какими из перечисленных веществ
реагирует оксид кальция:
Н2О, NaOH, HC1, СО2, Р2О5, H2SO4, Ba(OH)2?
Запишите уравнения соответствующих реакций.
13.
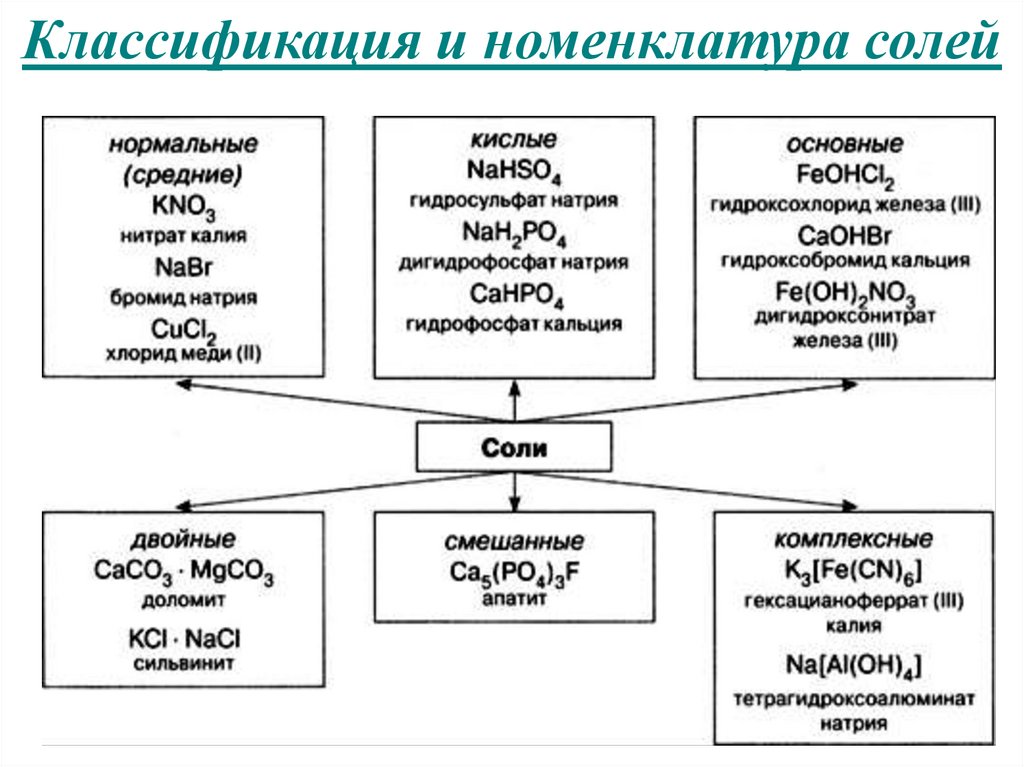
Классификация и номенклатура солей14.
Химические свойства солейХимические свойства средних солей
1. Взаимодействие с металлами
2 Al + 3 ZnSO4 = Al2(SO4)3 + 3 Zn
2. Нерастворимые разлагаются при нагревании BaCO3 = BaO + CO2
3. Реакции ионного обмена
BaSO4 + 2 HNO3 = Ba(NO3)2 + H2SO4
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓+ 3Na2SO4
3Zn(NO3)2 + 2K3PO4 = Zn3(PO4)2 + 6KNO3
Химические свойства кислых солей
1. Взаимодействие с избытком щелочи:
KHSO4 + KOH = K2SO4 + H2O
2. Взаимодействие с кислотами:
KHSO4 + HCl = KCl + H2SO4
3. Разложение
2KHSO4 = K2SO4 + H2SO4
Химические свойства основных солей
1. Взаимодействие с избытком кислоты:
ZnOHCl + HCl = ZnCl2 + H2O
2. Термическое разложение:
(ZnOH)2SO3 = 2 ZnO + H2SO3
15.
1. Закончить уравнения следующих реакцийZnS + H2S
CaCO3 + KOH
KOH + H2SO4
KCI + BaSO4
K2CO3 + H2SO4
Fe(OH)3 + H2SO4
NaHCO3
Ca(HCO3)2 + Ca(OH)2
16.
Степень окисления элемента в формулеСтепень окисления (с.о.) – условный заряд атома в соединении,
вычисленный из предположения, что оно состоит только из ионов.
Ионы – это положительно (катионы) или отрицательно (анионы)
заряженные частицы, образованные в результате отдачи или присоединения
электронов нейтральными атомами.
17.
Элементы, имеющие постоянную степень окисления1. Сумма степеней окисления в нейтральном соединении равна 0,
т.е. сумма зарядов «-» равна сумме зарядов «+»;
2. С.О. фтора (F) всегда –1;
3. С.О. металлов Iа группы (Li, Na, K, Rb, Cs) +1;
4. С.О. металлов IIа группы (Be, Mg, Ca, Sr, Ba) +2;
5. С.О. алюминия (Al) +3;
-1
6. С.О. водорода (Н) +1 , кроме гидридов CaH2;
+2
-1
7. С.О. кислорода (О) –2, кроме OF2 и перодксидов H2О2
8. С.О. галогенов (VIIа) в бескислородных соединениях –1
-1
-1
-1
НCl NaBr KI
9. С.О. простого вещества равна 0.
0
0
Cl2; O2
18.
Правило определения степени окисления элемента в формулеПрограмма деятельности
1) Запиши известные значения с.о.
элементов
Пример выполнения
+1
K2 Cr2 O7
+1
2) Вычисли суммарные заряды «+» и «-»
–2
K2 Cr2 O7
+2
3) По разнице между зарядами «+» и «-»
рассчитываем степень неизвестную степень
окисления элемента
–2
–14
+1 +6 –2
K2 Cr2 O7
+2 +12 –14










 Химия
Химия








