Похожие презентации:
Классификация неорганических соединений
1.
Повторение 8 классучитель химии
МБУ «Лицей 57» г.о. Тольятти
Новикова Ирина Валерьевна
2.
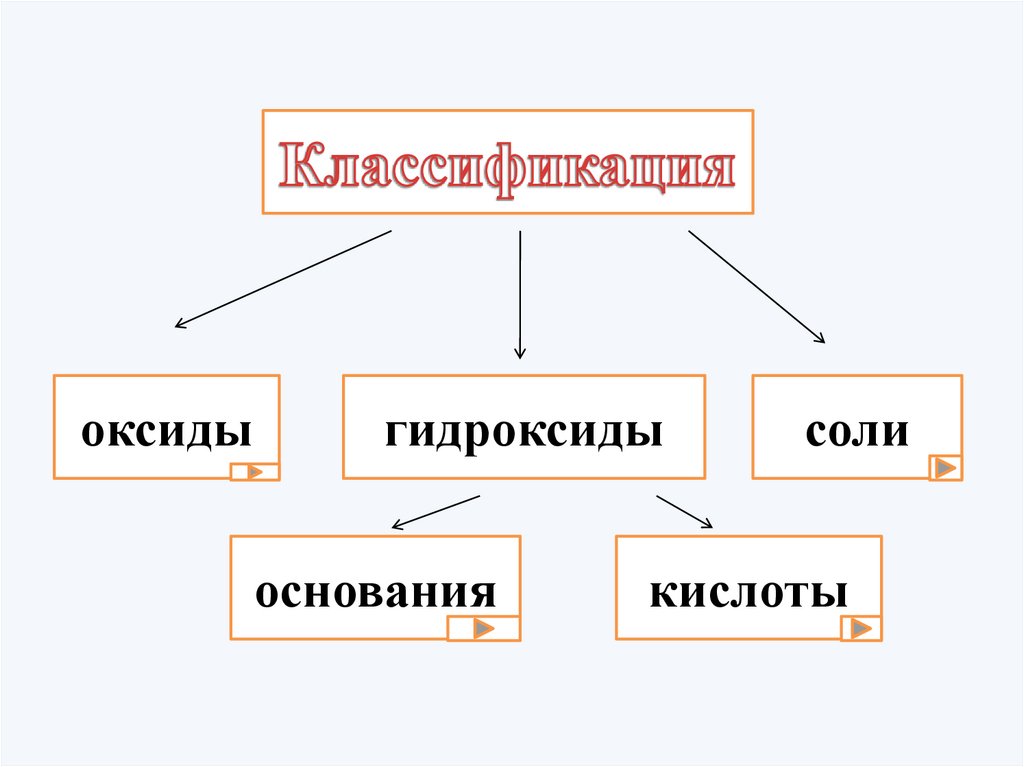
оксидыгидроксиды
основания
соли
кислоты
3.
Оксиды MxOyОсновные
Амфотерные
Кислотные Несолеобра
-зующие
Металл со с.о.
+1,+2
Металл со с.о. +3
Металл со с.о. +5- CO, SiO, NO, N2O
+7
Неметаллы со с.о.
+4-+8
Запишите по три примера для каждого типа оксида.
Химические свойства оксидов:
оксид = соль ( соединение)
Оксид + основание = соль +вода ( обмена)
кислоты = соль +вода ( обмена)
металл с основным оксидом = новый металл + оксид
(замещение)
4.
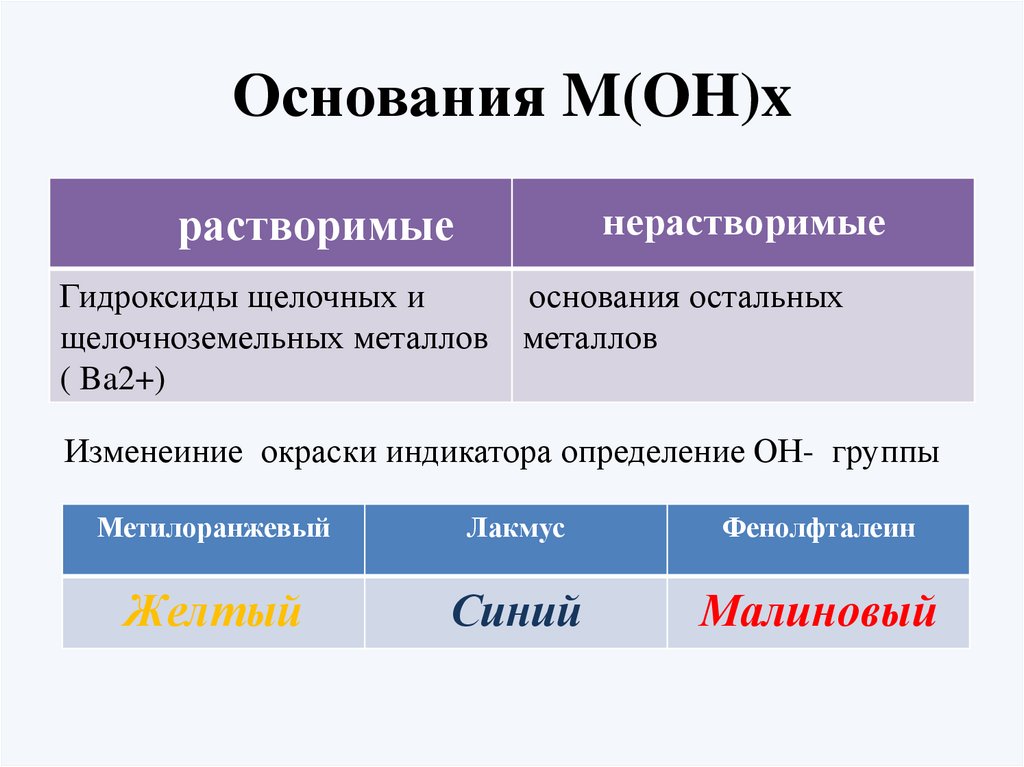
Основания M(OH)xнерастворимые
растворимые
Гидроксиды щелочных и
основания остальных
щелочноземельных металлов металлов
( Ba2+)
Изменеиние окраски индикатора определение ОН- группы
Метилоранжевый
Лакмус
Фенолфталеин
Желтый
Синий
Малиновый
5.
Свойства основанийкислотные оксиды = соль + вода (обм)
• Основание + кислоты = соль + вода (нейтрал)
( растворимые)
амфотерные основания = комплекс соль
соль(р-р) = основание + соль
• Приведите примеры уравнений реакций для каждого
• типа реакции.
• Дома повторить получение оснований.
6.
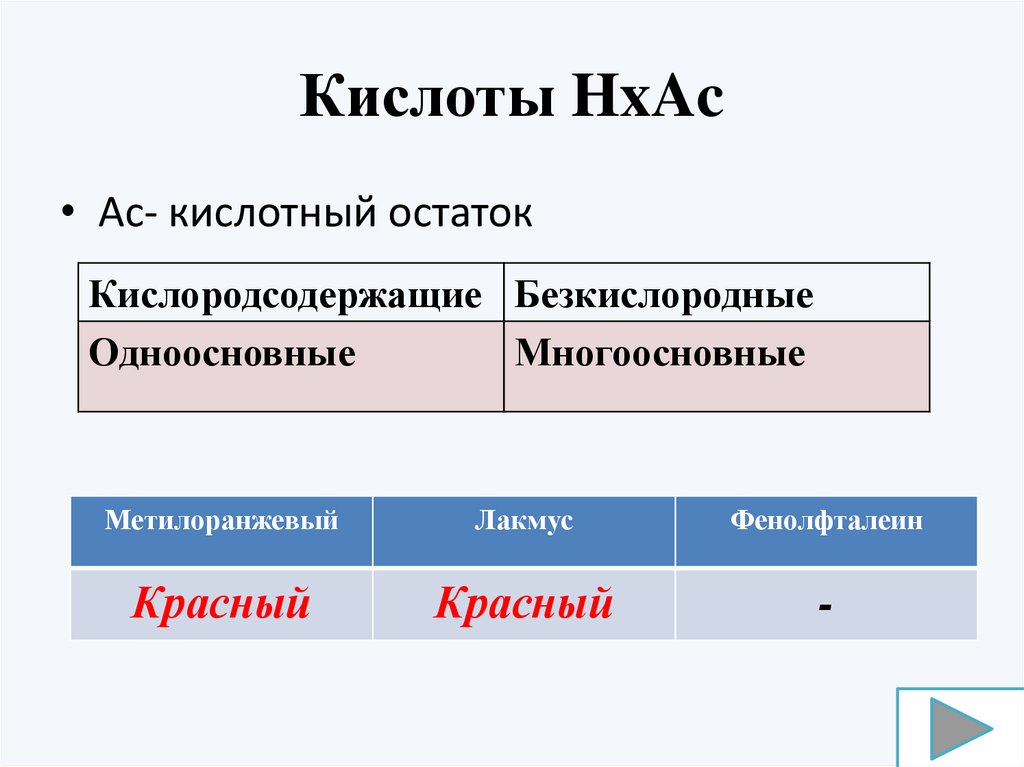
Кислоты HxAc• Ac- кислотный остаток
Кислородсодержащие Безкислородные
Одноосновные
Многоосновные
Метилоранжевый
Лакмус
Фенолфталеин
Красный
Красный
-
7.
Свойства кислот• Кислоты + металл ( в станд ряду напряжение до водорода) =
соль + водород (замещение)
Исключение концентрированная серная кислота и азотная кислота любой
концентрации
основной оксид = соль +вода (обмен)
• Кислота + основание = соль+ вода (нейтрализация)
соль (более слабой кислоты) = соль + кислота
• HI, HClO4, HBr, HCl, H2SO4, HNO3, HMnO4, H2SO3, H3PO4,
HF, HNO2, H2CO3, H2S, H2SiO3 сила кислот уменьшается
• Приведите примеры уравнений реакций для каждого
• типа реакции.
• Дома повторить получение оснований.
8.
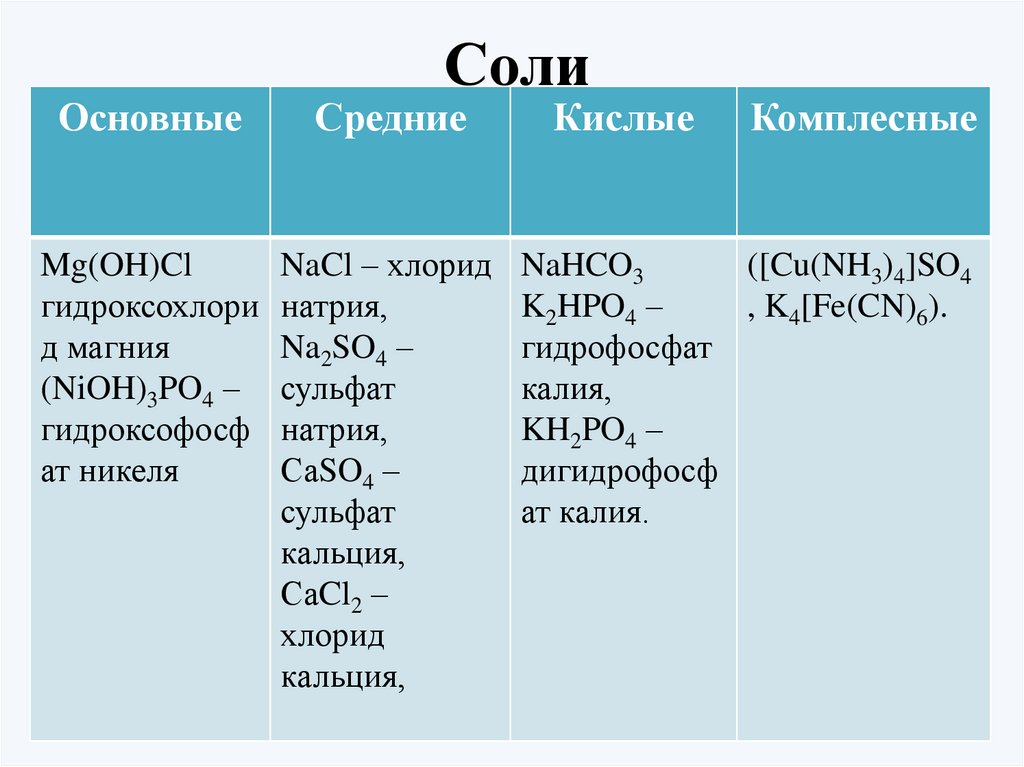
ОсновныеСоли
Средние
Mg(OH)Cl
NaCl – хлорид
гидроксохлори натрия,
д магния
Na2SO4 –
(NiOH)3PO4 – сульфат
гидроксофосф натрия,
ат никеля
СаSO4 –
сульфат
кальция,
СаCl2 –
хлорид
кальция,
Кислые
Комплесные
NaHCO3
([Cu(NH3)4]SO4
K2HPO4 –
, K4[Fe(CN)6).
гидрофосфат
калия,
KH2PO4 –
дигидрофосф
ат калия.
9.
Задания• 1.Лишнее вещество.
• а) SO3, HNO3, FeO, K2O, CO2, CuO.
• б) O3, H2SO4, Al(OH)3, HCl, H3PO4, H2CO3
• в) Zn(OH)2, KOH, Fe(OH)2, Ba, NaOH, Ba(OH)2
• г) KNO3, FeSO4, NaCl, Al2S3, BaO, CaCO3
• 2.Закончите уравнения реакций(напишите
реакции ионного обмена)
• Ba(OH)2+ H3PO4 =
• CaO + CO2 =
• NaOH+ CuSO4=
10.
Литератураhttp://nsportal.ru/shkola/khimiya/library/2014/08/26/klassifikatsiya-klassovneorganicheskikh-soedineniy-8-klass
Химия 8 С.О. Габриелян , 2011






 Химия
Химия








