Похожие презентации:
Классификация. Неорганических соединений
1.
КЛАССИФИКАЦИЯ.НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
2.
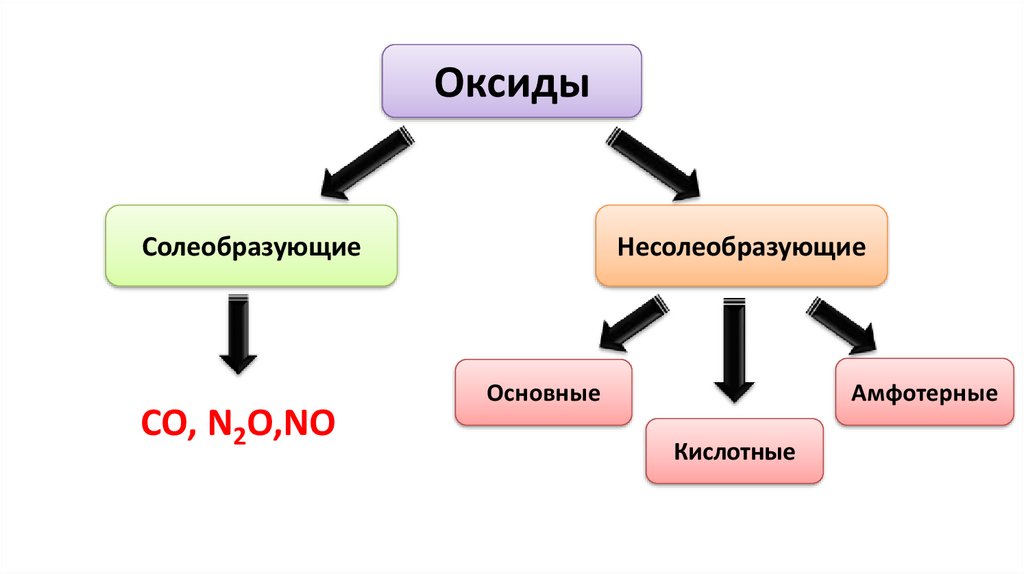
ОксидыСолеобразующие
CO, N2O,NO
Несолеобразующие
Амфотерные
Основные
Кислотные
3.
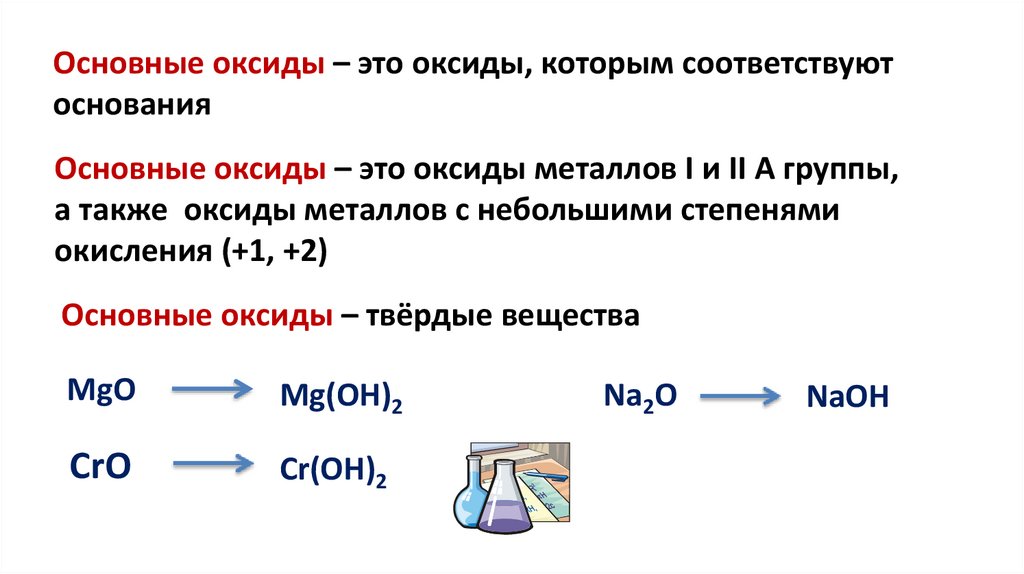
Основные оксиды – это оксиды, которым соответствуютоснования
Основные оксиды – это оксиды металлов I и II A группы,
а также оксиды металлов с небольшими степенями
окисления (+1, +2)
Основные оксиды – твёрдые вещества
MgO
Mg(OH)2
CrO
Cr(OH)2
Na2O
NaOH
4.
Реакция основных оксидов с кислотамиОсновный оксид + кислота = соль + вода
CuO + H2SO4 = CuSO4 + H2O
Реакция основных оксидов с кислотными
Основный оксид + кислотный оксид = соль
3Na2O + P2O5 = 2Na3PO4
MgO + SO3 = MgSO4
Реакция основных оксидов с водой
Основный оксид + вода = основание
CaO + H2O = Ca(OH)2
CaO + H2O = Ca2+ + 2OH-
CuO + H2O ≠
5.
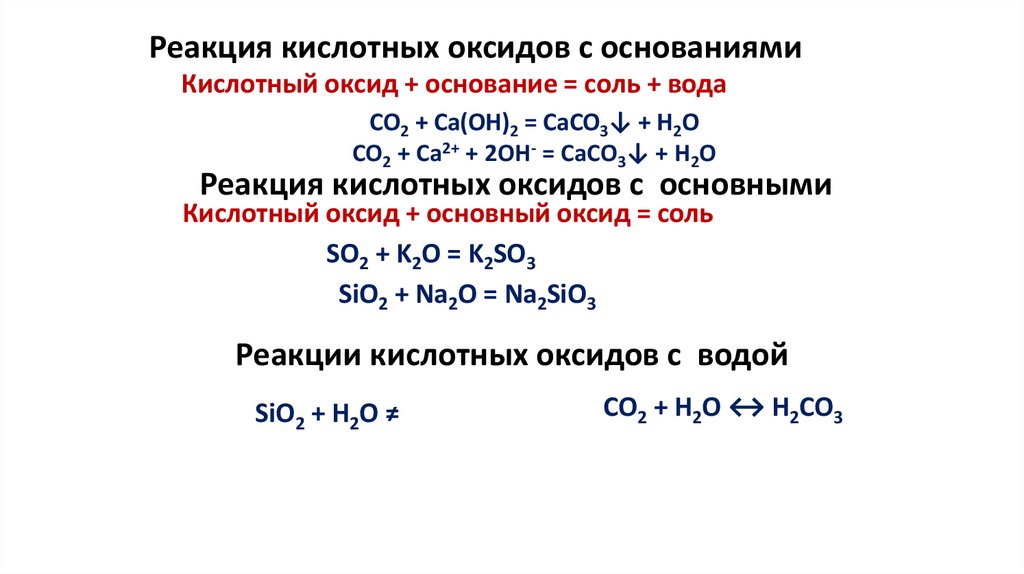
Реакция кислотных оксидов с основаниямиКислотный оксид + основание = соль + вода
CO2 + Ca(OH)2 = CaCO3↓ + H2O
CO2 + Ca2+ + 2OH- = CaCO3↓ + H2O
Реакция кислотных оксидов с основными
Кислотный оксид + основный оксид = соль
SO2 + K2O = K2SO3
SiO2 + Na2O = Na2SiO3
Реакции кислотных оксидов с водой
SiO2 + H2O ≠
CO2 + H2O ↔ H2CO3
6.
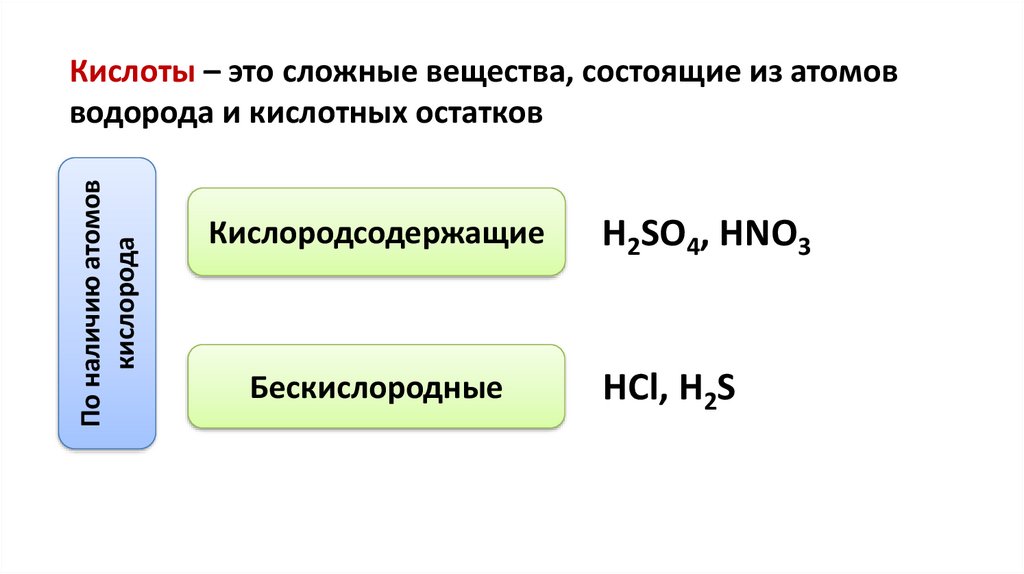
По наличию атомовкислорода
Кислоты – это сложные вещества, состоящие из атомов
водорода и кислотных остатков
Кислородсодержащие
Бескислородные
H2SO4, HNO3
HCl, H2S
7.
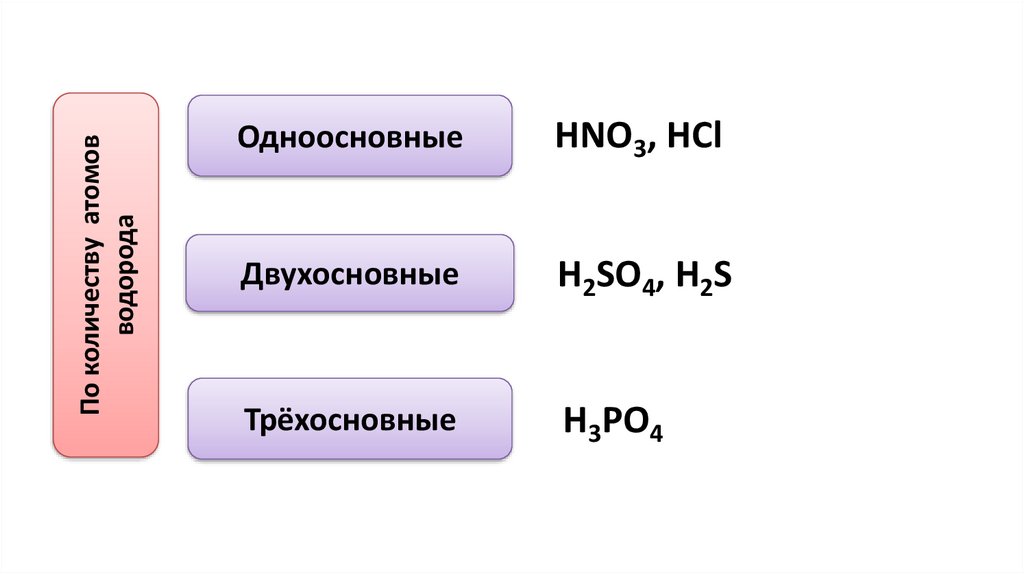
По количеству атомовводорода
Одноосновные
HNO3, HCl
Двухосновные
H2SO4, H2S
Трёхосновные
H3PO4
8.
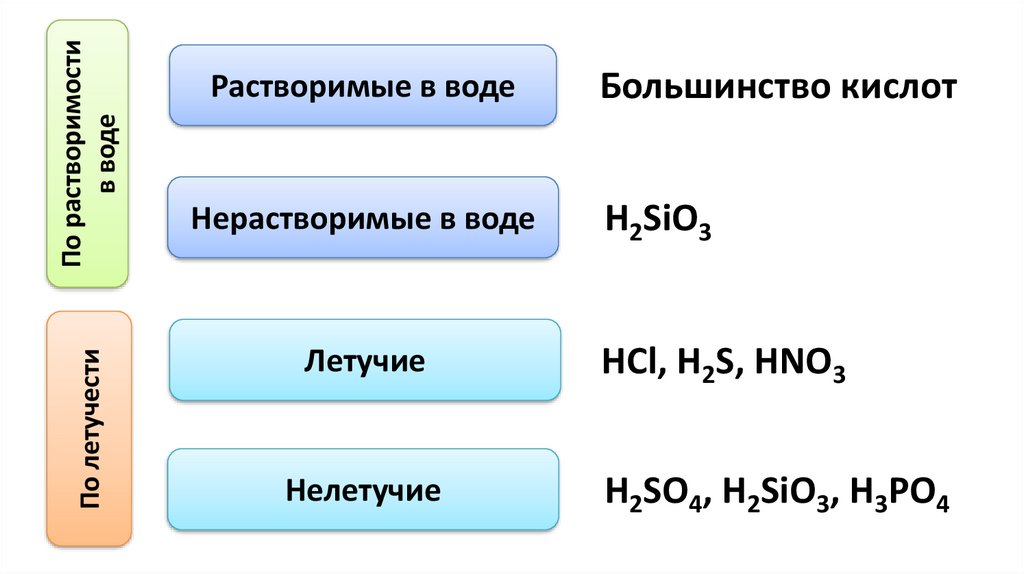
По растворимостив воде
По летучести
Растворимые в воде
Нерастворимые в воде
Летучие
Нелетучие
Большинство кислот
H2SiO3
HCl, H2S, HNO3
H2SO4, H2SiO3, H3PO4
9.
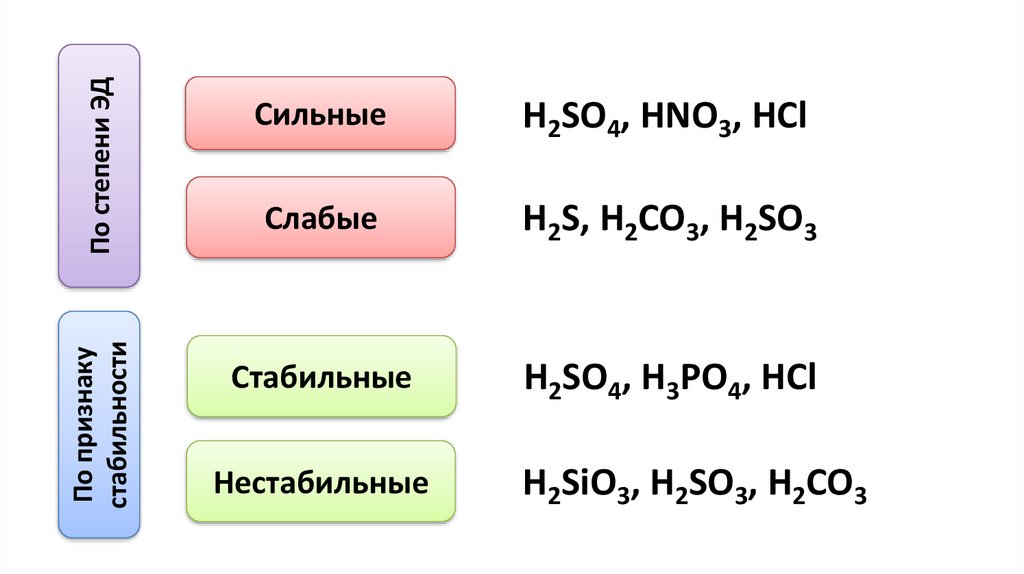
По степени ЭДПо признаку
стабильности
Сильные
H2SO4, HNO3, HCl
Слабые
H2S, H2CO3, H2SO3
Стабильные
H2SO4, H3PO4, HCl
Нестабильные
H2SiO3, H2SO3, H2CO3
10.
Реакция с основаниямиКислота + основание = соль + вода
NaOH + HCl = NaCl + H2O
ОН- + Н+ = Н2О
Реакция с оксидами металлов
Кислота + оксид металла = соль + вода
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O
Реакция с солями
Кислота + соль = новая кислота + новая соль
2HCl + Na2SiO3 = 2NaCl + H2SiO3↓
2H+ + SiO32- = H2SiO3↓
11.
Основания – это электролиты, при диссоциации которых вкачестве катионов выступают катионы металла (или
аммония), а в качестве анионов – гидроксид-ионы
Число групп ОН- = степени окисления металла
+1
NaOH
+2
Ba(OH)2
Группа ОН: мыльность на ощупь,
изменение окраски индикаторов
12.
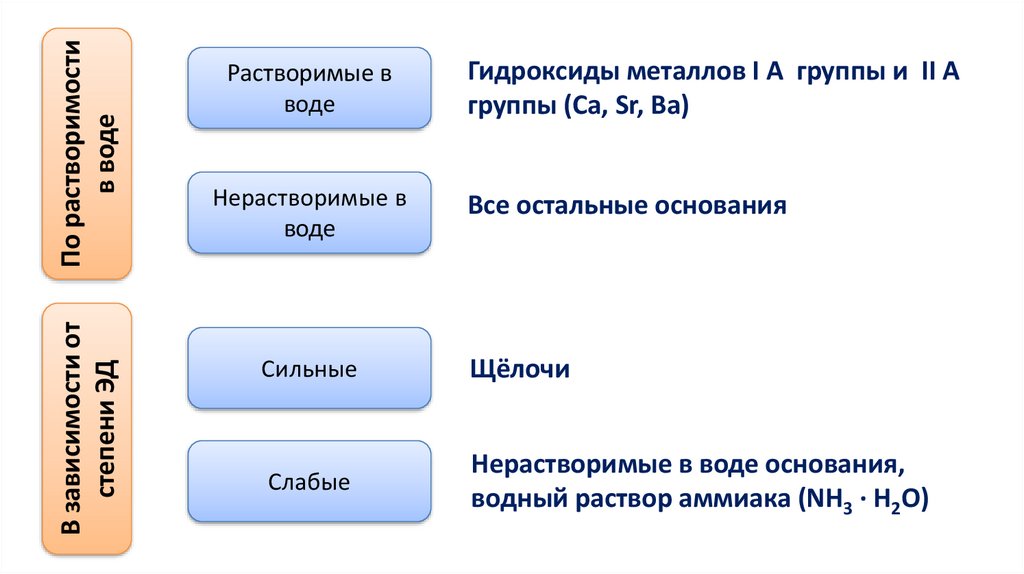
По растворимостив воде
В зависимости от
степени ЭД
Растворимые в
воде
Нерастворимые в
воде
Гидроксиды металлов I A группы и II A
группы (Ca, Sr, Ba)
Все остальные основания
Сильные
Щёлочи
Слабые
Нерастворимые в воде основания,
водный раствор аммиака (NH3 · H2O)
13.
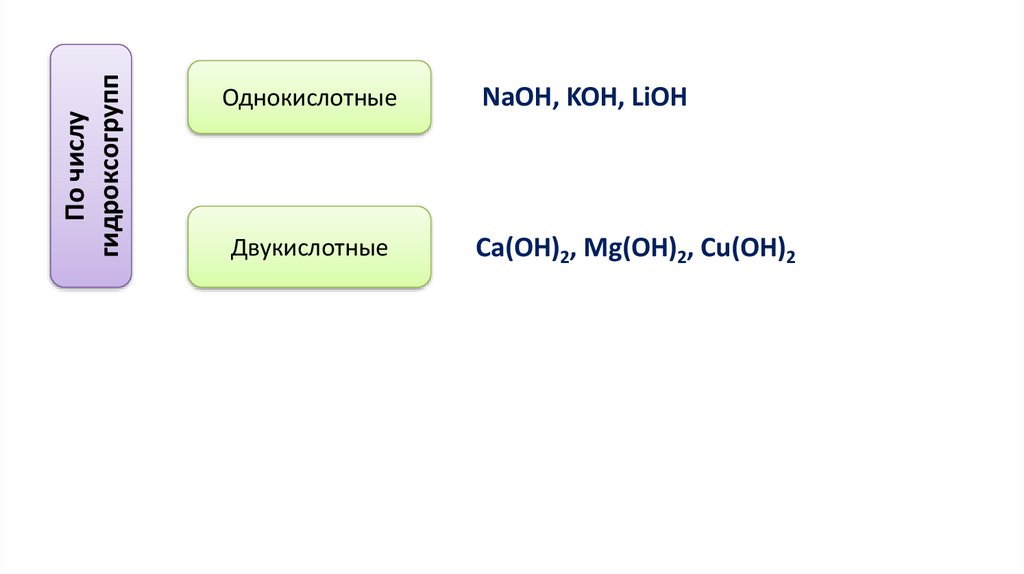
По числугидроксогрупп
Однокислотные
Двукислотные
NaOH, KOH, LiOH
Ca(OH)2, Mg(OH)2, Cu(OH)2
14.
Реакции оснований с кислотами (реакции обмена)Основание + кислота = соль + вода
NaOH + HCl = NaCl + H2O
ОН- + Н+ = Н2О
Реакции оснований с оксидами неметаллов (реакции обмена)
Основание + оксид неметалла = соль + вода
Са(ОН)2 + СО2 = СаСО3↓ + Н2О
Са2+ + 2ОН- + СО2 = СаСО3↓ + Н2О
Разложение нерастворимых оснований
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Cu2+ + 2OH- = Cu(OH)2↓
Реакции оснований с солями
Основание + соль = новая соль + новое основание
NaOH + NH4Cl = NaCl + NH3↑ + H2O
OH- + NH4+ = NH3↑ + H2O
15.
Средние соли – это продукты полного замещения атомовводорода в кислоте на металл
Na2CO3 – карбонат натрия
Na2CO3 = 2Na+ + CO32-
Al2(SO4)3 – сульфат алюминия
Al2(SO4)3 = 2Al3+ + 3SO42-
Ba(NO3)2 – нитрат бария
Ba(NO3)2 = Ba2+ + 2NO3-
CaCl2 – хлорид кальция
CaCl2 = Ca2+ + 2Cl-
K3PO4 – фосфат калия
K3PO4 = 3K+ + PO43-
16.
Кислые соли – это продукты неполного замещения атомовводорода в кислоте на металл
NaHSO4
KHCO3
CaHPO4
Название средних солей + слово «гидро»
NaHSO4 – гидросульфат натрия
NaHSO4 = Na+ + HSO4-
KHCO3 – гидрокарбонат калия
HSO4- ↔ H+ + SO42-
CaHPO4 – гидрофосфат кальция
17.
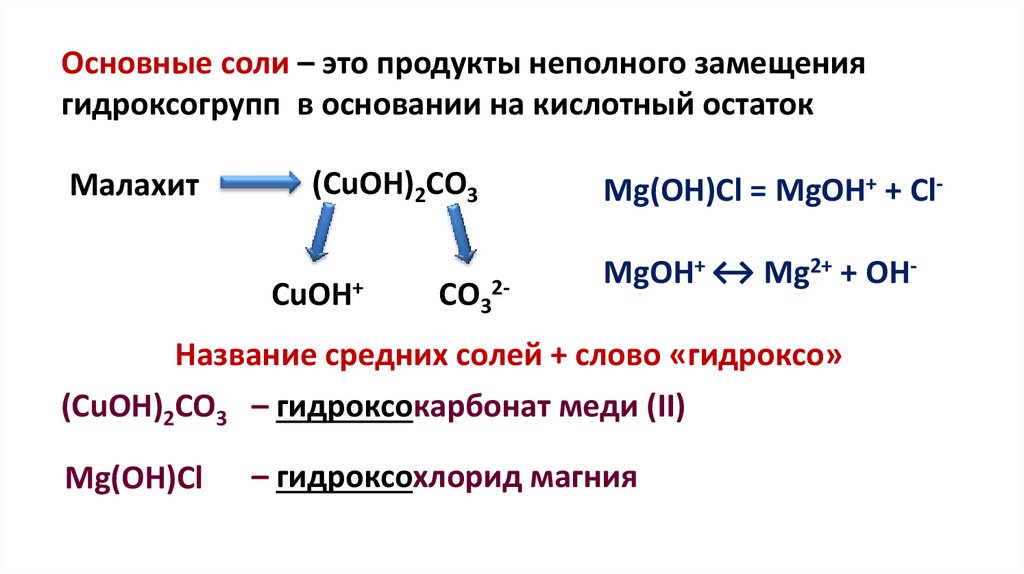
Основные соли – это продукты неполного замещениягидроксогрупп в основании на кислотный остаток
Малахит
(CuOH)2CO3
CuOH+
СО32-
Mg(OH)Cl = MgOH+ + Cl-
MgOH+ ↔ Mg2+ + OH-
Название средних солей + слово «гидроксо»
(CuOH)2CO3 – гидроксокарбонат меди (II)
Mg(OH)Cl
– гидроксохлорид магния
18.
Реакция солей с кислотамиСоль + кислота = новая соль + новая кислота
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
SiO32- + 2H+ = H2SiO3↓
Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O
CO32- + 2H+ = CO2↑ + H2O
NaNO3 + H2SO4 ≠
19.
Реакция солей со щелочамиСоль + щёлочь = новая соль + новое основание
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4
Fe3+ + 3OH- = Fe(OH)3↓
(NH4)2SO4 + 2KOH = K2SO4 + 2NH3↑ + 2H2O
NH4+ + OH- = NH3↑ + H2O
Ba(NO3)2 + KOH ≠
t
20.
Реакция солей с металламиСоль + металл = другая соль + другой металл
21.
Реакция солей между собойСоль1 + соль2 = соль3 + соль4
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Ba2+ + SO42- = BaSO4↓
Условия протекания реакций:
Обе соли должны быть растворимыми
Металлы не должны реагировать с водой











 Химия
Химия








