Похожие презентации:
Соли, их классификация и свойства (урок 1)
1.
2.
3.
1)Познакомить учащихся с понятием соли, научитьсоставлять формулы солей и давать им названия;
2) Изучить классификацию солей;
3)Рассмотреть химические свойства солей;
4)Продолжить формирование умений составлять
уравнения химических реакций.
4.
1. Какие классы веществ вы знаете?2. Что такое оксиды?
3. Как классифицируются оксиды?
4. Что такое основания?
5. Как можно классифицировать основания?
6. Что такое кислоты?
7. Как можно классифицировать кислоты?
5.
1. Выберите формулу оксида серы (IV) – Iвариант
Выберите формулу оксида углерода (II) –
II вариант:
а)H2S
б) CO
в) SO3
г) ZnO
д) SO2
Рассчитайте массовую долю кислорода
выбранных оксидах
в
6.
2. Выберите формулу серной кислоты –I вариант
Выберите формулу сернистой кислоты –
II вариант
а) H2SiO3
в) H2SO3
б) H2SO4
г) H2S
Найдите молекулярные массы выбранных
кислот.
7.
3. Выберите формулы растворимых в водеоснований – I вариант
Выберите формулы нерастворимых в воде
оснований – II вариант
а)Cu(OH)2
в) LiOH
б) KOH
г) AI(OH)3
8.
А) Азотистая кислота1. H2CO3
Б) Гидроксид кальция
2. Al2O3
В) Оксид фосфора (V)
3. CuOH
Г) Угольная кислота
4. P2O5
Д) Оксид алюминия
5. Ca(OH)2
Е) Гидроксид меди (I)
6. HNO2
9.
I вариантII вариант
1. д
2. б
3. б, в
1. б
2. в
3. а, г
6. А-6, Б-5, В-4, Г-1, Д-2, Е-3
10.
Выберите формулы, в которыхлакмус меняет свой цвет
на красный – I вариант,
на синий – II вариант
(Ответ подтвердите практически)
а) НСI
б) H2SO4
в) NaOH
г) KOH
11.
1 ВАРИАНТРассчитайте массу 3 моль оксида
кальция.
2 ВАРИАНТ
Рассчитайте массу 2 моль
гидроксида натрия.
12.
Na2SO4 ,HCI,
КОН,
CO2,
K2S, H2SO4,
AI2O3, ВаCl2,
NaOH, К3РО4.
13.
Na2SO4ВаCl2
K2S
K3PO4
14.
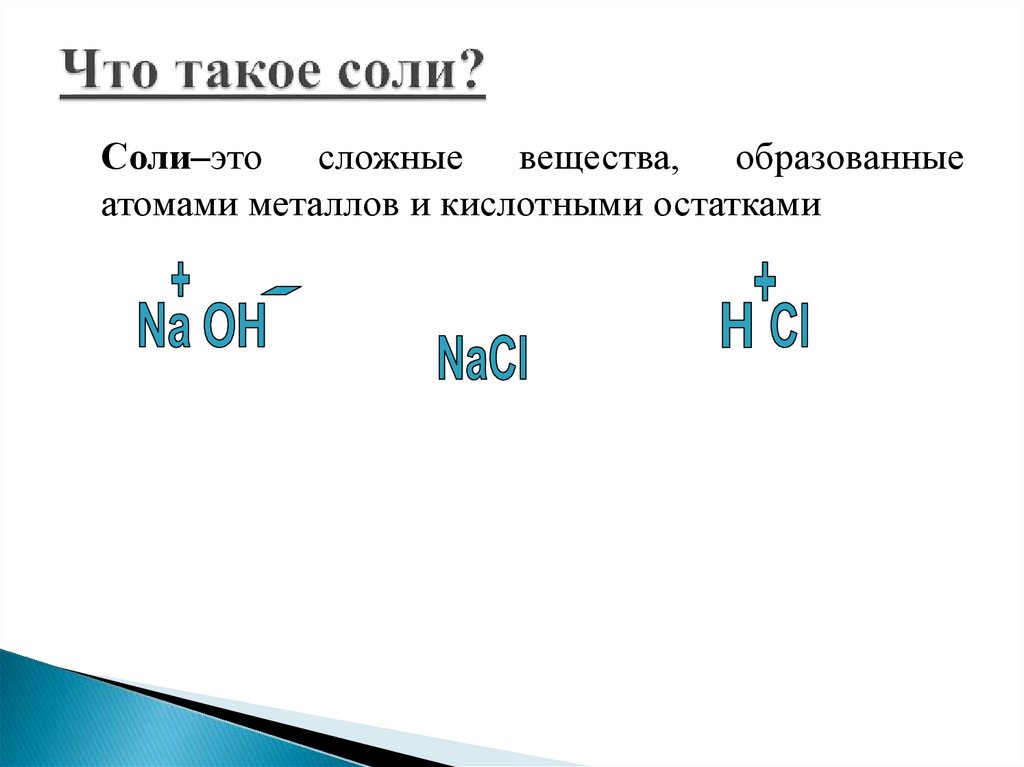
Соли–это сложные вещества, образованныеатомами металлов и кислотными остатками
15.
НазваниеНазвание
кислотного + металла (в р.п.)
остатка
+
хлорид натрия
CaCO3
карбонат кальция
Са3(РО4)2 фосфат кальция
FeCI2
хлорид железа (II)
NaCl
Указание
валентности
(если она переменная)
16.
Вы наверное устали? Ну тогда все дружно встали.Две минуты отдыхаем, но урок не забываем.
Основный оксид – руки вперед
Кислотный оксид – руки вверх
Кислота – руки в стороны
Основание – руки вниз
Соль – вращаем головой.
17.
CuO, N2O5 вспомним классы мы опятьH2S, KOH лучше думай, мозг ты наш!
NaCl и KBr – голова идёт кругом.
Покачали головой,
И усталость с нас долой!
18.
СолиСредние
(нормальные)
Кислые
Основные
19.
Средние соли - это продукты полного замещенияатомов водорода в кислоте на металл. Na2CO3,
CuSO4
Кислые соли – это продукты неполного замещения
атомов водорода в кислоте на металл.
NaHCO3 (гидрокарбонат натрия)
Mg(HSO4)2 (гидросульфат магния)
Основные соли – это продукты неполного
замещения гидроксогрупп в основании на
кислотный остаток.
(CuOH)2CO3 (гидроксокарбонат меди (II))
AlOHCl2 (гидроксохлорид алюминия)
20.
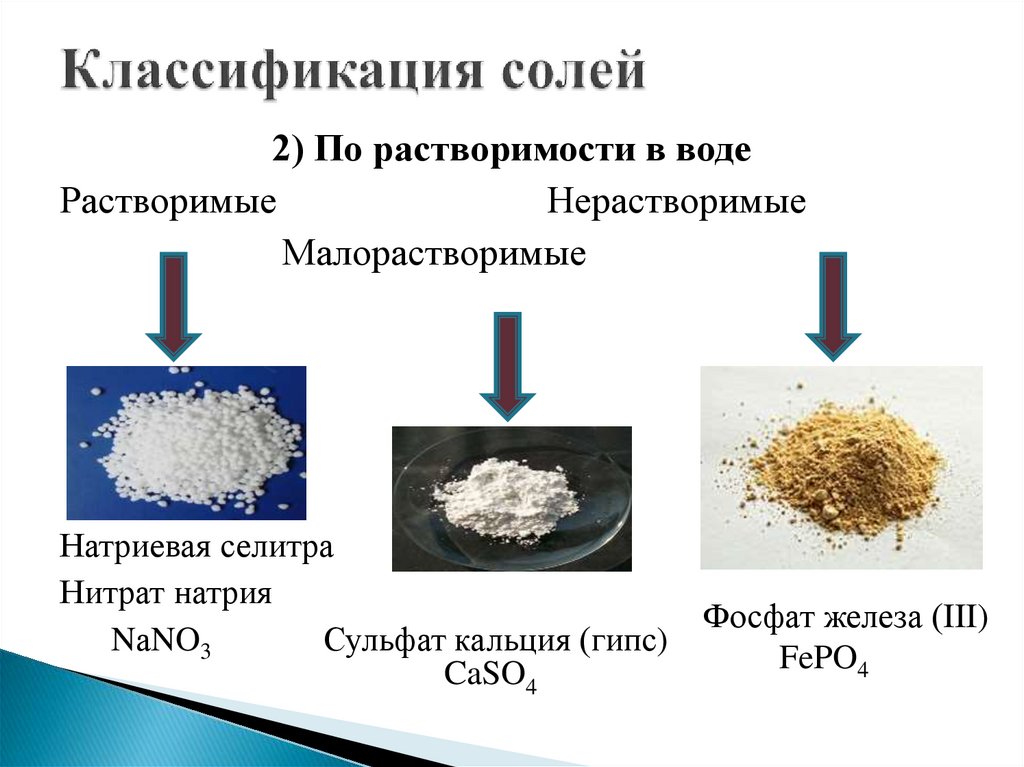
2) По растворимости в водеРастворимые
Нерастворимые
Малорастворимые
Натриевая селитра
Нитрат натрия
Фосфат железа (III)
NаNO3
Сульфат кальция (гипс)
FePO4
CaSO4
21.
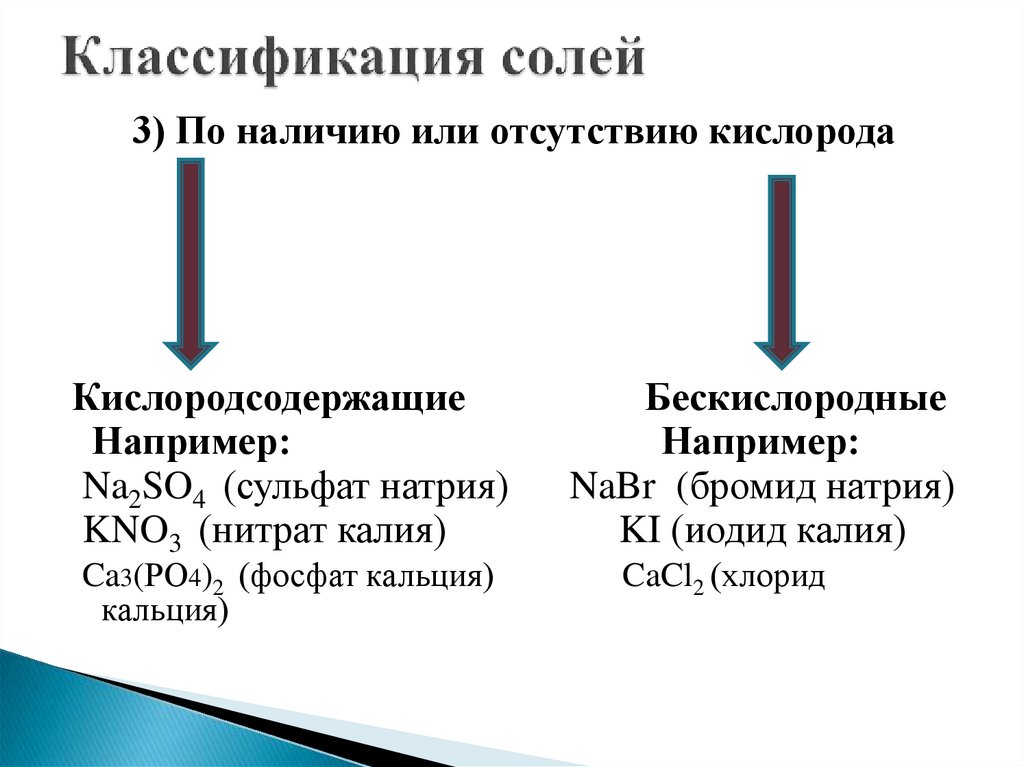
3) По наличию или отсутствию кислородаКислородсодержащие
Например:
Na2SO4 (сульфат натрия)
KNO3 (нитрат калия)
Ca3(РО4)2 (фосфат кальция)
кальция)
Бескислородные
Например:
NaBr (бромид натрия)
KI (иодид калия)
CaCl2 (хлорид
22.
Определите, какие из данных солей являютсянерастворимыми:
1. Na2SO4
3. ВаSO4
2. K2S
4. AgCl
Определите, какие из данных солей являются
бескислородными:
1. Na2SO4
3. ВаSO4
2. K2S
4. AgCl
23.
1) Соль + металл = другая соль + другой металлНапример: CuSO4(p-p) + Fe = FeSO4 (p-p) + Cu
Правила: а) металл должен находиться в ряду
напряжений левее металла соли;
б) обе соли (и реагирующая, и образующаяся в
результате реакции) должны быть растворимыми;
в) металлы не должны взаимодействовать с водой,
поэтому металлы главных подгрупп I и II группы
ПС Д.И.Менделеева не вытесняют другие
металлы из растворов солей, так как они активно
взаимодействуют с водой.
24.
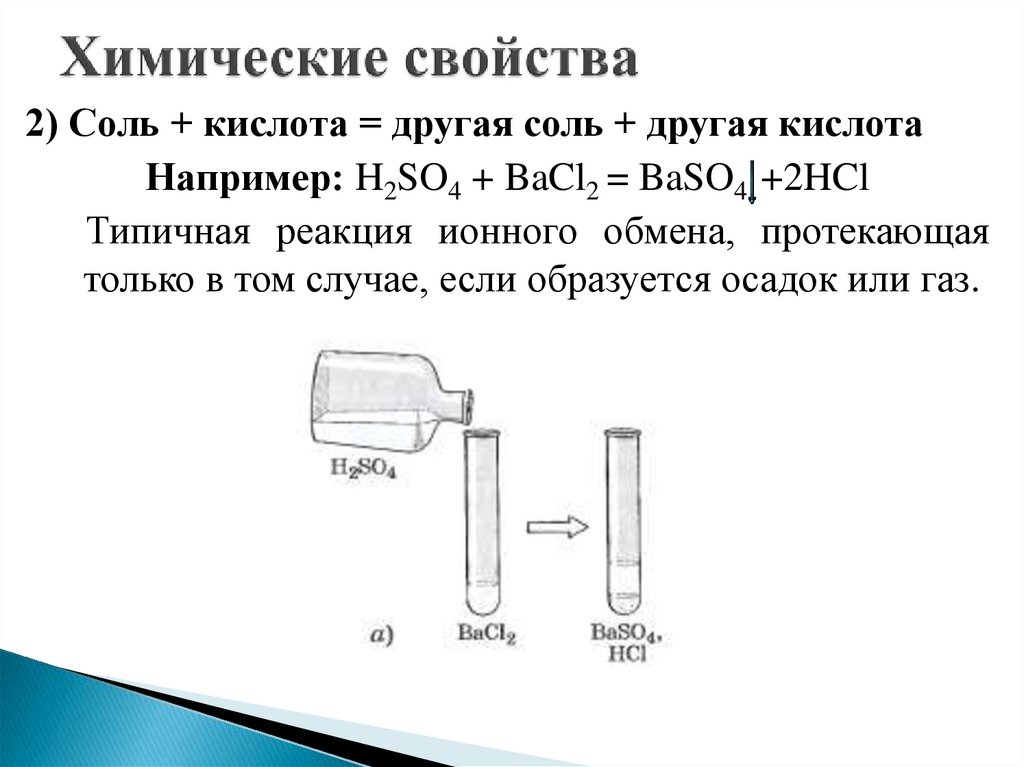
2) Соль + кислота = другая соль + другая кислотаНапример: H2SO4 + BaCl2 = BaSO4 +2HCl
Типичная реакция ионного обмена, протекающая
только в том случае, если образуется осадок или газ.
25.
3) Соль + щелочь = другая соль + другое основаниеНапример: NaOH + CuSO4 = Na2SO4 + Cu(OH)2
Типичная реакция ионного обмена, протекающая
только в том случае, если образуется осадок или газ.
26.
4) Соль1 + соль2 = соль3 + соль4Например: АgNO3 + KCl = KNO3 +AgCl
АgNO3 + KI = KNO3 +AgI
АgNO3 + K3РО4 = KNO3 +Ag3РО4
Типичная реакция ионного обмена, протекающая
только в том случае, если образуется осадок.
27.
Тест «Как я запомнил тему»:1) Выберите формулу соли:
а) HCl
б) Ca(OH)2
в) Na2SO4
г) MgО
2) Какая из приведенных солей бескислородная:
а) CаSO4
б) KBr
в) NH4NO3
г) Na2CO3
3) Какая из приведенных солей
кислородсодержащая:
а) K2S
б) KBr
в) NаСl
г) Na2CO3
28.
4) К какому типу солей относится данная соль AlOHCl2:а) средняя
б) основная
в) кислая
г) ни к одной из этих
5) Какая реакция не является типичной
реакцией для средних солей:
а) соль + металл
б) соль + кислота
в) соль + оксид
г) соль + щелочь
29.
СаОСаSO4
HCl
H2SO3
MgCl2
KOH
H2S
Na3PO4
CaCO3
30.
СаОСаSO4
HCl
H2SO3
MgCl2
KOH
H2S
Na3PO4
CaCO3
31.
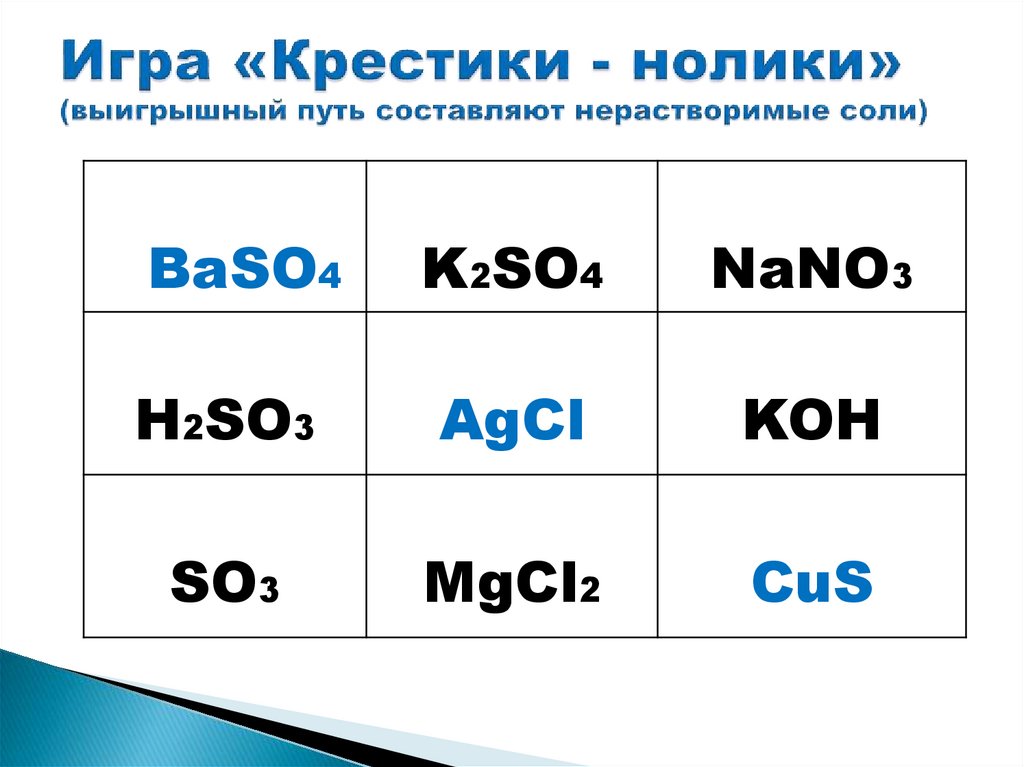
BaSO4K2SO4
NaNO3
H2SO3
AgCl
KOH
SO3
MgCl2
CuS
32.
BaSO4K2SO4
NaNO3
H2SO3
AgCl
KOH
SO3
MgCl2
CuS
33.
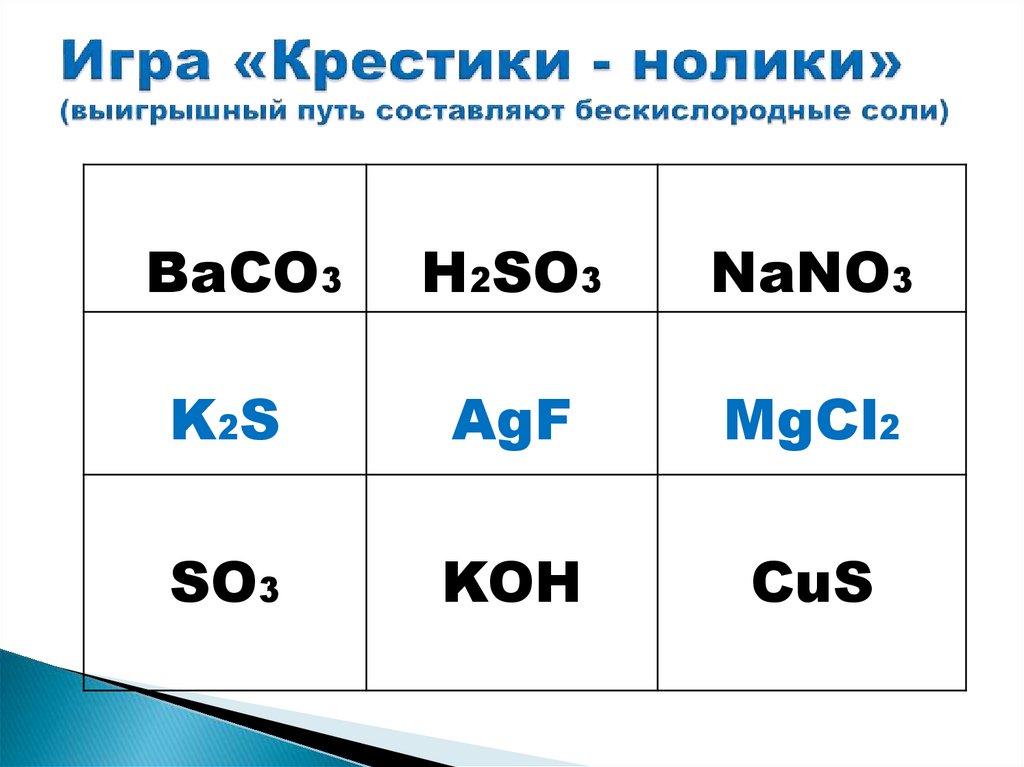
BaCO3H2SO3
NaNO3
K2S
AgF
MgCl2
SO3
KOH
CuS
34.
BaCO3H2SO3
NaNO3
K2S
AgF
MgCl2
SO3
KOH
CuS
35.
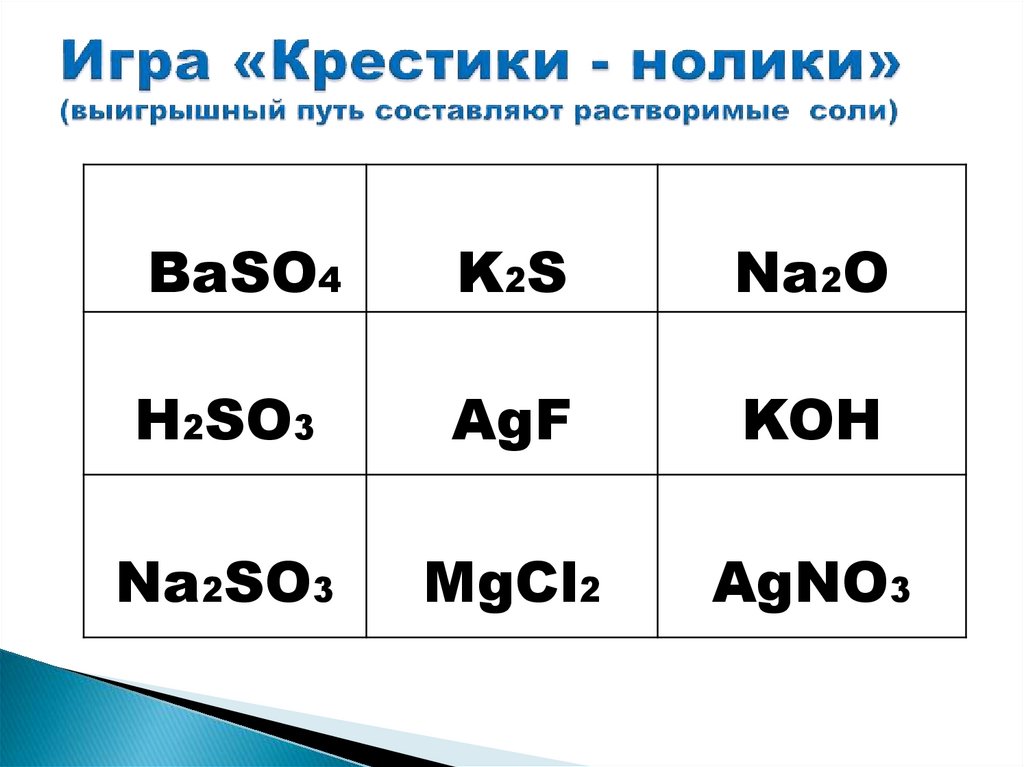
BaSO4K2S
Na2O
H2SO3
AgF
KOH
Na2SO3
MgCl2
AgNO3
36.
BaSO4K2S
Na2O
H2SO3
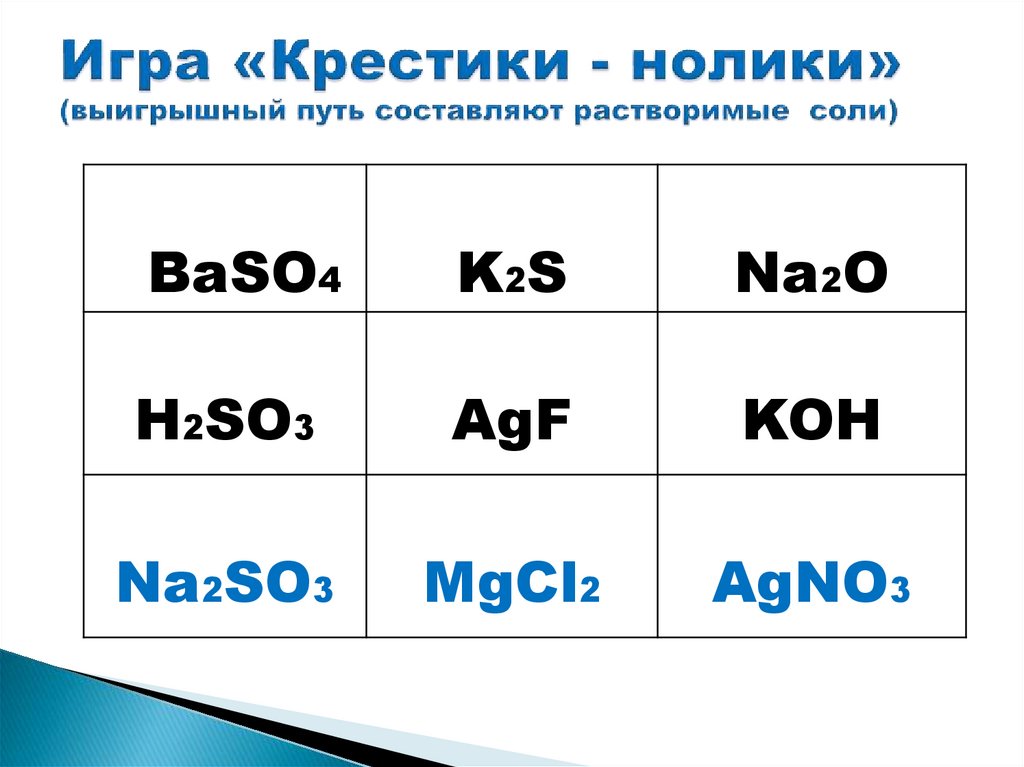
AgF
KOH
Na2SO3
MgCl2
AgNO3
37.
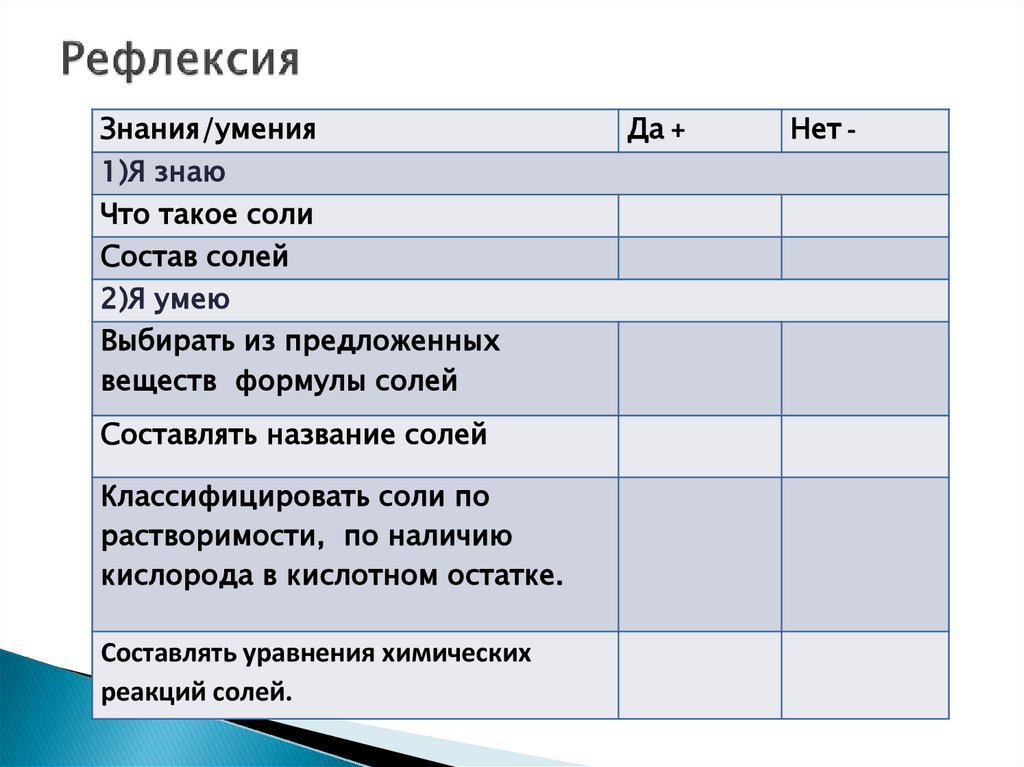
Знания/умения1)Я знаю
Что такое соли
Состав солей
2)Я умею
Выбирать из предложенных
веществ формулы солей
Составлять название солей
Классифицировать соли по
растворимости, по наличию
кислорода в кислотном остатке.
Составлять уравнения химических
реакций солей.
Да +
Нет -
38.
§26 вопр. 1-3 (устно), 4,5 (письменно)Подготовить сообщение на тему: «Значение соды в
народном хозяйстве»





























 Химия
Химия








